含能材料是武器系统的动力源和威力源,未来战争模式和作战环境的多样性、复杂性、不确定性等特点,对新型武器系统的战场适应性提出更加严苛和特殊的要求,因此,弹药装药对新型含能材料的爆轰性能和安全性能也提出更高的要求,然而目前具有实际应用价值的单质含能材料依然屈指可数,大范围使用的仍是2, 4, 6-三硝基甲苯(TNT)、1, 3, 5-三硝基-1, 3, 5-三氮杂环己烷(RDX)、1, 3, 5, 7-四硝基-1, 3, 5, 7-四氮杂环辛烷(HMX)等材料。国内外研究者致力于设计、研发出能量密度高、热稳定性好、安全性能优的新型高能量密度化合物,近来多硝基氮杂芳环化合物成为含能材料研发领域的热点,此类化合物往往能形成类苯结构的共轭离域体系,是一类撞击和摩擦感度低、热分解温度高、爆轰性能良好的单质含能材料[1-3],其中4, 4′, 5, 5′-四硝基-2, 2′-联咪唑(TNBI)是该类化合物的一个典型代表,TNBI质量密度为1.80 g·cm-3,热分解温度高达290 ℃,爆速为7.840 km·s-1,爆压为27.6 GPa,生成热为232 kJ·mol-1 [4],随后,研究者对TNBI的分子结构、性能及含能离子盐衍生物等进行大量的研究工作[5-9]。由于TNBI分子中的亚氨基结构及邻位硝基的强吸电子性效应,使TNBI存在较强酸性,严重限制了进一步应用,影响长储稳定性。理论及实验的研究结果表明,通过向化合物分子的亚氨基部位引入氨基,不但可降低化合物酸性,提高长储稳定性,还可增加化合物的氮含量,改善爆轰能量水平[10-14]。
本文以自制的TNBI·2H2O为原料,经N-胺化反应合成了1-氨基-4, 4′, 5, 5′-四硝基-2, 2′-联咪唑(ATNBI)和1, 1′-二氨基-4, 4′, 5, 5′-四硝基-2, 2′-联咪唑(DATNBI),表征了目标物结构;获得了DATNBI单晶并进行结构解析;利用差示扫描量热(DSC)方法研究DATNBI的热稳定性;采用Gaussian 09程序[15]和Kamlet-Jacobs方程[16]预估了化合物DATNBI和ATNBI的爆轰性能,为进一步研究提供支撑。
2 实验部分 2.1 试剂与仪器浓氨水(质量分数w=26%~28%)、浓盐酸(w=36%~38%)、二甲基甲酰胺、异丙醇、氯仿、甲醇、乙腈、乙酸乙酯、石油醚,分析纯,成都市科龙化工试剂厂;四乙基氢氧化铵的甲醇溶液(w=25%),分析纯,Aldrich试剂公司;TNBI·2H2O、2, 4, 6-三甲基苯磺酰羟胺(MSH), 均为实验室自制。
AV 500型(500 MHz)超导核磁共振仪,瑞士BRUKER公司;NEXUS 870型傅里叶变换红外光谱仪,美国热电尼高力公司;VARIO-EL-3型元素分析仪,德国EXEMENTAR公司;Q-200差示扫描量热仪,美国TA公司;Smart APEXⅡCCD四圆单晶衍射仪,瑞士BRUKER公司。
2.2 合成路线以TNBI·2H2O为原料、MSH为N-胺化试剂,经N-胺化反应合成了2种N-氨基化合物—ATNBI和DATNBI,合成路线如图 1所示。
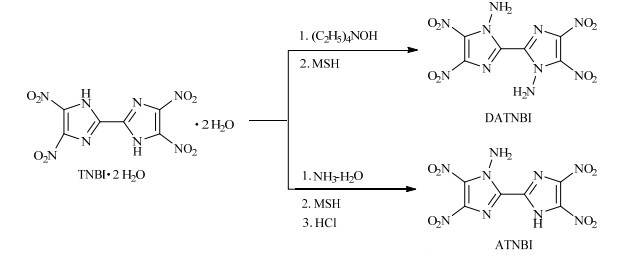
|
图 1 ATNBI和DATNBI的合成路线 Fig.1 Synthetic routes of ATNBI and DATNBI |
室温下,将3.44 g(9.82 mmol) TNBI·2H2O加入80.0 mL水中,体系冷却至5~10 ℃,滴加5.0 mL浓氨水,加完后升温至50 ℃反应6 h,降温至5 ℃搅拌10 min,过滤、异丙醇洗、干燥得黄色固体;室温下,取1.04 g(3 mmol) 上述黄色固体溶解于15.0 mL二甲基甲酰胺中,分批加入0.86 g(4 mmol) MSH,加完后室温反应20 h,将反应液倒入60.0 mL水中,氯仿萃取,萃取残液浓缩后,浓盐酸酸化至pH=3,冷却、过滤、水洗、干燥得0.49 g黄色固体,收率为49.6%。
1H NMR(DMSO-d6, 500 MHz),化学位移δ:7.23(s, 2H, NH2);13C NMR(DMSO-d6, 125 MHz), δ:132.13、135.38、135.70、137.47、139.36、140.61;IR(KBr, cm-1),波数υ:3 336、3 264、1 538、1 510、1 402、1 364、1 311、990、854;元素分析C6H3N9O8(质量分数wB/%):计算值:C 21.89, H 0.92, N 38.30;实测值:C 21.82, H 1.01, N 38.39。
2.3.2 1, 1′-二氨基-4, 4′, 5, 5′-四硝基-2, 2′-联咪唑(DATNBI)的合成室温搅拌下,将0.525 g(1.5 mmol) 4, 4′, 5, 5′-四硝基-2, 2′-联咪唑二水合物加入8.0 mL甲醇中,体系冷却至5~10 ℃,滴加1.853 g(3.15 mmol) 25% 四乙基氢氧化铵的甲醇溶液,室温反应0.5 h,过滤、干燥得黄色固体;室温下,将0.968 g(4.5 mmol) MSH溶解于15.0 mL乙腈溶液中,将上述黄色固体加入MSH的乙腈溶液中,在20~25 ℃反应6 h,过滤、蒸除溶剂,色谱柱分离(洗脱剂,体积比V乙酸乙酯: V石油醚=1:2.5)、干燥得0.32 g黄色固体,收率为62.0%。
1H NMR(DMSO-d6, 500 MHz), δ:6.97(s, 4H, 2NH2);13C NMR(DMSO-d6, 125 MHz), δ:131.66、134.30、135.73;IR(KBr, cm-1), υ:3 361、3 259、1 594、1 558、1 532、1 362、1 323、1 144、1 045、850;元素分析C6H4N10O8(wB/%):计算值:C 20.94, H 1.17, N 40.70;实测值:C 20.98, H 1.13, N 40.75。
2.4 DATNBI单晶培养准确称量1.0 g纯度大于99.0% 的DATNBI样品,将其加入10.0 mL无水乙腈中,加热至40 ℃使DATNBI完全溶解,自然冷却至室温,过滤出不溶物,滤液置于干净的烧杯中,在20~25 ℃下缓慢挥发7 d后,得到淡黄色柱状晶体,从中挑选合适尺寸的单晶颗粒进行结构测试。
2.5 DATNBI晶体结构测定选取0.36 mm×0.27 mm×0.14 mm的单晶,在Smart APEX Ⅱ CCD衍射仪上,用MoKα射线(波长λ=0.071 073 nm)、石墨单色器。在温度为(296±2) K下,以ω扫描方式扫描,扫描范围:2.34°≤θ≤25.10°,-5≤h≤5,-8≤k≤5,-20≤l≤20,其中,θ为衍射角,h、k、l分别为晶面衍射指标,共收集衍射点2 792个,其中独立衍射点1 050个,选取I>2σI (I为衍射强度,σI为衍射强度的标准误差)的1 050个点用于结构测定和修正,全部数据均经Lp因子和半经验吸收校正,所有计算均用SHELXTL—97程序[17-18]完成。
3 结果与讨论 3.1 DATNBI晶体结构解析
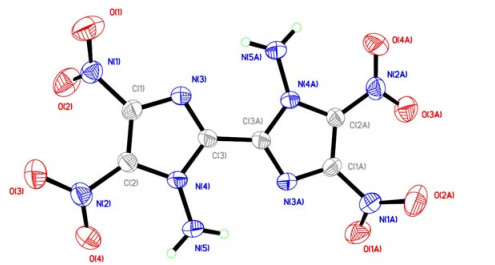
|
图 2 DATNBI的分子结构 Fig.2 Molecular structure of DATNBI |
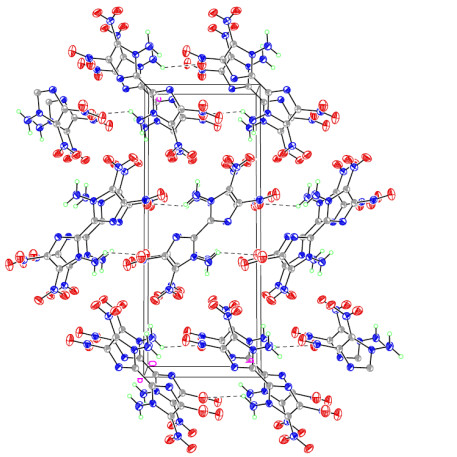
|
图 3 DATNBI的晶胞堆积图 Fig.3 Packing structure of DATNBI unit cell |
晶体分析结果表明,该晶体为单斜晶系,空间群为P2(1)/n。晶体学参数为:a=(0.489 12±0.000 15) nm,b=(0.694 0 ±0.000 2) nm,c=(1.745 6±0.000 5) nm,β=(93.709±0.005)°,V=0.591 3±0.000 3) nm 3,Z=4,Dc=1.933 g·cm-3,μ=0.178 mm-1,F(000)=348,其中,a、b、c分别为晶胞的3个单位向量的长度,β为a和c之间的夹角,V为晶胞体积,Z为晶胞中分子数,Dc为晶体密度,μ为线性吸收系数,F(000)为晶胞中的电子数,单晶编号CCDC号1826482。该晶体结构由Patterrson直接法解出,原子位置均由差值Fourier合成法得到。分子结构用110个参数、由块矩阵最小二乘法进行优化(对于氢原子采用各向同性热参数,对于非氢原子采用各向异性热参数)。对于I>2σI 数据的最终残差因子R1=0.058 0,权重残差因子wR2=0.162 5;对所有数据的偏差因子R1=0.072 6,wR2=0.186 7,最佳拟合度s=1.008,最终差值电子云密度的最高峰为615 e·nm-3,最低峰为-582 e·nm-3。
从图 2、3中可以看出,DATNBI分子属于中心对称结构,在其晶体结构中,所有碳碳键、碳氮键的键长均介于单键和双键键长之间,且O(3)—N(2)—C(2)—C(1)、O(4)—N(2)—C(2)—C(1)的二面角分别为(-14.5±0.5)°和(164.6±0.3)°,表明联咪唑环以及C(2)、C(2)A上连接的2个硝基上的所有原子几乎处在同一平面上。这可能是由于上述所有基团之间形成了一个大的离域共轭体系,从而也使该化合物表现出良好的热稳定性(热分解峰温度为255.8 ℃)。同时,由于DATNBI分子结构中含有大量负电性N、O原子,以及氨基基团中活性氢的存在,使得DATNBI晶胞堆积结构中存在大量的由硝基O原子和氨基H原子之间形成的分子间氢键作用(N—H···O),形成了交联状的三维空间网络结构,有利于进一步提升该化合物的热稳定性。
3.2 DATNBI的热性能采用DSC方法研究了DATNBI的热稳定性(实验条件:动态氮气气氛,压力为0.1 MPa,温度范围25~500 ℃,升温速率5 ℃·min-1,试样量约0.5~1.0 mg,试样皿为铝盘),实验结果如图 4所示。
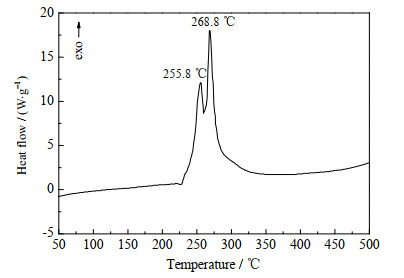
|
图 4 DATNBI的DSC曲线 Fig.4 DSC curve of DATNBI |
从图 4的DSC曲线可知,在升温过程中,DATNBI不存在吸热熔化峰,只有放热分解峰,表明该化合物的热分解是没有经历吸热熔化的相变过程,而是由固相直接分解。DATNBI分别在255.8、268.8 ℃处存在2个明显的放热分解峰,表明该化合物至少经历了2个热分解过程,同时从该化合物的晶胞堆积图(图 3)可以看出,由于该化合物晶体中存在丰富的分子间氢键作用,形成了错综复杂的三维空间网络结构,也使该化合物具有较好的热稳定性。
3.3 目标物的爆轰性能采用Gaussian 09程序[15]中的密度泛函理论(DFT)方法,获得B3LYP/6-31G**水平下目标物的最优稳定优化构型,利用原子化(CBS—4M)方法[19]计算了目标物的固相生成热;基于实测晶体密度和固相生成热,利用Kamlet—Jacobs爆轰方程[16]预估了ATNBI和DATNBI的爆轰性能,目标物与常用炸药TNT、RDX、HMX的爆轰性能见表 1。表中,OB为氧平衡。
由表 1的结果可以看出,2种N-氨基化合物ATNBI和DATNBI,较胺化前体TNBI的密度ρ、生成热ΔHf(s)、爆速u、爆压p和爆热Q等性能都有较大幅度的改善,尤其是向分子中引入2个N-氨基的目标物DATNBI,其质量密度由1.80增加到1.933 g·cm-3,生成热由232.0增加到487.8 kJ·mol-1,爆速和爆压分别由7.840 km·s-1、27.6 GPa增加到8.860 km·s-1、37.0 GPa,由此可知,在化合物分子结构中引入更多的N-氨基结构,可使化合物具有更高的密度、更高的正生成热和更优良的爆轰性能。ATNBI和DATNBI的爆轰性能明显优于TNT,其中DATNBI的性能更优于RDX,是一种综合性能优良的新型高能量密度材料。
|
|
表 1 目标物与常用炸药的性能 Table 1 Properties of target compounds and typical explosives |
(1) 以TNBI为原料,合成了2种N-氨基化合物—1-氨基-4, 4′, 5, 5′-四硝基-2, 2′-联咪唑(ATNBI)和1, 1′-二氨基-4, 4′, 5, 5′-四硝基-2, 2′-联咪唑(DATNBI)。
(2) 获得了DATNBI的单晶并进行结构解析,该化合物为单斜晶系,空间群为P2(1)/n,由于负电性N、O原子以及氨基活性氢的存在,使该化合物晶体中存在丰富的分子间氢键作用,提高了热稳定性,其2个热分解峰温度分别为255.8和268.8 ℃。
(3) 性能研究结果表明,DATNBI的晶体密度为1.933 g·cm-3,理论爆速为8.860 km·s-1,爆压为37.0 GPa,生成热为487.8 kJ·mol-1,综合性能水平优于RDX,是一种综合性能优良的新型高能量密度材料。
| [1] |
霍欢, 王伯周, 翟连杰, 等. 不敏感含能化合物5, 7-二氨基-4, 6-二硝基苯并连三唑-1-氧化物的合成、表征与性能[J]. 含能材料, 2016, 24(9): 857-861. HUO H, WANG B Z, ZHAI L J, et al. An insensitive energetic compound 5, 7-diamino-4, 6-dinitrobenzotriazol-3-ium-1-oxide: synthesis, characterization and performances[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2016, 24(9): 857-861. |
| [2] |
吴军鹏, 曹端林, 王建龙, 等. 3, 4, 5-三硝基吡唑及其衍生物的研究进展[J]. 含能材料, 2016, 24(11): 1121-1130. WU J P, CAO D L, WANG J L, et al. Progress on 3, 4, 5-trinitro-1H-pyrazole and its derivatives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2016, 24(11): 1121-1130. DOI:10.11943/j.issn.1006-9941.2016.11.016 |
| [3] |
HUANG Y, ZHANG Y, SHREEVE J M. Nitrogen-rich salts based on energetic nitroaminodiazido 1, 3, 5-triazine and guanazine[J]. Chemistry - A European Journal, 2011, 17(5): 1538-1546. DOI:10.1002/chem.201002363 |
| [4] |
LIU L, ZHANG Y, ZHANG S, et al. Heterocyclic energetic salts of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazole[J]. Journal of Energetic Materials, 2015, 33(3): 202-214. DOI:10.1080/07370652.2014.970246 |
| [5] |
CROMER D T, STORM C B. Structure of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazole Dihydrate[J]. Acta Crystallographica Section C: Crystal Structure Communications, 1990, c46: 1957-1958. |
| [6] |
KLAPÖTKE T M, PREIMESSER A, STIERSTORFER J. Energetic derivatives of 4, 4', 5, 5'-tetranitro-2, 2'-bisimidazole (TNBI)[J]. Zeitschrift fur Anorganische und Allgemeine Chemie, 2012, 638(9): 1278-1286. DOI:10.1002/zaac.201200188 |
| [7] |
CHAVEZ D E, PARRISH D, PRESTON D N, et al. Synthesis and energetic properties of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazolate (N4BIM) salts[J]. Propellants, Explosives, Pyrotechnics, 2012, 37(6): 647-652. DOI:10.1002/prep.201200040 |
| [8] |
PARASKOS A J, COOKE E D, CAFLIN K C. Bishydrazinium and diammonium salts of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazolate(TNBI): Synthesis and properties[J]. Propellants, Explosives, Pyrotechnics, 2015, 40(1): 46-49. DOI:10.1002/prep.201400056 |
| [9] |
KIM S H, KIM J S. High nitrogen energetic salts of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazole[J]. Bulletin of the Korean Chemical Society, 2013, 34(8): 2503-2506. DOI:10.5012/bkcs.2013.34.8.2503 |
| [10] |
GAPONIK P N, KARAVAI V P. Synthesis of 1-aminotetrazole[J]. Khimiya Geterotsiklicheskikh Soedinenii, 1983, 6(4): 841-842. DOI:10.1007/BF00523087 |
| [11] |
KLAPÖTKE T M, PIERCEY D G, STIERSTORFER J. Amination of energetic anions: High-performing energetic materials[J]. Dalton Transactions, 2012, 41(31): 9451-9459. DOI:10.1039/c2dt30684k |
| [12] |
YIN P, ZHANG Q, ZHANG J, et al. N-trinitroethylamino functionalization of nitroimidazoles: A new strategy for high performance energetic materials[J]. Journal of Materials Chemistry A, 2013, 1(25): 7500-7510. DOI:10.1039/c3ta11356f |
| [13] |
ZHAO X, QI C, ZHANG L, et al. Amination of nitroazoles-A comparative study of structural and energetic properties[J]. Molecules, 2014, 19(1): 896-910. DOI:10.3390/molecules19010896 |
| [14] |
LI Y, LIU N, SU P, et al. Synthesis and structural characterization of N-amino compounds[J]. Asian Journal of Chemistry, 2014, 26(21): 7151-7156. DOI:10.14233/ajchem.2014.16529 |
| [15] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09[CP]. Wallingford CT: Gaussian Inc, 2009.
|
| [16] |
KAMLET M J, JACOBS S J. Chemistry of detonations. Ⅰ. A simple method for calculating detonation properties of C-H-N-O explosives[J]. The Journal of Chemical Physics, 1968, 48(1): 23-35. DOI:10.1063/1.1667908 |
| [17] |
SHELDRICK, G. M. SHELXTL-97, Program for crystal structure solution[CP]. Göttingen: University of Göttingen, 1997.
|
| [18] |
SHELDRICK, G. M. SHELXTL-97, Program for crystal structure refinement[CP]. Göttingen: University of Göttingen, 1997.
|
| [19] |
MONTGOMERY J A, FRISCH M J, OCHTERSKI J W, et al. A complete basis set model chemistry Ⅶ. Use of the minimum population localization method[J]. The Journal of Chemical Physics, 2000, 112(15): 6532-6542. DOI:10.1063/1.481224 |




