2. 河北省科学院 能源研究所,河北 石家庄 050081
2. Institute of Energy Resources, Hebei Academy of Sciences, Shijiazhuang 050081, China
近年来,锂离子电池具有较高的能量密度,优异的循环寿命和突出的安全性能,被认为是最具潜力的储能设备之一[1-3]。但是,目前锂离子电池依然不能满足电动汽车和混合动力电动汽车对能量密度的高要求。正极材料镍锰酸锂(LiNi0.5Mn1.5O4,LNMO)因具有资源丰富、成本低、安全性好等特点,引起广大研究者的关注。该材料具有146.7 mAh·g-1的理论容量和4.7 V的高工作电压,从而拥有高能量密度(650 Wh·kg-1),其能量密度高于目前常用的钴酸锂(518 Wh·kg-1)、磷酸铁锂(495 Wh·kg-1)及锰酸锂(492 Wh·kg-1)的能量密度[4-5]。然而,高的工作电位会导致锰离子溶解和电解液分解的问题,有机电解液分解会产生多种有机与无机副产物(C2H5OCOOPF4、HF、LiF等),反应过程如式(1)和(2)。这些副产物会附着于LNMO材料表面,从而形成固体电解质界面层(solid electrolyte interface,SEI),增加电池阻抗。另外,HF还会破坏LNMO的晶体结构,反应过程如式(3),将破坏电极材料结构的稳定性,进而导致容量随着循环严重衰减[6-9]。以上这些问题严重削弱了LNMO材料的倍率性能和循环稳定性。为了改善LNMO材料的电化学性能,研究人员对该材料做了许多改性工作:一是在材料中掺杂金属或非金属元素,例如掺杂Mg[10]、Al[11]、Co[12]、Ni[13]、Si[14]和F[15]等元素;二是对材料进行表面包覆,如包覆ZrO2[16]、LiFePO4[17]、MgF2[18]、ZnO[19]和FePO4[20]等物质。研究证明对LNMO材料进行表面包覆能够有效地阻止副反应发生,进而改善该材料的电化学性能。
| ${\rm{LiP}}{{\rm{F}}_{\rm{6}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{LiF + P}}{{\rm{O}}_{\rm{4}}}{{\rm{H}}_{\rm{3}}}{\rm{ + 5HF}}$ | (1) |
| ${\rm{DEC + LiP}}{{\rm{F}}_{\rm{6}}} \to {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OCOOP}}{{\rm{F}}_{\rm{4}}}{\rm{ + }}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{4}}}{\rm{ + HF + LiF}}$ | (2) |
| ${\rm{2LiN}}{{\rm{i}}_{{\rm{0}}{\rm{.5}}}}{\rm{M}}{{\rm{n}}_{{\rm{1}}{\rm{.5}}}}{{\rm{O}}_{\rm{4}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 4}}{{\rm{F}}^{\rm{ - }}} \to {\rm{3N}}{{\rm{i}}_{{\rm{0}}{\rm{.25}}}}{\rm{M}}{{\rm{n}}_{{\rm{0}}{\rm{.75}}}}{{\rm{O}}_{\rm{2}}}{\rm{ + 0}}{\rm{.25Ni}}{{\rm{F}}_{\rm{2}}}{\rm{ + 0}}{\rm{.75Mn}}{{\rm{F}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + 2LiF}}$ | (3) |
实验室制备LNMO正极材料多采用溶胶凝胶法[21]、共沉淀法[22]及固相法[23]等,而固相法被认为是一种简单、易行、且易大规模工业化的合成路线。TiO2资源丰富,成本低,结构稳定,并且对提高正极材料的电化学性能具有积极的作用[24]。最近,ZHANG等[25]通过改进的溶胶凝胶法将TiO2包覆于锰酸锂正极材料表面,在室温和高温环境下被修饰后的锰酸锂电化学性能都有不同程度的提高。本文采用固相法制备LNMO正极材料,随后采用简单易行的液相包覆方法,制备不同TiO2包覆量的LNMO材料,并对制备出的材料进行结构表征及电化学性能分析,系统研究TiO2包覆对LNMO材料结构及电化学性能的影响。
2 实验 2.1 原料及设备实验所用的主要原料:碳酸锂(99.0%,Li2CO3),氧化镍(99.0%,NiO),二氧化锰(90.0%,MnO2),钛酸四异丙酯(C12H28O4Ti),上海阿拉丁股份有限公司;导电炭黑,上海汇平化工有限公司;聚偏氟乙烯(PVDF),深圳市泰能材料有限公司;电解液1 mol·L-1六氟磷锂(LiPF6)/碳酸乙烯酯(EC)+碳酸二甲酯(DMC) (体积比1:1),深圳新宙邦科技股份有限公司;N-甲基吡咯烷酮(NMP),迈奇化学股份有限公司。
实验所用的主要仪器:南京南大仪器厂生产的球磨机;合肥科晶材料技术有限公司生产的箱式炉和管式炉;米开罗那有限责任公司生产的手套箱;武汉市蓝电电子股份有限公司生产的CT2001A型电池测试系统;美国Gamry公司生产Interface 1000型电化学工作站;日本Rigaku公司生产的Ultima IV型X射线衍射(X-ray diffraction,XRD);捷克Tescan公司生产的Maia3 MHL型扫描电子显微镜(scanning electron microscope,SEM),带有能谱仪(energy disperse spectroscopy,EDS);日本FEI公司生产的Tecnai G2 F20S-TWIN型场发射透射电镜(transmission electron microscope,TEM);美国Thermo Electron公司生产的ESCALAB 250型X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)。
2.2 样品制备将3.879 g Li2CO3、3.773 g NiO、14.490 g MnO2、75 mL无水乙醇和300 g大、中、小氧化锆珠子加入到500 mL的球磨罐。以300 r·min-1转速球磨16 h,随后将混合物干燥,获得的材料置于箱式炉中,空气气氛中,先从室温以5 ℃·min-1升温速率,经95 min升温至500 ℃煅烧5 h,再连续经1 h升温至800 ℃煅烧8 h,自然降温冷却,得到LNMO正极材料,标记为Pristine-LNMO。
将89 mg钛酸四异丙酯(TTIP)加入到30 mL的无水乙醇中,搅拌均匀后加入5 g LNMO,继续搅拌1 h,升温至90~100 ℃,搅拌蒸干。再将蒸干的材料放入管式炉中,从室温以5 ℃·min-1升温速率经85 min至450 ℃煅烧5 h,自然降温冷却,获得TiO2包覆的LNMO材料LNMO-T-1 (TiO2的质量分数为0.5%)。按以上方法,制备得到LNMO-T-2 (TiO2的质量分数为1.0 %)和LNMO-T-3 (TiO2的质量分数为2.0%)。
2.3 电极的制备和电池的组装将活性物质LNMO、PVDF以及导电炭黑按质量比8:1:1混合均匀,加入适量NMP,研磨5 h制成均匀电极浆料。采用涂膜法,用湿膜制备器将混合均匀的电极浆料均匀涂覆在铝箔集流体上,电极浆料厚度为100 μm,烘干得到整张电极片。然后使用压片机将整张电极片切成直径为1.2 cm的电极片,将压后的电极片放入真空干燥箱中,烘干所含微量的水分,转移至手套箱中。CR2032型纽扣式电池在氩气保护的手套箱中组装,电池中的正极是敷有LNMO材料浆料的圆形电极片,负极是金属锂片,滴入电解液,正负极间的隔膜是Celgard 2400聚丙烯微孔膜。电池组装好后静置12 h后即可进行电化学测试。
2.4 表征方法采用XRD测试材料的晶体结构,以Cu-Kα为辐射源,管压40 kV,管流40 mA,扫描范围2θ为10~90°,扫描速率为0.02°·s-1,停留时间2 s。采用SEM和TEM观察材料形貌和表面包覆层。采用EDS和XPS确定材料的元素组成及化合价。
2.5 电化学性能测试采用CT2001A型电池测试系统对扣式电池进行恒流充放电测试,电池充放电测试电压范围3.5~5 V,充放电倍率为0.2、0.5、1、2、3、5和7 C (1 C = 140 mAh·g-1)。
采用Interface 1 000电化学工作站对扣式电池进行循环伏安测试(cyclic voltammetry,CV)及交流阻抗测试(electrochemical impedance spectroscopy,EIS)。循环伏安测试的电压范围3.5~5 V,扫描速率为0.2 mV·s-1,交流阻抗测试的频率为10 mHz ~100 kHz。
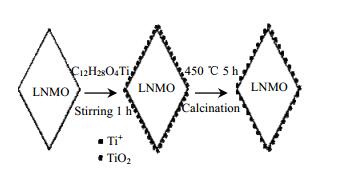
3 结果与讨论 3.1 结构与形貌图 1为采用TTIP作为Ti源,制备TiO2包覆LNMO材料的过程。首先通过搅拌使Ti+均匀分布于LNMO材料表面,然后将蒸干的材料在空气氛围中煅烧。在此过程中,TIPP中的C、O元素反应成为CO2与H2O脱离材料,从而在LNMO表面形成TiO2包覆层。
|
图 1 TiO2包覆的LNMO材料的制备过程 Fig.1 Preparation process of TiO2 coated LNMO materials |
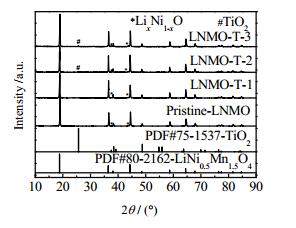
图 2为不同样品的XRD图谱。从图中可以看出,所有样品的特征衍射峰都较尖锐,衍射峰与标准LNMO卡片(PDF#80-2162)一致,说明材料的结晶度较好。采用TiO2包覆后的LNMO材料依然保持着较好的尖晶石结构,说明表面TiO2包覆过程并没有破坏晶体结构。另外,由于高温煅烧使晶体产生氧空位,从而产生LixNi1-xO杂质,对应于XRD图中2θ为37.5°、43.6°的杂质峰[26]。可以看出,所有材料都具有微小量的杂质成分。因为TiO2含量相对较少,包覆改性后材料的XRD图谱中不能检测到TiO2全部清晰的衍射峰。值得注意的是,LNMO-T-2和LNMO-T-3在位于2θ为25.6°的位置出现TiO2微弱的衍射峰,并且随着包覆TiO2量的增加而逐渐增强,从而确定包覆后的LNMO材料中有TiO2存在。
|
图 2 Pristine-LNMO、LNMO-T-1、LNMO-T-2和LNMO-T-3样品的XRD图谱 Fig.2 XRD patterns of Pristine-LNMO, LNMO-T-1, LNMO-T-2 and LNMO-T-3 samples |
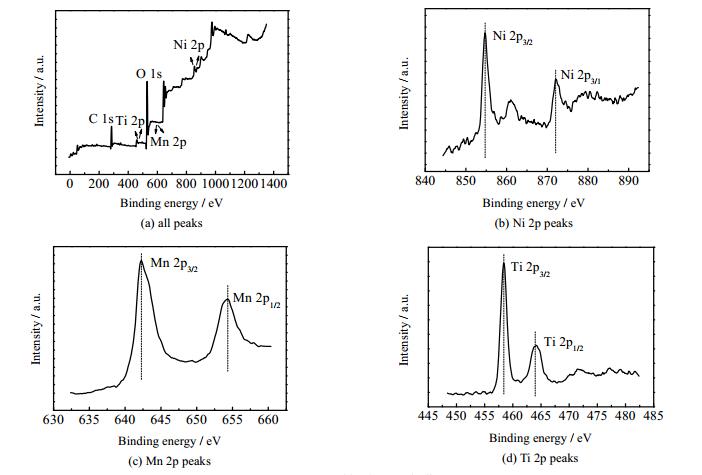
为了分析各元素在LNMO-T-2中的存在形式,对该样品进行XPS测试。从图 3(b)的Ni 2p光谱中,可以观察到在854.9和872.5 eV处有2个不同的峰,分别对应于Ni 2p3/2和Ni 2p1/2轨道Ni2+的特征峰[27]。从图 3(c)中可以看出,Mn 2p图谱中有2个分离良好的峰,分别对应于Mn 2p3/2和Mn 2p1/2轨道Mn4+的特征峰[28]。而图 3(d)中,Ti 2p图谱中也有2个明显分离的峰,分别对应于Ti 2p3/2和Ti 2p1/2轨道Ti4+的特征峰[29],说明材料表面具有以Ti4+形式存在的钛元素。
|
图 3 LNMO-T-2样品的XPS能谱图 Fig.3 XPS patterns of the LNMO-T-2 sample |
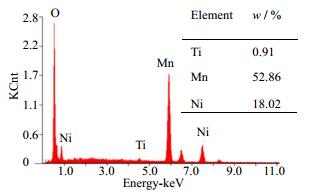
图 4(a)为Pristine-LNMO的SEM照片,可以看出,采用固相球磨法制得的LNMO材料为表面光滑的纳米颗粒。图 4(b)为LNMO-T-2的SEM照片,可以看到经过TiO2包覆后的LNMO材料表面相对较为粗糙,甚至出现少许微小粒子。图 5为LNMO-T-2的EDS能谱图,Ti元素所占的质量百分比为0.91%。图 6为LNMO-T-2的EDS能谱元素分布图,图中显示Ni、Mn和Ti元素清晰存在,Ti元素的分布具有与Ni和Mn元素相同的均匀性。

|
图 4 Pristine-LNMO和LNMO-T-2样品的SEM照片 Fig.4 SEM micrographs of Pristine-LNMO and LNMO-T-2 samples |
|
图 5 LNMO-T-2样品的能谱图 Fig.5 EDS pattern of the LNMO-T-2 sample |

|
图 6 LNMO-T-2样品的能谱元素扫描图 Fig.6 EDS maps of the LNMO-T-2 sample |
图 7为Pristine-LNMO和LNMO-T-2的TEM照片。从图 7(a)可以看出,Pristine-LNMO粒子为表面光滑且边界清晰的纳米颗粒,而从图 7(b)展示的LNMO-T-2的粒子表面相对较粗糙,且颗粒的边界模糊。2种样品都有对应于尖晶石相(111)平面的清晰晶格条纹和0.47 nm的晶格间距,说明2种样品都有良好的结晶度。另外,可以清晰地观察到在LNMO-T-2表面有一层致密的包覆层。结合前面XRD、XPS、SEM和EDS结果,可以确定此包覆层是TiO2。

|
图 7 Pristine-LNMO和LNMO-T-2样品的TEM照片 Fig.7 TEM micrographs of Pristine-LNMO and LNMO-T-2 samples |
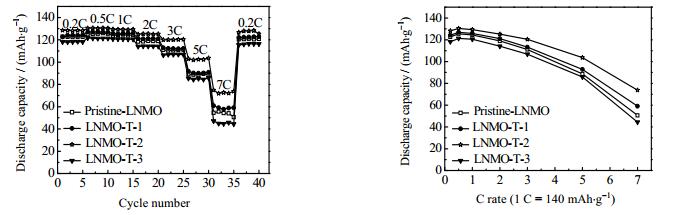
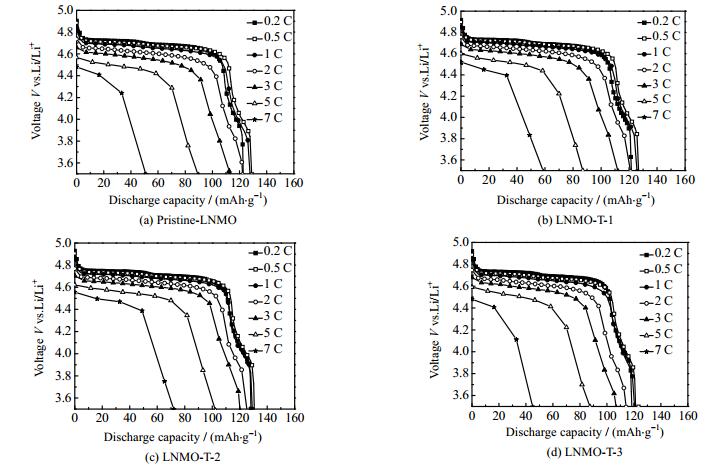
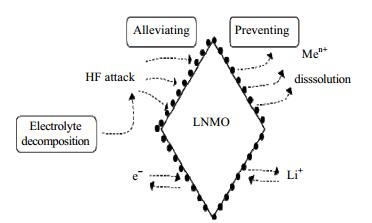
图 8为不同样品的倍率性能曲线。从图中可知,与Pristine-LNMO相比,LNMO-T-1、LNMO-T-2和LNMO-T-3的放电比容量在不同的倍率下都有显著提升,尤其是在5 C和7 C倍率下,LNMO-T-2样品呈现出最好的倍率性能。表 1列出了不同样品在不同倍率下的放电比容量。其中,Pristine-LNMO的放电比容量在0.2、0.5、1、2、3、5和7 C倍率下依次为122.6、126.0、124.1、118.9、110.8、89.5和54.0 mAh·g-1;LNMO-T-1的放电比容量依次为123.1、127.0、125.7、121.1、112.0、90.2和58.8 mAh·g-1;LNMO-T-2的放电比容量依次为126.0、130.6、129.0、125.1、120.3、102.3和72.1 mAh·g-1;LNMO-T-3的放电比容量依次为118.2、121.3、120.5、114.2、106.9、84.4和45.7 mAh·g-1。随着TiO2包覆量的增加,TiO2包覆的LNMO材料的倍率性能先提高后降低。倍率性能的降低归因于过厚的TiO2包覆层会阻碍Li+的传输[24]。图 9(a~d)为不同样品在不同倍率下的放电曲线。所有的曲线都是由4.7 V的长平台和4.0 V的一个短平台组成,它们分别归因于Ni2+/Ni4+和Mn3+/Mn4+的氧化还原反应[30]。从图中可知TiO2包覆的LNMO正极材料的放电平台的极化程度小于未包覆的LNMO正极材料的极化程度,其中LNMO-T-2的极化程度最小,表明TiO2包覆层能够削弱电极在充放电过程中的极化作用。在LNMO材料表面包覆适量的TiO2可以有效减弱该材料表面与电解液之间的副反应,削弱由电解液分解产生的HF对LNMO结构的攻击,减少锰离子溶解于电解液,从而防止了LNMO材料结构的破坏,进而提高LNMO材料的倍率性能[24],如图 10所示。
|
图 8 Pristine-LNMO、LNMO-T-1、LNMO-T-2和LNMO-T-3样品的倍率性能曲线 Fig.8 Rate capability curves of Pristine-LNMO, LNMO-T-1, LNMO-T-2 and LNMO-T-3 samples |
|
|
表 1 不同样品在不同倍率下的放电比容量 Table 1 Discharge capacities of different samples at different C rates |
|
图 9 不同样品在不同倍率下的恒流放电曲线 Fig.9 Galvanostatic discharge curves of different samples at different C rates |
|
图 10 TiO2包覆层改进LNMO电化学性能的机理 Fig.10 Mechanism of electrochemical performance improvement of TiO2 coated LNMO |
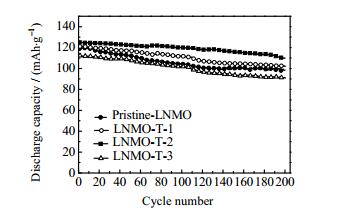
图 11对比了在常温条件下不同样品在2 C倍率下经过200次充放电循环后的稳定性。Pristine-LNMO、LNMO-T-1、LNMO-T-2和LNMO-T-3的首次放电容量为119.3、120.9、123.0、112.5 mAh·g-1,经过200次的充放电循环后放电容量变为98.7、102.0、108.1、91.1 mAh·g-1,容量保持率分别为82.7%、84.4%、87.9%和81.8%(表 2所示),其中LNMO-T-2样品的循环稳定性最好。TiO2包覆于LNMO材料表面,阻止了LNMO材料与电解液的副反应,改善了LNMO的循环稳定性,随着TiO2包覆量的增多,阻碍了Li+的传输,增大电极的电阻,所以LNMO-T-3样品的循环稳定性较低[24]。
|
图 11 Pristine-LNMO、LNMO-T-1、LNMO-T-2和LNMO-T-3样品在2 C倍率下的循环稳定性 Fig.11 Cycling stability of Pristine-LNMO, LNMO-T-1, LNMO-T-2 and LNMO-T-3 samples at 2 C |
|
|
表 2 不同样品在2 C倍率下的放电容量保持率 Table 2 Discharge capacity retention of different samples at 2 C |
图 12(a)为不同样品的CV曲线。在4.6~4.9 V处出现双峰,对应Ni2+/Ni3+和Ni3+/Ni4+的氧化还原峰,4.1 V左右处出现的小峰对应着Mn3+/Mn4+的氧化还原峰[31]。LNMO材料的容量主要由较强的Ni2+/Ni4+的氧化还原提供。经过TiO2包覆后的LNMO材料的CV曲线并没有出现其他氧化还原峰,说明形成的TiO2并没有发生氧化还原反应。相比其他样品,LNMO-T-2表现出最大的峰值电流,说明LNMO-T-2具有最优异的充放电性能。表 3列出不同样品氧化还原峰的电位差。从表中可以看出,TiO2包覆的LNMO材料电位差均小于Pristine-LNMO电位差,其中LNMO-T-2的电位差最小(0.282 V),说明LNMO-T-2的极化程度最小,与前面图 9(a~d)充放电曲线表现一致。进一步证明在LNMO表面包覆一层TiO2可以阻止LNMO材料的极化,防止电极材料结构的坍塌,使LNMO-T-2正极材料具有最好的可逆性。
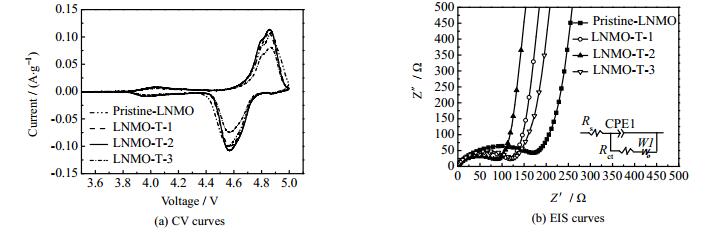
|
图 12 Pristine-LNMO、LNMO-T-1、LNMO-T-2和LNMO-T-3样品的循环伏安曲线以及交流阻抗曲线 Fig.12 CV and EIS curves of Pristine-LNMO, LNMO-T-1, LNMO-T-2 and LNMO-T-3 samples |
|
|
表 3 不同样品的阳极峰电位(φpa,V)、阴极峰电位(φpc,V)以及电位差(∆V,V) Table 3 Potentials of anode (φpa, V) and cathode peaks (φpc, V) and potential difference (∆V, V) of different samples |
图 12(b)为不同样品的EIS曲线。所有曲线均由高频区的半圆弧和低频区的斜线组成。半圆弧主要与电解质/电极界面之间复杂的电化学反应有关,其大小表示电荷转移的阻抗(Rct),反映电极能否进行大倍率充放电。低频区斜线的斜率与Li+的动力学性能有关,斜率越高,Li+动力学性能越优越[32]。Pristine-LNMO、LNMO-T-1、LNMO-T-2和LNMO-T-3的Rct分别为172.4、127.4、90.7和141.7 Ω,其中LNMO-T-2的Rct最小,且在中低频区的斜线具有最大的斜率。说明TiO2包覆层有利于减小Rct,提高材料的Li+动力学性能,进而提高材料的电化学性能。
4 结论(1) 采用固相球磨法制备出LNMO正极材料,并将TiO2包覆于LNMO材料表面。XRD、TEM、SEM、EDS、XPS一系列结构表征结果证明,TiO2能够均匀地包覆于LNMO晶体表面且未改变LNMO晶体结构。
(2) 电化学测试结果表明,当TiO2包覆量为w=1.0%时,LNMO-T-2具有最优的倍率性能及循环稳定性。尤其在7 C倍率下容量有显著提高,从54.0提升到72.1 mAh·g-1,在2 C倍率下进行200次循环,LNMO-T-2的容量保持率为87.9%,高于Pristine-LNMO容量保持率(82.7%)。
(3) 采用液相法将质量分数w = 0.5%或w = 1.0% TiO2包覆于LNMO材料表面,能够减弱电极极化程度,降低Rct,提高材料的Li+动力学性能,从而改善LNMO材料的电化学性能。该方法简单、易行,易于工业化。
| [1] |
TARASCON J M, ARMAND M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359-367. DOI:10.1038/35104644 |
| [2] |
ARMAND M, TARASCON J M. Building better batteries[J]. Nature, 2008, 451(7179): 652-657. DOI:10.1038/451652a |
| [3] |
KIM T H, PARK J S, CHANG S K, et al. The current move of lithium ion batteries towards the next phase[J]. Energy Materials, 2011, 2(7): 860-872. |
| [4] |
MANTHIRAM A, CHEMELEWSKI K, LEE E S, et al. A perspective on the high-voltage LiNi0.5Mn1.5O4 spinel cathode for lithium-ion batteries[J]. Energy & Environmental Science, 2014, 7(4): 1339-1350. |
| [5] |
LU J, LEE K S. Spinel cathodes for advanced lithium ion batteries: A review of challenges and recent progress[J]. Materials Technology, 2016, 31(11): 628-641. DOI:10.1080/10667857.2016.1208957 |
| [6] |
GAO Z G, SUN K, CONG L N, et al. High performance 5 V LiNi0.5Mn1.5O4 spinel cathode materials synthesized by an improved solid-state method[J]. Journal of Alloys and Compounds, 2016, 654: 257-263. DOI:10.1016/j.jallcom.2015.08.066 |
| [7] |
FENG X Y, SHEN C, XIANG H F, et al. High rate capability of 5 V LiNi0.5Mn1.5O4 cathode material synthesized via a microwave assist method[J]. Journal of Alloys and Compounds, 2017, 695: 227-232. DOI:10.1016/j.jallcom.2016.10.186 |
| [8] |
HONG S K, MHO S I, YEO H, et al. Structural and electrochemical characteristics of morphology-controlled Li[Ni0.5Mn1.5]O4 cathodes[J]. Electrochimica Acta, 2015, 156: 29-37. DOI:10.1016/j.electacta.2015.01.027 |
| [9] |
LU D S, XU M Q, ZHOU L, et al. Failure mechanism of graphite/LiNi0.5Mn1.5O4 cells at high voltage and elevated temperature[J]. Journal of Electrochemical and Society, 2013, 160(5): A3138-A3143. DOI:10.1149/2.022305jes |
| [10] |
LIU M H, HUANG H T, LIN C M, et al. Mg gradient-doped LiNi0.5Mn1.5O4 as the cathode material for Li-ion batteries[J]. Electrochimica Acta, 2014, 120: 133-139. DOI:10.1016/j.electacta.2013.12.065 |
| [11] |
SUN P, MA Y, ZHAI T Y, et al. High performance LiNi0.5Mn1.5O4 cathode by Al-coating and Al3+-doping through a physical vapor deposition method[J]. Electrochimica Acta, 2016, 191: 237-246. DOI:10.1016/j.electacta.2016.01.087 |
| [12] |
YANG Y, Li S, ZHANG Q, et al. Spherical agglomeration of octahedral LiNi0.5Co4xMn1.5-3xO4 cathode material prepared by a continuous coprecipitation method for 5 V lithium-ion batteries[J]. Industrial and Engineering Chemistry Research, 2017, 56(1): 175-182. |
| [13] |
MAO J, DAI K H, XUAN M J, et al. Effect of chromium and niobium doping on the morphology and electrochemical performance of high-voltage spinel LiNi0.5Mn1.5O4 cathode material[J]. ACS Applied Materials & Interfaces, 2016, 8(14): 9116-9124. |
| [14] |
KEPPELER M, NAGESWARAN S, KIM S J, et al. Silicon doping of high voltage spinel LiNi0.5Mn1.5O4 towards superior electrochemical performance of lithium ion batteries[J]. Electrochimica Acta, 2016, 213: 904-910. DOI:10.1016/j.electacta.2016.08.014 |
| [15] |
LUO Y, LI H Y, LU T L, et al. Fluorine gradient-doped LiNi0.5Mn1.5O4 spinel with improved high voltage stability for Li-ion batteries[J]. Electrochimica Acta, 2017, 238: 237-245. DOI:10.1016/j.electacta.2017.04.043 |
| [16] |
WU H, BELHAROUAK I, ABOUIMRANE A, et al. Surface modification of LiNi0.5Mn1.5O4 by ZrP2O7 and ZrO2 for lithium-ion batteries[J]. Journal of Power Sources, 2010, 195(9): 2909-2913. DOI:10.1016/j.jpowsour.2009.11.029 |
| [17] |
LIU D, TROTTIER J, CHAREST P, et al. Effect of nano LiFePO4 coating on LiMn1.5Ni0.5O4 5 V cathode for lithium ion batteries[J]. Journal of Power Sources, 2012, 204: 127-132. DOI:10.1016/j.jpowsour.2011.11.059 |
| [18] |
KRAYTSBERG A, DREZNER H, AUINAT M, et al. Atomic layer deposition of a particularized protective MgF2 film on a Li-ion battery LiMn1.5Ni0.5O4 cathode powder material[J]. ChemNanoMat, 2015, 1(8): 577-585. DOI:10.1002/cnma.201500149 |
| [19] |
ARREBOLA J, CABALLERO A, HERN L, et al. Re-examining the effect of ZnO on nano sized 5 V LiNi0.5Mn1.5O4 spinel: an effective procedure for enhancing its rate capability at room and high temperatures[J]. Journal of Power Sources, 2010, 195(13): 4278-4284. DOI:10.1016/j.jpowsour.2010.01.004 |
| [20] |
LIU D, BAI Y, ZHAO S, et al. Improved cycling performance of 5 V spinel LiMn1.5Ni0.5O4 by amorphous FePO4 coating[J]. Journal of Power Sources, 2012, 219: 333-338. DOI:10.1016/j.jpowsour.2012.07.058 |
| [21] |
史晋宜, 丁元生. 不同方法合成LiNi0.5Mn1.5O4对其形貌及性能影响研究[J]. 山东化工, 2012, 41(11): 18-20. SHI J Y, DING Y S. Different methods to synthesize LiNi0.5Mn1.5O4 and effect on morphology and properties[J]. Shandong Chemical Industry, 2012, 41(11): 18-20. DOI:10.3969/j.issn.1008-021X.2012.11.006 |
| [22] |
ZHANG K, LI P, MA M, et al. Designed seamless outer surface: Application for high voltage LiNi0.5Mn1.5O4 cathode with excellent cycling stability[J]. Journal of Power Sources, 2016, 336: 307-315. DOI:10.1016/j.jpowsour.2016.10.074 |
| [23] |
SCLAR H, HAIK O, MENACHEM T, et al. The effect of ZnO and MgO coatings by a sono-chemical method on the stability of LiMn1.5Ni0.5O4 as a cathode material for 5 V Li-ion batteries[J]. Journal of the Electrochemical Society, 2012, 159(3): A228-A237. DOI:10.1149/2.032203jes |
| [24] |
KIM S J, KIM M C, KWAK D H, et al. Highly stable TiO2 coated LiMnO3 cathode materials for lithium-ion batteries[J]. Journal of Power Sources, 2016, 304: 119-127. DOI:10.1016/j.jpowsour.2015.11.020 |
| [25] |
ZHANG C C, LIU X Y, WU J H, et al. Enhancing electrochemical performance of LiMn2O4 cathode material at elevated temperature by uniform nano sized TiO2 coating[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(1): 640-647. |
| [26] |
ZHONG Q, Bonakdarpour A, ZHANG M, et al. Synthesis and electrochemistry of LiNixMn2-xO4[J]. Journal of Electrochemical Society, 1997, 144(1): 205-213. DOI:10.1149/1.1837386 |
| [27] |
WEI Y J, KIM K B, CHEN G, et al. Evolution of the local structure and electrochemical properties of spinel LiNixMn2-xO4 (0 ≤ x ≤ 0.5)[J]. Electrochimica Acta, 2006, 51(16): 3365-3373. DOI:10.1016/j.electacta.2005.09.035 |
| [28] |
LU J, PENG Q, WANG W Y, et al. Nano scale coating of LiMO2 (M=Ni, Co, Mn) nano belts with Li+-conductive Li2TiO3: toward better rate capabilities for Li-ion batteries[J]. Chemical Society Reviews, 2013, 135(5): 1649-1652. DOI:10.1021/ja308717z |
| [29] |
SACHS M, GELLERT M, CHEN M, et al. LiNi0.5Mn1.5O4 high voltage cathode coated with Li4Ti5O12: a hard X-ray photoelectron spectroscopy (HAXPES) study[J]. Physical Chemistry Chemical Physics, 2015, 17(47): 31790-31800. DOI:10.1039/C5CP03837E |
| [30] |
MANTHIRAM A, CHEMELEWSKI K, LEE E S, et al. A perspective on the high-voltage LiMn1.5Ni0.5O4 spinel cathode for lithium-ion batteries[J]. Energy & Environmental Science, 2014, 7(4): 1339-1350. |
| [31] |
HUANG B, LI X H, WANG Z X, et al. A novel carbamide-assistant hydrothermal process for coating Al2O3 onto LiMn1.5Ni0.5O4 particles used for cathode material of lithium-ion batteries[J]. Journal of Alloys and Compounds, 2014, 585: 313-319. |
| [32] |
CHO H M, CHEN M V, MACRAE A C, et al. Effect of surface modification on nano-structure LiNi0.5Mn1.5O4 spinel materials[J]. ACS Applied Materials & Interfaces, 2015, 7(30): 16231-16239. |




