目前世界范围内销售的药物中超过三分之一都具有手性结构,新药多倾向以单一对映体形式申报[1]。药物对映体之间的药理活性、在生物体内的代谢过程及毒副作用方面存在显著差异,因此,手性药物更需要关注其用药的安全性[2]。
酮洛芬((±)-(R, S)-2-(3-苯甲酰基苯基)丙酸,图 1)是一种优良的2-芳基丙酸类非甾体抗炎药,广泛应用于类风湿关节炎治疗、风湿性脊椎炎、产后及术后止痛[3]。酮洛芬分子结构中有一个手性中心,存在一对光学异构体。药理研究表明酮洛芬对映体之间的药理活性存在显著差异,只有S-酮洛芬具有抗炎抗风湿和镇痛作用,而R-酮洛芬几乎没有药理活性,但R-酮洛芬对牙周病有极好的防治作用[4]。因此酮洛芬外消旋体的拆分在临床应用上具有重要使用价值。
|
图 1 S-酮洛芬和R-酮洛芬结构式 Fig.1 Structures of S-ketoprofen and R-ketoprofen |
目前,S-酮洛芬的生产方法主要有两大类:不对称合成法和外消旋体拆分法[5]。不对称合成法存在反应路线过长、产率较低、易发生外消旋化和试剂价格昂贵等缺点[6]。目前,外消旋体拆分法可以分为结晶拆分[7]、生物拆分[8]、色谱拆分[9-10]和手性萃取拆分[11-12]等。但前几种方法由于步骤繁多,过程复杂,拆分成本较高等难以用于实际生产。手性液液萃取拆分法由于其步骤简便,设备简单,能耗低,易于操作等优点而被广泛运用[13],手性液液萃取的关键在于寻找一种合适的手性选择剂。近年来,已有学者采用手性液液萃取技术对酮洛芬对映体进行手性拆分进行研究[12]。目前报道用于酮洛芬拆分的手性选择剂主要有酒石酸类衍生物和环糊精类衍生物。田丰娟等[12]使用三甲基-β-环糊精和自制的L-酒石酸异丁酯双相识别手性萃取拆分酮洛芬对映体,选择性系数最高可以达到1.56。但三甲基-β-环糊精的价格贵,而且其回收再利用的难度较大,同时L-酒石酸异丁酯需自制,在一定程度上也增加了工业化过程的难度。因此,寻找新的价格低廉和高效手性选择剂仍是一个重要的研究方向。
手性离子液体指具有手性中心的离子液体,兼备离子液体的优点和手性识别选择的功能。其具有蒸气压低、热稳定性好、离子导电性能优越等特点以及结构可设计性的优点,即可针对不同的目标分子对离子液体的结构进行精细的调控或通过不同阴阳离子的组合使离子液体满足不同的应用需求[14-16]。目前手性离子液体在拆分手性化合物方面的应用已有相关文献报道[17]。由于天然氨基酸成本较低以及可生物降解等优势,氨基酸离子液体(AAIL)作为手性离子液体中的一类在目前的研究已有报道。Tang等[17]通过添加乙酸铜与氨基酸离子液体[Emim][L-Pro]形成配合物萃取拆分苯丙氨酸对映体,对映体选择性高达50.6%。
本文重点筛选以天然氨基酸为阴离子的手性离子液体,通过实验对比,选择[Bmim][L-Trp]作为手性选择剂,探究了有机溶剂的种类,手性选择剂的浓度,药物浓度,水相pH及甲醇含量等因素对萃取分离效果的影响,优化萃取拆分条件,以期为后续寻找更高效合适的手性选择剂提供参考。
2 实验部分 2.1 主要试剂与仪器1-丁基-3-甲基咪唑L-色氨酸([Bmim][L-Trp])、1-丁基-3-甲基咪唑L-谷氨酸([Bmim][L-Glu])、1-丁基-3-甲基咪唑L-苯丙氨酸([Bmim][L-Phe])、1-丁基-3-甲基咪唑L-丝氨酸([Bmim][L-Ser])(纯度97.0%,上海成捷化学有限公司);酮洛芬(纯度98.0%,上海阿拉丁生化科技有限公司);S-酮洛芬(河南省标物生物科技有限公司商城分公司);1, 2-二氯乙烷、三氯甲烷、正辛醇(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,天津市四友精细化学品有限公司);正癸醇(分析纯,上海阿拉丁生化科技有限公司);正己烷(色谱纯,Sigma-Aldrich);去离子水。
LSHZ-300水浴恒温振荡器(太仓市豪城实验仪器制造有限公司);Agilent 1260 Infinity Ⅱ型液相色谱仪(HPLC,安捷伦有限公司);FA1004A电子天平(上海精天电子仪器有限公司);PHS-25酸度计(上海仪电科学仪器股份有限公司)。
2.2 萃取实验过程因酮洛芬的水溶性不佳,故采用一定浓度的甲醇水溶液溶解酮洛芬。将酮洛芬外消旋体溶于含有一定浓度的手性离子液体的甲醇水溶液中作水相,并用0.3 mol·L-1的磷酸缓冲溶液调节水相pH,有机溶剂作有机相。各取3.0 mL水相和有机相置于10 mL离心管中,在20℃、200 r·min-1置于水浴恒温振荡器中充分振荡3 h,然后静置平衡15 min。待两相平衡后,取有机相进行HPLC分析,由于实验过程中两相体积变化微小,实验误差可忽略不计。水相中酮洛芬的浓度可通过差减法求得。
2.3 分析方法有机相中酮洛芬对映体浓度通过Agilent 1260 Infinity Ⅱ型液相色谱仪及其配套系统检测,手性柱为CHIRALPAKR IG (5 μm,4.6 mm × 250 mm),流动相由正己烷(含0.1%三氟乙酸)与乙醇按体积比92:8配成,流量为1 mL·min-1,紫外检测器检测波长为254 nm,柱温控制在15℃。其中S-酮洛芬后出峰。S-酮洛芬和R-酮洛芬在水相中的浓度通过质量衡算获得。
在平衡时S-酮洛芬和R-酮洛芬的分配系数K和对映体选择性系数α通过式(1-a)、(1-b)与(2)计算:
| $ {K_{\rm{S}}} = \frac{{{C_{{\rm{So}}}}}}{{{C_{{\rm{Sa}}}}}} $ | (1-a) |
| $ {K_{\rm{R}}} = \frac{{{C_{{\rm{Ro}}}}}}{{{C_{{\rm{Ra}}}}}} $ | (1-b) |
| $ \alpha {\rm{ = }}\frac{{{K_{\rm{S}}}}}{{{K_{\rm{R}}}}} $ | (2) |
其中CSo和CSa分别表示有机相和水相中S-酮洛芬的浓度,CRo和CRa分别表示有机相和水相中R-酮洛芬的浓度,KS和KR分别表示S-酮洛芬和R-酮洛芬的分配系数,α为酮洛芬对映体的选择性系数。
3 结果与讨论 3.1 手性离子液体的选择考察了以1-丁基-3-甲基咪唑为阳离子,探究色氨酸、谷氨酸、苯丙氨酸和丝氨酸四种不同氨基酸作为阴离子形成的氨基酸离子液体为手性选择剂对酮洛芬对映体萃取拆分过程的影响,实验结果如表 1所示。实验以1, 2-二氯乙烷为有机相,10%甲醇水溶液中酮洛芬浓度为200 ppm,不同氨基酸离子液体的浓度均为0.04 mol·L-1,pH值2.0。从表 1可以看出,[Bmim][L-Trp]和[Bmim][L-Ser]对酮洛芬拆分有较好的效果,综合考虑分配系数和选择性系数,最终选择[Bmim][L-Trp]作为手性选择剂对酮洛芬进行手性萃取拆分的研究。由表 1中的分配系数和选择性系数还可以看出,[Bmim][L-Trp]对R-酮洛芬的识别能力大于[Bmim][L-Trp]对S-酮洛芬的识别能力。
|
|
表 1 不同氨基酸离子液体对K和α的影响 Table 1 Effects of different AAIL on K and α |
在pH为2.0的10%甲醇水溶液中溶有0.04 mol·L-1的[Bmim][L-Trp]和100ppm酮洛芬对映体,考察了1, 2-二氯乙烷,三氯甲烷,正癸醇,正辛醇和正己烷这五种不同溶剂对酮洛芬对映体分配行为的影响,结果如表 2所示。从表 2中可以看出,在实验所用疏水有机溶剂中,综合考虑分配系数和选择性系数,1, 2-二氯乙烷是萃取拆分酮洛芬对映体较为合适的有机溶剂。三氯甲烷作为有机溶剂时,酮洛芬对映体的选择性系数为1.17,但分配系数较大;而当正癸醇和正辛醇作为溶剂时,由于这两种溶剂对手性选择剂有一定的溶解性,使水相中的手性选择剂向有机相中转移,导致两对映体的分配系数变大,拆分效果不理想。所以选择1, 2-二氯乙烷作为有机相。
|
|
表 2 有机溶剂对K和α的影响 Table 2 Effects of different organic solvents on K and α |
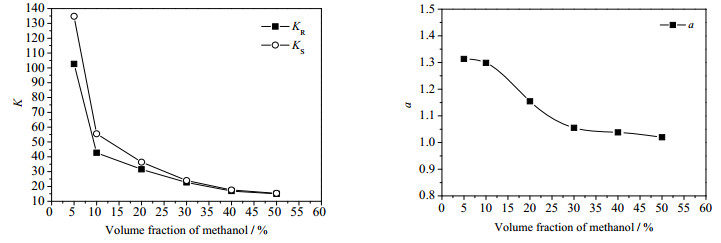
考察了不同浓度的[Bmim][L-Trp]对酮洛芬对映体分配行为的影响,以1, 2-二氯乙烷为有机溶剂,在pH为2.0的10%甲醇水溶液中溶有100 ppm酮洛芬对映体。酮洛芬对映体的分配系数和选择性系数如图 2所示。从图中可以看出,[Bmim][L-Trp]浓度的变化对分配系数和选择性系数的影响是不同的:在实验浓度范围内,随着[Bmim][L-Trp]浓度的增大,KR和KS均减小,但选择性系数α随着浓度的增大而逐渐增大,当[Bmim][L-Trp]浓度为0.04 mol·L-1时,选择性系数最大。在整个实验浓度范围内,都有KS > KR,说明随着水相中的手性选择剂[Bmim][L-Trp]浓度的增加,其对R-酮洛芬的识别能力总是大于对S-酮洛芬的识别能力,当[Bmim][L-Trp]的浓度为0.04 mol·L-1时,萃取拆分的效果较好。

|
图 2 [Bmim][L-Trp]浓度变化对K和α的影响 Fig.2 Effects of [Bmim][L-Trp] concentration on K and α |
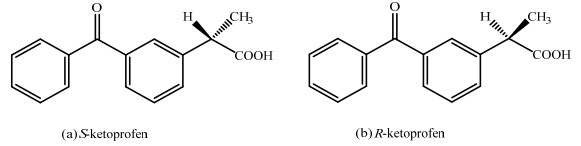
以1, 2-二氯乙烷为有机相,在10%甲醇水溶液中溶有0.04 mol·L-1的[Bmim][L-Trp]和100ppm酮洛芬对映体,水相pH变化对酮洛芬对映体分配行为的影响如图 3所示。由图 3可知,在实验pH范围内,随着pH的增大,分配系数和选择性系数都减小。
|
图 3 pH对K和α的影响 Fig.3 Effects of pH on K and α |
手性识别机制基于溶质和手性选择剂之间的特殊短暂的相互作用如范德华力,空间位阻或氢键,或者非特定的长距离相互作用疏水力和离子强度等。引起上述结果的可能原因是随着的pH的增大产生大量的酮洛芬离子,而手性选择剂只对分子型的酮洛芬有识别能力,因此酮洛芬对映体与手性拆选择剂间的作用减弱了,导致分配系数和分离因子都减少[12]。所以,萃取过程应该控制在低的pH值,在本实验过程中,在pH=1.0和pH=2.0的条件下萃取过程的选择性系数比较大,综合考虑分配系数和选择性系数,最终选择水相的合适pH为2.0。
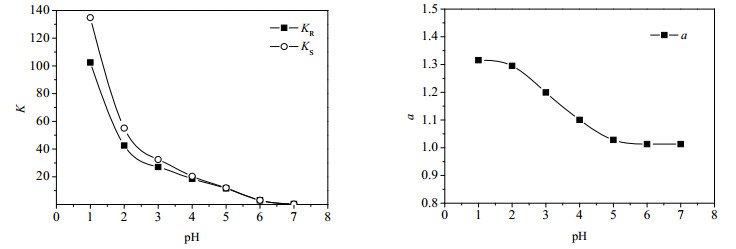
3.5 药物浓度的影响酮洛芬对映体的浓度会影响手性选择剂与酮洛芬消旋体形成非对映体复合物的浓度,并对酮洛芬对映体的分配系数和选择性系数产生影响。实验以1, 2二氯乙烷为有机相,pH为2.0的10%甲醇水溶液中溶有0.04 mol·L-1的[Bmim][L-Trp],考察了酮洛芬浓度为50 ppm,100 ppm,200 ppm,300 ppm,400 ppm和500 ppm时的萃取分配行为,实验结果如图 4所示。从图 4可以发现:在实验条件下,随着酮洛芬浓度的增大,分配系数逐渐增大但选择性系数却逐渐减小,当酮洛芬浓度为50ppm或100ppm时,选择性系数较大,综合考虑选择性系数以及对药物的处理量,最终选择酮洛芬的合适浓度为100ppm。
|
图 4 酮洛芬浓度对K和α的影响 Fig.4 Effects of ketoprofen concentration on K and α |
这可能是由于酮洛芬的水溶性较差,随着水相中酮洛芬浓度的增大,实际与水相中的手性选择剂作用的酮洛芬浓度有限,绝大多数酮洛芬外消旋体未经拆分就被萃取到有机相中,使得随着酮洛芬浓度的增加,分配系数逐渐增大的同时导致选择性系数出现明显的下降。
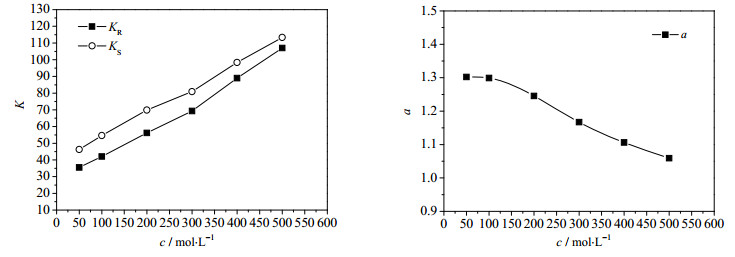
3.6 甲醇含量的影响由于酮洛芬在水中的溶解度较低,因此采用一定浓度的甲醇溶液溶解酮洛芬消旋体。实验表明,甲醇在水溶液中的浓度不会影响实验的进行,但是对萃取过程有一定的影响。以1, 2-二氯乙烷为有机溶剂,考察不同甲醇浓度下,[Bmim][L-Trp]对酮洛芬对映体萃取过程的影响,结果如图 5所示。从图中可以看出,在实验范围内,随着甲醇在水相中体积分数的增大,分配系数K和选择性系数α均减小,这可能由于随着随着甲醇浓度的增加,越来越多的甲醇分子与酮洛芬分子形成氢键,减少了酮洛芬与手性选择剂之间的作用,从而导致分配系数和选择性系数都逐渐减小。实验结果表明,在甲醇体积分数为5%和10%时,萃取过程的选择性系数较大,综合考虑分配系数和选择性系数,最终选择合适的甲醇体积分数为10%。
|
图 5 甲醇体积分数对K和α的影响 Fig.5 Effects of volume fraction of methanol on K and α |
通过以上影响因素的分析结果可知,以手性离子液体[Bmim][L-Trp]为手性选择剂,1, 2-二氯乙烷为有机相对酮洛芬进行萃取拆分时,[Bmim][L-Trp]和药物浓度分别为0.04 mol·L-1和100 ppm,水相pH为2.0,甲醇体积分数为10%时,萃取分离效果较好,选择性系数可达1.30。虽然本文的单相萃取体系的选择性系数尚低于田丰娟等[11]使用三甲基-β-环糊精和自制的L-酒石酸异丁酯双相识别手性萃取体系的选择性系数。但本文所用的手性离子液体[Bmim][L-Trp]对环境的影响较小,成本相对较低,后期的分离回收也相对较容易,故仍具有较好的研究价值。
4 结论(1) 手性离子液体[Bmim][L-Trp]能够用于手性萃取拆分酮洛芬对映体。且其对R-对映体的识别能力大于对S-对映体。
(2) 有机溶剂的种类,手性选择剂的浓度,药物浓度,水相pH及甲醇含量等因素对都会对酮洛芬对映体的萃取分离效果产生影响。使用1, 2-二氯乙烷作为有机溶剂,[Bmim][L-Trp]和药物浓度分别为0.04 mol·L-1和100ppm,水相pH为2.0,甲醇体积分数为10%,萃取分离效果较好,选择性系数可达1.30。
| [1] | Mohan S J, Mohan E C, Yamsani M R. Chirality and its importance in pharmaceutical field-an overview[J]. International Journal of Pharmaceutical Sciences and Nanotechnology, 1998, 1(4): 309-316. |
| [2] | YANG Mu(杨沐), ZHONG Wen-ying(钟文英), HOU Wen(侯雯). Advances in research on analytical methods of chiral drugs(手性药物分析方法研究进展)[J]. Progress in Pharmaceutical Sciences(药学进展), 2014, 38(3): 209-214. |
| [3] | Huang K, Jiao F, Liu S, et al. Enantioselective extraction of ketoprofen enantiomers using ester alcohol R, R-di-tartarates or S, S-di-tartarates as chiral selector[J]. Latin American Applied Research, 2006, 36(3): 187-191. |
| [4] | MEI Zhi-nan(梅之南), FEI Xiao-ping(裴小平), CAI Hong-sheng(蔡鸿生). The pharmacokinetic and pharmacodynamics properties of dexketoprofen(右旋酮洛芬的药动学和药效学性质)[J]. Chinese Journal of New Drugs(中国新药杂志), 1998, 7(5): 7-9. |
| [5] | Ong A L, Kamaruddin A H, Bhatia S. Current technologies for the production of (S)-ketoprofen:process perspective[J]. Process Biochemistry, 2005, 40(11): 3526-3535. DOI:10.1016/j.procbio.2005.03.054. |
| [6] | SHI Kai-yun(石开云), YU Qing-bao(余清宝), ZOU Xiao-chuan(邹晓川). Study of research progress in the synthetic methods of ketoprofen(酮洛芬合成方法研究进展)[J]. Fine Chemicals(精细化工), 2015, 32(8): 841-848. |
| [7] | Manimaran T, Potter A A. Resolution of ketoprofen: US, 5, 162, 572[P]. 1992-11-10. |
| [8] | Park H J, Choi W J, Huh E C, et al. Production of optically active ketoprofen by direct enzymatic esterification[J]. Journal of Bioscience & Bioengineering, 1999, 87(4): 545-547. |
| [9] | Mullangi R, Yao M, Srinivas N R. Resolution of enantiomers of ketoprofen by HPLC:a review[J]. Biomedical Chromatography, 2003, 17(7): 423-434. DOI:10.1002/(ISSN)1099-0801. |
| [10] | He X, Lin R, He H. Chiral separation of ketoprofen on a chirobiotic t column and its chiral recognition mechanisms[J]. Chromatographia, 2012, 75(23-24): 1355-1363. DOI:10.1007/s10337-012-2352-z. |
| [11] | TIAN Feng-juan(田丰娟), SONG Li-tao(松丽涛), JIANG Xin-yu(蒋新宇). Enantioseparation of ketoprofen enantiomers by biphasic recognition chiral extraction(酮洛芬对映体的双相识别手性萃取分离)[J]. Chemistry(化学通报), 2010, 73(7): 634-639. |
| [12] | Schuur B, Verkuijl B J, Minnaard A J, et al. Chiral separation by enantioselective liquid-liquid extraction[J]. Organic & Biomolecular Chemistry, 2011, 9(1): 36-51. |
| [13] | Kapnissi-Christodoulou C P, Stavrou I J, Mavroudi M C. Chiral ionic liquids in chromatographic and electrophoretic Separations[J]. Journal of Chromatography A, 2014, 1363: 2-10. DOI:10.1016/j.chroma.2014.05.059. |
| [14] | Zhang M, Liang X, Jiang S, et al. Preparation and applications of surface-confined ionic-liquid stationary phases for liquid chromatography[J]. Trends in Analytical Chemistry, 2014, 53: 60-72. DOI:10.1016/j.trac.2013.09.011. |
| [15] | Tao G H, He L, Liu W S, et al. Preparation, characterization and application of amino acid-based green ionic liquids[J]. Green Chemistry, 2006, 8(7): 639-646. DOI:10.1039/b600813e. |
| [16] | CUI Xing(崔兴), YU Fei(于飞), ZHU Hai(朱海), et al. Review on enantioseparation using chiral ionic liquids(手性离子液体拆分对映体技术研究进展)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2016, 30(6): 1229-1240. |
| [17] | Tang F, Zhang Q, Ren D, et al. Functional amino acid ionic liquids as solvent and selector in chiral extraction[J]. Journal of Chromatography A, 2010, 1217(28): 4669-4674. DOI:10.1016/j.chroma.2010.05.013. |




