污水治理一直是环境保护的核心问题之一。工业废水中常含有许多难处理物质或有毒有害物质,如重金属、染料、酚类物质等[1]。传统的污水处理手段包括了许多物理或化学方法,如过滤[2]、离子交换[3]、溶剂抽提[4]、高级氧化技术[5]、活性炭吸附[6]等。这些技术对特定污染物的去除效率较高,但存在着化学品用量大、设备价格昂贵、操作成本高以及适用范围有限等方面的缺陷,应用受到了很大限制[7]。相比于传统的物理化学方法,生物处理法是一种更为经济的处理方式,除了大规模使用的活性污泥是一种良好的、比较粗犷的生物处理方法以外,还有一些相对精细的生物方法也受到了重视,譬如生物吸附法、生物降解法以及生物吸附和生物降解联用等方法。采用的微生物对废水中某种或某类有害物质具有选择吸附的能力,还有的微生物能够对这些有害物质进行不同程度的降解[8~12]。由于这些方法有较强的针对性,一般并不用于废水处理的前过程,而成为废水达到排放标准前的一个重要选择。
生物体作为吸附剂是一个重要的实验内容,早在20世纪70年代就有生物吸附剂用于废水处理的论文和专利[13]。在发酵工业中产生的废弃真菌菌体是一个极好的廉价吸附剂来源[14],其中包括各种丝状真菌和酵母。常用的丝状真菌主要有青霉菌、黑曲霉、云芝、匍枝根霉、米根霉、糙皮侧耳、黄孢原毛平革菌、少根根霉、云芝、镰刀菌等等。因为在真菌细胞壁上存在有大量的功能基团,如羟基、羧基、氨基、磺酸盐和磷酸盐基团等,这些基团赋予了真菌强大的吸附功能[15, 16]。同时,真菌自身也会产生一些酶,具有对一些有机和无机污染物降解作用[17, 18]。因此真菌可以作为污水治理中一个良好的生物吸附剂。
本文主要对这些年来丝状真菌在污水处理过程中的生物作用以及其研究进展作一简要综述。
2 丝状真菌对废水中有害物质的脱除机理在废水处理中,最难处理的废水主要有印染废水、造纸废水、电镀废水等,因为其中含有难于脱除的有害成分,譬如印染废水中的各种染料、造纸废水尤其是再生纸废水中的油墨和微小纸屑、电镀废水中的重金属离子,尤其是六价铬离子等等,很难达到排放标准。针对这些有害成分,丝状真菌具有较好的生物作用,可以降低这些成分的浓度,甚至完全脱除,其中最重要的生物作用之一就是生物吸附。
近年来,关于真菌的生物吸附在污水治理中应用的报道比较普遍,丝状真菌的使用有望替代或加强传统的吸附工艺[19],其原因在于丝状真菌表面和内部具有十分丰富的化学官能团,这种吸附作用不仅活菌丝具备,而且已经灭活的菌丝体也都具备[20]。这些作用已经在吸附染料、重金属、酚类化合物等物质中得以体现。
在生物吸附时,除了使用游离菌丝外,还使用由这些菌丝自组装而成的菌丝球。菌丝球具有固定的形状,在用作生物吸附剂时,可以按照常规的吸附操作脱除废水中的有害成分。由于大多真菌擅长产生漆酶等对污染物有强大降解能力的酶,因此对于活体真菌,在去除污染物时,除了吸附外,还可能包含一定程度的生物降解[21]。而对于灭活的真菌,去污一般只与吸附相关,并不涉及细胞的代谢运输过程[8],但在去除一些化学性质活泼的污染物时也能发生一些氧化还原反应,例如灭活的黑曲霉在处理含Cr6+ 废水时可将其还原成为无毒的Cr3+[22]。
2.1 丝状真菌对污染物的吸附机理鉴于真菌的多样性以及废水中污染物的复杂程度,阐明真菌对废水的生物吸附机理十分不易。目前的吸附机理研究一般限于在实验室条件下单一种类真菌对某个特定污染物吸附特性的研究[13]。真菌吸附污染物有多种途径,因此也有多种并存的生物吸附机制。基于细胞代谢水平或污染物的吸附位点,真菌的生物吸附机制可以有不同的分类[23]。
根据生物吸附与细胞代谢的关联,真菌的生物吸附机制可以分成两类:(1)不依赖细胞代谢的被动吸附,其机理包括离子交换、沉淀作用、络合作用和物理吸附等[24];(2) 依赖于细胞代谢的主动吸附,这一吸附过程需要能量的驱动[13]。在实际应用中,真菌有时会被烘干或者以其他形式灭活以利于运输和保存,这些灭活的菌体对废弃物的吸附属于被动吸附,其吸附效率只与生物体和被吸附物之间的相互作用有关。譬如在染料吸附中,已灭活的真菌主要通过细胞壁上的化学官能团与染料结合。活细胞同样能进行被动吸附,但是细胞对溶液中的被吸附物有保护机制,并在一定程度上抑制细胞壁对这些物质的被动吸附作用[8]。因此,有人提出[25, 26],已灭活的菌体在吸附诸如重金属和酚类物质等有毒性的污染物时更具潜力。许多被动吸附过程,如物理吸附、离子交换、络合作用以及沉淀作用都很容易受到细胞周围微环境的影响,而细胞的普通代谢活动,如营养摄取、呼吸作用以及代谢物的释放都会改变被动吸附的微环境,因而活细胞的吸附机制比已灭活的细胞要复杂得多[27]。
根据污染物在细胞上的结合位点,真菌的生物吸附机理可以分为以下三类:(1) 细胞外的富集、沉淀;(2) 细胞表面吸附;(3) 细胞内累积[28]。真菌细胞壁的化学组成以及结构排列十分复杂,溶液中的污染物可以被吸附在细胞壁的表面,也可以被吸收到细胞壁的内部,其中有一部分还可能进入细胞质并与其它化合物或细胞器发生结合。细胞壁的主要成分是多糖、脂质和蛋白质,它们能提供许多官能团用以吸附污染物[7]。大部分真菌的细胞壁是由微纤丝层构成的,而微纤丝则由壳聚糖或纤维素分子链组成。壳聚糖在真菌的生物吸附过程中能起到十分重要的作用。重金属离子能与甲壳素或壳聚糖的氨基结合,同时这些氨基也能与染料中的活性基团产生分子间作用并将染料分子结合,从而实现对重金属和染料等污染物的生物吸附[29],例如少根根霉的细胞壁中甲壳素含量就非常高,因而拥有十分出色的吸附能力。
在实际处理过程中,污水的成分往往十分复杂,污染物化学性质也各不相同,因此每一种污水的生物吸附过程都涉及到许多不同的机理。但从实效性来说,最重要的研究工作是针对不同污水来源,设计出相应的生物吸附系统使其能良好地净化污水,而吸附机理的研究则是为了对已有系统的剖析和改进[13]。图 1为海洋紫微青霉菌菌丝吸附刚果红的情况[12],图 1(A)为未吸附刚果红的菌丝,图 1(B)为多次吸附刚果红的菌丝,由此可知刚果红不仅在表面吸附,而且还进入到菌丝内部。

|
图 1 海洋紫微青霉菌菌丝吸附刚果红情况[12] Fig.1 Microscopic observation of mycelium before and after dye adsorption (a) before adsorption (b)after adsorption for 12 h |
丝状真菌作为一种生物吸附剂,在废水处理中已有较为广泛的研究,但生物吸附剂相对于传统的吸附剂而言,它的最大特点就是具有生物活性,除了可以吸附废水中的污染物之外,还能对其进行降解、转化、还原等[21],使污染物的去除更为彻底。活菌体和已灭活菌体都可以用于生物吸附,甚至在某些情况下已灭活菌体的吸附效果更佳,但生物降解必须由具有生命活性的菌体完成,因为降解完全依赖于真菌生命体的代谢过程及其分泌到周边环境中各种的酶[8]。
真菌所分泌的酶功能各异,其中漆酶是已知的功能最为强大的酶之一,这里将重点介绍。漆酶是一种结合多个铜离子的蛋白质,属于铜蓝氧化酶,许多环境污染物,如木质素、染料、酚类化合物等的催化氧化都可以通过真菌漆酶来完成[30~32]。大多数真菌漆酶是胞外酶,分子量60~70 kDa[32, 33]。同时,漆酶对底物的催化具有非特异性,它能催化氧化包括苯酚在内的许多种类的污染物[34]。除了对传统工业废水的处理外,真菌漆酶也应用于许多含有新兴污染物的废水处理[35]。例如,从云芝菌中提取的漆酶可降解城市污水中的多种天然或人工合成雌激素,包括雌酮、雌二醇、雌三醇等[36, 37],这些漆酶对氧苯酮的降解率也高达95%~100%[38]。白腐菌Funaliatrogii ATCC 200800可以通过分泌漆酶和锰过氧化物酶来降解合成染料[21]。从栓菌Trametes sp.中提取的漆酶可用于降解酚类的内分泌干扰物,如双酚A、壬基苯酚、辛基苯酚和炔雌醇等[39]。
除了漆酶以外,真菌往往还具备较强的分泌纤维素酶能力,这些酶包括 b -葡萄糖苷酶、纤维素内切酶和纤维素外切酶。一些在极端环境下生长的真菌更是能够产生抗逆性较佳的纤维素酶,可在高盐高温等不利环境下对废水中的纤维素进行有效降解。薛栋升等[40~42]从东海海底泥中分离到了一株耐盐且高产的内切葡聚糖酶和b-葡萄糖苷酶的海洋黑曲霉ZJUBE-1,该菌可用于处理含纤维素的高盐废水。
在用微生物处理含重金属废水时,除了把重金属吸附到菌丝体表面外,还可能会出现氧化还原作用,也就是将高价的金属离子还原至较低价态。以Cr6+ 为例,在脱除Cr6+ 的过程中,吸附与还原可以同时进行,但还原速度慢于吸附速度。Cr6+ 可通过与菌体表面的电子供体直接接触而被还原为Cr3+,也可通过与菌体细胞壁结合后再接受菌体传递的电子并被还原为Cr3+[43, 44]。
3 丝状真菌在废水处理中的应用范围废水的成分往往十分复杂,有害成分也比较多,本节着重介绍丝状真菌对于两类废水中常见污染物的脱除研究,即染料和重金属。此外,丝状真菌作为一种腐生生物,对于废水污泥的处理也有良好的效果。
3.1 丝状真菌对含染料废水的脱色由于染料具有较高的化学稳定性、光稳定性,含染料废水成为了最难处理的污水之一,仅纺织工业每年就会排放至少1.5×108 m3的含染料废水[45]。颜色是染料废水的最显著特征之一,只要水中含有微量染料就可以被轻易观察到。因此,染料废水处理显得极为重要[46, 47]。吸附法已被证明是一种非常有效的染料废水处理方法,先前活性炭被认为是一种最为常用的吸附剂,然而活性炭制备成本较高且再生困难,限制了其大规模的应用[48]。近年来,真菌对染料的脱色功能得到了大量关注,并发现真菌确实具有较强吸附和降解染料的能力,已用于脱除染料的菌种有青霉菌、黑曲霉、云芝、匍枝根霉、米根霉等[1, 20, 49~53]。已报道的可脱除的染料种类达上百种,涵盖了偶氮类、三苯甲烷类、金属耦合类、杂环类染料四个大类[7, 49, 54~56]。
由于颜色是废水的第一特征,因此在含染料废水的处理过程中,脱色率是一项重要的指标。对一种特定的染料而言,不同物种的真菌菌丝对其脱色率往往有较大差异。例如青霉菌Penicilliumgeastrivorus在实验条件下对染料活性黑的脱色率高达99%[57],而黑曲霉的脱色率只有88%,且需要更长的时间[58]。这就说明真菌对染料的脱色能力存在较大的种间差异。工业废水的成分并不单一,往往含有多种浓度不一的染料和其他有害物质,因此,某些对多种染料都具备较强吸附能力的真菌在实际应用中就具备较大的潜力。本课题组[12]采用了从海洋中筛选得到的紫微青霉菌(PenicilliumjanthinellumP1),通过对9种不同染料的脱水实验证明,这是一个具备广谱吸附能力的真菌,该真菌对刚果红、萘酚绿B,铬黑T,氨基黑10B的脱色率都大于99%,对中性品红、甲基红、酸性复红、结晶紫和灿烂绿的脱除率也分别达到94.4%、82.1%、63.5%、56.9% 和63.0%。
3.2 丝状真菌对含重金属废水的吸附和还原作用除了染料以外,重金属也是废水中另一典型的难处理物质。诸如电镀、电池生产、采矿、印刷等工业都会产生含重金属离子的废水[59]。环境中的重金属会在食物链中逐渐富集并最终对人类健康造成极大的威胁[6, 60, 61]。许多生物材料,如农业废弃物或活性污泥都有一定的吸附重金属的能力,但其对重金属的结合能力以及选择性往往并不理想,因此研究者们一直在寻求更为高效的生物吸附剂[23]。真菌细胞壁的表面有许多可以特异性结合重金属离子的官能团。许多真菌都具备良好的抗逆性和重金属吸附能力,部分物种的吸附效率甚至高于活性炭[1]。目前被广泛研究用于重金属吸附的真菌物种有糙皮侧耳、黑曲霉、黄孢原毛平革菌、少根根霉、云芝、镰刀菌等等,这些真菌的共同特点就是易于获得大量菌体且生产成本较低。可吸附的重金属离子的种类有Zr4+、U6+、Ni2+、Cr6+、Cu2+、Zn2+、Pb2+、Cd2+ 等,几乎涵盖了废水中常见的有害重金属类型[25, 61~67]。
不同真菌对同一重金属离子的吸附能力也存在较大种间差异。例如对于Cu2+ 的去除,云芝、黑曲霉、简青霉、棘孢木霉等多种真菌均有吸附效果,但其吸附能力各异,从12.18 到140.9 mg▪g-1不等[64, 68]。
丝状真菌在处理含某些特定重金属废水时,除了吸附以外,还存在氧化还原现象,即吸附-还原过程。Park等人[22]研究发现,非活性的黑曲霉等能将毒性较大的Cr6+ 还原为几乎无毒的Cr3+,如果时间足够长,不仅使溶液中不再存在Cr6+,而且也使菌丝表面吸附的Cr6+全部还原为Cr3+。而最近我们在用活性的海洋黑曲霉吸附Cr6+ 时也发现,海洋黑曲霉不仅能够吸附Cr6+,同时具备将Cr6+ 还原为Cr3+ 的能力。
3.3 废水污泥的处理传统的污水处理方式会产生大量的废水污泥,污泥的含水量往往超过90%,这就对其运输和后续处理造成了一定的困扰[69]。这些污泥若没有得到妥善处理,同样会对环境造成较大的污染,因此废水污泥的清理同样是废水处理过程中的重要环节[70]。废水污泥含有大量微生物和有机物。真菌作为一种腐生生物,十分适宜用于处理废水污泥,同时在真菌对污泥的降解产物也能为真菌生长提供营养来源[71, 72]。用于废水污泥处理的真菌大多为丝状真菌,它们所发挥的功能包括减少有机固体、生物絮凝、去除病原体、脱水以及解毒等等[73]。在污泥处理方面,真菌相比细菌具有更大的优势,因为真菌所能降解底物的范围更广,底物结构也更复杂[74]。有大量的丝状真菌已经应用于污泥处理研究中,其中包括黑曲霉[75]、微紫青霉[76]、黄孢原毛平革菌[77]、木霉[78]等等。
3.4 其他应用含酚废水也是当今世界上危害大、污染范围广的工业废水之一,是环境中水污染的重要来源[79, 80]。通常含酚废水中以苯酚和甲酚含量最高,酚类化合物的毒性又以苯酚为最大,因此美国环境保护署(EPA)规定废水中的苯酚含量不得超过1 mg▪L-1[81]。近年来,关于丝状真菌去除废水中酚类化合物的研究逐渐增多,大量研究表明丝状真菌对苯酚和多种氯代酚均有可观的去除效果[26, 82~84]。
丝状真菌对农药废水、含油废水、焦化废水、造纸废水等也有较好的净化作用。例如,广泛应用于肥皂、洗发水、牙膏和消毒水中的强效抑菌剂三氯生,它具有很长的半衰期并可能对人类造成健康隐患。在三氯生含量为7.5 mg▪L-1的半合成培养基中加入花斑曲霉,可使其降解率达到71.91%[85]。再者,焦化废水含有大量的酚类化合物和其他污染物,往往难以治理且具有一定的毒性和致癌性,用黄孢原毛平革菌对焦化废水进行3天的降解处理,其对废水中酚类化合物和COD的去除率可分别达到84% 和80%,效果十分显著[86]。
4 影响生物吸附法废水处理效率的因素影响丝状真菌生物吸附和降解效率的因素十分繁多,其中真菌生物质的物理化学属性以及其排放的代谢产物是决定性因素。这些性质会受到真菌的菌丝形态、年龄以及生长条件影响,而通过对生物质进行物理或化学预处理能极大地改变真菌细胞的性质。同时,反应环境的改变可以很大程度地影响菌体的生长代谢状况以及菌体与污染物的互相作用,生物反应器的使用则能提高菌体的利用率。
4.1 菌丝体的物理化学性质(1) 丝状真菌的特有形态——菌丝球
丝状真菌在工业应用中可能遇到的两个问题:吸附完成后如何进行固液分离以及如何解决阻塞效应[54]。实验室中主要通过离心方法进行固液分离,但在大规模废水处理过程中是不实际的;解决阻塞效应主要通过对菌体进行固定化,但这同样会增加操作成本,同时也会影响吸附过程中的传质效果[7]。许多丝状真菌如青霉菌、曲霉菌和木霉菌等在特定的液体培养过程中,其菌丝会互相缠绕形成菌丝球,可以看做是一种自固定化的过程[87, 88]。菌丝球有诸多优点,如生存能力较强、沉降速度快、可以重复利用等,能有效地解决实际应用中出现的固液分离问题,并减少阻塞的发生。王明霞等[12]采用从东海淤泥中筛选得到的微紫青霉Penicilliumjanthinellum sp.菌株对偶氮染料刚果红进行脱色研究,发现该菌株的菌丝球有极佳的固液分离效果,并在在重复利用5次后,染料脱色率仍可达到91.3%(图 2)。

|
图 2 (a)微紫青霉菌P1 丝球利用次数对刚果红脱色的影响,C0:50 mg▪L-1 (b)菌丝球形态 Fig.2 (a) The decolorization of Congo red dye by Penicilliumjanthinellum sp. mycelial pellets in repeated batch system C0: 50 mg▪L-1, (b) the picture of P. janthinellum sp. mycelial pellets (1) mycelial pellets after one reusing cycle (2) three reusing cycles (3) and five reusing cycles (4)[12] |
(2) 固定化
许多丝状真菌无法形成菌丝球或只能形成不稳定的菌丝团,对于这些真菌可以采用固定化的方式以提高其机械强度、提升其多孔特性、减少阻塞问题并实现菌体的多次利用,因而能大幅提高真菌的使用效率。许多材料都可以应用于真菌的固定化,目前较为常用的有尼龙海绵、聚氨酯泡沫塑料、丝瓜络、聚苯乙烯泡沫塑料、海藻酸钙凝胶球、离子交换树脂XAD、褐煤颗粒、ZrOCl2活化浮石等[91~96]。例如,在去除废水中Cr3+、Cd2+ 和Cu2+ 的过程中,可将糙皮侧耳菌丝体固定在离子交换树脂XAD上对这三种重金属离子进行吸附,在进行了十次吸附和解析之后,其吸附性能依旧十分稳定[97]。
(3) 预处理
生物吸附剂可以采用预处理方法以提高吸附性能,其中有物理方法、化学方法和生物改性方法。
物理方法一般包括高压蒸汽处理、烘干和粉碎。有多项研究表明,灭活的真菌在吸附重金属等有毒污染物时比活细胞拥有更强的吸附能力[25, 26],这可能是由于活细胞的自我保护机制能阻止有毒物质进入细胞内部。因此诸如煮沸、冻干、高压蒸汽等具有灭活效果的处理方法能提高菌体对有毒物质的吸附效率。其中高压蒸汽法还能是细胞结构破裂并释放出胞内化合物从而可能提供更多的污染物结合位点[98]。干燥可以大幅减轻真菌生物质的重量并为其运输提供便利。对菌体的粉碎可以提高其表面积从而提升吸附速率,但也会对吸附结束后的固液分离效果产生较大的影响。
化学方法一般为酸处理和碱处理。碱处理可以促成几丁质脱乙酰反应从而形成甲壳素-葡聚糖复合物,这一复合物对金属离子有更高的亲和力[99]。酸处理可以改变真菌细胞的表面电势并加强其与带负电荷染料的结合能力[100]。在实际应用中,具体的预处理方法会根据污染物的化学性质以及真菌的物种来研究制定。例如,酸处理和碱处理都会降低云芝吸附染料刚果红的能力,而高压蒸汽处理则能提高其脱色率。
生物改性方法包括改善培养条件或通过基因工程技术改变其遗传特性等,从而可以改善丝状真菌的特异性吸附能力、产酶能力或固液分离效果等。例如在适宜条件下培养微紫青霉等具备成球能力的真菌[12],使其形成菌丝球,可以大大提升它们在废水处理过程中的固液分离效果,从而有效节约处理成本并可防止反应器堵塞等不利情况的发生。
4.2 反应条件的影响目前关于反应条件对废水处理效果的影响报道较多,譬如pH、温度、营养、盐度、介体添加以及生物反应器的使用等。
(1) pH
污水的pH值决定了真菌生物质的表面电势和污染物的离子形式,即同时影响了吸附剂的结合位点和被吸附物的化学性质。重金属吸附受pH值的影响最为严重。在酸性条件下,金属阳离子诸如Cu2+、Cd2+、Ni2+、Co2+、Zn2+ 会与氢离子在结合位点处发生竞争从而降低真菌菌体的吸附效果[101, 102]。同样在酸性条件下,含有重金属的阴离子诸如TcO4-、PtCl43-、CrO42-、Au(CN)2- 其吸附效率则会大大增加。对于染料而言,在低pH值时往往也能获得更高的吸附率。pH值的变化还会极大地改变酶的活性,从而影响真菌的生物降解效率。同时,污染物分子的跨膜运输是胞内生物催化的限速步骤,而跨膜运输的速率很大程度上也受到pH值的影响[103]。例如,在使用黄孢原毛平革菌处理焦化废水的过程中,酚类化合物和COD的去除率会受到温度和pH值的双重影响。
(2) 温度
温度的变化会影响所有与真菌生命活动相关的进程,因此对于每一种真菌而言,其对污染物的最高降解率往往与最佳的生长温度相关。值得一提的是,漆酶的高效催化一般发生在室温范围内,即温度为20~40℃ 的环境中,因此漆酶在实际应用中具备相当大的潜力[104]。温度对生物吸附的影响并不如pH那样强烈,在某些情况下,较高的温度能增加生物吸附剂的表面活性并增加染料分子的动能从而使吸附率有所增加[55, 105]。但是非常高的温度则会使细胞表面钝化并破坏部分污染物结合位点,反而会导致吸附效率大幅下滑[94, 106]。低温会抑制细胞活性和大部分利于生物吸附的辅助过程,因此会造成吸附效率的降低。
(3) 营养
酶的生产在很大程度上依赖于营养物质的供给,在印染等工业的废水中往往缺乏营养物质,此时就要往废水中加入一定的C/N源以提高真菌的产酶能力,从而加强废水的降解效果。在许多偶氮染料的降解研究中,往废水中添加少量的葡萄糖即可显著提高其降解率[56]。而诸如蛋白胨、尿素、酵母提取物等氮源的添加则往往更为有效、这可能是由于氮源是蛋白质合成的物质基础,且氮源能转化为NADH并担当污染物降解的电子供体[107]。
(4) 盐度
某些工业污水具有相当高的含盐量从而对其中的污染物的吸附效率以及丝状真菌在其中的生存能力造成较大影响。例如,在少根根霉对染料黄色RL的吸附过程中,加入50 g▪L-1的NaCl可使吸附效率下降28.8%[108]。从海洋中筛选得到的真菌菌株如微紫青霉ZJU-BS-P1,因其特殊的海洋环境而具备较强的耐盐能力,即使在盐浓度较高的情况下依然能保持良好的吸附效率[12]。
(5) 中介物的添加
漆酶以及其他氧化酶能氧化某些小分子化合物(中介物)并形成自由基,也就是氧化态的中介物[109]。这些自由基可以作为氧化还原中介物并促进其他化合物的氧化,而当中介物不存在时,这些化合物则无法被氧化。因此中介物可以拓展氧化酶的底物范围,具有十分重要的应用价值。此外,氧化还原中介物还能在缺氧条件下提升许多还原反应的进程[103]。例如,在不使用中介物的情况下,双氯芬酸的完全降解需要4 h,加入中介物丁香醛后,反应时间缩短至2 h,而加入1-羟基苯并三唑后则只需0.5 h[110]。
(6) 生物反应器的影响
生物反应器可以决定真菌细胞和废水中污染物的作用模式,从而显著影响生物降解的效率。生物反应器技术包括旋转鼓轮、填充床、流化床、细胞固定化以及膜生物反应器等等。例如,膜生物反应器的使用可以显著提高云芝菌对含染料废水的脱色效果[111];再者,通过对连续填充床、连续流化床和补料流化床三种反应器的对比后,发现补料流化床(图 3)的生物降解效率最高,可使白腐菌F29对染料橙色二号的脱色率达到97%以上[112];此外还有对污泥废水处理中使用的液态生物转化反应器[113]等。
|
图 3 补料流化床反应器的原理图[112] Fig.3 Schematic diagram of the fedbatch fluidized-bed decolorization reactor[112] |
工业废水所包含的污染物种类极为繁多,目前大部分关于真菌治理废水的研究主要集中于某种真菌对废水中特定污染物的去除效果,但该真菌对废水中其他污染物的去除率可能并不理想。此外,不同菌株对同一污染物的去除能力也不尽相同。因此,针对不同的工业废水,可将几种高效菌株结合使用组成新的生物体系,以达到同时去除该废水中多种污染物的目的[114]。
(1) 真菌与真菌的协同作用
不同真菌菌株对某一污染物的吸附能力往往存在较大差异,因此将不同吸附功能的几种真菌联合使用可以提高污染物的整体去除效率。例如,Mishra等[18]将Lentulus曲霉、土曲霉和米根霉三种真菌制备成生物吸附剂组合,用于混合废水的处理,该废水中同时含有两种染料和两种重金属离子,即酸性蓝161、颜料橙34、Cr6+ 和Cu2+。结果表明这一组合的吸附效果优于任一单一菌种。
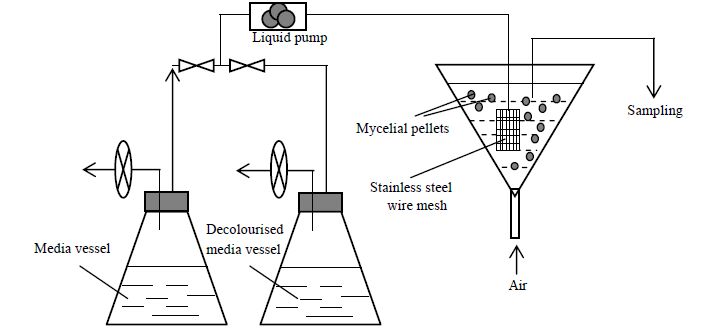
真菌的降解能力十分强大,但种间差异也十分明显。因此,将不同真菌联合使用可能极大地提高其对废水的总降解能力。例如,将两种丝状真菌的混合体(黑曲霉和微紫青霉)用于对废水污泥的生物修复,可在10天后使其总固体悬浮物、浊度、COD分别下降98%,99%和 93 %[113]。在真菌液体培养中,一些丝状真菌可以形成菌丝球。作为真菌的自固定化产物以及生物活性颗粒,这些菌丝球拥有许多分散菌丝所不具备的优良性能,如快速沉降、易于固液分离、可重复利用等等。同时由于菌丝球具备较高的机械强度和稳定的结构,还能作为全细胞固定的载体。陈慧英等[11, 115]将海洋内生拟盘多毛孢菌J63的孢子接入到微紫青霉P1菌丝球内,经过培养即可形成由这两个物种组成的混合菌丝球,即双菌株-全细胞固定化体系。其中,微紫青霉P1有较强的吸附能力并能分泌纤维素酶,而J63可以产漆酶并降解木质素和多种染料[116, 117],这一混合菌丝球可应用于造纸工业废水的处理,在整个污水处理过程中不仅能分泌漆酶,也能产生纤维素酶(图 4),尽管两种酶的酶活都不高,但能成功使废水脱色并去除其中不溶性的小纤维。
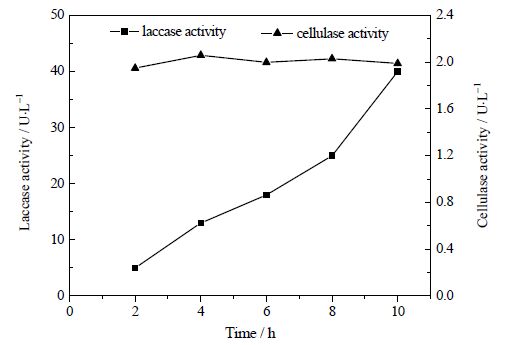
|
图 4 漆酶和纤维素酶在污水处理过程中的变化[115] Fig.4 Profiles of laccase and cellulase produced by mixed pellets during wastewater treatment |
(2) 真菌与细菌的协同作用
针对部分特定污染物而言,某些细菌比真菌拥有更强的降解能力,并且细菌也可以固定在真菌菌丝球上形成真菌-细菌的混合体系。这样的体系具备包括生物降解和生物吸附在内的多重功能。例如,将具备苯胺降解能力的醋酸不动杆菌JH-9和其他COD高效降解菌固定到黑曲霉Y3的菌丝球上即可制备成多功能混合菌丝球,并可用于序批式活性污泥法(SBR)中以高效去除废水中的苯胺[118]。鞘氨醇单胞菌QYY具有良好的偶氮还原活性,而青霉菌QQ则具备较高的偶氮染料吸附能力,因此这两种菌的组合很好地完成了吸附-降解这一协作过程,其对含偶氮染料废水的脱色效果明显优于任一单一菌种[119]。再者,黄孢原毛平革菌可用于多环芳烃的吸附和降解,而在其菌丝球中接入土壤野生的微生物后,它对多环芳烃的去除率得到了明显提升[120]。
5 丝状真菌用于废水处理的优势与缺陷通过以上讨论可以看到,用丝状真菌来处理工业废水是一种高效、绿色的处理方法,具有多种优点。包括:①成本低。生物原料的成本通常远低于物理化学药剂如活性炭、离子交换树脂等等,同时可以利用工业发酵的废弃菌丝体。②高效性。在废水中污染物浓度较低时仍能达到较高的去除率。③选择性。真菌对染料、重金属等污染物有一定的选择性,在污水中存在大量的C/N/K/Na等常规元素时,仍能对特定的污染物进行定向清除。④适宜反应温度多为常温。丝状真菌的最佳吸附温度以及真菌漆酶和其他许多酶类的最佳反应温度都接近室温,无需额外加热或制冷,减少能源消耗。⑤可去除的污染物种类多。丝状真菌种类繁多且功能各异,目前已研究的物种种类依然只是冰山一角。尚有许多真菌未被研究甚至未被发现,潜力十分巨大。⑥许多丝状真菌在液体培养过程中易形成菌丝球,这种自固定化现象能加大菌丝体的机械强度并使其易于固液分离,还可以有效减少反应器堵塞等不利情况的发生,这使丝状真菌相比于酵母和细菌有了巨大的实用优势。
然而,在丝状真菌用于废水处理的研究经历了几十年之后,虽有大量的科技文献发表,却至今未实现商业化规模应用,发展不尽如人意。本文在对大量文献进行分析后,关于丝状真菌用于废水处理时尚存在的缺陷提出了以下看法:
(1) 吸附速度慢,吸附量不大。真菌适合在低浓度废水中进行污染物的选择性去除,但在污染物(尤其是有毒污染物)浓度较高时,由于其生长受到影响且吸附量有限,对废水的处理效果并不理想。
(2) 处理成本高。虽然广泛存在低成本的生物原料,如在工业发酵生产中遗弃的真菌菌丝体等,但为了适宜废水处理要求,往往要经过各种物理化学方法的改性修饰,因此成本迅速增加。
(3) 不易保存。丝状真菌具有生物活性且含水量很高,若保存时间过久则容易腐败,影响处理效果,甚至会产生异味。因此必须在污水排除的地点就地制备后马上投入应用,这就大大增加了使用难度。
(4) 使用工艺复杂。和其他生物处理剂一样,丝状真菌具有柔软、机械强度低等特性,因而在处理废水中所使用的处理条件需要更加温和,如搅拌速率和水力冲击不宜过强等,这就使污水处理工艺更为复杂,对反应器的要求也更高。
(5) 利用后的去向问题。生物吸附剂的再生性不如传统的物理化学制剂,经酸碱或有机溶剂洗脱效果往往并不理想。因此在实际应用中必然涉及到废弃生物质的去向问题,且生物体容易腐败变质,若随意丢弃则会产生二次污染。
(6) 关于降解的研究依然太少。在涉及到丝状真菌处理废水的文献中,大部分研究都只关注于生物吸附,这是因为生物吸附易于观察、检测和表征,更容易获得实验结果,而处理效果更为彻底的生物降解则研究不足。丝状真菌作为一种生物材料,其最大的特点就是具有生物活性,若不对其降解能力进行深入研究,那么它对废水的处理效果还远不及活性炭或离子交换树脂等传统材料。
6 结 语丝状真菌在污水处理中的生物吸附和生物降解功能已经受到了许多学者的关注,这是由于真菌生物质较为廉价且治理效果良好,并具有较大潜力。但是,若要让这一技术真正迈入应用,仍有较多问题需要克服,同时鉴于污水的复杂性,针对某一种污水制定出适宜、高效、无害化的处理方式依然是一个艰巨的任务。最好的处理方法往往是根据对废水的组成、预计处理费用、降解产物的毒性以及处理后的废水的再利用等多个因素的评估,制定出两个或多个菌株的组合对该废水进行处理。目前大部分关于真菌治理污水的研究都基于实验室水平。因此除了基础的实验室研究外,还需要广泛开展中试研究以适应实际应用。
| [1] | Rangabhashiyam S, Suganya E, Selvaraju N . Significance of exploiting non-living biomaterials for the biosorption of wastewater pollutants[J]. World Journal of Microbiology & Biotechnology , 2014, 30 (6) : 1669-1689 |
| [2] | Zouboulis A I, Lazaridis N K, Grohmann A . Toxic metals removal from waste waters by upflow filtration with floating filter medium. I. The case of zinc[J]. Separation Science and Technolog , 2002, 37 (2) : 403-416 DOI:10.1081/SS-120000795 |
| [3] | Kabsch-Korbutowicz M, Krupinska B . Removal of natural organic matter from water by using ion-exchange resins[J]. Przemysl Chemiczny , 2008, 87 (5) : 473-475 |
| [4] | Lin S H, Juang R S . Removal of free and chelated Cu(II) ions from water by a nondispersive solvent extraction process[J]. Water Research , 2002, 36 (14) : 3611-3619 DOI:10.1016/S0043-1354(02)00074-X |
| [5] | Esplugas S, Gimenez J, Contreras S . Comparison of different advanced oxidation processes for phenol degradation[J]. Water Research , 2002, 36 (4) : 1034-1042 DOI:10.1016/S0043-1354(01)00301-3 |
| [6] | Kurniawan T A, Chan G Y S, Lo W H . Comparisons of low-cost adsorbents for treating wastewaters laden with heavy metals[J]. Science of the Total Environment , 2006, 366 (2-3) : 409-426 DOI:10.1016/j.scitotenv.2005.10.001 |
| [7] | Crini G . Non-conventional low-cost adsorbents for dye removal:a review[J]. Bioresource Technology , 2006, 97 (9) : 1061-1085 DOI:10.1016/j.biortech.2005.05.001 |
| [8] | Volesky B . Biosorption and me[J]. Water Research , 2007, 41 (18) : 4017-4029 DOI:10.1016/j.watres.2007.05.062 |
| [9] | Fu Y Z, Viraraghavan T . Fungal decolorization of dye wastewaters:a review[J]. Bioresource Technology , 2001, 79 (3) : 251-262 DOI:10.1016/S0960-8524(01)00028-1 |
| [10] | McMullan G, Meehan C, Conneely A . Microbial decolourisation and degradation of textile dyes[J]. Applied Microbiology and Biotechnology , 2001, 56 (1-2) : 81-87 DOI:10.1007/s002530000587 |
| [11] | Chen H Y, Guan Y X, Yao S J . A novel two-species whole-cell immobilization system composed of marine-derived fungi and its application in wastewater treatment[J]. Journal of Chemical Technology and Biotechnology , 2014, 89 (11) : 1733-1740 DOI:10.1002/jctb.2014.89.issue-11 |
| [12] | Wang M X, Zhang Q L, Yao S J . A novel biosorbent formed of marine-derived Penicillium janthinellum mycelial pellets for removing dyes from dye-containing wastewater[J]. Chemical Engineering Journal , 2015, 259 : 837-844 DOI:10.1016/j.cej.2014.08.003 |
| [13] | Gadd G M . Biosorption:critical review of scientific rationale, environmental importance and significance for pollution treatment[J]. Journal of Chemical Technology and Biotechnology , 2009, 84 (1) : 13-28 DOI:10.1002/jctb.v84:1 |
| [14] | Zhou J L, Kiff R J . The uptake of copper from aqueous-solution by immobilized fungal biomass[J]. Journal of Chemical Technology and Biotechnology , 1991, 52 (3) : 317-330 |
| [15] | Bowman S M, Free S J . The structure and synthesis of the fungal cell wall[J]. Bioessays , 2006, 28 (8) : 799-808 DOI:10.1002/(ISSN)1521-1878 |
| [16] | Cabib E, Bowers B, Sburlati A . Fungal cell-wall synthesis-the construction of a biological structure[J]. Microbiological Sciences , 1988, 5 (12) : 370-375 |
| [17] | Awasthi M K, Pandey A K, Khan J . Evaluation of thermophilic fungal consortium for organic municipal solid waste composting[J]. Bioresource Technology , 2014, 168 : 214-221 DOI:10.1016/j.biortech.2014.01.048 |
| [18] | Mishra A, Malik A . Novel fungal consortium for bioremediation of metals and dyes from mixed waste stream[J]. Bioresource Technology , 2014, 171 : 217-226 DOI:10.1016/j.biortech.2014.08.047 |
| [19] | Sharma P, Kaur H, Sharma M . A review on applicability of naturally available adsorbents for the removal of hazardous dyes from aqueous waste[J]. Environmental Monitoring and Assessment , 2011, 183 (1-4) : 151-195 DOI:10.1007/s10661-011-1914-0 |
| [20] | Srinivasan A, Viraraghavan T . Decolorization of dye wastewaters by biosorbents:a review[J]. Journal of Environmental Management , 2010, 91 (10) : 1915-1929 DOI:10.1016/j.jenvman.2010.05.003 |
| [21] | Raghukumar C, Chandramohan D, Michel F C . Degradation of lignin and decolorization of paper mill bleach plant effluent (BPE) by marine fungi[J]. Biotechnology Letters , 1996, 18 (1) : 105-106 DOI:10.1007/BF00137820 |
| [22] | Park D, Yun Y S, Jo J H . Mechanism of hexavalent chromium removal by dead fungal biomass of Aspergillus niger[J]. Water Research , 2005, 39 (4) : 533-540 DOI:10.1016/j.watres.2004.11.002 |
| [23] | Sag Y . Biosorption of heavy metals by fungal biomass and modeling of fungal biosorption:a review[J]. Separation and Purification Methods , 2001, 30 (1) : 1-48 DOI:10.1081/SPM-100102984 |
| [24] | Veglio F, Beolchini F . Removal of metals by biosorption:a review[J]. Hydrometallurgy , 1997, 44 (3) : 301-316 DOI:10.1016/S0304-386X(96)00059-X |
| [25] | Kumar R, Bishnoi N R, Garima . Biosorption of chromium(VI) from aqueous solution and electroplating wastewater using fungal biomass[J]. Chemical Engineering Journal , 2008, 135 (3) : 202-208 DOI:10.1016/j.cej.2007.03.004 |
| [26] | Rao J R, Viraraghavan T . Biosorption of phenol from an aqueous solution by Aspergillus niger biomass[J]. Bioresource Technology , 2002, 85 (2) : 165-171 DOI:10.1016/S0960-8524(02)00079-2 |
| [27] | Gadd G M, White C . Microbial treatment of metal pollution-a working biotechnology[J]. Trends in Biotechnology , 1993, 11 (8) : 353-359 DOI:10.1016/0167-7799(93)90158-6 |
| [28] | Muraleedharan T R, Iyengar L, Venkobachar C . Biosorption-an attractive alternative for metal removal and recovery[J]. Current Science , 1991, 61 (6) : 379-385 |
| [29] | Crini G, Badot P M . Application of chitosan, a natural aminopolysaccharide, for dye removal from aqueous solutions by adsorption processes using batch studies:a review of recent literature[J]. Progress in Polymer Science , 2008, 33 (4) : 399-447 DOI:10.1016/j.progpolymsci.2007.11.001 |
| [30] | Xu F . Oxidation of phenols, anilines, and benzenethiols by fungal laccases:correlation between activity and redox potentials as well as halide inhibition[J]. Biochemistry , 1996, 35 (23) : 7608-7614 DOI:10.1021/bi952971a |
| [31] | Aust S D, Benson J T . The fungus among us-use of white-rot fungi to biodegrade environmental-pollutants[J]. Environmental Health Perspectives , 1993, 101 (3) : 232-233 DOI:10.1289/ehp.93101232 |
| [32] | Giardina P, Faraco V, Pezzella C . Laccases:a never-ending story[J]. Cellular and Molecular Life Sciences , 2010, 67 (3) : 369-385 DOI:10.1007/s00018-009-0169-1 |
| [33] | Baldrian P . Fungal laccases-occurrence and properties[J]. Fems Microbiology Reviews , 2006, 30 (2) : 215-242 DOI:10.1111/j.1574-4976.2005.00010.x |
| [34] | Reiss R, Ihssen J, Thony-Meyer L . Bacillus pumilus laccase:a heat stable enzyme with a wide substrate spectrum[J]. Bmc Biotechnology , 2011, 14 (2) : 8 |
| [35] | Gasser C A, Ammann E M, Shahgaldian P . Laccases to take on the challenge of emerging organic contaminants in wastewater[J]. Applied Microbiology and Biotechnology , 2014, 98 (24) : 9931-9952 DOI:10.1007/s00253-014-6177-6 |
| [36] | Auriol M, Filali-Meknassi Y, Adams C D . Removal of estrogenic activity of natural and synthetic hormones from a municipal wastewater:efficiency of horseradish peroxidase and laccase from Trametes versicolor[J]. Chemosphere , 2008, 70 (3) : 445-452 DOI:10.1016/j.chemosphere.2007.06.064 |
| [37] | Auriol M, Filali-Meknassi Y, Tyagi R D . Laccase-catalyzed conversion of natural and synthetic hormones from a municipal wastewater[J]. Water Research , 2007, 41 (15) : 3281-3288 DOI:10.1016/j.watres.2007.05.008 |
| [38] | Garcia H A, Hoffman C M, Kinney K A . Laccase-catalyzed oxidation of oxybenzone in municipal wastewater primary effluent[J]. Water Research , 2011, 45 (5) : 1921-1932 DOI:10.1016/j.watres.2010.12.027 |
| [39] | Tanaka T, Tonosaki T, Nose M . Treatment of model soils contaminated with phenolic endocrine-disrupting chemicals with laccase from Trametes sp in a rotating reactor[J]. Journal of Bioscience and Bioengineering , 2001, 92 (4) : 312-316 DOI:10.1016/S1389-1723(01)80232-2 |
| [40] | Xue D S, Chen H Y, Lin D Q . Optimization of a natural medium for cellulase by a marine aspergillus niger using response surface methodology[J]. Applied Biochemistry and Biotechnology , 2012, 167 (7) : 1963-1972 DOI:10.1007/s12010-012-9734-4 |
| [41] | Xue D S, Chen H Y, Ren Y R . Enhancing the activity and thermostability of thermostable beta-glucosidase from a marine Aspergillus niger at high salinity[J]. Process Biochemistry , 2012, 47 (4) : 606-611 DOI:10.1016/j.procbio.2011.12.021 |
| [42] | LIU Jie-feng(刘杰凤), XUE Dong-sheng(薛栋升), HE Ke-ke(何可可) . Screening of a cellulase producing halotolerant strain marine aspergillu spand its fermentation conditions(一株耐盐纤维素酶海洋曲霉的筛选及产酶条件研究)[J]. Journal of Food Science and Biotechnology(食品与生物技术学报) , 2012, 31 (7) : 711-718 |
| [43] | Park D, Yun Y S, Park J M . Comment on the removal mechanism of hexavalent chromium by biomaterials or biomaterial-based activated carbons[J]. Industrial & Engineering Chemistry Research , 2006, 45 (7) : 2405-2407 |
| [44] | Park D, Yun Y S, Park J M . Studies on hexavalent chromium biosorption by chemically-treated biomass of Ecklonia sp[J]. Chemosphere , 2005, 60 (10) : 1356-1364 DOI:10.1016/j.chemosphere.2005.02.020 |
| [45] | Ip A W M, Barford J P, Mckay G . A comparative study on the kinetics and mechanisms of removal of Reactive Black 5 by adsorption onto activated carbons and bone char[J]. Chemical Engineering Journal , 2010, 157 (2-3) : 434-442 DOI:10.1016/j.cej.2009.12.003 |
| [46] | Banat I M, Nigam P, Singh D . Microbial decolorization of textile-dye-containing effluents:a review[J]. Bioresource Technology , 1996, 58 (3) : 217-227 DOI:10.1016/S0960-8524(96)00113-7 |
| [47] | Robinson T, McMullan G, Marchant R . Remediation of dyes in textile effluent:a critical review on current treatment technologies with a proposed alternative[J]. Bioresource Technology , 2001, 77 (3) : 247-255 DOI:10.1016/S0960-8524(00)00080-8 |
| [48] | Xiong X J, Meng X J, Zheng T L . Biosorption of CI Direct Blue 199 from aqueous solution by nonviable Aspergillus niger[J]. Journal of Hazardous Materials , 2010, 175 (1-3) : 241-246 DOI:10.1016/j.jhazmat.2009.09.155 |
| [49] | Solis M, Solis A, Perez H I . Microbial decolouration of azo dyes:a review[J]. Process Biochemistry , 2012, 47 (12) : 1723-1748 DOI:10.1016/j.procbio.2012.08.014 |
| [50] | Abd El-Rahim W M, Moawad H, Khalafallah M . Microflora involved in textile dye waste removal[J]. Journal of Basic Microbiology , 2003, 43 (3) : 167-174 DOI:10.1002/jobm.200390019 |
| [51] | Akar T, Arslan S, Akar S T . Utilization of Thamnidium elegans fungal culture in environmental cleanup:a reactive dye biosorption study[J]. Ecological Engineering , 2013, 58 : 363-370 DOI:10.1016/j.ecoleng.2013.06.026 |
| [52] | Bayramoglu G, Arica M Y . Biosorption of benzidine based textile dyes "Direct Blue 1 and Direct Red 128" using native and heat-treated biomass of Trametes versicolor[J]. Journal of Hazardous Materials , 2007, 143 (1-2) : 135-143 DOI:10.1016/j.jhazmat.2006.09.002 |
| [53] | Binupriya A R, Sathishkumar M, Kavitha D . Experimental and isothermal studies on sorption of Congo red by modified mycelial biomass of wood-rotting fungus[J]. Clean-Soil Air Water , 2007, 35 (2) : 143-150 DOI:10.1002/(ISSN)1863-0650 |
| [54] | Gupta V K, Suhas . Application of low-cost adsorbents for dye removal-a review[J]. Journal of Environmental Management , 2009, 90 (8) : 2313-2342 DOI:10.1016/j.jenvman.2008.11.017 |
| [55] | Kaushik P, Malik A . Fungal dye decolourization:recent advances and future potential[J]. Environment International , 2009, 35 (1) : 127-141 DOI:10.1016/j.envint.2008.05.010 |
| [56] | Khan R, Bhawana P, Fulekar M H . Microbial decolorization and degradation of synthetic dyes:a review[J]. Reviews in Environmental Science and Bio-Technology , 2013, 12 (1) : 75-97 DOI:10.1007/s11157-012-9287-6 |
| [57] | Yang Q X, Yang M, Pritsch K . Decolorization of synthetic dyes and production of manganese-dependent peroxidase by new fungal isolates[J]. Biotechnology Letters , 2003, 25 (9) : 709-713 DOI:10.1023/A:1023454513952 |
| [58] | Taskin M, Erdal S . Reactive dye bioaccumulation by fungus Aspergillus niger isolated from the effluent of sugar fabric-contaminated soil[J]. Toxicology and Industrial Health , 2010, 26 (4) : 239-247 DOI:10.1177/0748233710364967 |
| [59] | Kadirvelu K, Thamaraiselvi K, Namasivayam C . Removal of heavy metals from industrial wastewaters by adsorption onto activated carbon prepared from an agricultural solid waste[J]. Bioresource Technology , 2001, 76 (1) : 63-65 DOI:10.1016/S0960-8524(00)00072-9 |
| [60] | Dal Bosco S M, Jimenez R S, Vignado C . Removal of Mn(II) and Cd(II) from wastewaters by natural and modified clays[J]. Adsorption-Journal of the International Adsorption Society , 2006, 12 (2) : 133-146 DOI:10.1007/s10450-006-0375-1 |
| [61] | Fu F L, Wang Q . Removal of heavy metal ions from wastewaters:a review[J]. Journal of Environmental Management , 2011, 92 (3) : 407-418 DOI:10.1016/j.jenvman.2010.11.011 |
| [62] | Aksu Z, Balibek E . Chromium(VI) biosorption by dried Rhizopus arrhizus:effect of salt (NaCl) concentration on equilibrium and kinetic parameters[J]. Journal of Hazardous Materials , 2007, 145 (1-2) : 210-220 DOI:10.1016/j.jhazmat.2006.11.011 |
| [63] | Chen F, Tan N, Long W . Enhancement of uranium(VI) biosorption by chemically modified marine-derived mangrove endophytic fungus Fusarium sp #ZZF51[J]. Journal of Radioanalytical and Nuclear Chemistry , 2014, 299 (1) : 193-201 DOI:10.1007/s10967-013-2758-6 |
| [64] | Iskandar N L, Zainudin N A I M, Tan S G . Tolerance and biosorption of copper (Cu) and lead (Pb) by filamentous fungi isolated from a freshwater ecosystem[J]. Journal of Environmental Sciences-China , 2011, 23 (5) : 824-830 DOI:10.1016/S1001-0742(10)60475-5 |
| [65] | Moussous S, Selatnia A, Merati A . Batch cadmium(II) biosorption by an industrial residue of macrofungal biomass (Clitopilus scyphoides)[J]. Chemical Engineering Journal , 2012, 197 : 261-271 DOI:10.1016/j.cej.2012.04.106 |
| [66] | Ozer A, Ozer D . Comparative study of the biosorption of Pb, Ni(II) and Cr(VI) ions onto S-cerevisiae:determination of biosorption heats[J]. Journal of Hazardous Materials , 2003, 100 (1-3) : 219-229 DOI:10.1016/S0304-3894(03)00109-2 |
| [67] | Sari A, Tuzen M . Kinetic and equilibrium studies of biosorption of Pb(II) and Cd(II) from aqueous solution by macrofungus (Amanita rubescens) biomass[J]. Journal of Hazardous Materials , 2009, 164 (2-3) : 1004-1011 DOI:10.1016/j.jhazmat.2008.09.002 |
| [68] | Subbaiah M V, Vijaya Y, Reddy A S . Equilibrium, kinetic and thermodynamic studies on the biosorption of Cu(II) onto Trametes versicolor biomass[J]. Desalination , 2011, 276 (1-3) : 310-316 DOI:10.1016/j.desal.2011.03.067 |
| [69] | Zaidi M K . Wastewater reuse risk assessment, decision making, and environmental security:a technical report[J]. Real-Time and Deliberative Decision Making:Application to Emerging Stressors , 2008 : 445-450 |
| [70] | Martins A M P, Pagilla K, Heijnen J J . Filamentous bulking sludge-a critical review[J]. Water Research , 2004, 38 (4) : 793-817 DOI:10.1016/j.watres.2003.11.005 |
| [71] | Khursheed A, Kazmi A A . Retrospective of ecological approaches to excess sludge reduction[J]. Water Research , 2011, 45 (15) : 4287-4310 DOI:10.1016/j.watres.2011.05.018 |
| [72] | Osiewacz H D . Genes, mitochondria and aging in filamentous fungi[J]. Ageing Research Reviews , 2002, 1 (3) : 425-442 DOI:10.1016/S1568-1637(02)00010-7 |
| [73] | Fakhru'l-Razi A, Molla A H . Enhancement of bioseparation and dewaterability of domestic wastewater sludge by fungal treated dewatered sludge[J]. Journal of Hazardous Materials , 2007, 147 (1-2) : 350-356 DOI:10.1016/j.jhazmat.2007.01.060 |
| [74] | More T T, Yan S, Tyagi R D . Potential use of filamentous fungi for wastewater sludge treatment[J]. Bioresource Technology , 2010, 101 (20) : 7691-7700 DOI:10.1016/j.biortech.2010.05.033 |
| [75] | Mannan S, Fakhru'l-Razi A, Alam M Z . Use of fungi to improve bioconversion of activated sludge[J]. Water Research , 2005, 39 (13) : 2935-2943 DOI:10.1016/j.watres.2005.04.074 |
| [76] | Molla A H, Fakhru'l-Razi A, Abd-Aziz S . In-vitro compatibility evaluation of fungal mixed culture for bioconversion of domestic wastewater sludge[J]. World Journal of Microbiology & Biotechnology , 2001, 17 (9) : 849-856 |
| [77] | Subramanian S B, Yan S, Tyagi R D . A new, pellet-forming fungal strain:its isolation, molecular identification, and performance for simultaneous sludge-solids reduction, flocculation, and dewatering[J]. Water Environment Research , 2008, 80 (9) : 840-852 DOI:10.2175/106143008X304703 |
| [78] | Verma M, Brar S K, Tyagi R D . Wastewater sludge as a potential raw material for antagonistic fungus (Trichoderma sp.):role of pre-treatment and solids concentratio[J]. Water Research , 2005, 39 (15) : 3587-3596 DOI:10.1016/j.watres.2005.07.001 |
| [79] | Hank D, Azi Z, Hocine S A . Optimization of phenol adsorption onto bentonite by factorial design methodology[J]. Journal of Industrial and Engineering Chemistry , 2014, 20 (4) : 2256-2263 DOI:10.1016/j.jiec.2013.09.058 |
| [80] | Senturk H B, Ozdes D, Gundogdu A . Removal of phenol from aqueous solutions by adsorption onto organomodified Tirebolu bentonite:equilibrium, kinetic and thermodynamic study[J]. Journal of Hazardous Materials , 2009, 172 (1) : 353-362 DOI:10.1016/j.jhazmat.2009.07.019 |
| [81] | Banat F A, Al-Bashir B, Al-Asheh S . Adsorption of phenol by bentonite[J]. Environmental Pollution , 2000, 107 (3) : 391-398 DOI:10.1016/S0269-7491(99)00173-6 |
| [82] | Kumar N S, Boddu V M, Krishnaiah A . Biosorption of phenolic compounds by trametes versicolor polyporus fungus[J]. Adsorption Science & Technology , 2009, 27 (1) : 31-46 |
| [83] | Kumar N S, Min K . Phenolic compounds biosorption onto Schizophyllum commune fungus:FTIR analysis, kinetics and adsorption isotherms modeling[J]. Chemical Engineering Journal , 2011, 168 (2) : 562-571 DOI:10.1016/j.cej.2011.01.023 |
| [84] | Denizli A, Cihangir N, Tuzmen N . Removal of chlorophenols from aquatic systems using the dried and dead fungus Pleurotus sajor caju[J]. Bioresource Technology , 2005, 96 (1) : 59-62 DOI:10.1016/j.biortech.2003.11.029 |
| [85] | Tastan B E, Donmez G . Biodegradation of pesticide triclosan by A. versicolor in simulated wastewater and semi-synthetic media[J]. Pesticide Biochemistry and Physiolog , 2015, 118 : 33-37 DOI:10.1016/j.pestbp.2014.11.002 |
| [86] | Lu Y, Yan L H, Wang Y . Biodegradation of phenolic compounds from coking wastewater by immobilized white rot fungus Phanerochaete chrysosporium[J]. Journal of Hazardous Materials , 2009, 165 (1-3) : 1091-1097 DOI:10.1016/j.jhazmat.2008.10.091 |
| [87] | Krull R, Wucherpfennig T, Esfandabadi M E . Characterization and control of fungal morphology for improved production performance in biotechnology[J]. J Biotechnol , 2013, 163 (2) : 112-123 DOI:10.1016/j.jbiotec.2012.06.024 |
| [88] | Papagianni M . Fungal morphology and metabolite production in submerged mycelial processes[J]. Biotechnology Advances , 2004, 22 (3) : 189-259 DOI:10.1016/j.biotechadv.2003.09.005 |
| [89] | Aksu Z, Gonen F . Biosorption of phenol by immobilized activated sludge in a continuous packed bed:prediction of breakthrough curves[J]. Process Biochemistry , 2004, 39 (5) : 599-613 DOI:10.1016/S0032-9592(03)00132-8 |
| [90] | Aksu Z . Application of biosorption for the removal of organic pollutants:a review[J]. Process Biochemistry , 2005, 40 (3-4) : 997-1026 DOI:10.1016/j.procbio.2004.04.008 |
| [91] | Bohmer U, Kirsten C, Bley T . White-rot fungi combined with lignite granules and lignitic xylite to decolorize textile industry wastewater[J]. Engineering in Life Sciences , 2010, 10 (1) : 26-34 DOI:10.1002/elsc.v10:1 |
| [92] | Enayatzamir K, Alikhani H A, Yakhchali B . Decolouration of azo dyes by phanerochaete chrysosporium immobilised into alginate beads[J]. Environmental Science and Pollution Research , 2010, 17 (1) : 145-153 DOI:10.1007/s11356-009-0109-5 |
| [93] | Grinhut T, Salame T M, Chen Y N . Involvement of ligninolytic enzymes and Fenton-like reaction in humic acid degradation by Trametes sp[J]. Applied Microbiology and Biotechnology , 2011, 91 (4) : 1131-1140 DOI:10.1007/s00253-011-3300-9 |
| [94] | Iqbal M, Saeed A . Biosorption of reactive dye by loofa sponge-immobilized fungal biomass of Phanerochaete chrysosporium[J]. Process Biochemistry , 2007, 42 (7) : 1160-1164 DOI:10.1016/j.procbio.2007.05.014 |
| [95] | Karimi A, Vahabzadeh F, Bonakdarpour B . Use of Phanerochaete chrysosporium immobilized on Kissiris for synthetic dye decolourization:involvement of manganese peroxidase[J]. World Journal of Microbiology & Biotechnology , 2006, 22 (12) : 1251-1257 |
| [96] | Maurya N S, Mittal A K, Cornel P . Biosorption of dyes using dead macro fungi:effect of dye structure, ionic strength and pH[J]. Bioresource Technology , 2006, 97 (3) : 512-521 DOI:10.1016/j.biortech.2005.02.045 |
| [97] | Kocaoba S, Arisoy M . The use of a white rot fungi (Pleurotus ostreatus) immobilized on Amberlite XAD-4 as a new biosorbent in trace metal determination[J]. Bioresource Technology , 2011, 102 (17) : 8035-8039 DOI:10.1016/j.biortech.2011.05.004 |
| [98] | Fu Y Z, Viraraghavan T . Removal of a dye from an aqueous solution by the fungus Aspergillus niger[J]. Water Quality Research Journal of Canada , 2000, 35 (1) : 95-111 |
| [99] | Wang J L, Chen C . Biosorption of heavy metals by Saccharomyces cerevisiae:a review[J]. Biotechnology Advances , 2006, 24 (5) : 427-451 DOI:10.1016/j.biotechadv.2006.03.001 |
| [100] | Fu Y Z, Viraraghavan T . Removal of CI acid blue 29 from an aqueous solution by aspergillus niger[J]. Aatcc Review , 2001, 1 (1) : 36-40 |
| [101] | Gadd G M, White C . Copper uptake by Penicillium-Ochro-Chloron-Influence of Ph on toxicity and demonstration of energy-dependent copper influx using protoplasts[J]. Journal of General Microbiology , 1985, 131 (Aug) : 1875-1879 |
| [102] | Shroff K A, Vaidya V K . Kinetics and equilibrium studies on biosorption of nickel from aqueous solution by dead fungal biomass of mucor hiemalis[J]. Chemical Engineering Journal , 2011, 171 (3) : 1234-1245 DOI:10.1016/j.cej.2011.05.034 |
| [103] | Kodam K M, Soojhawon I, Lokhande P D . Microbial decolorization of reactive azo dyes under aerobic conditions[J]. World Journal of Microbiology & Biotechnology , 2005, 21 (3) : 367-370 |
| [104] | Wells A, Teria M, Eve T . Green oxidations with laccase-mediator systems[J]. Biochemical Society Transactions , 2006, 34 : 304-308 DOI:10.1042/BST0340304 |
| [105] | Bakshi D K, Saha S, Sindhu I . Use of Phanerochaete chrysosporium biomass for the removal of textile dyes from a synthetic effluent[J]. World Journal of Microbiology & Biotechnology , 2006, 22 (8) : 835-839 |
| [106] | Erden E, Kaymaz Y, Pazarlioglu N K . Biosorption kinetics of a direct azo dye Sirius Blue K-CFN by Trametes versicolor[J]. Electronic Journal of Biotechnology , 2011, 14 (2) : 8 |
| [107] | Chang J S, Kuo T S, Chao Y P . Azo dye decolorization with a mutant Escherichia coli strain[J]. Biotechnology Letters , 2000, 22 (9) : 807-812 DOI:10.1023/A:1005624707777 |
| [108] | Aksu Z, Balibek E . Effect of salinity on metal-complex dye biosorption by Rhizopus arrhizus[J]. Journal of Environmental Management , 2010, 91 (7) : 1546-1555 DOI:10.1016/j.jenvman.2010.02.026 |
| [109] | Canas A I, Camarero S . Laccases and their natural mediators:biotechnological tools for sustainable eco-friendly processes[J]. Biotechnology Advances , 2010, 28 (6) : 694-705 DOI:10.1016/j.biotechadv.2010.05.002 |
| [110] | Lloret L, Eibes G, Moreira M T . On the use of a high-redox potential laccase as an alternative for the transformation of non-steroidal anti-inflammatory drugs (NSAIDs)[J]. Journal of Molecular Catalysis B-Enzymatic , 2013, 97 : 233-242 DOI:10.1016/j.molcatb.2013.08.021 |
| [111] | Kim T H, Lee Y, Yang J . Decolorization of dye solutions by a membrane bioreactor (MBR) using white-rot fungi[J]. Desalination , 2004, 168 : 287-293 DOI:10.1016/j.desal.2004.07.011 |
| [112] | Zhang F M, Knapp J S, Tapley K N . Development of bioreactor systems for decolorization of Orange II using white rot fungus[J]. Enzyme and Microbial Technology , 1999, 24 (1-2) : 48-53 DOI:10.1016/S0141-0229(98)00090-8 |
| [113] | Rahman R A, Molla A, Fakhru'l-Razi A . Assessment of sewage sludge bioremediation at different hydraulic retention times using mixed fungal inoculation by liquid-state bioconversion[J]. Environmental Science and Pollution Research , 2014, 21 (2) : 1178-1187 DOI:10.1007/s11356-013-1974-5 |
| [114] | Mishra A, Malik A . Metal and dye removal using fungal consortium from mixed waste stream:optimization and validation[J]. Ecological Engineering , 2014, 69 : 226-231 DOI:10.1016/j.ecoleng.2014.04.007 |
| [115] | Chen H Y, Wang M X, Shen Y B . Optimization of two-species whole-cell immobilization system constructed with marine-derived fungi and its biological degradation ability[J]. Chinese Journal of Chemical Engineering , 2014, 22 (2) : 187-192 DOI:10.1016/S1004-9541(14)60024-0 |
| [116] | Feng X Y, Chen H Y, Xue D S . Enhancement of laccase activity by marine-derived deuteromycete pestalotiopsis sp J63 with agricultural residues and inducers[J]. Chinese Journal of Chemical Engineering , 2013, 21 (10) : 1182-1189 DOI:10.1016/S1004-9541(13)60567-4 |
| [117] | FENG Xiao-yu(冯晓雨), CHEN Hui-ying(陈慧英), XUE Dong-sheng(薛栋升) . Effect of inorganic salts on laccase production by marine-derived pestalotiopsis sp. J63 and on azo dye decolorization(无机盐对海洋内生拟盘多毛孢菌J63产漆酶及漆酶脱色偶氮类染料的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (1) : 90-95 |
| [118] | Zhang S, Li A, Cui D . Performance of enhanced biological SBR process for aniline treatment by mycelial pellet as biomass carrier[J]. Bioresource Technology , 2011, 102 (6) : 4360-4365 DOI:10.1016/j.biortech.2010.12.079 |
| [119] | Gou M, Qu Y Y, Zhou J T . Azo dye decolorization by a new fungal isolate, Penicillium sp QQ and fungal-bacterial cocultures[J]. Journal of Hazardous Materials , 2009, 170 (1) : 314-319 DOI:10.1016/j.jhazmat.2009.04.094 |
| [120] | Chen B L, Ding J . Biosorption and biodegradation of phenanthrene and pyrene in sterilized and unsterilized soil slurry systems stimulated by Phanerochaete chrysosporium[J]. Journal of Hazardous Materials , 2012, 229 : 159-169 |




