2. 甘肃省生物质能与太阳能互补供能系统重点实验室, 甘肃 兰州 730050;
3. 中国科学院西北生态环境资源研究院冻土工程国家重点实验室, 甘肃 兰州 730050
2. Key Lab of Complementary Energy System of Biomass and Solar Energy Gansu Province, Lanzhou 730050, China;
3. Northwest Institute of Eco-Environment and Resources, Chinese Academy of Sciences, Lanzhou 730050, China
能源和环境问题是当今世界面临的重大课题。随着化石燃料的大量消耗,CO2气体的排放量逐年增加,导致全球气候变暖和温室效应问题[1-2]。在“双碳”目标的大背景下,实现CO2气体的高效捕集和封存是实现CO2减排的有效方式,也是推动绿色发展、实现“碳达峰”、“碳中和”目标的重要途径[3]。
气体水合物是由气体分子和水分子在一定温度、压力条件下形成的一种非化学计量的笼型晶体化合物。基于气体水合物法的CO2捕集和封存技术是实现二氧化碳气体减排的有效途径,也是当前气体水合物应用研究领域的热点[4-5]。国内外学者对多孔介质中水合物的生成过程开展了大量的理论和实验研究,并取得了一系列重要成果[6-11]。现有研究表明:当初始压力小于CO2液化压力时,随着压力的升高,CO2水合物的生成速率不断加快,较高的初始压力有助于提高CO2水合物的最终转化率,且初始压力越高,开始阶段形成水合物速度越快[12-15]。同时,研究发现CO2的液化会影响水合物的生成速率,但作用机理尚不明确[16]。Zhou等[17]研究发现,初始压力的增加有效提高了水合物的生成速率,气体消耗随着初始压力的增加而增加。祁影霞等[18]实验研究表明,添加一定体积比的水合物晶块可缩短水合物形成的诱导时间,降低水合物生成的过冷度。另外,在多孔介质体系中,较高的初始压力有助于提高水合物的生成过程,增大初始压力可以明显提高水合物的储气能力[19, 20]。张凤琦等[21]研究了不同注入压力对液态条件下CO2-CH4水合物置换过程的影响,发现低压条件下有利于获得较优的置换效果。综上所述,温度、压力、多孔介质参数、CO2相态等因素对多孔介质中水合物的生成过程具有重要影响,但目前研究主要集中在非液化状态,且关于液化条件对多孔介质中CO2水合物生成过程影响的研究还鲜见报道,有待进一步揭示液化条件对水合物生成过程的作用机理及其动力学机制。
鉴此,本研究采用石英砂模拟多孔介质条件,研究不同初始压力和温度条件下多孔介质体系中CO2水合物的生成过程,分析液化条件对多孔介质中CO2水合物生成过程的定量影响,为温室气体CO2的地质封存提供一定的理论依据和参考。
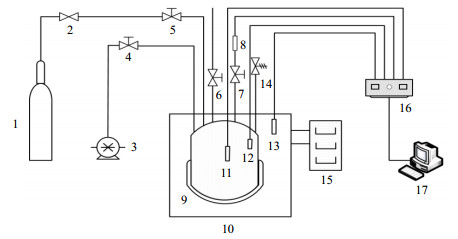
2 实验 2.1 实验装置实验装置如图 1所示,该系统主要由高压水合反应釜、温度控制系统、数据采集仪、真空系统、二氧化碳及氮气气瓶等几部分组成。高压反应釜为圆柱形,反应釜体积为300 mL,由316 L不锈钢制成,耐压20 MPa;真空系统通过2XZ-0.5型旋片真空泵实现,极限压力为6×10−3 kPa;温度控制系统由恒温酒精浴实现,温控范围为−20 ~100 ℃;温度传感器采用Pt 100铂电阻温度传感器,控温精度为±0.05 ℃;压力传感量程为0~10 MPa,测量精度为0.05%;数据采集通过Agilent 34970A数据采集仪实现,由安捷伦科技有限公司(西安)生产,可分别采集实验过程中温度、压力的变化,并实时记录和显示。
|
图 1 实验系统示意图 Fig.1 Schematic diagram of the experimental setup 1. gas cylinder 2. relief valve 3. vacuum pump 4-7. rotary screw valve 8. pressure sensor 9. reactor 10. constant temperature alcohol bath 11-13. temperature sensor 14. safety valve 15. cryogenic circulator 16. data acquisition 17. computer |
CO2体积分数为99.99%,由兰州兰恒特种气体有限公司提供;N2体积分数为99.9%,由浙江三环化学试剂有限公司提供;石英砂纯度为99.0%,由天津市立元化工有限公司提供。实验中使用的蒸馏水由实验室自制。
2.3 实验过程实验前,将实验用石英砂样品清洗干净后置于红外干燥箱内干燥10 h,烘干水分。首先,取100 mL干燥后的700 μm的石英砂试样,装入预先清洗干净的反应釜中,再加入50 mL的自制蒸馏水使其达到饱和,盖上反应釜盖,静置一段时间使水均匀分散在多孔介质中。将反应釜封装并连接好管路后,置于恒温酒精浴中。
实验开始前,向反应釜内充入N2至5.0 MPa进行保压,用以测试装置的气密性。待气密性测试结束之后,打开真空泵,对反应釜和管路进行抽真空。然后,向反应釜中充入CO2气体至实验预设压力(3.9、4.2、4.5、4.8和5.1 MPa),之后不再向反应釜内补充CO2气体;调节恒温酒精浴温度,使低温循环器调至预设温度,以确保实验过程中初始时刻反应釜内温度相同。当高压水合反应釜内温度恒定,对水合反应系统开始降温,进行不同初始压力、温度条件下CO2水合物的生成过程实验研究。当反应釜内压力保持2 h稳定不变时,认为水合反应结束。反应过程中反应釜内压力、多孔介质温度、气相温度及恒温空气浴的温度通过Agilent 34970A数据采集仪采集和实时记录。
2.4 数据处理本实验在恒容条件下进行,利用实际气体的状态方程,可计算得到水合反应过程中不同时刻的CO2气体消耗量,进而可求得水合反应过程中CO2水合物的平均生成速率[12, 22]。CO2水合物的平均生成速率v表示单位时间内消耗的CO2气体量,可由式(1)计算得到[12]
| $ v = \frac{{\Delta n}}{{\Delta t}} = \frac{{{n_0} - {n_t}}}{{\Delta t}} $ | (1) |
式中:v为CO2水合物的平均生成速率,mol·s−1;n0为初始时刻CO2气体的物质的量,mol;nt为水合反应结束时CO2气体的物质的量,mol;Δt为水合反应结束与系统随冷浴降温至相平衡点的时间差,s;在给定时间t内的CO2气体的消耗量n可通过实际气体的状态方程计算得到。
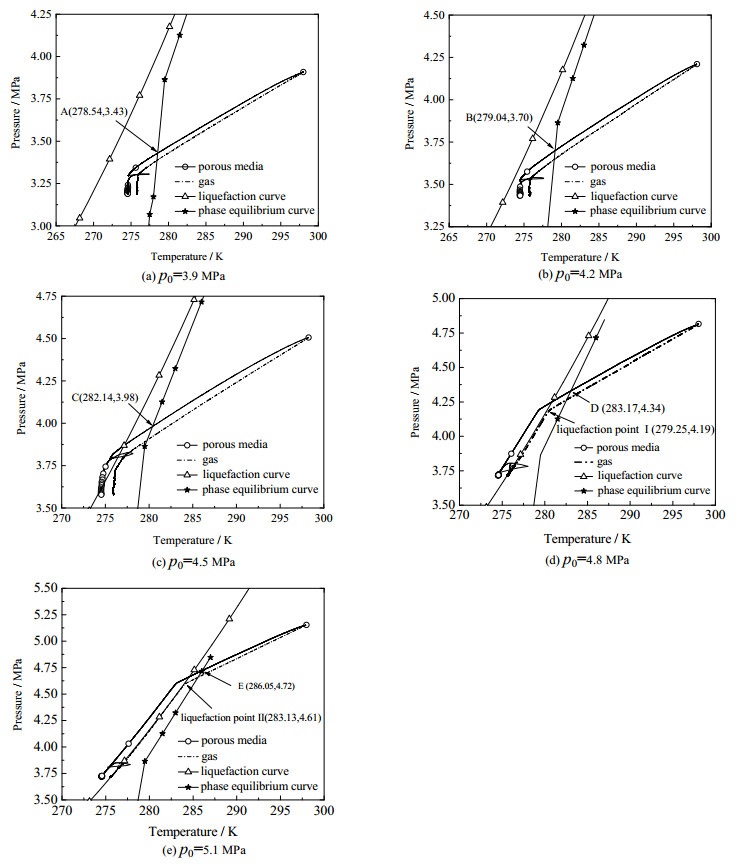
3 结果与讨论 3.1 不同初始压力条件下多孔介质中CO2水合物的生成过程研究图 2为温度T=273.5 K,初始压力p0分别为3.9、4.2、4.5、4.8和5.1 MPa时,粒径为700 μm的石英砂介质中CO2水合物生成过程的温度压力变化曲线。图中A、B、C、D、E分别为各初始压力对应的多孔介质中温压曲线与相平衡曲线的交点,I1、I2分别为初始压力4.8、5.1 MPa对应的液化点。从图 2(d)~(e)中可以看出,随着体系温度的降低,反应釜内温度压力逐渐降低。同时,温压曲线在降温过程中达到某一可生成水合物的相平衡条件后[23-24],但均未立即生成水合物,随着水合反应的继续进行,在某一时刻出现温度陡升的现象。这是由于水合物短时间内大量生成放热引起温度的上升。在水合反应体系中从系统达到平衡条件直至第一次出现水合物大量生成的这段时间称为诱导时间[24-28]。由图中2(a)和(b)可以看出,气体的温压曲线并未与液化曲线相交,表明釜内CO2以气体形式生成水合物;而图 2(c)中气体温压曲线与液化曲线存在相交区域,但随着反应的继续进行逐渐脱离液化曲线,并且气体温压曲线并未与液化曲线存在明显交点,说明釜内CO2绝大多数以气体形式存在,CO2气体的液化量较少;从图 2(d)和(e)中可以看出,气体的温压曲线完全进入液化曲线内侧,说明达到液化点以后,釜内存在大量液态的CO2,不同相态的CO2会对多孔介质体系中CO2水合物的生成过程产生重要影响。
|
图 2 不同初始压力下二氧化碳水合物生成过程中温度压力的变化曲线 Fig.2 Temperature and pressure profiles during CO2 hydrate formation under different initial pressures |
同时,从图 2(d)和(e)中还可以看出,当反应釜内气体温压曲线达到液化条件后并未立即出现明显转折点,而上层气体温压曲线达到液化条件后,由于气体液化使釜内压力降低,温压曲线上立即出现了转折点。这是由于在反应系统降温的过程中,石英砂体系温度先于上层气体达到液化条件,但由于初始时刻石英砂体系中水为饱和状态,渗入的少量CO2气体大多溶解于饱和水中,以游离态形式存在的CO2非常少,此时石英砂体系内虽然达到了CO2气体的液化条件,但微量CO2的液化不足以明显改变反应釜内的压力,温压曲线并未出现明显转折点。随着水合反应的继续,当上层气体达到液化条件后,反应釜内大量气态CO2发生液化,导致釜内压力在短时间内急剧降低,温压曲线立即出现转折点。同时,由于反应釜内压力急剧下降,压力随时间的变化曲线出现陡降,多孔介质体系中温压曲线也出现明显转折点。在水合反应过程中,随着时间的推移,气体温压曲线几乎和液化曲线重合,而多孔介质温压曲线除温度陡升点外,其变化规律几乎完全与液化曲线的变化规律一致。与非液化条件相比,液化条件下多孔介质中CO2水合物的生成过程呈现出与之完全不同的变化规律[12, 14, 24]。另外,由图 2(a)、(b)可以看出,当釜内温度达到温度陡升点后,多孔介质内温压曲线逐渐偏离液化曲线,其变化趋势几乎平行于相平衡曲线直至水合反应结束。这说明,此时CO2水合物生成是引起釜内温压变化的主要因素,且在图 2(c)中呈现出与图 2(a)和(b)类似的变化规律。综上可知,在多孔介质体系CO2水合物生成过程中,当CO2气体未达到液化条件,或者CO2气体液化量非常少时,反应釜内温压的变化主要由水合反应决定;当釜内完全达到CO2气体的液化条件后,反应釜内水合物生成引起的温压变化并不足以改变CO2气体的液化趋势,且当水合物大量生成之后,由于后续反应中水合物生成量较少,反应釜内温压曲线并没有出现明显变化。同时,从图 2(d)和(e)可以看出,当温度达到陡升点之后,反应釜内温压曲线变化幅度较小,这进一步说明在此之后水合物生成量少,反应釜内温压曲线变化不明显,且反应过程中CO2气体始终未脱离液化区域。
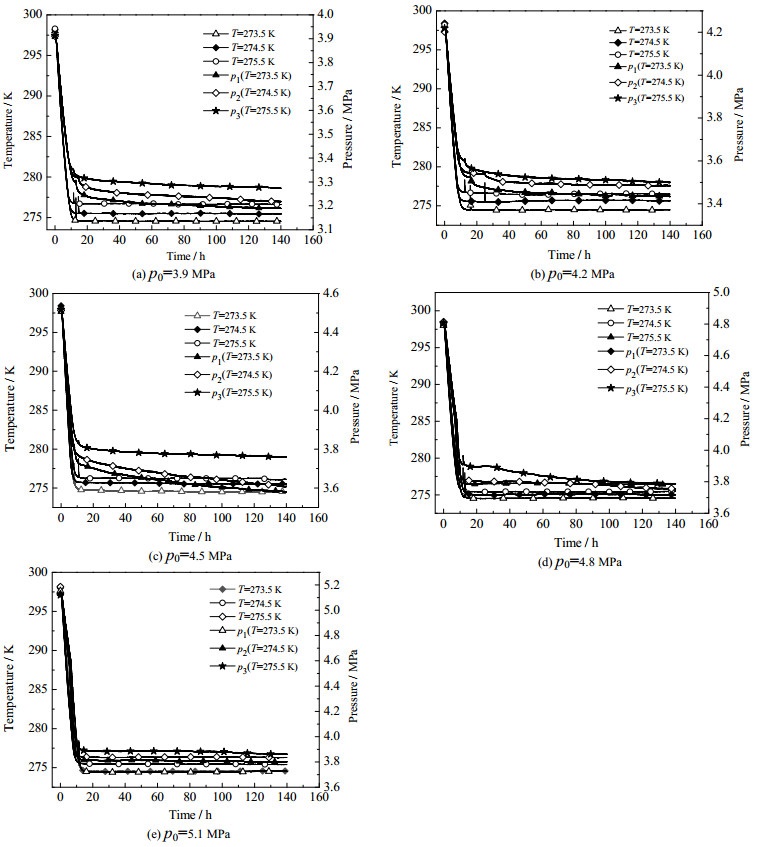
3.2 不同初始压力和温度条件对多孔介质中CO2水合物生成特性的影响图 3为温度为273.5、274.5和275.5 K,初始压力分别为3.9、4.2、4.5、4.8和5.1 MPa时,粒径为700 μm的石英砂介质中CO2水合物生成过程中温度压力的变化曲线。图中p1、p2、p3分别为温度273.5、274.5、275.5 K对应的反应体系中气相的压力。从图 3(a)和(b)可以看出,当温度为273.5、274.5和275.5 K时,初始压力为3.9和4.2 MPa条件下水合物生成过程中CO2气体均不液化,CO2水合物生成过程的温度压力曲线呈现相似的变化趋势。当温度为273.5、274.5和275.5 K时,CO2水合物的生成速率随初始压力的升高呈逐渐增加的趋势。研究结果表明:当温度分别为273.5和275.4 K时,在较低的初始压力下,CO2水合物的生成速率随压力的升高变化较慢,且当温度为273.5 K、初始压力低于4.2 MPa时,CO2水合物的生成速率随初始压力的增加几乎保持不变。
|
图 3 不同条件下多孔介质中二氧化碳水合物生成过程的温压曲线 Fig.3 Temperature and pressure profiles during CO2 hydrate formation under different initial pressures and temperatures |
由图 3(a)和(b)中的相平衡曲线可知,在此温度压力条件下水合物的生成均存在较大驱动力,且温度越低驱动力越大,而在此条件下呈现出明显的反常现象。这主要是由于,在非液化条件下,随着初始压力的增加,水合物的生成驱动力逐渐增大,且随着水合物的进一步生成,在气-水界面快速形成一层水合物膜阻碍了气-液的有效接触,抑制了水合反应的进一步进行[12, 17, 19]。在水合反应过程中,水合物生成放出大量的热量,导致温度升高,使水合反应驱动力下降,且过冷度越大,水合物膜的形成速度越快,水合物生成过程的放热量越多,对水合反应过程的抑制作用越明显。因此,275.5 K时CO2的生成速率并没有出现随着初始压力的升高而明显加快的现象。同时,温度越低,越有利于CO2气体分子在多孔介质颗粒表面吸附[11, 27],为多孔介质中水合物晶核的形成提供了更多可能。与274.5 K相比,温度为273.5 K时吸附能力更强,从而在一定程度上减弱了铠甲效应以及水合反应放热对多孔介质中CO2水合物生成过程的抑制作用[18, 22, 28],从而使多孔介质体系CO2水合物的生成速率随初始压力升高而增加。
图 3(c)为温度为273.5、274.5和275.5 K,初始压力为4.5 MPa时CO2水合物生成过程的温度压力变化曲线。在不同的温度条件下,当初始压力为4.5 MPa时,CO2气体刚刚开始出现液化现象。液化能够强化CO2气体在多孔介质体系中的传质过程[13, 21]。当压力为4.5 MPa时,随着温度的升高,液化量不断减少,当温度达到275.5 K时,实验温压曲线和液化曲线所围面积近乎为0,说明反应体系中CO2气体的液化程度较小,进而使液化对传质过程的强化作用大幅减弱。同时,随着温度的升高,多孔介质颗粒对CO2气体分子的吸附作用不断减弱,进而影响多孔介质体系中CO2水合物的生成过程。因此,当温度为275.5 K时,4.5 MPa压力下水合反应速率并未出现较低温度时的陡升现象。
图 3(d)和(e)为温度为273.5、274.5和275.5 K,初始压力为4.8和5.1 MPa时CO2水合物生成过程的温度压力的变化曲线。由图 3(d)和(e)可以看出,当压力为4.8和5.1 MPa时,反应体系中气态CO2在实验温度条件下均大量液化。CO2的液化可有效克服水的表面张力[21, 29-31],增加与水的接触面积,在水中的迁移和渗流作用使多孔介质内某一特定成核位置的CO2浓度升高,为水合物的生成过程提供了更大的驱动力,对CO2水合物的成核和生成过程具有明显促进作用[32-33],进而加快了多孔介质体系中水合物的成核速率,有效增加了单位时间内CO2水合物的生成量。因此,液化强化传质成为多孔介质体系水合反应过程的主导因素,在不同的温度条件下,当初始压力为4.8和5.1 MPa时,多孔介质体系中CO2水合物的生成速率均大幅度提高。
另外,研究结果进一步表明:在同一温度条件下,多孔介质中CO2水合物的生成速率整体呈现随初始压力升高而不断增加的趋势,且在水合反应过程的不同阶段,多孔介质中CO2水合物的生成速率表现为驱动力大小、铠甲效应、吸附作用以及液化强化传质等因素综合作用的结果,且在不同的温度压力条件下,不同阶段其主导因素不同,进而对多孔介质体系中CO2水合物生成过程及生成特性的影响程度也不同。
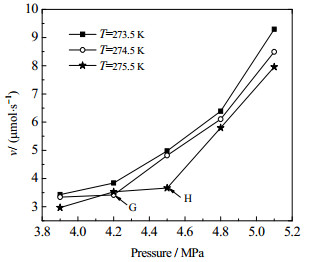
3.3 液化条件对多孔介质中CO2水合物生成速率的定量影响图 4为温度为273.5、274.5和275.5 K时,不同初始压力条件下(3.9、4.2、4.5、4.8和5.1 MPa),粒径为700 μm的石英砂介质中CO2水合物生成过程中生成速率随初始压力的变化曲线。图中G、H分别为274.5和275.5 K时水合物生成速率随压力变化曲线的拐点。在水合反应体系中,CO2气体经历了从非液化到液化的变化过程。通过不同初始压力、温度条件下多孔介质中CO2水合物的生成过程,可计算得到反应过程中不同时刻的CO2气体消耗量,进而可求得水合反应过程中CO2水合物的平均生成速率[12-13, 22, 24]。从图 4中可以看出,在相同的温度条件下,二氧化碳水合物的生成速率受初始压力的影响较大;随着初始压力的升高,多孔介质中CO2水合物的生成速率整体呈不断增加的变化趋势,但局部出现了零星反常点。通过一系列的平行实验对此现象进行了进一步验证,发现水合物生成过程中反常点的出现并非偶然现象。这进一步说明,在多孔介质体系CO2水合物的生成过程中,初始压力不是影响水合反应速率的唯一因素。多孔介质中CO2水合物的生成速率整体呈现出随初始压力升高而不断增加的趋势,在水合物生成过程的不同阶段,驱动力大小、铠甲效应、吸附作用以及液化强化传质等因素对CO2水合物的生成速率的影响不同,在不同阶段其主导因素不同。不同温度和初始压力条件下多孔介质中二氧化碳水合物的生成速率如表 1所示。
|
图 4 不同温度下二氧化碳水合物生成速率随压力的变化曲线 Fig.4 Formation rates of CO2 hydrate as a function of pressure under different temperatures |
|
|
表 1 不同初始压力下二氧化碳水合物的平均生成速率比较 Table 1 Comparison of average formation rates under different initial pressures |
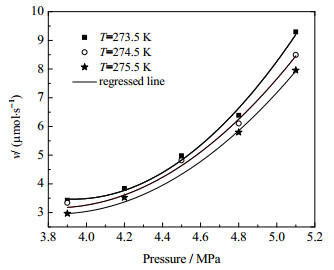
图 5给出了不同温度条件下二氧化碳水合物的生长速率随压力的变化拟合曲线。由图 5可知,在一定的温度条件下,二氧化碳水合物生成速率随压力的变化近似于抛物线,关联式各项系数如表 2所示。在相同的温度下,随着初始压力的增加,多孔介质中CO2水合物的生成速率不断增大;同时,温度越低,生成速率随压力的变化曲线向上弯曲程度越明显,说明压力对水合物生成速率的影响越显著。在相同的压力下,随着温度的降低,多孔介质中二氧化碳水合物的生成速率逐渐增大。
|
图 5 不同温度下二氧化碳水合物生成速率随压力的变化拟合曲线 Fig.5 Fitting curves of formation rate as a function of pressure under different temperatures |
|
|
表 2 不同温度下二氧化碳水合物的生成速率随压力的变化关系参数比较 Table 2 Comparison of formation parameters as a function of pressure under different temperatures |
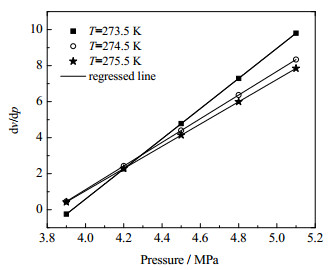
为了进一步揭示不同温度条件下多孔介质中二氧化碳水合物的生成速率随压力的变化关系,对图 5进一步做求导处理,不同温度下CO2水合物生成速率的一阶导数dv/dp随压力的变化关系如图 6所示,不同温度压力条件下CO2水合物生成速率的变化率如表 3所示。从图 6中可以看出,随着温度的降低,二氧化碳水合物生成速率的一阶导数曲线的斜率不断增加,这说明随着温度的降低,二氧化碳水合物生成速率的变化随压力的升高逐渐增大,即较低的温度条件有利于同压力下水合物生成速率的增加,表明压力对多孔介质中CO2水合物生成速率的影响程度趋于增强。
|
图 6 不同温度下二氧化碳水合物生成速率随压力一阶导数的变化关系 Fig.6 Relationship between the first derivative of formation rate as a function of pressure under different temperatures |
|
|
表 3 不同温度下二氧化碳水合物的生成速率随压力一阶导数的变化关系 Table 3 Relationship between the first derivative of formation rate as a function of pressure under different temperatures |
(1) 在相同的温度条件下,随着初始压力的增加,多孔介质中CO2水合物的生成速率逐渐增大;CO2水合物的生成速率整体呈现出随初始压力升高而不断增加的趋势。
(2) 当压力低于液化压力时,随着初始压力的增加,CO2水合物的生成速率逐渐增大,且温度越高,多孔介质中CO2水合物生成速率增加的趋势越明显。
(3) 当CO2气体压力达到液化压力时,随着初始压力的不断升高,CO2水合物的生成速率明显增大;液化可有效促进多孔介质中CO2水合物的生成过程,液化条件下CO2水合物的最大生成速率达到了9.297×10−3 mol·s−1。
| [1] |
LIBES S. Introduction to marine biogeochemistry[M]. [S. l.]: Academic Press, 2011.
|
| [2] |
HASSELMANN K, LATIF M, HOOSS G, et al. The challenge of long-term climate change[J]. Science, 2003, 302(5652): 1923-1925. DOI:10.1126/science.1090858 |
| [3] |
GOUGH C, MANDER S, HASZELDINE S. A roadmap for carbon capture and storage in the UK[J]. International Journal of Greenhouse Gas Control, 2010, 4(1): 1-12. DOI:10.1016/j.ijggc.2009.10.014 |
| [4] |
陈广印, 孙强, 郭绪强, 等. 水合物法连续分离煤层气实验研究[J]. 高校化学工程学报, 2013, 27(4): 561-566. CHEN G Y, SUN Q, GUO X Q, et al. Experiment study on the continuous separation process of coal bed methane via forming hydrate[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(4): 561-566. DOI:10.3969/j.issn.1003-9015.2013.04.003 |
| [5] |
KOMAI T, YAMAMOTO Y, HANEDA H, et al. Fundamental study on gas hydrate recovery from marine sediments: The twelfth International Offshore and Polar Engineering Conference [C]. [S. l. ]: OnePetro, 2002.
|
| [6] |
SUN, JIANG S, LI S, et al. Hydrate formation from clay bound water for CO2 storage[J]. Chemical Engineering Journal, 2021, 406: 126872-126881. DOI:10.1016/j.cej.2020.126872 |
| [7] |
ZANG X, WAN L, LIANG D. Investigation of the hydrate formation process in fine sediments by a binary CO2/N2 gas mixture[J]. Chinese Journal of Chemical Engineering, 2019, 27(9): 2157-2163. DOI:10.1016/j.cjche.2019.02.032 |
| [8] |
KAWASAKI T, OBARA S. CO2 hydrate heat cycle using a carbon fiber supported catalyst for gas hydrate formation processes[J]. Applied Energy, 2020, 269: 115-125. |
| [9] |
ZHOU X, LIANG D. Enhanced performance on CO2 adsorption and release induced by structural transition that occurred in TBAB·26H2O hydrates[J]. Chemical Engineering Journal, 2019, 378: 122-128. |
| [10] |
HOU J, JI Y, ZHOU K, et al. Effect of hydrate on permeability in porous media: pore-scale micro-simulation[J]. International Journal of Heat and Mass Transfer, 2018, 126: 416-424. DOI:10.1016/j.ijheatmasstransfer.2018.05.156 |
| [11] |
KADOURA A, NARAYANAN NAIR A K, SUN S. Molecular dynamics simulations of carbon dioxide, methane, and their mixture in montmorillonite clay hydrates[J]. The Journal of Physical Chemistry C, 2016, 120(23): 12517-12529. DOI:10.1021/acs.jpcc.6b02748 |
| [12] |
ZHANG X, LI J, WU Q, et al. Effect of initial pressure on the formation of carbon dioxide hydrate in frozen quartz sand[J]. Energy & Fuels, 2019, 33(11): 11346-11352. |
| [13] |
李金平, 李洋, 姚泽, 等. 初始压力对冰冻石英砂中CO2水合物生成特性的影响[J]. 过程工程学报, 2019, 19(1): 216-222. LI J P, LI Y, YAO Z, et al. Influence of the initial pressure on formation characteristics of CO2 hydrate in quartz sand below freezing point[J]. The Chinese Journal of Process Engineering, 2019, 19(1): 216-222. |
| [14] |
李淑霞, 陈月明, 王瑞和, 等. 初始压力对多孔介质中气体水合物生成的影响[J]. 实验力学, 2009, 24(4): 313-319. LI S X, CHEN Y M, WANG R H, et al. On the influence of initial pressure on natural gas hydrate formation in a porous medium[J]. Journal of Experimental Methanics, 2009, 24(4): 313-319. |
| [15] |
张金华, 张郁, 魏伟. 石英砂介质中CO2水合物形成影响研究[J]. 天然气化工(C1化学与化工), 2018, 43(2): 34-39. ZHANG J H, ZHANG Y, WEI W. Influence factors of carbon dioxide hydrate formation in quartz sand media[J]. Natural Gas Chemical Industry, 2018, 43(2): 34-39. DOI:10.3969/j.issn.1001-9219.2018.02.007 |
| [16] |
谢振兴, 谢应明, 周兴法, 等. 充注压力对压缩式制冷循环连续制备CO2水合物的影响[J]. 化工学报, 2014, 65(6): 2301-2307. XIE Z X, XIE Y M, ZHOU X F, et al. Effects of charge pressure on continuous production of CO2 hydrate in compression refrigeration cycle[J]. CIESC Journal, 2014, 65(6): 2301-2307. DOI:10.3969/j.issn.0438-1157.2014.06.047 |
| [17] |
ZHOU S, YAN H, SU D, et al. Investigation on the kinetics of carbon dioxide hydrate formation using flow loop testing[J]. Journal of Natural Gas Science and Engineering, 2017, 49: 385-392. |
| [18] |
祁影霞, 张华. 添加水合物促进二氧化碳水合物生成的实验研究[J]. 高校化学工程学报, 2010, 24(5): 842-846. QI Y X, ZHANG H. Experiment study on formation of CO2 hydrate with hydrate additive[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(5): 842-846. DOI:10.3969/j.issn.1003-9015.2010.05.019 |
| [19] |
SUN D, ENGLEZOS P. Storage of CO2 in a partially water saturated porous medium at gas hydrate formation conditions[J]. International Journal of Greenhouse Gas Control, 2014, 25: 1-8. DOI:10.1016/j.ijggc.2014.03.008 |
| [20] |
DING A L, YANG L, FAN S S, et al. Reversible methane storage in porous hydrogel supported clathrates[J]. Chemical Engineering Science, 2013, 96: 124-130. DOI:10.1016/j.ces.2013.03.050 |
| [21] |
张凤琦, 陈国兴, 郭开华, 等. 液态二氧化碳置换整形甲烷水合物过程特性[J]. 过程工程学报, 2018, 18(3): 639-645. ZHANG F Q, CHEN G X, GUO K H, et al. Process characteristics on replacement of bulk-methane hydrates with liquid carbon dioxide[J]. The Chinese Journal of Process Engineering, 2018, 18(3): 639-645. |
| [22] |
LINGA P, HALIGYA C, NAM S C, et al. Gas hydrate formation in a variable volume bed of silica sand particles[J]. Energy & Fuels, 2009, 23(11): 5496-5507. |
| [23] |
OTA M, ABE Y, WATANABE M, et al. Methane recovery from methane hydrate using pressurized CO2[J]. Fluid Phase Equilibria, 2005, 228/229: 553-559. DOI:10.1016/j.fluid.2004.10.002 |
| [24] |
张学民. 冰点以下多孔介质中CO2和CH4水合物的相平衡及置换特性研究[D]. 兰州: 兰州理工大学, 2015. ZHANG X M. Study on phase equilibrium of CO2 and CH4 hydrate and replacement characteristics below the freezing point [D]. Lanzhou: Lanzhou University of Technology, 2015. |
| [25] |
LIU N, XUAN X B, LIU D P, et al. CO2 reduction by clathrate hydrate crystallization[J]. Environmental Engineering and Management Journal, 2011, 10(6): 837-841. DOI:10.30638/eemj.2011.116 |
| [26] |
周诗岽, 陈小康, 边慧, 等. CO2水合物在管道中的生成及堵塞特性[J]. 化工进展, 2018, 37(11): 4250-4256. ZHOU S D, CHEN X K, BIAN H, et al. CO2 hydrate formation in pipeline and its plugging characteristics[J]. Chemical Industry and Engineering Progress, 2018, 37(11): 4250-4256. |
| [27] |
HE Y Y. Formation of methane and carbon dioxide hydrates in bulk and in porous media [D]. Munich: Technische Universiteit Delft, 2012.
|
| [28] |
STERN L A, KIRBY S H, DURHAM W B. Peculiarities of methane clathrate hydrate formation and solid-state deformation, including possible superheating of water ice[J]. Science, 1996, 273(5283): 1843-1848. DOI:10.1126/science.273.5283.1843 |
| [29] |
YUAN Q, SUN C Y, LIU B, et al. Methane recovery from natural gas hydrate in porous sediment using pressurized liquid CO2[J]. Energy Conversion and Management, 2013, 67: 257-264. DOI:10.1016/j.enconman.2012.11.018 |
| [30] |
LI S, WANG X H, SUN C Y, et al. Methane recovery from natural gas hydrate in porous sediment using gaseous CO2, liquid CO2, and CO2 emulsion[J]. Gas Injection for Disposal and Enhanced Recovery, 2014, 357-370. |
| [31] |
SUN X, WANG Z, SUN B, et al. Research on hydrate formation rules in the formations for liquid CO2 fracturing[J]. Journal of Natural Gas Science and Engineering, 2016, 33: 1390-1401. DOI:10.1016/j.jngse.2016.06.045 |
| [32] |
KVAMME B, AROMADA S A, SAEIDI N. Heterogeneous and homogeneous hydrate nucleation in CO2/water systems[J]. Journal of Crystal Growth, 2019, 522: 160-174. |
| [33] |
CUI J, SUN Z, WANG X, et al. Fundamental mechanisms and phenomena of clathrate hydrate nucleation[J]. Chinese Journal of Chemical Engineering, 2019, 27(9): 2014-2025. |




