水体富营养化已成为最严峻的水环境问题之一,磷是引起水体富营养化的主要元素之一[1]。高浓度的磷会导致水中藻类的大量繁殖和溶解氧的消耗[2]。因此,脱除废水中的磷是解决水体富营养化的关键,日益引起人们的广泛关注。
废水中的磷主要以磷酸盐形式存在,常用的脱磷方法有:化学沉淀法[3]、结晶法[4]、生物法[5]。化学沉淀法是应用最早、使用最广泛的除磷技术。但是,化学沉淀法需要消耗大量的絮凝剂或混凝剂[6],成本昂贵,且产生的化学污泥含水量大,脱水困难,容易产生二次污染。结晶法所采取的药剂成本较高,且只能用于回收高浓度的磷。生物法对磷的去除率可高达80%~90%,且运行费用较低,但脱磷效率受水的质量影响很大,工艺运行不稳定,难以控制。吸附法由于其工艺简单、运行可靠、成本较低、适应性广[7]等优点受到广泛关注。
常用的除磷吸附剂有活性氧化铝[8]、铁(氢)氧化物[9]、沸石[10, 11]、黏土[12]、明矾污泥[13]、藻类[14]等。水滑石(layered double hydroxides,LDHs)又叫双金属氢氧化物,它是一种典型的层状新型功能材料,属六方晶系[15]。其特殊的阴离子型层状结构使其具有碱性、层板上阳离子可调配性、层间阴离子可交换性等特性[16],因而具有较好的吸附能力,广泛用于载体、催化、吸附、阻燃等领域。但是,水滑石的研究报道主要集中于催化剂[17~19]以及重金属吸附[20],将其用于吸附脱除磷的研究报道较少。
本论文合成了一系列镁铝水滑石,将其用于脱除废水中的磷,对其吸附性能和结构进行了研究,对我国废水脱磷具有重要的指导意义和参考价值。
2 实验部分 2.1 仪器和设备721-紫外分光光度计(上海奥普勒仪器有限公司);HSY-C水浴恒温震荡器(金坛市鸿科仪器厂);电子天平(梅特勒-托利多仪器有限公司,精度为0.0001 g);HH-2数显恒温水浴锅(金坛市杰瑞尔电有限公司);YZ1515x蠕动泵(常州科健蠕动泵厂);101型电热鼓风干燥箱(北京市永光明医疗仪器有限公司);KSL-1200高温箱式炉(上海拜力生物科技有限公司)。
2.2 原料和试剂六水合硝酸镁;九水合硝酸铝;氢氧化钠;碳酸钠;磷酸二氢钾;硫酸;抗坏血酸;酒石酸锑钾;钼酸铵;以上试剂均为分析纯。去离子超纯水为实验室自制,电导率为0.055 μs·cm-1。
2.3 镁铝水滑石的制备将一定量的六水合硝酸镁(Mg(NO3)2·6H2O)和九水合硝酸铝(Al(NO3)3·9H2O)溶于去离子水中,将一定量的氢氧化钠(NaOH)、碳酸钠(Na2CO3)溶于去离子水中,将两种混合溶液通过蠕动泵逐滴滴加到四口烧瓶中,并在设定温度下保温搅拌,反应一段时间后静置冷却至室温,真空过滤,用去离子水将滤饼洗涤至中性。所得滤饼置于烘箱中,于100℃下干燥5 h,研磨即得水滑石产品,记为Mg-Al-LDH。干燥所得部分产品置于马弗炉中,在200~600℃下处理3 h,所得产品记为Mg-Al-LDO。
2.4 水中磷的吸附实验分别称取0.05、0.1、0.2、0.3和0.4 g吸附剂置于100 mL锥形瓶中,加入50 mL初始浓度为30 mg·L-1(吸附动力学实验时初始浓度为50 mg·L-1)的磷酸盐水溶液,在水浴振荡器中于25℃恒温振荡0.5 h,取上清液经0.45 μm滤膜过滤,测定滤液中磷酸盐的浓度。磷的吸附率(R)按照如下公式计算:
| $ R(\% ) = \frac{{{C_0} - {C_{\rm{t}}}}}{{{C_0}}} \times 100\% $ |
式中:C0是吸附前溶液中初始磷酸盐浓度,mg·L-1;Ct是吸附后溶液中剩余磷酸盐浓度,mg·L-1。
2.5 表征方法采用DX-1000型X射线衍射仪,Cu靶(λ = 0.1541 nm),管压40 kV,管流30 mA,2θ 15°~70°。Bruker-IFS66V/S型傅里叶变换红外光谱仪测试(KBr压片法),ASAP2021型比表面测定仪测试样品的比表面积和孔隙大小分布。
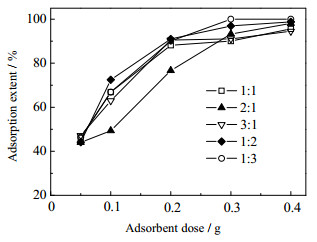
3 结果与讨论 3.1 镁铝比对水滑石磷吸附性能的影响通过改变镁铝摩尔比制备一系列镁铝水滑石吸附剂,其吸附磷的性能结果如图 1所示。
|
图 1 不同镁铝比对吸附磷性能的影响 Fig.1 Effects of Mg-Al ratio on phosphate adsorption |
由图 1中可知,随着吸附剂用量的增大,磷酸盐的吸附率显著增加,当吸附剂用量达到0.3 g后,磷酸盐的吸附率增长变缓。这是因为随着水滑石用量的增加,水滑石中可交换的阴离子更多,可与更多磷酸根离子发生离子交换。
从图中还可以看出,Mg/Al摩尔比为3:1时制备的水滑石的吸附率最好,当吸附剂用量大于0.2 g时,吸附率超过85%,当吸附剂用量达到0.3 g,吸附率可达到100%。因此,本文选择Mg/Al摩尔比为3:1。
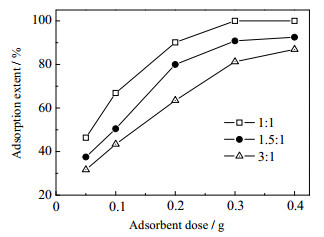
3.2 沉淀剂用量对水滑石磷吸附性能的影响在水滑石制备过程中,沉淀剂用量可能会对水滑石吸附磷性能产生较大影响。文中以水滑石分子式中镁铝阳离子所需的阴离子([16OH-+CO32-]/[6Mg2++2Al3+]摩尔比)为基准,在不同沉淀剂用量下制备出一系列镁铝水滑石,对水中磷酸盐的吸附结果见图 2。
|
图 2 不同沉淀剂对吸附磷性能的影响 Fig.2 Effects of precipitant dosage on phosphate adsorption |
从图 2可知:当吸附剂用量相同时,吸附率随沉淀剂用量的增加而减小。这可能是由于沉淀剂用量越大,体系过饱和度越大,水滑石结晶速度过快,晶体形成不完善,从而影响其吸附性能。因此,沉淀剂的用量选择1:1。
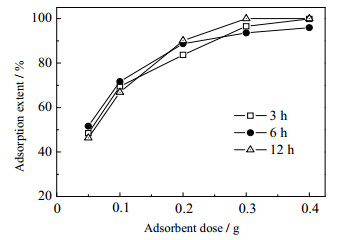
3.3 反应时间对镁铝水滑石磷吸附性能的影响通过改变反应时间所制备的镁铝水滑石对水中磷的吸附结果如图 3所示。
|
图 3 不同反应时间对吸附磷性能的影响 Fig.3 Effects of aging time on phosphate adsorption |
从图 3可知,反应时间对镁铝水滑石的吸附性能影响不大,当吸附剂的投加量为0.3 g时,吸附率均能达到90%以上。虽然反应时间为12 h下吸附率达到100%,考虑到制备时间以及耗能情况,本文选择反应时间为3 h。
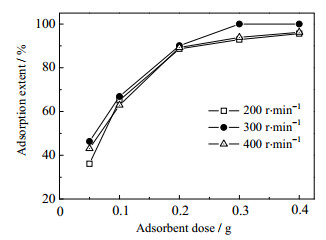
3.4 搅拌速度对镁铝水滑石磷吸附性能的影响图 4是不同搅拌速度下制得的水滑石对磷的吸附结果。从图 4可知:在实验选定的三个搅拌速度下,镁铝水滑石的磷吸附性能相差不大。但是,还是可以看出,当搅拌速度为300 r·min-1时吸附剂吸附效果最佳。这可能是由于搅拌速度较低时,镁铝离子在体系中不容易混合均匀,当搅拌速度过快时,强的剪切力又容易破坏水滑石的形成。因此,本实验的搅拌速度为300 r·min-1。
|
图 4 不同搅拌速度对吸附磷性能的影响 Fig.4 Effects of stirring speed on phosphate adsorption |
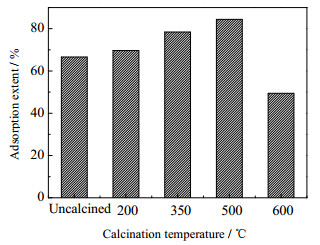
为了考察焙烧温度对水滑石吸附性能的影响,研究对吸附剂用量为0.1 g时,不同温度焙烧后水滑石的吸附性能进行了测试,其结果如图 5所示。
|
图 5 不同焙烧温度对吸附磷性能的影响 Fig.5 Effects of calcination temperature on phosphate adsorption |
由图 5可见,经过焙烧后,水滑石的吸附率明显增加,在500℃下焙烧的水滑石吸附率最高,与焙烧前的吸附率相比提高了18%,这可能是由于处理温度低于200℃时,水滑石分解不完全,层间的CO32-阻碍了磷酸根的进入,使得磷吸附能力较弱;经350和500℃焙烧后,水滑石的层板结构受到破坏,形成不定形体。在吸附磷酸盐的过程中,水滑石实现了其结构重组,即“记忆效应”[21],为了恢复原有的层板结构,大量磷酸根离子进入层板间,提高了对磷酸盐的吸附量[22]。当焙烧温度高于500℃,水滑石部分被烧结,逐步向镁铝尖晶石相转变,破坏了水滑石的结构信息,使其记忆效应减退,难以实现结构重组,导致吸附效果变差[23]。
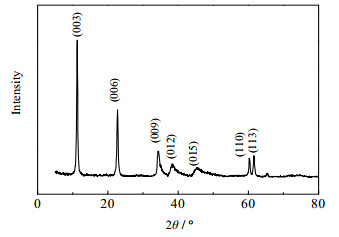
3.6 X射线衍射(XRD)从图 6可以看出,制得的水滑石分别在2θ为11.3、22.7、34.5、38.3、45.3、60.3和61.6°处出现特征衍射峰,其中11.3、22.7和34.5°分别对应镁铝水滑石的(003)、(006)、(009)晶面[24],这三个特征峰度强具有良好的倍数关系,表明制得的水滑石具有良好的层状结构。另外,从图中还可以看出,制得水滑石的衍射峰强而尖锐,没有出现其它杂相衍射峰,对称性较高。
|
图 6 水滑石样品的XRD谱图 Fig.6 XRD pattern of Mg-Al-LDH |
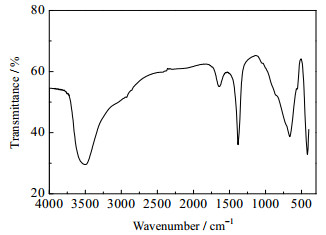
图 7是制得镁铝水滑石的FT-IR结果。从图中可以看出,镁铝水滑石在3450、1640、1370、787 cm-1等处出现了特征吸收峰,其中3450 cm-1归为缔和状态的O-H的伸缩振动,1640 cm-1为O-H的弯曲振动,表明层间结晶水的存在[25]。1370 cm-1附近的吸收峰为CO32-中CO的不对称伸缩振动峰,与参比化合物CaCO3的CO32-的吸收峰(1430 cm-1)相比,向低波数方向发生了较大的位移,表明层间进入的CO32-并不是真正自由的,与层间水分子存在强氢键作用。787和681 cm-1分别是CO32-的面外变形C-O伸缩振动峰和面内C-O弯曲振动特征峰。在453 cm-1处出现的吸收峰归因于阳离子(Mg2+、Al3+)的晶格振动[24]。
|
图 7 水滑石样品的FT-IR谱图 Fig.7 FT-IR spectra of Mg-Al-LDH |
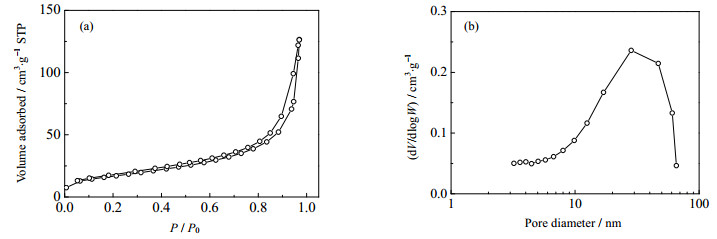
图 8是镁铝水滑石的N2-吸附脱附等温线和孔隙大小分布曲线。可以看出所得水滑石的等温线(a)属于Ⅳ型等温线,当它在相对高的压力下,表现出较高的吸附性,即为中孔的特征表现。在相对压力为0.4~0.8下,吸附剂的滞留回环符合H2情况,表明“墨水瓶孔道”比较狭窄。在相对压力为0.8~1.0下,吸附剂的滞留回环符合H3情况,这多出现在具有狭长裂口型孔状结构的片状材料中,通过纳米孔的表面上的微球的聚集形成[26]。从吸附剂样品的孔径分布曲线(b)中可以观察到,水滑石的孔径从3到100 nm,孔径分布较宽,属于中大孔材料。
|
图 8 水滑石样品氮的吸附脱附等温线和孔隙大小分布曲线 Fig.8 Nitrogen adsorption and desorption isotherms (a) and pore size distribution (b) of Mg-Al-LDH |
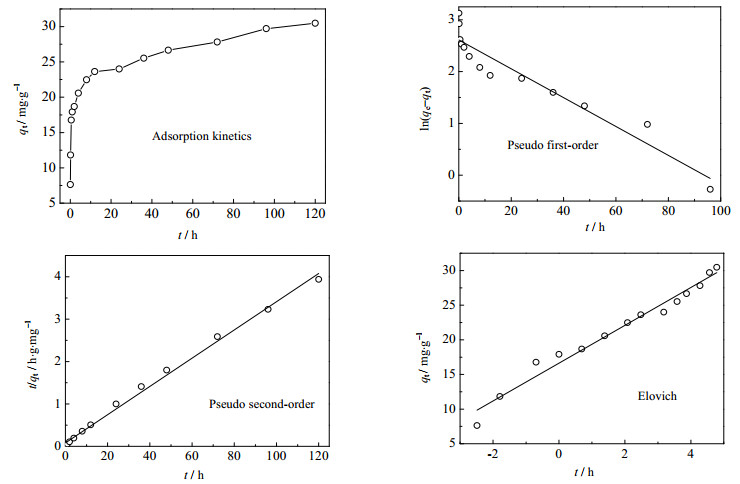
在水温为25℃恒温水浴振荡下、将0.1 g水滑石置于500 mL锥形瓶中,加入400 mL初始浓度为50 mg·L-1的磷酸盐水溶液条件下进行了吸附动力学研究,得到的动力学曲线以及应用不同动力学方程[27]对该吸附动力学曲线进行数据拟合如图 9所示,结果列于表 1。
|
图 9 吸附动力学方程拟合 Fig.9 Fitting results of adsorption kinetics with different equations |
|
|
表 1 不同吸附动力学方程拟合结果 Table 1 Fitting results of phosphate adsorption with different kinetic models |
从图 9和表 1中可以看出,该吸附剂吸附磷酸盐的动力学方程表现为假二级动力学方程 > 叶洛维奇方程 > 假一级动力学方程。因此,镁铝水滑石对磷的吸附过程动力学符合假二级动力学过程,这表明整个吸附过程可能由化学吸附或吸附剂的活性位点与磷酸之间的化学键引起的[28]。
4 结论(1) 采用共沉淀法成功制备了具有层状结构的镁铝水滑石,其最佳制备条件为:Mg/Al摩尔比为3:1、沉淀剂用量[16OH-+CO32-]/[6Mg2++2Al3+]摩尔比为1:1、反应时间为3 h、搅拌速度为300 r·min-1。当吸附剂用量为0.3 g,水中磷的吸附率可达到100%;
(2) 经过高温焙烧后,水滑石的吸附能力大幅提高,当水滑石用量为0.1 g时,经过500℃焙烧3 h后,吸附率与未焙烧水滑石相比提高了18%;
(3) XRD、FT-IR结果表明所制得的水滑石具有良好的层状结构,BET结果表明,所制备的镁铝水滑石的孔径为3~100 nm,属于中大孔镁铝水滑石。
(4) 水滑石的吸附磷动力学研究结果表明,其吸附动力学符合假二级动力学方程。
| [1] | Zhao D, Chen J P. Application of zirconium/PVA modified flat-sheet PVDF membrane for the removal of phosphate from aqueous solution[J]. Industrial & Engineering Chemistry Research , 2016, 55(24): 6835-6844. |
| [2] | Alshameri A, Yan C, Lei X. Enhancement of phosphate removal from water by TiO2/Yemeni natural zeolite:preparation, characterization and thermodynamic[J]. Microporous & Mesoporous Materials , 2014, 196(24): 145-157. |
| [3] | Zhou Z, Hu D L, Qiao W M, et al. Optimization for phosphorous removal in thickening and dewatering sludge water by polyaluminum chloride[J]. Environmental Science , 2014, 35(6): 2249-2255. |
| [4] | Li W, Zeng L, Kang Y, et al. A solid waste, crashed autoclaved aerated concrete, as a crystalline nucleus for the removal of low concentration of phosphate[J]. Desalination & Water Treatment , 2016, 57(30): 14169-14177. |
| [5] | Law Y, Kirkegaard R H, Cokro A A, et al. Integrative microbial community analysis reveals full-scale enhanced biological phosphorus removal under tropical conditions[J]. Scientific Reports , 2016, 6: 25719. DOI:10.1038/srep25719. |
| [6] | Zhang L, Zhou Q, Liu J, et al. Phosphate adsorption on lanthanum hydroxide-doped activated carbon fiber[J]. Chemical Engineering Journal , 2012, 185-186(6): 160-167. |
| [7] | Lalley J, Han C, Li X, et al. Phosphate adsorption using modified iron oxide-based sorbents in lake water:kinetics, equilibrium, and column tests[J]. Chemical Engineering Journal , 2016, 284: 1386-1396. DOI:10.1016/j.cej.2015.08.114. |
| [8] | Sousa A F D, Braga T P, Gomes E C C, et al. Adsorption of phosphate using mesoporous spheres containing iron and aluminum oxide[J]. Chemical Engineering Journal , 2012, 210: 143-149. DOI:10.1016/j.cej.2012.08.080. |
| [9] | Ren J, Li N, Zhao L, et al. Enhanced adsorption of phosphate by loading nanosized ferric oxyhydroxide on anion resin[J]. Frontiers of Environmental Science & Engineering , 2014, 8(4): 531-538. |
| [10] | Zamparas M, Drosos M, Georgiou Y, et al. A novel bentonite-humic acid composite material Bephos™ for removal of phosphate and ammonium from eutrophic waters[J]. Chemical Engineering Journal , 2013, 225: 43-51. DOI:10.1016/j.cej.2013.03.064. |
| [11] | Gibbs M, Özkundakci D. Effects of a modified zeolite on P and N processes and fluxes across the lake sediment-water interface using core incubations[J]. Hydrobiologia , 2011, 661(1): 21-35. DOI:10.1007/s10750-009-0071-8. |
| [12] | Yaghi N, Hartikainen H. Enhancement of phosphorus sorption onto light expanded clay aggregates by means of aluminum and iron oxide coatings[J]. Chemosphere , 2013, 93(9): 1879-1886. DOI:10.1016/j.chemosphere.2013.06.059. |
| [13] | Kuwahara Y. A novel conversion process for waste slag:synthesis of a hydrotalcite-like compound and zeolite from blast furnace slag and evaluation of adsorption capacities[J]. Journal of Materials Chemistry , 2010, 20(24): 5052-5062. DOI:10.1039/c0jm00518e. |
| [14] | Lu H, Yang L, Shabbir S, et al. The adsorption process during inorganic phosphorus removal by cultured periphyton[J]. Environmental Science & Pollution Research , 2014, 21(14): 8782-8791. |
| [15] | XU Sheng(徐圣), LIAO Meng-chen(廖梦尘), ZENG Hong-yan(曾虹燕), et al. Dissolution kinetics and thermodynamics of Mg-Al hydrotalcites(Mg-Al水滑石的溶解动力学及热力学)[J]. CIESC Journal (China)(化工学报) , 2014, 65(8): 2863-2868. |
| [16] | LIU Feng-xian(刘凤仙), XIA Sheng-jie(夏盛杰), XUE Ji-long(薛继龙), et al. Adsorption of Acid Yellow 17 with calcined Zn/Al layered double hydroxides(酸性黄17在焙烧态Zn/Al水滑石上的吸附研究)[J]. Journal of Chemical Engineering of Chinese Uniersities(高校化学工程学报) , 2015, 29(2): 487-494. |
| [17] | YUAN Bing(袁冰), ZHANG Xin(张新), HOU Wan-guo(侯万国). Synthesis and photocatalytic properties of Ni/Ti hydrotalcite-like compounds(Ni/Ti类水滑石的合成与光催化应用)[J]. Journal of Chemical Engineering of Chinese Uniersities(高校化学工程学报) , 2013, 27(2): 334-338. |
| [18] | ZENG Hong-yan(曾虹燕), FENG Zhen(冯震), LIAO Kai-bo(廖凯波), et al. Preparation and catalytic properties of Mg-AI hydrotalcites for synthesis of propylene glycol monomehtylehter(Mg-Al水滑石的制备及其催化合成丙二醇单甲醚的性能)[J]. Petrochemical Technology(石油化工) , 2008, 37(8): 788-792. |
| [19] | Kshirsagar S W, Patil N R, Samant S D. Preparation of Mg-Al hydrotalcite from the effluent of Friedel-Crafts reaction and its application as a catalyst in Knoevenagel reaction[J]. Green Chemistry Letters & Reviews , 2010, 3(4): 335-339. |
| [20] | LIAO Mei-fang(廖梅芳), ZHU Wen-jie(朱文杰), HAN Cai-yun(韩彩芸), et al. On the preparation of MgAl-LDH and its adsorption properties for chromium (Ⅵ)(镁铝水滑石的制备及其吸附Cr(Ⅵ)的性能)[J]. Journal of Safety and Environment(安全与环境学报) , 2016, 16(6): 200-207. |
| [21] | Ferreira O P, Alves O L, Gouveia D X, et al. Thermal decomposition and structural reconstruction effect on Mg-Fe-based hydrotalcite compounds[J]. Journal of Solid State Chemistry , 2004, 177(9): 3058-3069. DOI:10.1016/j.jssc.2004.04.030. |
| [22] | Lei C, Zhu X, Zhu B, et al. Superb adsorption capacity of hierarchical calcined Ni/Mg/Al layered double hydroxides for Congo Red and Cr(Ⅵ) ions[J]. Journal of Hazardous Materials , 2017, 321: 801-811. DOI:10.1016/j.jhazmat.2016.09.070. |
| [23] | CHENG Xiang(程翔), HUANG Xin-rui(黄新瑞), WANG Xing-zu(王兴祖), et al. Phosphate adsorption by ZnAlLa layered double hydroxides from excess sludge filtrate(ZnAlLa类水滑石对污泥脱水液中磷酸根的吸附)[J]. CIESC Journal(化工学报) , 2010, 61(4): 955-962. |
| [24] | Zhou J, Yang S, Yu J, et al. Novel hollow microspheres of hierarchical zinc-aluminum layered double hydroxides and their enhanced adsorption capacity for phosphate in water[J]. Journal of Hazardous Materials , 2011, 192(3): 1114-1121. DOI:10.1016/j.jhazmat.2011.06.013. |
| [25] | Rodrigues L A. An investigation of phosphate adsorption from aqueous solution onto hydrous niobium oxide prepared by co-precipitation method[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects , 2009, 334(1-3): 191-196. |
| [26] | HE Yu-sheng(何余生), LI Zhong(李忠), XI Hong-xia(奚红霞), et al. Research progress of gas-solid adsorption isotherms(气固吸附等温线的研究进展)[J]. Ion Exchange and Adsorption(离子交换与吸附) , 2004, 20(4): 376-384. |
| [27] | Cheng X, Huang X, Wang X, et al. Phosphate adsorption from sewage sludge filtrate using zinc-aluminum layered double hydroxides[J]. Journal of Hazardous Materials , 2009, 169(1-3): 958-964. DOI:10.1016/j.jhazmat.2009.04.052. |
| [28] | Yang K, Yan L G, Yang Y M, et al. Adsorptive removal of phosphate by Mg-Al and Zn-Al layered double hydroxides:kinetics, isotherms and mechanisms[J]. Separation & Purification Technology , 2014, 124: 36-42. |




