2. 浙江大学衢州研究院, 浙江 衢州 324000;
3. 浙江传化化学集团, 浙江 杭州 311215;
4. 化学工程联合国家重点实验室(浙江大学), 浙江 杭州 310058
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China;
3. Zhejiang Chuanhua Chemical Group Co. Ltd, Hangzhou 311215, China;
4. State Key Laboratory of Chemical Engineering, Zhejiang University, Hangzhou 310058, China
在聚合物合成过程中,反应体系中的单体、中间产物和聚合物浓度及分布随时间而发生改变,原位监测各组分在反应过程中的浓度分布随时间变化规律,对探明聚合机理、实现材料定制和优化反应过程非常重要。同时,在聚合物制品中,通常会复合乳化剂、增塑剂、交联剂等添加剂。添加剂的使用有助于聚合物加工或性能提高,但由于添加剂与聚合物之间通常在分子大小、极性上存在一定差异,造成其在聚合物中分布不均匀和迁移等问题,影响产品性能及长期使用能力,因此,有必要了解聚合物中添加剂的分布和迁移规律。常规的表征方法(如色谱[1-2]、质谱[3]、色谱-质谱联用[4]、核磁共振波谱(NMR)[5]等)可间接或直接测得多组分聚合物中特定添加剂的含量,但通常需要通过破坏性采样才能进行分析,并获取平均值,很难对聚合物不同微区中的添加剂含量进行原位监测。X射线光电子能谱法(XPS)[6-8]通过具有一定能量的单色射线照射样品,可激发样品表面的电子而获得样品表面元素的价态、质量比和质量分布[9],具有一定的微区成像功能,但定量分析误差较大[10],仅能检测样品表面至几十纳米深度的区域,无法直接获得组分化学结构信息。光谱技术中,应用广泛的红外光谱(傅里叶变换远红外光谱FTIR、近红外光谱NIR)[11-14]和拉曼光谱均可实现无损表征,除了能进行定性分析外,还可用于半定量分析,并有较好的精度[15-16]。然而,常规红外和拉曼光谱技术的分辨率低,因此需要与显微技术相结合[17-18]成为显微红外光谱技术和显微拉曼光谱技术,将光束高度聚集并提高能量,方可实现微区测量。显微拉曼光谱技术与显微红外光谱技术相比,空间分辨率较高(尺寸为0.5~1 μm)、不受水汽干扰、具有高度化学结构辨识能力等[19],因此更适用于聚合物材料中添加剂浓度、分布及迁移的表征。
本文将评述基于与显微技术耦合的拉曼光谱技术即显微拉曼光谱技术的聚合物材料中添加剂浓度、分布以及聚合过程中各组分变化的研究进展,具体包括:
(1) 聚合物加工过程(共混、成膜等)中、反应过程(聚合及老化)中各组分浓度分布变化规律;
(2) 聚合物产品中添加剂(乳化剂、染料、功能填料及增塑剂等)的浓度、分布与迁移规律。
2 拉曼光谱技术 2.1 原理及特点20世纪20年代初,印度科学家Raman用单色光照射约60种不同液体,发现照射过程产生了特殊的散射光,其波长与入射光不同[20],这是光子与分子相互作用产生电子激发虚态后返回不同振动激发态所致。在此过程中,光子运动方向和能量会发生改变,散射光与入射光波长一样的散射被称为瑞利散射(Rayleigh scattering),波长变长的为斯托克斯散射(Stokes scattering),波长变短的则为反斯托克斯散射(Anti-Stokes scattering),这种散射光的波长变化在拉曼谱图中的反映称为拉曼位移[21]。由于斯托克斯散射强度比反斯托克斯散射强度更高,因此斯托克斯散射常被用在拉曼光谱技术中。
在拉曼光谱检测时,不同化学结构的化合物分子的散射光波长发生改变的规律不同,在谱图上呈现出不同程度的拉曼位移,被称为化合物分子指纹光谱。这种“指纹”能对化学成分进行辨识,因此,拉曼光谱可用于聚合物化学成分、聚集态结构(包括结晶度、取向度、共混聚合物相结构)的定性及定量分析,也可对固化、降解、聚合物反应等过程进行原位监测。由于拉曼散射光强度非常低,仅为瑞利散射的10−7倍,在20世纪早期缺乏大功率激光的情况下无法得到应用[22]。直到20世纪60年代末激光光源的应用,将入射光的单色性和强度大幅提高,同时也增强了拉曼散射光强度,使拉曼光谱技术得以快速发展。20世纪80年代,衍生出兼具空间分辨率高、对化学结构敏感的显微拉曼光谱成像技术,并开展了聚合物化学结构表征研究[23-24]。表 1汇总了20世纪50年代以来陆续出现的一系列先进的拉曼光谱技术,包括共振拉曼光谱(RRS)技术[25]、超拉曼散射(HRS)技术[26]、相干拉曼散射显微镜(CRSM)技术[27]、表面增强拉曼光谱(SERS)技术[28]、拉曼光谱成像(RSI)技术[29]、激光显微共聚焦拉曼光谱(LMCRS)技术[30]、倒置显微拉曼光谱(IMRS)技术[31]以及LMCRS-扫描电镜(RISE)技术[32]等。
|
|
表 1 先进的拉曼光谱技术 Table 1 Advanced Raman spectroscopy techniques |
RRS技术是一种增强拉曼信号技术,通过控制激光波长接近电子吸收带(实现共振),使拉曼散射强度呈几个数量级的增强,激光和电子跃迁之间的频率差越小,RRS强度就越强,从而提高灵敏性与选择性[33]。HRS技术利用非线性光学过程(双光子过程)[34],产生与常规单光子过程的拉曼散射不同的信号,从而可获得样品的特定信息(超拉曼散射对于对称结构信息更为敏感)。CRSM技术同时使用了两种激光器——泵浦激光器和斯托克斯激光器,利用这两种激光器之间的相互作用而产生非线性光学过程,从而使检测灵敏度较传统拉曼光谱提高了约1 000倍,且具有快速成像能力,200像素×200像素仅需1 s成像[35]。CRSM技术分为相干反斯托克斯拉曼(CARS)技术和受激拉曼散射(SRS)技术,其中,CARS技术因仅增强了某一个基团的信号,因而很难用于定量分析;而SRS则在谱图上与自发拉曼一致,可等比例增强谱图中的特征峰,因此有益于定量分析中的应用。SERS技术是一种增强拉曼信号技术,通过将检测分子吸附到金属纳米颗粒上[36],形成局域表面等离子体共振,从而提高拉曼光谱的灵敏性和选择性,且不受拉曼光谱仪不同型号的影响[37-38]。总的来说,RRS、CRSM与SERS技术均属于增强拉曼信号的技术,可进行普通拉曼光谱无法实现的微量或痕量物质检测,允许对检测物进行快速、无创的原位检测[33, 35-36],适合聚合物合成、降解等的原位表征[39-42]。然而,RRS在共振条件下会出现宽荧光带,荧光背景增强,使谱带发生畸变,降低信噪比[43];相较而言,CRSM和SERS的荧光干扰小得多。HRS可获得化学结构的补充信息,但其信号较弱,需与SERS等信号增强技术联用[44]。
RSI技术通过精密控制光学平台按一定步长移动,对样品进行全面快速扫描,再使用分析软件将各点所采集的光谱数据进行处理,得到高精度绘制的拉曼图像[45],该图像不仅能反映样品中的物质分布,还能给出样品各位点的特征谱图,用于研究聚合物中的填料分布[46]及结晶聚合物中的晶相分布[47]。LMCRS技术是一种将传统拉曼光谱与显微分析相结合形成的技术,可实现对检测样品不同区域在微米尺度范围的原位分析[48],可对聚合物中不同区域(空间分辨率约为1 μm)乳化剂浓度定量检测[16, 49-50]。IMRS技术是在共聚焦拉曼光谱技术基础上,耦合了倒置显微镜,适用于原位表征涂层干燥或自修复等反应过程[51-52]。RISE技术是在共聚焦拉曼光谱技术基础上,耦合透射电子显微镜,从而进一步提高空间分辨率和成像能力[53]。
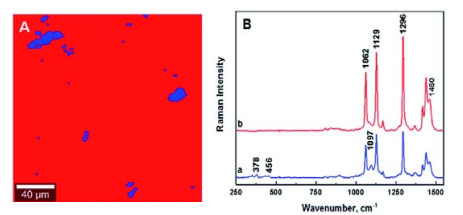
2.2 组成分布分析RSI技术多用于样品表面形貌分析。如Lewandowska等[46]利用该技术对高密度聚乙烯(HDPE)/酸酐改性聚乙烯(MAPE)混合物中纤维素纳米晶(CNC)的分布进行大面积绘制成像(见图 1),图中蓝色和红色区域分别为CNC与HDPE的拉曼响应,可直观地显示HDPE混合物中的CNC分布。
2.3 定量分析拉曼光谱技术可用于添加剂含量的定量或半定量研究[16],这是因为拉曼位移与分子振动模式有关,其峰响应强度与添加剂的浓度呈正比[54],即所采集的添加剂分子拉曼散射过程从能级i变成能级j的拉曼散射强度Sij,与添加剂的浓度cij和特征系数kij呈正比[55]:
| $ {S_{ij}} \sim {c_{ij}}\left\{ {{n_L}{{\left( {\frac{1}{{{\lambda _\text{L}}}} - \Delta {\upsilon _{{\rm{R}}, ij}}} \right)}^4}{L_{ij}}\frac{{\partial {\sigma _{ij}}}}{{\partial \varOmega }}{\rm{d}}\varOmega {{\left[ {1 - \exp \left( {\frac{{h{c_0}\Delta {\upsilon _{{\rm{R}}, ij}}}}{{{k_{\rm{B}}}T}}} \right)} \right]}^{ - 1}}{b_{ij}}} \right\} = {c_{ij}}{k_{ij}} $ | (1) |
式(1)中的kij与nL、λL、ΔυR, ij、Lij(受折射率影响)、σij、Ω、h、c0、kB及T有关;bij为仪器常数,取决于光学元件的效率、探测器的量子效率和光谱仪的效率。
将式(1)应用于样品中组分p和m可知,这2个组分的拉曼散射强度与其浓度呈正比,即[55]
| $ \frac{S_{\mathrm{p}}}{S_{\mathrm{m}}}=K_{\mathrm{p} / \mathrm{m}} \times \frac{c_{\mathrm{p}}}{c_{\mathrm{m}}} $ | (2) |
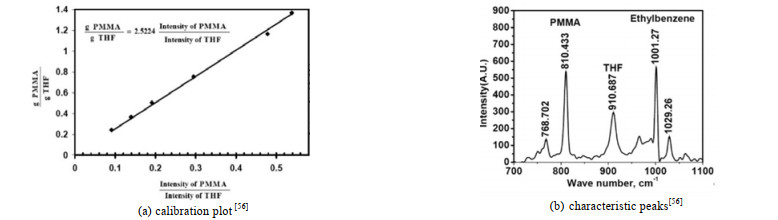
首先确定所测组分p和m的拉曼光谱特征峰,建立特征峰散射强度与所测组分浓度之间的关系曲线,再通过检测未知浓度的样品中组分p和m的特征峰散射强度,即可获得未知浓度的样品中的组分浓度。图 2为聚甲基丙烯酸甲酯(PMMA)/四氢呋喃(THF)混合体系的特征峰散射强度与浓度之间的关系曲线,以及PMMA和THF的特征峰[56],该体系中PMMA和THF可分别视为组分p和m。
|
图 2 聚甲基丙烯酸甲酯/四氢呋喃混合物的特征峰强度与浓度之间的关系曲线及特征峰[56] Fig.2 Calibration plot and characteristic peaks of poly(methyl methacrylate)-tetrahydrofuran mixtures[56] |
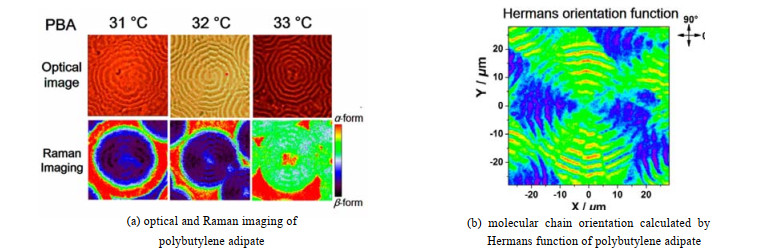
对于结晶型聚合物,传统XRD、红外光谱等技术无法获得聚合物中如α、β等晶型的晶区与非晶区的分布。Wang等[47]利用高分辨的RSI技术,对聚己二酸丁二醇酯(PBA)中的球晶分布进行快速绘图成像,并结合Hermans取向函数,计算了PBA球晶中的分子链取向(见图 3),得到PBA中准确晶体结构。
|
图 3 聚己二甲酸丁二醇酯晶区成像与分子链取向图[47] Fig.3 Images of crystalline region and molecular chain orientation of polybutylene adipate [47] |
复合材料中组成分布制约着材料性能。聚己内酯(PCL)、聚环氧乙烷(PEO)和透明质酸(HA)通过共混、纺丝加工成医用复合材料,如果复合材料中聚合物分布不均匀,则会严重影响材料的力学性能。Kotzianová等[57]利用LMCRS技术,对多个PCL/HA与PEO/HA复合材料中的聚合物分布加以区分,并利用奇异值分解法,快速辨别拉曼光谱重要信息,获得了不同区域的聚合物比例。
加工条件(如温度)影响复合材料中聚合物的分布。Unger等[58]使用LMCRS-RSI偶联技术,研究了加工温度对聚(β-羟丁酸)(PHB)/聚乳酸复合膜中聚合物的相间分离影响,发现富含PHB的小尺度晶区会随加工温度的升高而发生聚并,导致晶体尺寸变大。
燃料电池隔膜材料中的掺杂情况与其导电效率密切相关。Conti等[59]基于拉曼光谱技术,得到了不同浓度磷酸分子掺杂的聚(2, 5-苯并咪唑)(AB-PBI)膜的拉曼谱图,发现有掺杂的聚合物中,磷酸自由基团响应增强、C─H平面变形响应消失,出现C─H平面弯曲(δ)、C═C和C─N的伸缩振动(υ)响应强度及位置改变等掺杂过程的特征响应,进而得以观测掺杂程度、解析掺杂过程。
PMMA玻璃化转变温度接近105 ℃,因此需要较高的加工温度。加入甲苯等溶剂可起到塑化作用、提高其加工性,因此需要掌握甲苯在加工过程中的溶解、蒸发行为。Merklein等[52]利用IMRS原位表征了PMMA膜中甲苯的质量浓度分布,揭示了甲苯在PMMA中扩散动力学及其与温度、浓度之间的关系。
聚合物吸收CO2等气体后也会发生塑化,而拉曼光谱技术对聚合物吸收CO2等气体后所发生的化学结构改变特别敏感。Yoon等[60]、Ikeda-Fukazawa等[61]以及Knauer等[62]利用LMCRS技术,原位表征了CO2(1 265/1 372 cm−1)在PMMA、聚甲基丙烯酸乙酯(PEMA)和PCL中的拉曼光谱,通过谱图中CO2浓度分布,获得了聚合物中气体扩散系数,并通过聚合物中C─H伸缩振动增强、C─C骨架伸缩振动减弱现象,得到了聚合物链段改变规律。
当溶解了易挥发溶剂的聚合物溶液涂覆在物体表面后,溶剂挥发而得到聚合物涂层。Arya等利用LMCRS技术,分别对聚苯乙烯(PS)/THF/对二甲苯(PX)[56]、PMMA/THF/乙苯(EB)[56]、PS/PX、PS/THF、PMMA/THF及PMMA/EB体系[63-64]用内标法构建了关系曲线,然后原位获得了聚合物体系中溶剂挥发过程拉曼光谱,结合关系曲线得到了溶剂浓度随时间的变化规律,并计算得到扩散系数,证明自由体积模型更适用于对易挥发溶剂体系的预测,对不易挥发溶剂体系的预测结果则有较大误差。
表 2将聚合物复合材料中小分子的分布和迁移研究进行了汇总。
|
|
表 2 聚合物复合材料中小分子分布和迁移 Table 2 Distribution and migration of various small molecules in polymers |
通过拉曼光谱技术可原位监测聚合过程中单体浓度变化,以便掌握聚合反应动力学。乳液聚合是常用的聚合方法之一,其以水为溶剂,因而很难使用红外光谱技术,但拉曼光谱技术受水的影响较小,因此可用于乳液聚合过程的原位监测。Gheghiani等[65]利用拉曼光谱技术原位监测了甲基丙烯酸甲酯(MMA) 与丙烯酸丁酯(BA)的乳液共聚,获得了聚合过程中单体、聚合物浓度变化情况。
在聚合物纳米复合材料合成中,Wellington等[66]利用LMCRS技术原位监测了聚三甲基丙烷三丙烯酸酯(PTMPTA)/Fe3O4纳米复合材料合成过程中三甲基丙烷三丙烯酸酯(TMPTA)单体转化率随时间变化情况,获得了PTMPTA/Fe3O4纳米复合材料的合成动力学。
对于聚吡咯及聚噻吩的电化学氧化还原,Bukowska等[67]利用LMCRS技术,原位监测反应过程,发现聚吡咯氧化后υ(C═C)峰红移30 cm−1且可逆,而聚噻吩氧化后υ(C═C)峰明显变弱且不可逆。Bouabdallaoui等[40]利用RRS技术,得到了铂电极上聚噻吩薄膜的还原、氧化、过氧化过程的拉曼谱图,结果显示,υ (C─C)和υ (C═C)峰强度随着氧化过程逐渐增强,在过氧化时得到大幅增强。
氧化会提升共轭导电聚合物的导电性,但过氧化则可能造成导电性的不可逆损失。Dunst等[68]利用LMCRS技术进行反应过程的原位监测,获得了NO2与聚(3, 4-二氧乙烯吩)(PEDOT)/还原氧化石墨烯膜相互作用的拉曼谱图,观察到了PEDOT的υ(C═C)响应逐渐红移,但随着氧化进行,NO2会引起PEDOT过度氧化导致导电性下降且不可逆,因此,可从υ(C─C)和υ(C═C)峰强度下降的趋势中总结出调控共轭导电聚合物的导电性的方式。
对于自修复聚合物,Vasiliu等[51]利用IMRS技术,得到了聚异丁烯在自修复过程中的拉曼谱图,发现位于2 125 cm−1处υ (C≡C)的强度逐渐增加,并在1 440 cm−1处出现了新生成的三唑环(C2H3N3)响应,从而深化了对叠氮-炔环加成的自修复机理的认知。
聚氯乙烯(PVC)会降解生成多烯烃产物,导致产品延展性、透明度及导电等性能严重变差。Kuznetsov等[41]利用RRS技术监测PVC的降解,原位表征了PVC的光降解和热降解过程(见图 4)。PVC降解过程中,在大约1 120 cm−1和大约1 495 cm−1处出现了多烯烃C═C振动特征峰,表明生成了不同长度的多烯烃。Zhang等[53]利用RISE技术,表征了PVC在超声、过滤循环过程中纳米塑料(NP)的生成情况,从υ (C─Cl)(639/697 cm−1)、δ(C─H)(1 432 cm−1)和υ(C─H)(2 917 cm−1)的PVC特征峰中分辨出了NP。
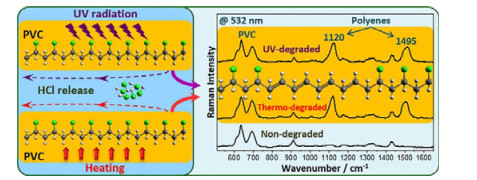
|
图 4 基于RRS的PVC光降解和热降解机理的研究[41] Fig.4 Mechanism study of photodegradation and thermal degradation of PVC via resonance Raman spectroscopy[41] |
在燃料电池隔膜制备中,可通过辐射接枝技术改性隔膜。在聚偏二氟乙烯(PVDF)薄膜上可接枝聚苯乙烯磺酸(PSSA)进行改性,但PVDF/PSSA接枝隔膜使用中会出现降解而降低效率。Ericson等[69]利用LMCRS技术,监测了PVDF/PSSA隔膜在燃料电池使用时的降解过程,从PVDF和PSSA分别在610 cm−1和1 127 cm−1的不同时段拉曼特征峰的变化,对隔膜稳定性进行考察,发现在电池阴极处PSSA降解显著。
氧化降解聚乙烯(OPE)是在聚乙烯(PE)中添加了氧化剂以促进降解。Wrona等[39]利用SERS技术,对OPE薄膜在双氧水、热、光等条件下的降解进行表征,结果表明,SERS对每种降解条件下的检测都很敏感,在双氧水氧化条件下可很快地检测出在1 044 cm−1处属于υ (C─C)的新特征峰,而使用常规的FTIR技术则无法在短时间内发现该体系发生的氧化反应。
4 聚合物中添加剂分布 4.1 乳化剂聚合物胶乳中通常含有乳化剂,其分布与迁移影响着聚合物性能[70]。聚合物表面因聚集过多的乳化剂而影响其黏结性和光泽[71],乳化剂迁移还会导致聚合物膜防水性能下降[72]。
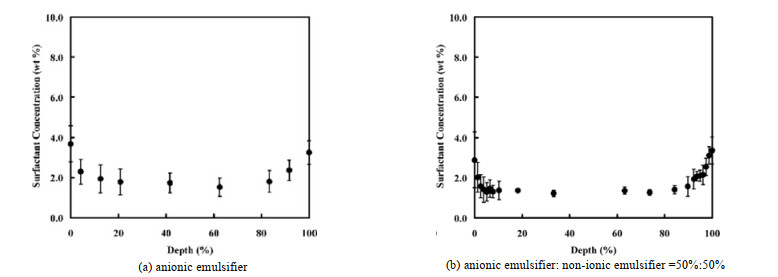
针对聚合物膜内部和表面的乳化剂分布,Arnold等[73-74]利用LMCRS技术,研究了不同时间十二烷基硫酸钠(SDS)在聚丙烯酸酯(PA)膜中的分布情况,以1 086 cm−1处的S═O和1 063 cm−1处的C─C分别作为SDS和PA的拉曼特征峰,构建了SDS和PA拉曼特征峰强度与SDS质量浓度之间的关系曲线,由此获得了PA中不同位置的SDS浓度,结果显示,低pH值条件下SDS在PA膜中呈现不均匀分布,而高pH值下在膜中则趋于均匀分布,但均在聚合物表面发生聚集,且在高pH值下表面聚集现象更明显。Xu等[16]也利用LMCRS技术,研究了阴离子乳化剂乙氧基化壬基酚磺基琥珀酸半酯二钠盐和非离子乳化剂壬基酚聚氧乙烯醚在PA膜中的分布(见图 5),由图 5可见,阴离子乳化剂在聚合物表面聚集更为明显。Zhang等[49-50]同样利用LMCRS技术,研究了PA膜中的乳化剂分布,发现烷烃链越长的阴离子乳化剂,其迁移至聚合物表面的量就越少;此外,使用可聚合的乳化剂也可抑制其向聚合物表面迁移。
4.2 染料涤纶、氨纶等聚合物织物产品通常需用分散染料进行染色,染料因在后处理和使用中存在色牢度下降、色相改变等问题[75-76],从而对织物品质稳定性产生极大的影响。
针对聚合物膜中的分散染料分布,Fleming等[77]利用LMCRS技术,考察了在超临界CO2条件下所浸染的聚对苯二甲酸乙二醇酯(PET)中偶氮类染料分散黄23的分布情况,分别计算分散黄23和PET在1 454~1 480 cm−1和1 700~1 760 cm−1对应的特征峰峰面积,得到了分散黄23在PET中的分布,发现分散黄23在PET中分布不均,从PET表面到内部,分散黄23的质量浓度逐渐降低。Kazarian等[78]利用LMCRS技术,对偶氮类染料分散橙25与分散红1在PET和PMMA中的分散情况进行了研究,与Fleming等的结论相似,染料在PET中分布不均匀,从PET表面向内部质量浓度逐渐降低。
4.3 其他添加剂聚合物如果复合各种添加剂与填料,可改变聚合物的相关性能。研究药物缓释层中药物、燃料电池隔膜中甲醇、水等小分子分布与迁移等,能更好地评判材料性能[79-82]。Zerda等[83]和Lewandowska等[46]利用RSI技术,研究聚合物中的填料分布。发现二氧化硅在聚丁二烯/溴化聚异丁基对甲基苯乙烯(BIMS)中的分布不均,相容性较差;但添加了天然橡胶或丁苯橡胶后,相容性得以显著提升[83]。在MAPE中加入聚环氧乙烷(PEO),可显著提高CNC在MAPE中的相容性[46]。Eaton等[84]利用LMCRS技术,表征了甲氧基硅烷、[3-(氨基)丙基]三甲氧基硅烷、[3-(巯基)丙基]三乙氧基硅烷等3种硅烷偶联剂在PVC中的分布与迁移,发现温度低于PVC玻璃化转变温度时,硅烷偶联剂几乎不扩散;反之,硅烷偶联剂开始迁移,使用塑化剂后,迁移速率迅速增加。
针对药物在聚合物中的分散情况,Balss等[85]利用LMCRS技术,得到了西罗莫司(Sirolimus)在PE、乙烯和醋酸乙烯共聚物混合物(PEVA)、聚甲基丙烯酸丁酯(PBMA)中的校准曲线,预测了多组聚合物样品中的西罗莫司含量。Mazzoni等[86]利用LMCRS技术,得到了萘普生(Naproxen)和酮洛芬(Ketoprofen)在聚乙烯吡咯烷酮(PVP)-醋酸乙烯酯(VA)聚合物基质中的三维分布图像,发现两种药物在PVP-VA体系中都处于非结晶状态。Ando等[87]利用LMCRS技术,研究了双氯芬酸钠(DCF)在透明质酸钠(HA)膜中的分布,以1 579 cm−1和1 376 cm−1分别作为DCF和HA的特征峰,发现中高含量DCF的HA膜表面DCF容易发生聚集,且含量越高,表面DCF聚集程度越高;而低含量DCF的HA膜表面,DCF聚集没有明显规律,只在HA膜表面发生部分聚集。Vogt等[88]利用LMCRS技术,研究了依布硒啉(Ebselen)在PVP-VA膜中的分布,分别以985~1 005 cm−1和915~940 cm−1作为依布硒啉和PVP-VA的特征峰,发现两者相容性差,依布硒啉的分布不均匀。
针对溶剂吸收,Naddaf等[89]利用LMCRS技术,测得25 ℃下1×10−5~10×10−5 mol⋅L−1苯酚在聚(N-异丙基丙烯酰胺)(PNIPAM)水凝胶膜中的扩散系数,数值为(0.335~5.62)×10−11 m2⋅s−1。Poggendorf等[90]利用LMCRS技术,发现聚乙二醇(PEG)在PNIPAM水凝胶膜中的扩散受温度和PEG的水溶液质量浓度影响,温度升高、PEG溶液浓度增大,造成PNIPAM水凝胶膜收缩,扩散阻力增加。Siebel等[91]利用IMRS技术,研究了聚醋酸乙烯酯(PVAc)中甲醇和甲苯的扩散行为,在0.2 m⋅s−1风速、20 ℃条件下,分别对PVAc的甲醇溶液和PVAc的甲苯溶液(溶质和溶剂质量比均为1:2)进行干燥成膜,测得甲醇和甲苯扩散系数都约为10−10 m2⋅s−1。Nixdorf等[92]利用拉曼光谱技术研究了PMMA膜的甲醇溶胀行为,发现膜溶胀程度影响甲醇扩散,测得20 ℃下甲醇的扩散系数为3×10−12 m2⋅s−1。Chang等[93]利用拉曼光谱技术,测得25 ℃下1.2 mm厚的PS膜中乙腈、己烷和1-丙醇的扩散系数分别为(1.7±0.18)×10−11、(3.7±0.98)×10−11和(6.2±8.9)×10−11m2⋅s−1。
对于聚合物膜中水分子分布及迁移,Scharfer等[94]利用LMCRS技术,原位表征了甲醇和水在183 μm厚的Nafion膜中的扩散,得到20 ℃下甲醇和水的扩散系数分别为2.80×10−10和5.00×10−10m2⋅s−1,并验证了扩散系数的温度依赖性,发现温度越高,扩散行为越强烈。Tabuchi等[95]利用LMCRS技术,表征了水分子在Nafion膜中的输运情况,以3 200 cm−1和3 500 cm−1处的响应作为水分子的特征峰,研究了不同相对湿度下膜中水分子含量及存在状态,发现在低含水量下,3 500 cm−1峰对含水量不敏感,而3 200 cm−1峰对含水量较为敏感,推测3 500 cm−1处的响应代表可自由移动的水分子,而3 200 cm−1处的响应则代表与膜中磺酸基团结合的水分子。Hara等[96]利用LMCRS技术,原位表征了工作中的燃料电池,得到了不同条件下水分子在Nafion膜中的输运情况,发现电流密度由100 mA⋅cm−2提升至250 mA⋅cm−2后,膜中水分子含量有所提升,阳极(H2)和阴极(O2)进料气流流量由10 mL⋅min−1、10 mL⋅min−1提升至25 mL⋅min−1、50 mL⋅min−1后,膜中水分子含量反而减少。
表 3汇总了各种添加剂及溶剂在聚合物中的分布与迁移情况。
|
|
表 3 聚合物中各种添加剂及溶剂的分布及迁移 Table 3 Distribution and migration of various additives and solvents in polymers |
聚合物产品是通过多级次聚集态结构设计、填料和添加剂引入来定制产品性能的,因此非常有必要对其化学、微观结构信息进行系统了解。拉曼光谱衍生技术能快速、准确地获取样品微区的化学信息,揭示聚合物材料制备过程中所发生的变化规律,以及反映添加剂在聚合物中的分布及迁移。拉曼光谱衍生技术中,增强信号的RRS技术,可用于微量检测,但不适用易产生荧光的体系;SERS是一种较为成熟的痕量检测技术,但制样要求限制了其在较大尺寸样品检测中的应用;CARS技术由于仅关注增强特定基团信号,制约了其在定量分析中的应用;LMCRS与RSI技术较为成熟,已被广泛应用于化学、材料、生物、医学等领域;而HRS和LMCRS-扫描电镜相结合的RISE新兴技术因较复杂而应用较少,但对空间分辨率(尺寸约为0.5 μm)或对成像速率有更高要求的场合可使用RISE技术。
显然,将上述技术相互结合,可获得更完整的表征结果。例如,带有LMCRS技术的光谱仪,与RSI技术耦合,可实现样品空间高分辨率成像;又如将侧重制样的SERS技术与LMCRS相结合,或将提升谱图中峰强度的RRS与CRSM技术相结合,可以提升样品空间的分辨率;对于像HRS这种对分子对称结构敏感、但响应强度低于常规拉曼散射的技术,可将其与RRS、SERS等增强信号技术相结合。
随着光源和信号采集处理技术的提升,可提高现有技术的测量精度、实现对低含量物质准确定量分析;将新型能谱、电镜等检测技术与拉曼光谱技术相耦合,可提高样品空间成像的分辨率;将机器学习和人工智能引入谱图、图像的辨识和数据处理中,可提高成像速率、实现实时原位化学结构与含量等信息反馈,促进拉曼光谱技术的进步。
符号说明:
bij
⎯ 仪器常数,无因次
Sm
⎯ 组分m的散射强度,cd
c0
⎯ 光速,m⋅s−1
Sp
⎯ 组分p的散射强度,cd
cij
⎯ 添加剂分子的浓度,mol⋅L−1
T
⎯ 温度,K
cm
⎯ 组分m的浓度,mol⋅L−1
δ
⎯ 平面弯曲位移,cm−1
cp
⎯ 组分p的浓度,mol⋅L−1
Ω
⎯ 光学探测器的立体角,sr
h
⎯ 普朗克常数,N⋅m⋅s
λL
⎯ 激光激发辐射波长,nm
Kp/m
⎯ 组分p与m的特征系数kp与km的比值
σij
⎯ 微分拉曼散射截面积,m2
kB
⎯ 玻尔兹曼常数,J⋅K−1
υ
⎯ 伸缩振动位移,cm−1
kij
⎯ 特征系数,无因次
ΔυR, ij
⎯ 拉曼位移,cm−1
Lij
⎯ 局域电磁场强度,μA⋅m−1
下标
nL
⎯ 激发光子数,无因次
i, j
⎯ 能级
Sij
⎯ 拉曼散射强度,cd
p, m
⎯ 组分
| [1] |
TIAN L L, MA Y N, JI R. Quantification of polystyrene plastics degradation using 14C isotope tracer technique[J]. Methods in Enzymology, 2021, 648: 121-136. |
| [2] |
WYATT V T, JONES K. Quantification of monomers in poly(glycerol-co-diacid) gels using gas chromatography[J]. Journal of Biobased Materials and Bioenergy, 2012, 6(1): 119-124. DOI:10.1166/jbmb.2012.1189 |
| [3] |
YAN W Y, AMMON D M JR, GARDELLA J A JR, et al. Quantitative mass spectrometry of technical polymers: A comparison of several ionization methods[J]. European Journal of Mass Spectrometry, 1999, 4(6): 467-474. |
| [4] |
GHAFFAR A, VERSCHUREN P G, GEENEVASEN J A J, et al. Fast in vitro hydrolytic degradation of polyester urethane acrylate biomaterials: Structure elucidation, separation and quantification of degradation products[J]. Journal of Chromatography A, 2011, 1218(3): 449-458. DOI:10.1016/j.chroma.2010.11.053 |
| [5] |
ZHANG Q, GUO N Z, SUN Y, et al. Absolute quantification of poly(DL-lactide-co-glycolide) in microspheres using quantitative 1H NMR spectroscopy[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 146: 273-278. DOI:10.1016/j.jpba.2017.08.046 |
| [6] |
DUPONT-GILLAIN C C, NYSTEN B, ROUXHET P G. Collagen adsorption on poly(methyl methacrylate): Net-like structure formation upon drying[J]. Polymer International, 1999, 48(4): 271-276. DOI:10.1002/(SICI)1097-0126(199904)48:4<271::AID-PI119>3.0.CO;2-J |
| [7] |
BURRELL M C, BHATIA Q S, MICHAEL R S. XPS and static SIMS studies of copoly(ether esters) containing mixed polyether soft blocks[J]. Surface and Interface Analysis, 1994, 21(8): 553-559. DOI:10.1002/sia.740210807 |
| [8] |
TSOURAPAS G, RUTTEN F J M, BRIGGS D, et al. Surface spectroscopic imaging of PEG-PLA tissue engineering constructs with ToF-SIMS[J]. Applied Surface Science, 2006, 252(19): 6693-6696. DOI:10.1016/j.apsusc.2006.02.277 |
| [9] |
储伟. 催化剂工程[M]. 成都: 四川大学出版社, 2006. CHU W. Catalyst engineering[M]. Chengdu: Sichuan University Press, 2006. |
| [10] |
TOUGAARD S. Practical guide to the use of backgrounds in quantitative XPS[J]. Journal of Vacuum Science & Technology A, 2021, 39(1): 011201. |
| [11] |
SAMOUDI B, BENDAOU O, HANAFI I, et al. FTIR and Raman spectroscopy study of soot deposits produced in the infrared multiphoton dissociation of vinyl bromide[J]. Journal of Spectroscopy, 2022, 2022: 9942870. |
| [12] |
KIMBER J A, GERST M, KAZARIAN S G. Fast drying and film formation of latex dispersions studied with FTIR spectroscopic imaging[J]. Langmuir, 2014, 30(45): 13588-13595. DOI:10.1021/la5035257 |
| [13] |
EVANSON K W, URBAN M W. Surface and interfacial FTIR spectroscopic studies of latexes. I. Surfactant-copolymer interactions[J]. Journal of Applied Polymer Science, 1991, 42(8): 2287-2296. DOI:10.1002/app.1991.070420820 |
| [14] |
ZHAO C L, HOLL Y, PITH T, et al. FTIR-ATR spectroscopic determination of the distribution of surfactants in latex films[J]. Colloid and Polymer Science, 1987, 265(9): 823-829. DOI:10.1007/BF01418459 |
| [15] |
NIU B J, URBAN M W. Surface and interfacial Fourier transform infrared spectroscopic studies of latexes. ⅩⅥ. Quantitative analysis of surfactant in multilayered films[J]. Journal of Applied Polymer Science, 1996, 62(11): 1903-1911. DOI:10.1002/(SICI)1097-4628(19961212)62:11<1903::AID-APP15>3.0.CO;2-Z |
| [16] |
XU G H, DONG J P, ZHANG J G, et al. Characterizing the distribution of nonylphenol ethoxylate surfactants in water-based pressure-sensitive adhesive films using atomic-force and confocal Raman microscopy[J]. The Journal of Physical Chemistry B, 2008, 112(38): 11907-11914. DOI:10.1021/jp804876x |
| [17] |
DIEING T, HOLLRICHER O, TOPORSKI J. Confocal Raman microscopy[M]. Berlin: Springer, 2011.
|
| [18] |
吴瑾光. 近代傅里叶变换红外光谱技术及应用[M]. 北京: 科学技术文献出版社, 1994. WU J G. Modern Fourier transform infrared spectroscopy and its application[M]. Beijing: Science and Technology Literature Press, 1994. |
| [19] |
袁媛, 王梦梵, 曲云菲, 等. 拉曼光谱技术在高分子表征研究中的应用[J]. 高分子学报, 2021, 52(9): 1206-1220. YUAN Y, WANG M F, QU Y F, et al. Application of Raman spectroscopy in the characterization of polymers[J]. Acta Polymerica Sinica, 2021, 52(9): 1206-1220. |
| [20] |
RAMAN C V, KRISHNAN K S. A new type of secondary radiation[J]. Nature, 1928, 121(3048): 501-502. |
| [21] |
JIANG H Y, DING C H, WANG Y, et al. RETRACTED ARTICLE: Determination of acetaminophen spatial distribution and content in tablets using confocal micro-Raman spectroscopy mapping[J]. Journal of Nanoparticle Research, 2020, 22(9): 265. DOI:10.1007/s11051-020-04970-z |
| [22] |
SIEBERT F, HILDEBRANDT P. Vibrational spectroscopy in life science [M]. Weinheim: Wiley, 2007.
|
| [23] |
CHADHA S, GHIAMATI E, MANOHARAN R, et al. UV-excited Raman and resonance Raman spectra of synthetic polymers[J]. Applied Spectroscopy, 1992, 46(7): 1176-1181. DOI:10.1366/0003702924124141 |
| [24] |
GERRARD D L, MADDAM W F. Polymer characterization by Raman spectroscopy[J]. Applied Spectroscopy Reviews, 1986, 22(2/3): 251-334. |
| [25] |
SHORYGIN P. Resonance Raman effect[J]. Pure and Applied Chemistry, 1962, 4(1): 87-96. DOI:10.1351/pac196204010087 |
| [26] |
TERHUNE R W, MAKER P D, SAVAGE C M. Measurements of nonlinear light scattering[J]. Physical Review Letters, 1965, 14(17): 681-684. DOI:10.1103/PhysRevLett.14.681 |
| [27] |
MAKER P D, TERHUNE R W. Study of optical effects due to an induced polarization third order in the electric field strength[J]. Physical Review, 1965, 137(3A): A801-A818. DOI:10.1103/PhysRev.137.A801 |
| [28] |
FLEISCHMANN M, HENDRA P J, MCQUILLAN A J. Raman spectra of pyridine adsorbed at a silver electrode[J]. Chemical Physics Letters, 1974, 26(2): 163-166. DOI:10.1016/0009-2614(74)85388-1 |
| [29] |
DELHAYE M, DHAMELINCOURT P. Raman microprobe and microscope with laser excitation[J]. Journal of Raman Spectroscopy, 1975, 3(1): 33-43. DOI:10.1002/jrs.1250030105 |
| [30] |
WHITE J G, AMOS W B. Confocal microscopy comes of age[J]. Nature, 1987, 328(6126): 183-184. DOI:10.1038/328183a0 |
| [31] |
SCHABEL W, LUDWIG I, KIND M. Measurements of concentration profiles in polymeric solvent coatings by means of an inverse confocal micro Raman spectrometer-Initial results[J]. Drying Technology, 2004, 22(1/2): 285-294. |
| [32] |
SCHMIDT U, LIU W, YANG J Y, et al. The power of confocal Raman-AFM and Raman-SEM (RISE) imaging in polymer research[J]. Microscopy and Microanalysis, 2015, 21(Suppl.3): 2189-2190. |
| [33] |
EFREMOV E V, ARIESE F, GOOIJER C. Achievements in resonance Raman spectroscopy: Review of a technique with a distinct analytical chemistry potential[J]. Analytica Chimica Acta, 2008, 606(2): 119-134. DOI:10.1016/j.aca.2007.11.006 |
| [34] |
李荫远. 论高阶辐射过程Raman效应及其在光谱学中的应用[J]. 物理学报, 1964, 20(2): 164-173. LI Y Y. On the Raman effect of multiple radiation process and its applications in spectroscopy[J]. Acta Physica Sinica, 1964, 20(2): 164-173. |
| [35] |
MIN W, FREUDIGER C W, LU S J, et al. Coherent nonlinear optical imaging: Beyond fluorescence microscopy[J]. Annual Review of Physical Chemistry, 2011, 62(1): 507-530. DOI:10.1146/annurev.physchem.012809.103512 |
| [36] |
HAN X X, RODRIGUEZ R S, HAYNES C L, et al. Surface-enhanced Raman spectroscopy[J]. Nature Reviews Methods Primers, 2022, 1(1): 87. DOI:10.1038/s43586-021-00083-6 |
| [37] |
LANGER J, JIMENEZ DE ABERASTURI D, AIZPURUA J, et al. Present and future of surface-enhanced Raman scattering[J]. ACS Nano, 2020, 14(1): 28-117. DOI:10.1021/acsnano.9b04224 |
| [38] |
KNEIPP J, KNEIPP H, KNEIPP K. SERS-a single-molecule and nanoscale tool for bioanalytics[J]. Chemical Society Reviews, 2008, 37(5): 1052-1060. DOI:10.1039/b708459p |
| [39] |
WRONA M, SALAFRANCA J, NERÍN C. Fast assessment of oxo-biodegradable polyethylene film oxidation by surface-enhanced Raman scattering with in situ formation of a silver nanoparticle substrate[J]. Journal of Materials Chemistry C, 2017, 5(2): 463-469. DOI:10.1039/C6TC04401H |
| [40] |
BOUABDALLAOUI M, AOUZAL Z, BEN JADI S, et al. X-ray photoelectron and in situ and ex situ resonance Raman spectroscopic investigations of polythiophene overoxidation[J]. Journal of Solid State Electrochemistry, 2017, 21(12): 3519-3532. DOI:10.1007/s10008-017-3698-9 |
| [41] |
KUZNETSOV S M, SAGITOVA E A, PROKHOROV K A, et al. Raman spectroscopic detection of polyene-length distribution for high-sensitivity monitoring of photo-and thermal degradation of polyvinylchloride[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2021, 252: 119494. DOI:10.1016/j.saa.2021.119494 |
| [42] |
LI H Z, CHENG Y, TANG H J, et al. Imaging chemical kinetics of radical polymerization with an ultrafast coherent Raman microscope[J]. Advanced Science, 2020, 7(10): 1903644. DOI:10.1002/advs.201903644 |
| [43] |
徐冰冰, 金尚忠, 姜丽, 等. 共振拉曼光谱技术应用综述[J]. 光谱学与光谱分析, 2019, 39(7): 2119-2127. XU B B, JIN S Z, JIANG L, et al. A review of applications of resonance Raman spectroscopy[J]. Spectroscopy and Spectral Analysis, 2019, 39(7): 2119-2127. |
| [44] |
KELLEY A M. Hyper-Raman scattering by molecular vibrations[J]. Annual Review of Physical Chemistry, 2010, 61(1): 41-61. DOI:10.1146/annurev.physchem.012809.103347 |
| [45] |
林泽南. 基于拉曼光谱解析的聚合物共混体系组分含量测量方法研究[D]. 广州: 华南理工大学, 2021. LIN Z N. Study on component content measurement of polymer blends based on mathematical representation of Raman spectra [D]. Guangzhou: South China University of Technology, 2021. |
| [46] |
LEWANDOWSKA A E, INAI N H, GHITA O R, et al. Quantitative analysis of the distribution and mixing of cellulose nanocrystals in thermoplastic composites using Raman chemical imaging[J]. RSC Advances, 2018, 8(62): 35831-35839. DOI:10.1039/C8RA06674D |
| [47] |
WANG M F, VANTASIN S, WANG J P, et al. Distribution of polymorphic crystals in the ring-banded spherulites of poly (butylene adipate) studied using high-resolution Raman imaging[J]. Macromolecules, 2017, 50(8): 3377-3387. DOI:10.1021/acs.macromol.7b00139 |
| [48] |
许永建, 罗荣辉, 郭茂田, 等. 共聚焦显微拉曼光谱的应用和进展[J]. 激光杂志, 2007, 28(2): 13-14. XU Y J, LUO R H, GUO M T, et al. The application and development of confocal Raman micro-spectroscopy[J]. Laser Journal, 2007, 28(2): 13-14. DOI:10.3969/j.issn.0253-2743.2007.02.007 |
| [49] |
ZHANG J L, ZHAO Y X, DUBAY M R, et al. Surface enrichment by conventional and polymerizable sulfated nonylphenol ethoxylate emulsifiers in water-based pressure-sensitive adhesive[J]. Industrial & Engineering Chemistry Research, 2013, 52(25): 8616-8621. |
| [50] |
ZHANG J L, SEVERTSON S J, HOUTMAN C J. Characterizing the distribution of sodium alkyl sulfate surfactant homologues in water-based, acrylic pressure-sensitive adhesive films[J]. The Journal of Physical Chemistry B, 2011, 115(25): 8138-8144. DOI:10.1021/jp202731h |
| [51] |
VASILIU S, KAMPE B, THEIL F, et al. Insights into the mechanism of polymer coating self-healing using Raman spectroscopy[J]. Applied Spectroscopy, 2014, 68(5): 541-548. DOI:10.1366/13-07332 |
| [52] |
MERKLEIN L, ESER J C, BÖRNHORST T, et al. Different dominating mass transport mechanisms for drying and sorption of toluene-PMMA films-visualized with Raman spectroscopy[J]. Polymer, 2021, 222: 123640. DOI:10.1016/j.polymer.2021.123640 |
| [53] |
ZHANG W, DONG Z Q, ZHU L, et al. Direct observation of the release of nanoplastics from commercially recycled plastics with correlative Raman imaging and scanning electron microscopy[J]. ACS Nano, 2020, 14(7): 7920-7926. DOI:10.1021/acsnano.0c02878 |
| [54] |
李津蓉. 拉曼光谱的数学解析及其在定量分析中的应用[D]. 杭州: 浙江大学, 2013. LI J R. Mathematical representation of Raman spectra and applications in quantitative analysis [D]. Hangzhou: Zhejiang University, 2013. |
| [55] |
DOWY S, BRAEUER A, SCHATZ R, et al. CO2 partial density distribution during high-pressure mixing with ethanol in the supercritical antisolvent process[J]. The Journal of Supercritical Fluids, 2009, 48(3): 195-202. DOI:10.1016/j.supflu.2008.10.017 |
| [56] |
ARYA R K, VINJAMUR M. Measurement of concentration profiles using confocal Raman spectroscopy in multicomponent polymeric coatings-model validation[J]. Journal of Applied Polymer Science, 2013, 128(6): 3906-3918. DOI:10.1002/app.38589 |
| [57] |
KOTZIANOVÁ A, ŘEBÍČEK J, POKORNÝ M, et al. Raman spectroscopy analysis of biodegradable electrospun nanofibers prepared from polymer blends[J]. Monatshefte für Chemie-Chemical Monthly, 2016, 147(5): 919-923. DOI:10.1007/s00706-015-1639-9 |
| [58] |
UNGER M, SATO H, OZAKI Y, et al. Temperature-dependent Fourier transform infrared spectroscopy and Raman mapping spectroscopy of phase-separation in a poly(3-hydroxybutyrate)-poly(l-lactic acid) blend[J]. Applied Spectroscopy, 2013, 67(2): 141-148. DOI:10.1366/12-06712 |
| [59] |
CONTI F, MAJERUS A, DI NOTO V, et al. Raman study of the polybenzimidazole-phosphoric acid interactions in membranes for fuel cells[J]. Physical Chemistry Chemical Physics, 2012, 14(28): 10022-10026. DOI:10.1039/c2cp40553a |
| [60] |
YOON J H, KAWAMURA T, TAKEYA S, et al. Probing Fickian and non-Fickian diffusion of CO2 in poly(methyl methacrylate) using in situ Raman spectroscopy and microfocus X-ray computed tomography[J]. Macromolecules, 2004, 37(25): 9302-9304. DOI:10.1021/ma048742q |
| [61] |
IKEDA-FUKAZAWA T, KITA D, NAGASHIMA K. Raman spectroscopic study of CO2 sorption process in poly methyl methacrylate[J]. Journal of Polymer Science Part B: Polymer Physics, 2008, 46(8): 831-842. DOI:10.1002/polb.21421 |
| [62] |
KNAUER O S, PASTORE CARBONE M G, BRAEUER A, et al. Investigation of CO2 sorption in molten polymers at high pressures using Raman line imaging[J]. Polymer, 2013, 54(2): 812-818. DOI:10.1016/j.polymer.2012.11.053 |
| [63] |
ARYA R K. Measurement of concentration profiles in thin film binary polymer-solvent coatings using confocal Raman spectroscopy: Free volume model validation[J]. Drying Technology, 2014, 32(8): 992-1002. DOI:10.1080/07373937.2014.880714 |
| [64] |
ARYA R K, TEWARI K, SHUKLA S. Non-Fickian drying of binary polymeric coatings: Depth profiling study using confocal Raman spectroscopy[J]. Progress in Organic Coatings, 2016, 95: 8-19. DOI:10.1016/j.porgcoat.2016.02.004 |
| [65] |
GHEGHIANI M, CAILLOL N, HENROT S, et al. Monitoring of polymer content in an emulsion polymerization using spatially resolved spectroscopy in the near infrared region and Raman spectroscopy[J]. Polymer Engineering & Science, 2020, 60(9): 2248-2261. |
| [66] |
WELLINGTON N, PATHREEKER S, HOSEIN I D. Light-induced self-writing of polymer composites: A novel approach to develop core-shell-type structures[J]. Composites Communications, 2022, 30: 101058. DOI:10.1016/j.coco.2022.101058 |
| [67] |
BUKOWSKA J, JACKOWSKA K. In situ Raman studies of polypyrrole and polythiophene films on Pt electrodes[J]. Synthetic Metals, 1990, 35(1/2): 143-150. |
| [68] |
DUNST K J, TRZCIŃSKI K, SCHEIBE B, et al. Study of the NO2 sensing mechanism of PEDOT-RGO film using in situ Raman spectroscopy[J]. Sensors and Actuators B: Chemical, 2018, 260: 1025-1033. DOI:10.1016/j.snb.2018.01.089 |
| [69] |
ERICSON H, KALLIO T, LEHTINEN T, et al. Confocal Raman spectroscopic investigations of fuel cell tested sulfonated styrene grafted poly(vinylidene fluoride) membranes[J]. Journal of the Electrochemical Society, 2002, 149(2): A206. DOI:10.1149/1.1431964 |
| [70] |
XU G H, DONG J P, SEVERTSON S J, et al. Modifications of surfactant distributions and surface morphologies in latex films due to moisture exposure[J]. The Journal of Physical Chemistry B, 2009, 113(30): 10189-10195. DOI:10.1021/jp902716b |
| [71] |
YANG Y K, LI H, WANG F. Studies on the water resistance of acrylic emulsion pressure-sensitive adhesives (PSAs)[J]. Journal of Adhesion Science and Technology, 2003, 17(13): 1741-1750. DOI:10.1163/156856103322538651 |
| [72] |
BUTLER L N, FELLOWS C M, GILBERT R G. Effect of surfactant systems on the water sensitivity of latex films[J]. Journal of Applied Polymer Science, 2004, 92(3): 1813-1823. DOI:10.1002/app.20150 |
| [73] |
ARNOLD C, THALMANN F, MARQUES C, et al. Surfactant distribution in waterborne acrylic films. 1. Bulk investigation[J]. The Journal of Physical Chemistry B, 2010, 114(28): 9135-9147. DOI:10.1021/jp103347n |
| [74] |
ARNOLD C, KLEIN G, MAALOUM M, et al. Surfactant distribution in waterborne acrylic films: 2. Surface investigation[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011, 374(1/3): 58-68. |
| [75] |
崔浩然. 分散染料热迁移性对染品质量的影响[J]. 印染, 2003, 29(10): 13-17. CUI H R. Effects of thermal migration of disperse dyes on dyeing quality[J]. China Dyeing and Finishing, 2003, 29(10): 13-17. DOI:10.3321/j.issn:1000-4017.2003.10.005 |
| [76] |
徐敏. 分散染料在涤纶涂层织物上的迁移及色变研究[D]. 杭州: 浙江理工大学, 2012. XU M. Study on the dye transfer and color change of coated polyester fabrics [D]. Hangzhou: Zhejiang Sci-Tech University, 2012. |
| [77] |
FLEMING O S, KAZARIAN S G, BACH E, et al. Confocal Raman study of poly(ethylene terephthalate) fibres dyed in supercritical carbon dioxide: Dye diffusion and polymer morphology[J]. Polymer, 2005, 46(9): 2943-2949. DOI:10.1016/j.polymer.2005.02.067 |
| [78] |
KAZARIAN S G, CHAN K L A. Confocal Raman microscopy of supercritical fluid dyeing of polymers[J]. Analyst, 2003, 128(5): 499-503. DOI:10.1039/b304056a |
| [79] |
FRISCH H L, STERN S A. Diffusion of small molecules in polymers[J]. Critical Reviews in Solid State and Materials Sciences, 1983, 11(2): 123-187. DOI:10.1080/01611598308244062 |
| [80] |
FOREMAN M R, VOLLMER F. Optical tracking of anomalous diffusion kinetics in polymer microspheres[J]. Physical Review Letters, 2015, 114(11): 118001. DOI:10.1103/PhysRevLett.114.118001 |
| [81] |
CHEN X G, SUN H Y, YANG H Q, et al. Self-assembled dye-doped polymer microspheres as whispering gallery mode lasers: Proceedings of SPIE 10024, Optics in health care and biomedical optics VII [C]. Beijing: SPIE, 2017.
|
| [82] |
RANDALL G C, DOYLE P S. Permeation-driven flow in poly(dimethylsiloxane) microfluidic devices[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31): 10813-10818. |
| [83] |
ZERDA T W, SONG G, WADDELL W H. Distribution of elastomers and silica in polymer blends characterized by Raman microimaging technique[J]. Rubber Chemistry and Technology, 2003, 76(4): 769-778. DOI:10.5254/1.3547770 |
| [84] |
EATON P, HOLMES P, YARWOOD J. ATR/FT-IR and Raman microscopic investigation of diffusion and distribution of silane coupling agents in PVC films[J]. Applied Spectroscopy, 2000, 54(4): 508-516. DOI:10.1366/0003702001949672 |
| [85] |
BALSS K M, LLANOS G, PAPANDREOU G, et al. Quantitative spatial distribution of sirolimus and polymers in drug-eluting stents using confocal Raman microscopy[J]. Journal of Biomedical Materials Research Part A, 2008, 85A(1): 258-270. DOI:10.1002/jbm.a.31535 |
| [86] |
MAZZONI C, TENTOR F, ANTALAKI A, et al. Where is the drug? Quantitative 3D distribution analyses of confined drug-loaded polymer matrices[J]. ACS Biomaterials Science & Engineering, 2019, 5(6): 2935-2941. |
| [87] |
ANDO D, MIYAZAKI T, YAMAMOTO E, et al. Chemical imaging analysis of active pharmaceutical ingredient in dissolving microneedle arrays by Raman spectroscopy[J]. Drug Delivery and Translational Research, 2022, 12(2): 426-434. DOI:10.1007/s13346-021-01052-y |
| [88] |
VOGT F G, WILLIAMS G R. Analysis of a nanocrystalline polymer dispersion of ebselen using solid-state NMR, Raman microscopy, and powder X-ray diffraction[J]. Pharmaceutical Research, 2012, 29(7): 1866-1881. DOI:10.1007/s11095-012-0713-9 |
| [89] |
NADDAF A A, BART H J. Raman spectroscopy: Mutual diffusion coefficient in hydrogels[J]. Defect and Diffusion Forum, 2011, 312-315: 193-198. DOI:10.4028/www.scientific.net/DDF.312-315.193 |
| [90] |
POGGENDORF S, ADAMA MBA G, ENGEL D, et al. Diffusion of poly(ethylene glycol) and ectoine in NIPAAm hydrogels with confocal Raman spectroscopy[J]. Colloid and Polymer Science, 2011, 289(5/6): 545-559. |
| [91] |
SIEBEL D, SCHARFER P, SCHABEL W. Determination of concentration-dependent diffusion coefficients in polymer-solvent systems: Analysis of concentration profiles measured by Raman spectroscopy during single drying experiments excluding boundary conditions and phase equilibrium[J]. Macromolecules, 2015, 48(23): 8608-8614. DOI:10.1021/acs.macromol.5b02144 |
| [92] |
NIXDORF J, DI FLORIO G, BRÖCKERS L, et al. Uptake of methanol by poly(methyl methacrylate): An old problem addressed by a novel Raman technique[J]. Macromolecules, 2019, 52(13): 4997-5005. DOI:10.1021/acs.macromol.9b00205 |
| [93] |
CHANG T M, XANTHEAS S S, VASDEKIS A E. Mesoscale polymer dissolution probed by Raman spectroscopy and molecular simulations[J]. The Journal of Physical Chemistry B, 2016, 120(40): 10581-10587. DOI:10.1021/acs.jpcb.6b05565 |
| [94] |
SCHARFER P, SCHABEL W, KIND M. Modelling of alcohol and water diffusion in fuel cell membranes-Experimental validation by means of in situ Raman spectroscopy[J]. Chemical Engineering Science, 2008, 63(19): 4676-4684. DOI:10.1016/j.ces.2008.03.014 |
| [95] |
TABUCHI Y, ITO R, TSUSHIMA S, et al. Analysis of state of water in polymer electrolyte membrane by Raman spectroscopy and DFT[J]. ECS Transactions, 2010, 33(1): 1045-1053. DOI:10.1149/1.3484598 |
| [96] |
HARA M, INUKAI J, BAE B, et al. Micro-Raman study on water distribution inside a Nafion membrane during operation of polymer electrolyte fuel cell[J]. Electrochimica Acta, 2012, 82: 277-283. DOI:10.1016/j.electacta.2012.04.099 |
| [97] |
MOHAMED A L, ER-RAFIK M, MOLLER M. Suitability of confocal Raman microscopy for monitoring the penetration of PDMS compounds into cotton fibres[J]. Carbohydrate Polymers, 2013, 96(1): 305-313. DOI:10.1016/j.carbpol.2013.03.087 |