蛋氨酸(methionine)是一种重要的含硫氨基酸,广泛应用于医药、食品、调味剂、动物饲料等行业。在家禽的玉米-豆粕型饲粮中适当添加,能有效改善家禽的免疫状况、生长性能、血液生化指标状况及繁殖性能[1~4]。目前蛋氨酸的生产方法主要为化学法[5],合成的是D型和L型混合蛋氨酸,故其应用受到限制。蛋氨酸的化学生产过程还涉及丙烯醛、甲硫醇、氨、氰化物等危险化学品,且容易造成环境污染,因此也限制了蛋氨酸的大规模化学生产[6]。研究人员正积极探索采用发酵法合成蛋氨酸[7, 8]。诱变是常用的提高菌株合成蛋氨酸能力的方法,Kase等[9]通过在培养基中添加硒代蛋氨酸来筛选谷氨酸棒杆菌的乙硫氨酸抗性突变菌株,蛋氨酸产量为0.25 g·L-1,Chattopadhyay等[10]用亚硝基胍诱变大肠杆菌,筛选出抗苏氨酸和蛋氨酸的突变型菌株,蛋氨酸产量为2 g·L-1。Nakamori等[11]使用TN1对大肠杆菌诱变处理,使metJ基因发生突变,得到的蛋氨酸产量为0.91 g·L-1。在对大肠杆菌蛋氨酸合成的代谢调控机理研究的基础上[12~16],Usuda等[17]在大肠杆菌中过表达metA基因,敲除metJ、thrBC基因并弱化metK基因使蛋氨酸产量达到0.24 g·L-1。Schneider等[18]通过基因改造增加大肠杆菌硫代硫酸盐的转硫酶活性,并添加适当的硫源得到蛋氨酸产量0.55 g·L-1。
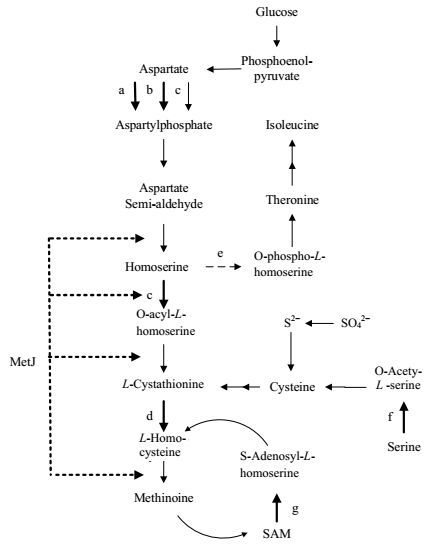
目前国内外的蛋氨酸发酵相关研究,多针对特定的单基因开展研究,并没有组合优化代谢网络,本研究在分析大肠杆菌的蛋氨酸合成途径及其调控机制(图 1)的基础上,通过过表达转运蛋白的方法,弱化了苏氨酸和MetJ蛋白反馈阻遏对蛋氨酸合成的影响,并考察了蛋氨酸合成途径中的关键基因,如天冬氨酸激酶Ⅰ基因(thrA)、天冬氨酸激酶Ⅱ基因(metL)、高丝氨酸酰基转移酶基因(metA)、胱硫醚水解酶(metC)基因、苏氨酸合成途径的关键基因(thrB)、蛋氨酸循环途径相关基因(dcm)以及蛋氨酸转运蛋白基因(yeaS、yieH)等多个不同因素对蛋氨酸合成的影响,对大肠杆菌的蛋氨酸合成代谢网络进行了定向改造及优化,提高大肠杆菌合成蛋氨酸合成效率。
|
图 1 大肠杆菌中的蛋氨酸合成途径 Fig.1 Methionine biosynthesis pathway in Escherichia coli a: Aspartate kinase (thrA); b: Aspartate kinaseⅡ (metL); c: homoserine O-acetyltransferase (metA); d: cystathionine beta-lyase(metC); e: homoserine kinase(thrB); f: Serine acetyltransferase (cysE); g: DNA (cytosine-5)-methyl-transferase (dcm); Over-expressed genes are indicated in thick lines; gene deletions are indicated in dotted lines; inhibitions are indicated in pecked lines |
表 1为本研究用到的菌株和质粒,表 2为本研究用到的引物。大肠杆菌(E. coli MG1655,E. coli DH5α)均为实验室保存,用于基因敲除的大肠杆菌菌株JW3909-1及JW0002-3、工具质粒pCP20及pKD46购自美国耶鲁大学大肠杆菌遗传保藏中心(the Coli Genetic Stock Center, CGSC)。质粒pDHC29为实验室保存。
| 表 1 本研究中用到的菌株和质粒 Table 1 Strains and plasmids used in this work |
| 表 2 本研究所用引物 Table 2 Primers used in this work |
限制性内切酶购于Fermentas公司,Taq聚合酶、Pfu DNA聚合酶、T4 DNA连接酶等购于TaKaRa公司。氯霉素、氨苄青霉素钠、硫酸卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)等购于Sigma公司。酵母提取物、胰蛋白胨为oxoid公司产品。其余试剂购于国药集团化学试剂有限公司,北京化工厂等。
2.3 DNA操作方法 2.3.1 一般DNA操作方法感受态细胞制备和转化等基本基因操作技术参照《分子克隆实验指南》[19],基因组提取、DNA酶切、连接、PCR等技术参照供应商提供的试剂盒说明书进行操作。
2.3.2 基因过表达菌株的构建根据大肠杆菌metA、metC、metL、cysE、dcm、thrA、yeaS、yieH基因序列,设计引物(表 2)、扩增基因并插入pDHC29的限制酶切位点,得到如表 1所示的重组质粒pDHm1、pDHm2、pDHm3、pDHm4、pDHm5、pDHm6、pDHm7、pDHm8。其中pDHmx携带基因metA、metC、yeaS,基因之间添加了核糖体结合位点TAAGGAGG及TCACACAGGAAAG,pDHmy携带基因cysE、yeaS,基因之间添加了核糖体结合位点TAAGGAGG。所有质粒均测序验证。
2.3.3 基因缺失菌株的构建采用一步敲除法[20]。简要步骤如下:以JW3909-1(ΔmetJ)、JW0002-3(ΔthrB)为供体菌,扩增含有相应敲除基因的DNA片段,转入携带辅助质粒pKD46的MG1655中,以卡那霉素抗性为筛选标记,即可获得相应基因缺陷型的大肠杆菌菌株;将pCP20导入重组菌,30℃培养2 h,然后升温至42℃培养12~16 h去除pCP20,可去除基因组中的卡那霉素抗性基因。构建的基因缺陷菌株如表 1所示。
2.4 培养基及培养条件取活化后单菌落至LB培养基中,37℃、190 r·min-1条件下摇瓶振荡培养18 h至OD 600 nm 2~4,按1%(V)的接种量转接到装有50 mL的1.5倍浓度LB发酵培养基(添加5 g·L-1 MgSO4及10 g·L-1 CaCO3)的250 mL三角瓶中,继续培养6 h直至OD600约为0.6,加入5 g·L-1葡萄糖及0.8 mmol·L-1 IPTG诱导,33℃、190 r·min-1条件下继续培养,从此时计为0 h,每隔8 h取样分析,至第32 h发酵结束。
2.5 分析方法发酵液样品经衍生化处理后采用HPLC法测定蛋氨酸浓度[21]。简要步骤如下:取发酵液1.5 mL,5000 r·min-1离心2 min,取上清液200 μL加入同样体积的水稀释,加入200 μL衍生化试剂邻苯二甲醛(OPA)混匀,2 min后加入500 μL硼酸盐缓冲液终止反应。采用岛津LC-15C型HPLC检测,检测条件为:流动相为磷酸盐:甲醇:乙腈=7:2.2:0.8,流速1.2 mL·min-1,色谱柱Purospher®STAR LP RP-18 endcapped(4.6 mm×250 mm,5 μm),进样体积20 μL;柱温55℃;检测器为紫外检测器(SPD-15C)。经独立重复试验验证,本分析方法标准曲线稳定,决定系数(R2)值为0.9995,在蛋氨酸0.05至0.8 g·L-1阈值内具有稳定的检测结果。
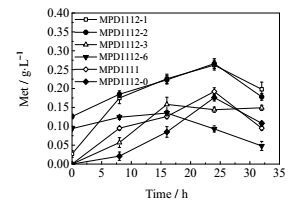
3 实验结果与讨论 3.1 蛋氨酸合成关键酶对蛋氨酸产量的影响大肠杆菌中存在一个L-蛋氨酸合成途径的全局阻遏蛋白MetJ,它以二聚体的形式识别并结合到DNA上一段共有的8 bp的DNA回文序列上[22],并与S-腺苷-蛋氨酸共同作用阻遏蛋氨酸合成途径的运行[23, 24]。大肠杆菌敲除阻遏基因metJ后,菌株MPD1111可以积累蛋氨酸,浓度为0.20 g·L-1 (图 2)。蛋氨酸合成途径的中间代谢物高丝氨酸在高丝氨酸激酶(thrB)等作用下合成苏氨酸最终合成异亮氨酸。为考察苏氨酸合成途径对蛋氨酸合成的影响,作者敲除了thrB,蛋氨酸积累的浓度为0.18 g·L-1,未能有效提高菌株合成蛋氨酸能力。分析原因,可能是苏氨酸为必需氨基酸,敲除其合成途径的关键基因会影响菌株的全局代谢,不利于蛋氨酸的积累。
|
图 2 过量表达蛋氨酸合成途径中关键基因对蛋氨酸合成的影响 Fig.2 Effects of overexpressing of key enzyme genes in methionine pathway on methionine production |
从葡萄糖到蛋氨酸的合成过程中主要合成酶为天冬氨酸激酶Ⅰ(thrA)、天冬氨酸激酶Ⅱ(metL)、高丝氨酸酰基转移酶(metA)、胱硫醚水解酶(metC)。为了强化蛋氨酸的主流代谢途径,使代谢流更多地引向蛋氨酸合成途径,以菌株MPD1112作为出发菌株,分别过表达这四个基因(图 1中a、b、c、d),得到对应菌株MPD1112-6,MPD1112-3,MPD1112-1,MPD1112-2。从图 2可以看出,过量表达metA、metC基因的菌株蛋氨酸产量均达到了0.26 g·L-1,表明metA和metC的过表达都对蛋氨酸积累起着很大作用。Fernández等[26]构建的metC蛋白过表达菌株能少量合成蛋氨酸,并发现metC基因与下游cysK基因(推断其编码半胱氨酸合酶)共转录,说明强化metC表达可能会强化半胱氨酸途径,利于蛋氨酸的合成。
天冬氨酸激酶是蛋基酸合成途径的主要合成酶,天冬氨酸激酶Ⅰ受到苏氨酸的抑制作用并且它的合成受苏氨酸和异亮氨酸阻遏。天冬氨酸激酶Ⅱ受蛋氨酸的抑制及阻遏作用[27]。天冬氨酸激酶Ⅰ(thrA)和天冬氨酸激酶Ⅱ(metL)的过表达菌株MPD1112-6,MPD1112-3蛋氨酸的发酵产量分别为0.13 g·L-1、0.16 g·L-1 (图 2),均低于对照组MPD1112-0的发酵蛋氨酸浓度0.18 g·L-1,可见天冬氨酸激酶的过表达对蛋氨酸积累影响较小。
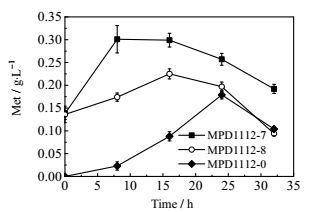
3.2 蛋氨酸转运对蛋氨酸合成的影响大肠杆菌种蛋氨酸的代谢合成存在反馈抑制机制,即胞内过度积累的蛋氨酸会抑制蛋氨酸的合成。因此,为了解除蛋氨酸的反馈抑制,作者在基础菌株MPD1112-0的基础上分别过表达了 E. coli MG1655中存在的两个蛋氨酸转运蛋白基因yeaS、yieH,得到相应菌株MPD1112-7、MPD1112-8。Kutukova等[28]研究表明过量表达属于RhtB转运蛋白家族的YeaS蛋白,会弱化菌体胞内蛋氨酸、亮氨酸等氨基酸及其类似物的反馈调节对蛋氨酸合成的影响。Kadner等[29]通过强化精氨酸转运也可使精氨酸产量提高到19.3 g·L-1。本实验选取了已知与蛋氨酸转运有明显关联的基因yeaS、yieH,分别过表达来考察强化蛋氨酸转运对蛋氨酸合成的影响。发酵结果如图 3,菌株MPD1112-7的蛋氨酸发酵产量为0.30 g·L-1,菌株MPD1112-8的蛋氨酸发酵产量为0.23 g·L-1,表明强化转运过程可以促进蛋氨酸的积累。在图 3中,与本文中其他菌株相比,菌株MPD1112-7发酵产物峰提前,最可能的原因是由于过量表达转运蛋白yeaS基因导致菌体细胞膜对于蛋氨酸的通透性改变,使得胞内蛋氨酸过早的外排至发酵液中。
|
图 3 蛋氨酸转运对蛋氨酸合成的影响 Fig.3 Effects of methionine transportation on methionine production |
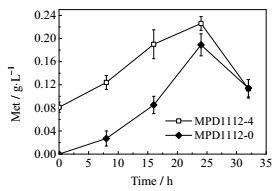
作为有机体必须氨基酸的蛋氨酸是唯一的含硫氨基酸,硫的引入则是以半胱氨酸的代谢产物为前体物质。通过代谢途径分析和已有研究可知,催化此前体物质生成的关键基因为丝氨酸乙酰转移酶(cysE)。半胱氨酸为蛋氨酸的合成提供硫,强化硫同化途径有利于蛋氨酸的合成[27, 30]。通过过量表达cysE基因考察半胱氨酸途径对蛋氨酸合成的影响,结果如图 4所示。菌株MPD1112-4的蛋氨酸发酵产量为0.22 g·L-1,表明强化半胱氨酸途径对蛋氨酸合成有促进作用。有研究认为减少硫同化过程中的能量消耗(如以气态甲硫醇或液态二甲基-二硫醚代替无机硫),有可能进一步提高蛋氨酸的产量[31]。菌株MPD1112-4产物出现最大值在发酵诱导后24 h出现,随后蛋氨酸产量大量减少,减少幅度较其他菌株更大,可见重组菌株MPD1112-4与其他重组菌株相比,对营养缺乏的耐受性更差一些。
|
图 4 强化半胱氨酸途径对蛋氨酸合成的影响 Fig.4 Effects of cysteine pathway on methionine production |
蛋氨酸循环(methionine cycle)主要包括如下几步反应,蛋氨酸在腺苷蛋氨酸合成酶的作用下与ATP反应生成S-腺苷蛋氨酸(SAM),SAM转出甲基后形成S-腺苷同型半胱氨酸(S-adenosyl homocystine,SAH),SAH水解释放出腺苷形成同型半胱氨酸(homocystine,hCys),hCys接受四氢叶酸提供的甲基再次生成蛋氨酸。通过过量表达循环中的关键酶DNA胞嘧啶转甲基酶(DCM)(图 1),考察蛋氨酸循环对蛋氨酸合成的影响,结果如图 5所示。过量表达DCM后菌株MPD1112-5的蛋氨酸发酵产量为0.20 g·L-1,略高于对照组。过量表达DCM可使蛋氨酸前体物质同型半胱氨酸再次生成,但有研究表明DCM的甲基化作用与大肠杆菌的许多限制系统有关[32],过表达DCM会消耗菌体能量而影响菌体生长代谢,影响发酵过程中蛋氨酸的积累。
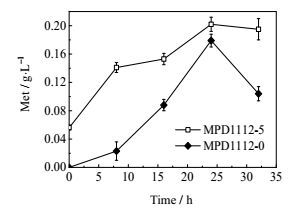
|
图 5 蛋氨酸循环对蛋氨酸合成的影响 Fig.5 Effects of methionine recycle pathway on methionine production |
根据以上研究,设计了两组大肠杆菌蛋氨酸合成途径优化方案:一是强化蛋氨酸合成途径和促进转运蛋白对蛋氨酸外排过程(菌株MPD1111-1),二是强化蛋氨酸合成途径和半胱氨酸合成途径(菌株MPD1111-2)。如图 6所示,菌株MPD111-1、MPD1111-2蛋氨酸发酵产量分别为0.40 g·L-1,0.37 g·L-1。表明通过对代谢网络理性设计可显著提高重组大肠杆菌合成蛋氨酸的能力。但在发酵后期,重组菌株皆出现产量下降的问题,可能原因是由于重组菌株为苏氨酸缺陷菌株,菌株本身代谢平衡受到影响,对环境耐受性变差;也可能是发酵后期菌液营养不足,蛋氨酸本身的产量较低,在后期重被菌体吸收用于自身代谢。在今后的研究中可增加营养物质浓度,适当添加苏氨酸以补充苏氨酸缺陷菌株的营养物质。大肠杆菌向胞内转运蛋氨酸的系统可适当弱化,以防止蛋氨酸分泌到胞外后不能累积而重回胞内。在蛋氨酸合成硫引入途径中,结果显示cysE过表达菌株产量偏低,可进一步通过加强无机硫到胞内的转运强化此途径,进而提高蛋氨酸的积累。
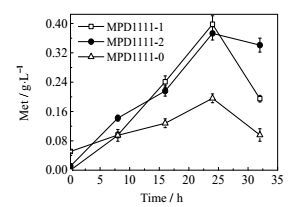
|
图 6 蛋氨酸合成途径优化对大肠杆菌合成蛋氨酸的影响 Fig.6 Effects of pathway optimization on methionine production by engineered E. coli |
本研究通过敲除蛋氨酸途径的阻遏蛋白基因metJ及苏氨酸合成途径中高丝氨酸激酶的编码基因thrB,部分解除了蛋氨酸合成的反馈阻遏,考察了蛋氨酸合成关键反应、蛋氨酸转运蛋白,以及与蛋氨酸合成途径密切相关的苏氨酸合成途径、蛋氨酸循环途径等不同因素对蛋氨酸合成的影响,优化了大肠杆菌代谢网络途径,得到了菌株MPD1111-1、MPD1111-2,发酵后蛋氨酸产量分别是0.40 g·L-1,0.37 g·L-1,为以后进一步的构建蛋氨酸高产菌株奠定了基础。
| [1] | Chaiyapoom B. Role of dietary methionine in poultry production[J]. British Poultry Science , 2009, 46(3): 169-179. DOI:10.2141/jpsa.46.169. |
| [2] | Rama Rao S V, Praharaj N K, Ramasubba Reddy V, et al. Interaction between genotype and dietary concentrations of methionine for immune function in commercial broilers[J]. British Poultry Science , 2003, 44(44): 104-12. |
| [3] | Hickling D, Guenter W, Jackson M E. The effects of dietary methionine and lysine on broiler chicken performance and breast meat yield[J]. Canadian Journal of Animal Science , 1990, 70(2): 673-678. DOI:10.4141/cjas90-079. |
| [4] | Gugołek A, Wyczling T, Janiszewski P, et al. The effect of dietary methionine levels on the performance parameters of arctic foxes (Vulpes Lagopus)[J]. Annals of Animal Science , 2012, 12(3): 393-401. |
| [5] | Leuchtenberger W. Amino acids-technical production and use:vol.6[M]. Weinheim:Wiley-VCH Verlag GmbH, 2008:465-502. |
| [6] | Goldfarb A S. Organic chemicals manufacturing hazards[M]. Ann Arbor:Ann Arbor Scnence, 1981:115-194. |
| [7] | Pham C B, Galvez F C F, Padolina W G, et al. Methionine production by batch fermentation from various carbohydrates[J]. ASEAN Food Journal , 1992, 7: 34-37. |
| [8] | Odunfa S A, Adeniran S A, Teniola O D, et al. Evaluation of lysine and methionine production in some lactobacilli and yeasts from Ogi[J]. International Journal of Food Microbiology , 2001, 63(1-2): 159-163. DOI:10.1016/S0168-1605(00)00320-2. |
| [9] | Kase H, Nakayama K. L-methionine production by methionine analog-resistant mutants of Corynebacterium glutamicum[J]. Agricultural & Biological Chemistry , 1975, 39(1): 153-160. |
| [10] | Chattopadhyay M K, Ghosh A K, Sengupta S, et al. Threonine analogue resistant mutants of Escherichia coli, K-12[J]. Biotechnology Letters , 1995, 17(6): 567-570. DOI:10.1007/BF00129378. |
| [11] | Nakamori S, Kobayashi S, Nishimura T, et al. Mechanism of l-methionine overproduction by Escherichia coli:the replacement of Ser-54 by Asn in the MetJ protein causes the derepression of l-methionine biosynthetic enzymes[J]. Applied Microbiology & Biotechnology , 1999, 52(2): 179-185. |
| [12] | Somers W S. Crystal structures of methionine repressor of E. coli and its complex with operator[D]. Leeds:University of Leeds, 1990. |
| [13] | Augustus A M, Reardon P N, Spicer L D. MetJ repressor interactions with DNA probed by in-cell NMR[J]. Proceedings of the National Academy of Sciences of the United States of America , 2009, 106(13): 5065-5069. DOI:10.1073/pnas.0811130106. |
| [14] | Mordukhova E A, Lee H S, Pan J G. Improved thermostability and acetic acid tolerance of Escherichia coli via directed evolution of homoserine o-succinyltransferase[J]. Applied & Environmental Microbiology , 2008, 74(74): 7660-7668. |
| [15] | Maxon M E, Redfield B, Cai X Y, et al. Regulation of methionine synthesis in Escherichia coli:effect of the MetR protein on the expression of the metE and metR genes[J]. Proceedings of the National Academy of Sciences , 1989, 86(1): 85-89. DOI:10.1073/pnas.86.1.85. |
| [16] | Bolten C J, Schröder H, Dickschat J, et al. Towards methionine overproduction in Corynebacterium glutamicum——methanethiol and dimethyldisulfide as reduced sulfur sources[J]. Journal of Microbiology & Biotechnology , 2010, 20(8): 1196-1203. |
| [17] | Usuda Y, Kurahashi O. Effects of deregulation of methionine Biosynthesis on methionine excretion in Escherichia coli[J]. Applied & Environmental Microbiology , 2005, 71(6): 3228-3234. |
| [18] | Schneider F, Molck S, Bathe B. Process for the fermentative production of sulphurous amino acids:WO, 098042[P]. 2012-07-26. |
| [19] | Sambrook J, Fritsch E F, Maniatis T. Molecular cloning:a laboratory manual[J]. Immunology , 2001, 49(1): 895-909. |
| [20] | Li M, Gu P, Kang J, et al. Extending homologous sequence based on the single gene mutants by one-step PCR for efficient multiple gene knockouts[J]. Folia Microbiologica , 2012, 57(3): 209-214. DOI:10.1007/s12223-012-0111-z. |
| [21] | Cooper J D H, Ogden G, Mcintosh J, et al. The stability of the o-phthalaldehyde/2-mercaptoethanol derivatives of amino acids:an investigation using high-pressure liquid chromatography with a precolumn derivatization technique[J]. Analytical Biochemistry , 1984, 142(1): 98-102. DOI:10.1016/0003-2697(84)90522-0. |
| [22] | Somers W S, Phillips S E. Crystal structure of the met repressor-operator complex at 2.8 resolution reveals DNA recognition by beta-strands[J]. Nature , 1992, 359(6394): 387-393. DOI:10.1038/359387a0. |
| [23] | Shoeman R, Redfield B, Coleman T, et al. Regulation of methionine synthesis in Escherichia coli:effect of metJ gene product and S-adenosylmethionine on the expression of the metF gene[J]. Proceedings of the National Academy of Sciences , 1985, 82(11): 3601-3605. DOI:10.1073/pnas.82.11.3601. |
| [24] | Shoeman R, Redfield B, Coleman T, et al. Regulation of methionine synthesis in Escherichia coli:effect of metJ gene product and S-adenosylmethionine on the in vitro expression of metB, metC and metJ genes[J]. Biochemical & Biophysical Research Communications , 1985, 133: 731-739. |
| [25] | Rowbury R J, Woods D D. Repression by methionine of cystathionine formation in Escherichia coli[J]. Journal of General Microbiology , 1964, 35(1): 145-158. DOI:10.1099/00221287-35-1-145. |
| [26] | Fernández M, Doesburg W V, Rutten G A M, et al. Molecular and functional analyses of the metC gene of lactococcus lactis, encoding cystathionine β-lyase[J]. Applied & Environmental Microbiology , 2000, 66(1): 42-48. |
| [27] | Herrmann K M, Somerville R L. Amino acids:biosynthesis and genetic regulation:vol.3[M]. New York:Addison Wesley, 1983. |
| [28] | Kutukova E A, Livshits V A, Altman I P, et al. The yeaS (leuE) gene of Escherichia coli, encodes an exporter of leucine, and the Lrp protein regulates its expression[J]. Febs Letters , 2005, 579(21): 4629-4634. DOI:10.1016/j.febslet.2005.07.031. |
| [29] | Kiryukhin M Y, Gusyatiner M M. A method for producing an l-amino acid using a bacterium of the enterobacteriaceae family with enhanced expression of the bssr gene:WO, EP, 2, 596, 137[P]. 2012-01-26. |
| [30] | Kawano Y, Ohtsu I, Ai T, et al. Involvement of the yciW, gene in l-cysteine and l-methionine metabolism in Escherichia coli[J]. Journal of Bioscience & Bioengineering , 2015, 119(3): 310-313. |
| [31] | Bolten C J, Schrder H, Dickschat J, et al. Towards methionine overproduction in Corynebacterium glutamicum——methanethiol and dimethyldisulfide as reduced sulfur sources[J]. Journal of Microbiology & Biotechnology , 2010, 20(8): 1196-1203. |
| [32] | Palmer B R, Marinus M G. The dam and dcm strains of Escherichia coli-a review[J]. Gene , 1994, 143(1): 1-12. DOI:10.1016/0378-1119(94)90597-5. |




