随着城市化和工业化的快速发展,挥发性有机化合物(VOCs)的排放量不断增加[1-2]。酯类化合物,比如乙酸乙酯(EA)作为一类重要的有机溶剂,广泛应用于包装印刷、胶黏剂、塑料、电子电路等行业,其挥发和泄漏通常会引起光化学雾霾,并对人体中枢神经造成严重损害[3-4]。目前,催化燃烧法由于净化效率高、无二次污染、能耗低等特点,成为酯类挥发性污染物处理的有效方法之一[5]。VOCs催化燃烧的关键在于高效催化剂的设计和开发。通常VOCs催化燃烧的材料可以分为3类:负载型贵金属催化剂、固体酸催化剂以及非贵金属氧化物催化剂。
其中,非贵金属氧化物催化剂因具有良好的抗中毒能力和相对较低的成本而被广泛用于酯类挥发性污染物的处理,尤其是过渡金属氧化物催化剂,比如Mn、Cu、Ce、Ti、Fe等氧化物[6-9]。Yang等[6]研究发现CeO2-ZrO2修饰的TiO2载体显著改善了CuO的分散性,从而提高了乙酸乙酯催化燃烧活性,并抑制了乙醇和乙醛等副产物的形成。Ma等[7]报道了在较低温度下煅烧的CeCuOx催化剂,由于其较高的表面积和丰富的多孔通道表现出较高的乙酸乙酯催化燃烧活性,同时良好的孔结构也促进了反应物和产物的扩散。然而,近年来大多数研究的重点都集中在如何提高金属氧化物催化剂的活性以及材料本身的设计(形貌控制、表界面改性等),缺乏对催化剂表面特性和酯类化合物催化燃烧性能关系的研究。对于酯类化合物而言,其在催化燃烧过程中不仅会发生氧化反应,而且还会发生水解反应。水解反应会衍生出更多的副产物,比如乙醇、乙酸、乙醛和丙酮等,同时,表面吸附的水解产物(乙酸盐/乙醇盐)也会进一步影响后续的氧化过程。酯类化合物的表面水解以及乙酸盐/乙醇盐等吸附产物的移除取决于催化剂的表面特性[8]。因此,深入理解金属氧化物催化剂表面性质对水解−氧化过程的影响,对开发和设计用于高效燃烧酯类挥发性有机污染物催化剂具有重要的指导意义。
因此,本研究选用乙酸乙酯作为酯类挥发性污染物的模型分子,通过简单的热解法制备了一系列金属氧化物MOx(M = Ce、Co、Al、Mg、V、W)催化剂,通过不同的结构表征以及原位漫反射红外光谱技术,探究它们表面性质与EA催化燃烧性能之间的关系。阐明了最优性能的CeO2催化剂上EA水解,表面水解产物移除与表面羟基、表面酸性、表面晶格氧迁移能力之间的关系。
2 实验(材料与方法) 2.1 实验材料与仪器主要试剂:Ce(NO3)3·6H2O(分析纯(AR),国药集团化学试剂公司);Co(NO3)3·6H2O(AR,国药集团化学试剂公司);Mg(NO3)2·6H2O(AR,国药集团化学试剂公司);Al(NO3)3·9H2O(AR,阿拉丁化学试剂公司);NH4VO3(质量分数w=99%,麦克林化学试剂公司);(NH4)6H2W12O40·xH2O(w=99.99%,阿拉丁化学试剂公司)。
主要仪器:GC9790型气相色谱仪(FID检测器,浙江温岭福立分析仪器有限公司);100系列KDSl20型微量注射泵(美国Stoelting公司);CDMC-21系列色谱数据处理工作站(上海市计算机研究所);D07系列质量流量控制器(北京七星华创电子股份有限公司)。
2.2 催化剂制备直接热解法:首先取3.0 g金属M前驱体,其中V使用偏钒酸铵,W使用偏钨酸铵,其余的金属离子M(M= Co、Ce、Al、Mg)全部使用金属硝酸盐,然后将前驱体研磨后放入马弗炉,500 ℃空气气氛中焙烧2 h,即可得到不同MOx催化剂。由于是在高温空气条件下焙烧,所得MOx为形态最稳定的金属氧化物。
2.3 结构表征采用Rigaku D/Max-RC粉末衍射仪(波长λ=1.540 6×10−10 m)测样品的XRD图,Cu Kα辐射,管电压为40 kV,管电流为100 mA,发射狭缝为(1/6)°,接收狭缝为0.3 mm,扫描范围为10°~90°,扫描速率为5 (°)·min−1,步长为0.02°。
催化剂的X射线光电子能谱(XPS,PHI5000 VersaProbe,日本ULVAC-PHI公司)通过Perkin-Elmer PHI 5000 CESCA系统测定,采用Mg靶(光子能量为1 253.6 eV)。数据处理采用Augerscan3.1软件,以C 1s = 284.6 eV为基准校正结合能。
N2吸/脱附量等温线的测试,由Micromeritics ASAP 2020型分析仪在液氮温度(77 K)下进行。样品测试前需在110 ℃下脱气1 h进行预处理。
称取200 mg粒径为0.3~0.5 mm的样品置于U形石英管中,加热至100 ℃,氮气吹扫1 h。然后气流切换为H2体积分数为5% 的H2/Ar混合气流(30 mL·min−1)稳定2 h,以10 ℃·min−1速率从50 ℃升温至700 ℃,采用TCD检测器色谱记录氢气的消耗。根据温度-时间与时间-TCD信号得出H2-TPR的图谱(TCD信号与温度的曲线)。
将200 mg粒径为0.3~0.5 mm的样品置于U形石英微反应器中。首先在450 ℃下使用30 mL·min−1的N2进行0.5 h的预处理,以去除催化剂表面吸附的水和有机物。随后继续使用30 mL·min−1的N2吹扫,直至样品冷却至100 ℃后关闭N2。在100 ℃下通入30 mL·min−1的NH3直至吸附饱和,然后关闭NH3。随后在100 ℃下用N2吹扫2 h以去除未吸附或弱吸附的NH3。将样品在30 mL·min−1的N2气流中以3 ℃·min−1的速率升温至500 ℃,利用TCD检测器色谱记录释放的NH3信号值。最终绘制出NH3–TPD图,展示TCD信号值与温度之间的关系。
2.4 原位漫反射红外光谱原位漫反射红外测试是在Thermo Scientific Nicolet iS50傅里叶变换红外装置上完成的,该装置配备液氮冷却的MCT检测器,扫描范围为4 000~800 cm−1。具体的实验步骤如下:称量30 mg粒径为0.106~0.125 mm的催化剂样品置于铺有石英砂的原位池上层。首先对催化剂进行预处理,在300 ℃下采用流速为40 mL·min−1 Ar和10 mL·min−1 O2的混合气体处理0.5 h,去除催化剂表面吸附的水和有机物。然后降温至50 ℃稳定后,采集样品背景。由微量进样泵将EA引入汽化室,通过混合气体(40 mL·min−1 Ar和10 mL·min−1 O2)将其带入原位池,其质量浓度控制在4 000 mg·m−3。同时,将原位池温度升至设定温度(50~300 ℃),并在每个温度下维持30 min直至吸附饱和。最后,采集不同温度下样品的漫反射信号,每个温度点采集3次,最后获得EA氧化的原位红外谱图。
2.5 EA的降解及其产物测定实验采用固定床石英微反应器(内径为5 mm)进行EA催化燃烧活性测试,实验系统如图 1所示。催化剂用量为200 mg,粒径为0.3~0.5 mm。由微量进样泵将EA引入汽化室,通过混合气体(80 mL·min−1 N2和20 mL·min−1 O2)将其带入石英微反应器中,其质量浓度控制在4 000 mg·m−3。混合气的空速为30 000 h−1。通过气相色谱(GC)对反应后的EA和副产物进行定量分析(标准曲线法)。EA的转化率(
| $ X = \frac{{{\rho _{\text{i}}} - {\rho _{\text{O}}}}}{{{\rho _{\text{i}}}}} \times 100\% $ | (1) |
| $ S = \frac{{\rho (\mathrm{C{O_2}})}}{{4 \times {\rho _{\text{O}}} \times X}} \times 100\% $ | (2) |
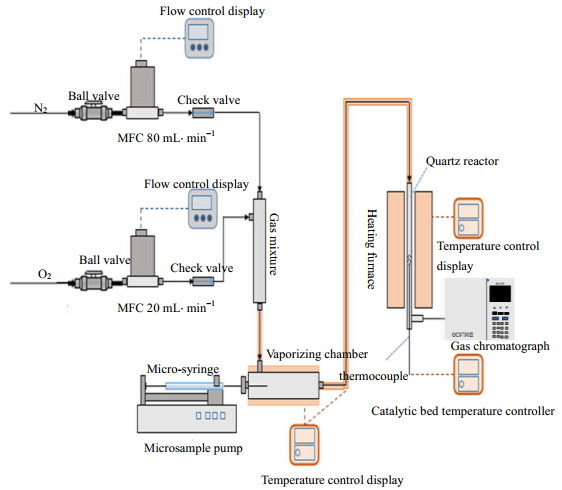
|
图 1 EA催化燃烧实验系统 Fig.1 Schematic diagram of the experimental setup for system of EA catalytic combustion |
式中:X为EA的转化率,%;
首先通过X射线粉末衍射(XRD)对直接热解法制备的催化剂进行晶体结构的研究,如图 2(a)所示。CeO2催化剂具有4个较为明显的衍射峰,分别为28.5°、33.1°、47.5°、56.3°,归属于立方萤石结构的(111)、(200)、(220)、和(311)晶面(PDF# 78-0694)[8]。WO3催化剂具有多个衍射峰,为混合晶相,其中5个明显的衍射峰,位于14.0°、24.1°、28.2°、33.4°、49.8°,分别归属于WO3六方相的(100)、(101)、(200)、(111)、(301) 晶面(PDF#75-2187)[9],另外位于24.1°、28.2°的两个峰,属于WO3单斜晶体的(002)、(112) 晶面(PDF#87-2386)[10]。Al2O3催化剂的衍射峰比较宽,说明其结晶度较低[11]。其他催化剂的特征衍射峰都对应于各自较为稳定的晶相[12-14]。图 2(b)呈现了MOx催化剂的N2吸附−脱附等温线。很明显,MgO、Al2O3和CeO2具有明显的回滞环,说明它们存在介孔结构,尤其是Al2O3具有最大的比表面积(105.2 m2·g−1)。
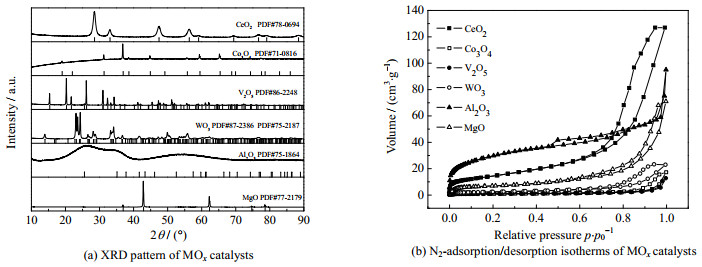
|
图 2 MOx催化剂的晶体结构与比表面积 Fig.2 Crystal structures and specific surface areas of MOx catalysts |
图 3(a)呈现了不同催化剂的O1s XPS光谱。从图中可以看出,CeO2和Co3O4的O1s光谱可以分为3个峰,分别归属于OⅠ(表面晶格氧)、OⅡ(表面吸附氧或表面氧空位)以及OⅢ(表面吸附的水或表面羟基)。OⅡ的出现,说明CeO2和Co3O4表面更容易形成氧空位,具有更优的表面晶格氧的迁移能力[15-17]。同时,CeO2和Co3O4的表面晶格氧(OⅠ)结合能较低,进一步说明了其表面晶格氧更容易逃逸。另外,Al2O3具有丰富的表面羟基(OⅢ峰面积较大),MgO增加的OⅢ可能与其强吸水性有关。
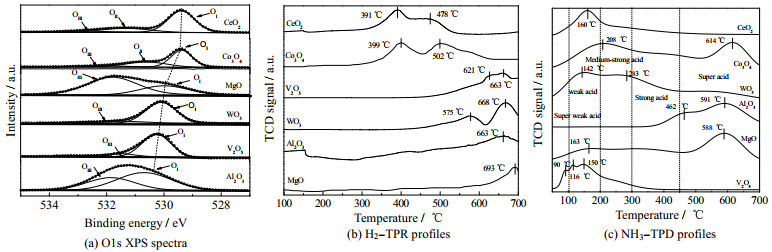
|
图 3 MOx催化剂的表面氧化还原性和表面酸性 Fig.3 Surface redox ability and surface acidity of MOx catalysts |
为了进一步研究催化剂的氧化还原能力,作者对其进行了H2−TPR实验。如图 3(b)所示,CeO2和Co3O4的H2−TPR呈现出2个较低温度的还原峰。以氧化铈为例,第1个还原峰在391 ℃下出现,归属于CeO2表面晶格氧的还原。其峰温度值越低,表明表面晶格氧的流动性越强,催化剂的氧化活性越强[15]。第2个还原峰在478 ℃出现,归因于其体相晶格氧的还原。其他金属氧化物的表面晶格氧或体相晶格氧还原温度都超过了500 ℃。总的来说,具有变价离子的金属氧化物,如Co3O4,CeO2,具有更低的还原峰,说明它们具有更好的氧化还原能力和晶格氧的迁移性[16-17],这与XPS的结论一致(图 3(a));而W[18],V[17],Al[19],Mg[20]氧化物的表面晶格氧还原比较困难,晶格氧流动以及氧空位的形成比较困难。对于催化燃烧反应,晶格氧的流动性以及氧的交换能力是非常重要的。
在VOCs催化燃烧过程中,催化剂的表面酸位点(如表面L酸,B酸等)对VOCs分子的吸附、解离和脱附起着重要作用[21]。本实验通过NH3−TPD研究了催化剂的表面酸性,结果如图 3(c)所示。CeO2催化剂在位于160 ℃左右有1个明显的脱附峰,可归因于吸附在Ce4+/Ce3+和表面酸性羟基上的NH3解吸。这一结果表明CeO2表面主要存在弱酸性位点[22-23]。V2O5催化剂也仅仅具有弱酸或者中强酸位点。但是Co3O4、Al2O3和MgO具有更强的酸位点(强酸或超强酸),其NH3解吸温度大于500 ℃。一般而言,丰富的强酸性,有利于表面碳键(如C─H,C─O)的活化和断裂。但是,酸度过强又会反过来阻碍具有孤对电子的Lewis碱性物种(如甲氧基、羧基等)的脱附,从而占据活性位点,阻碍反应的进一步进行。
3.3 MOx催化剂上EA催化燃烧的研究 3.3.1 MOx催化剂上EA催化燃烧的活性和CO2选择性图 4(a)、(b)分别呈现了不同金属氧化物上EA催化燃烧的活性和CO2选择性。结果表明,所有催化剂的EA转化率都随反应温度的升高而提高(图 4(a))。MOx催化剂的t20,t50和t90(转化率分别达到20%、50% 和90% 所需要的温度)总结在表 1中。根据t90结果,可以得出催化剂活性大小为:CeO2 > Co3O4 > V2O5 > WO3 > Al2O3 > MgO。CeO2、Co3O4的t90都小于250 ℃,这得益于它们优异的氧化还原性以及较强的表面晶格氧迁移能力(图 3(a)和图 3(b),XPS和H2-TPR结果)。其中CeO2活性更为突出(t90仅为189.3 ℃),可能与其较大的比表面积有关[24]。但是,比表面积的大小却不是活性的决定因素,比如Al2O3具有最大的比表面积(图 2(b)),但是其活性较差,说明EA催化燃烧的活性取决于催化剂的表面化学特性而非物理结构性质。V2O5、WO3、Al2O3、MgO的EA转化活性较低,甚至CO2的选择性在400 ℃时也难以达到90%。CeO2、Co3O4较高的CO2选择性与它们优越的深度氧化能力有关(XPS和H2-TPR结果)。
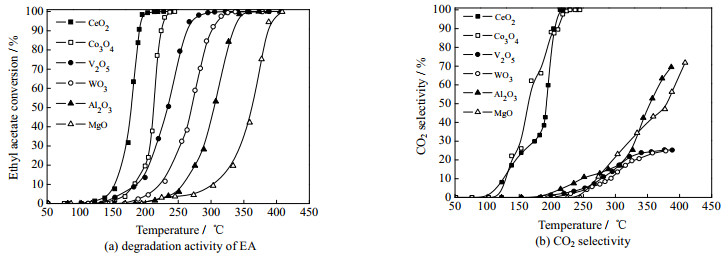
|
图 4 MOx催化剂的性能 Fig.4 Catalytic performance of MOx catalysts |
|
|
表 1 MOx催化剂上EA催化燃烧的活性数据 Table 1 Activity data of EA catalytic combustion on MOx catalysts |
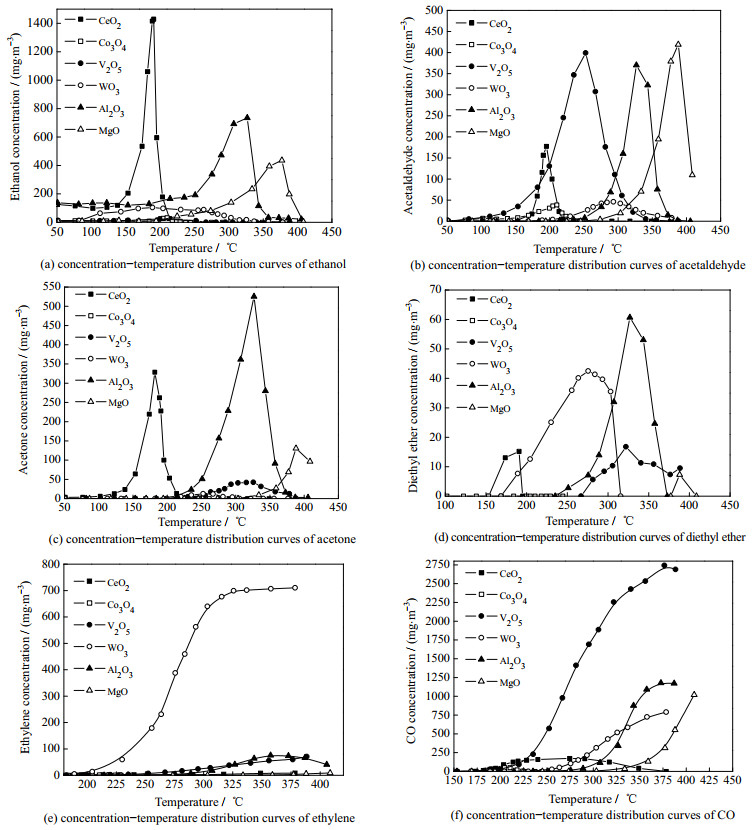
图 5(a)呈现了中间产物乙醇的浓度–温度分布曲线(火山型曲线)。乙醇只能来自EA的水解反应,即C─O单键的断裂。V2O5、Co3O4整个温度区间内(50~400 ℃,图 5(a))都呈现较低的乙醇浓度(< 41 mg·m−3);而MgO、Al2O3在高温区(> 250 ℃)内,图 5(a)呈现较高的乙醇浓度(极大浓度值大于410 mg·m−3),而且其乙醇的完全消失温度也较高(> 300 ℃)。尽管CeO2具有最大的乙醇浓度极值(接近1 438 mg·m−3),但乙醇的消失温度较低(< 250 ℃),这与其较好的中间产物深度氧化能力有关(XPS和H2-TPR结果)。根据文献[25-26],乙醇的生成和催化剂的表面羟基有关。MgO、Al2O3、CeO2在EA催化燃烧过程中会有更多的表面羟基参与(XPS结果,图 2(b)),本研究将在EA催化燃烧的原位红外光谱(DRIFTS,图 6)中进一步解释这一点。乙醛主要来自水解产物乙醇的氧化脱氢。WO3、Co3O4催化剂上乙醛的极大值质量浓度小于49 mg·m−3(图 5(b)),由于其本身乙醇的生成量就比较少(图 5(a)),从根源上减少了乙醛的生成。相反,Al2O3、MgO上能产生丰富的乙醇(图 5(a)),浓度大于410 mg·m−3),对应产生乙醛的极值浓度大于354 mg·m−3。但是,它们乙醛消失温度超过了350 ℃,这与其较差的深度氧化能力有关。V2O5表面羟基含量较少,生成的乙醇浓度低,但乙醛的浓度极值大于491 mg·m−3,这归因于V2O5被认为是良好的乙醇脱氢氧化催化剂[25-27]。CeO2上呈现了较低的乙醛极值浓度温度(接近200 ℃)及较低的完全降解温度(低于250 ℃)。乙醛在CeO2表面可以被迅速地氧化,这主要与CeO2优异的深度氧化能力有关[8]。EA催化燃烧原位红外光谱中(DRIFTS,图 6(a)),高温下CeO2表面未检测到乙醛的特征峰也说明了这一点。丙酮主要来自乙酸的酮化反应(图 5(c)),乙酸的酮化反应位点一般为催化剂表面的共轭酸−碱对[28]。CeO2上丙酮的最终消失温度低于250 ℃,这与其良好的氧化还原能力(图 3(b),H2-TPR)分不开。Al2O3的丙酮极值浓度大于518 mg·m−3,因为它是两性氧化物,既有酸性位,也有碱性位点[29]。Co3O4催化剂在整个温度区间都没有丙酮生成,V2O5的丙酮极值浓度不超过18 mg·m−3,基本可以忽略。中间产物乙醚来自乙醇的分子间脱水。从图 5(d)可以看出,只有Co3O4在EA催化燃烧过程中不产生乙醚,而CeO2的乙醚生成–消失温度区间很窄(173~200 ℃),说明乙醚在这两种催化剂上极不稳定,很容易被氧化。乙烯主要来自乙醇的分子间脱水反应。从图 5(e)中可以看出,除了Co3O4的乙烯浓度−温度分布曲线呈火山型外,其余金属氧化物的分布曲线都随着温度升高而升高。WO3呈现最大的乙烯转化浓度,高达710 mg·m−3)。因此,可以得出,Co3O4可以作为良好的乙烯降解催化剂,WO3反而可以作为优异的乙醇脱水生产乙烯的催化剂。需要说明的是,乙醚和乙烯产生的活性位点主要是催化剂表面的强酸位点(NH3−TPD结果),因此,Al2O3、WO3具有更高的乙醚和乙烯极值浓度。CO主要来自EA和其他中间产物的不完全氧化,主要和催化剂的氧化还原性能有关[30]。从图 5(f)中可以看出,只有CeO2、Co3O4的CO浓度–温度分布曲线呈火山型,其余的金属氧化物CO浓度都随温度上升而上升,其中,Co3O4催化剂上CO的极限浓度最低(< 62.5 mg·m−3),最终消失温度低于250 ℃,其通常被认为是优异的CO氧化催化剂[31-33]。V2O5在高温条件下CO的浓度值很高,400 ℃可以达到2 625 mg·m−3。
|
图 5 中间产物的浓度–温度分布曲线 Fig.5 Concentration−temperature distribution curves of intermediate products |
|
图 6 MOx催化剂上EA催化燃烧的原位DRIFTS光谱 Fig.6 In situ DRIFTS spectra of EA catalytic oxidation on the MOx catalyst |
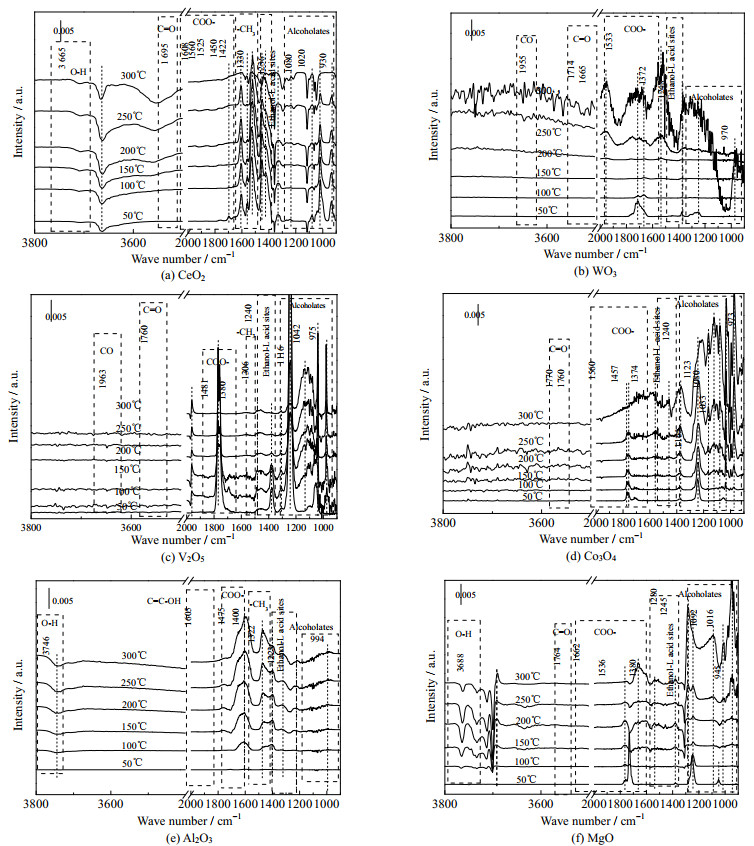
本研究进一步采用原位DRIFTS对EA催化燃烧过程中的表面吸附物种进行了检测(图 6)。氧气条件下,CeO2、Al2O3和MgO样品在3 500~3 800 cm−1出现了不同类型的羟基特征峰(图 6(a)、(e)、(f))[34-35],同时这些羟基的信号均为负值,表明这些氧化物表面羟基可以促进EA的水解而被消耗[34]。羟基的水解作用可以生成更多的乙醇,这与CeO2、Al2O3和MgO上显著的乙醇分布一致(图 5(a))。乙酸盐/乙醇盐(COO−,1 350~1 500 cm−1;─OCH2CH3,900~1 200 cm−1)是EA催化燃烧过程中主要的表面吸附物种[36],它们来自EA的水解以及中间产物(乙醇、乙醛、丙酮等)的进一步氧化。可以看出CeO2催化剂表面乙酸盐/乙醇盐的特征峰面积随温度的升高而减小(图 6(a)),说明表面乙酸盐/乙醇盐可以快速分解,归因于其表面优异的氧化还原能力(H2−TPR和XPS结果)。而V2O5、WO3、Co3O4、Al2O3和MgO催化剂出现相反的情况(图 6(b)~(f)),峰面积随温度升高而增大,说明乙酸盐/乙醇盐容易累积在表面,占据活性位点。1 224~1 280 cm−1归属于乙醇–L酸的特征峰[36],可以看出各催化剂都存在一定的乙醇吸附,尤其V2O5、Co3O4和MgO具有强烈的乙醇–L酸峰,进一步说明了强酸性(NH3-TPD)更容易累积路易斯碱性物种,如乙氧基团。Co3O4催化剂上乙醛和丙酮的特征峰(C═O,1 760 cm−1和1 770 cm−1)在高温300 ℃消失(图 6(b))。而WO3、MgO、V2O5、Al2O3能检测到明显的中间产物(醛/酮/烯醇(1 621~1 790 cm−1)和CO(1 800~2 100 cm−1))特征峰 [37-39],而且温度升高并不能减弱这些特征峰的强度(图 6(c)~(f))。其中V2O5上乙醛的特征峰强度最大,这要归因于其较弱的深度氧化能力和较强的乙醇脱氢氧化能力(乙醛浓度−温度分布曲线,图 5(b))。CeO2仅在50 ℃出现乙醛的吸附,说明低温水解产生的乙醇可以被快速氧化成乙醛。温度升高,乙醛又会被迅速氧化[8, 37]。总而言之,CeO2优异的深度氧化能力可以加快表面吸附物种的氧化分解,有利于表面活性位点的重生。
4 结论因此,根据以上结构表征、活性测试、产物分布以及原位红外光谱分析,可以得出:
(1) 具有变价离子的金属氧化物,比如CeO2、Co3O4,能表现出优异的EA转化活性和CO2选择性,这与它们优异的氧化还原性能有关。
(2) 非变价的氧化物,如MgO、Al2O3、WO3、V2O5等,其表面容易吸附乙醇、乙酸盐/乙醇盐等水解产物,从而占据活性位点。
(3) CeO2拥有最优的EA催化燃烧活性主要归因于其表面具有丰富的羟基,有利于EA的水解。同时,表面适度的酸性,减弱了乙醇等中间产物的强烈吸附。最重要的是其优异的表面晶格氧移动能力,有利于气相副产物以及表面吸附物种的快速氧化分解。
| [1] |
徐思遥, 李森, 彭东辉, 等. Cu-Co催化剂中Ce、La的添加对催化燃烧降解正庚烷性能的影响[J]. 高校化学工程学报, 2018, 32(5): 1153-1163. XU S Y, LI S, PENG D H, et al. Effects of Ce and La in Cu-Co catalysts on catalytic combustion of n-heptane[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(5): 1153-1163. |
| [2] |
马洪玺, 何双荣, 杨座国. 油烟气催化氧化净化过程研究[J]. 高校化学工程学报, 2019, 33(1): 228-236. MA H X, HE S R, YANG Z G. Study on catalytic combustion of cooking fume[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(1): 228-236. |
| [3] |
HE C, CHENG J, ZHANG X, et al. Recent advances in the catalytic oxidation of volatile organic compounds: A review based on pollutant sorts and sources[J]. Chemical Reviews, 2019, 119(7): 4471-4568. |
| [4] |
ZHAO Q, LI Y J, CHAI X L, et al. Interaction of inhalable volatile organic compounds and pulmonary surfactant: Potential hazards of VOCs exposure to lung[J]. Journal of Hazardous Materials, 2019, 369: 512-520. |
| [5] |
GUO Y L, WEN M C, LI G Y, et al. Recent advances in VOC elimination by catalytic oxidation technology onto various nanoparticles catalysts: A critical review[J]. Applied Catalysis B: Environmental, 2021, 281: 119447. |
| [6] |
YANG Y X, XU X L, SUN K P. A highly efficient copper supported catalyst for catalytic combustion of ethyl acetate[J]. Catalysis Communications, 2006, 7(10): 756-760. |
| [7] |
MA R H, SU X W, JIN L Y, et al. Preparation and characterizations of Ce-Cu-O monolithic catalysts for ethyl acetate catalytic combustion[J]. Journal of Rare Earths, 2010, 28(3): 383-386. |
| [8] |
SHEN Z D, GAO E H, MENG X Y, et al. Mechanistic insight into catalytic combustion of ethyl acetate on modified CeO2 nanobelts: Hydrolysis–oxidation process and shielding effect of acetates/alcoholates[J]. Environmental Science & Technology, 2023, 57(9): 3864-3874. |
| [9] |
YUAN H J, CHEN Y Q, YU F, et al. Hydrothermal synthesis and chromic properties of hexagonal WO3 nanowires[J]. Chinese Physics B, 2011, 20(3): 036103. |
| [10] |
KHATKO V, LLOBET E, VILANOVA X, et al. Gas sensing properties of nanoparticle indium-doped WO3 thick films[J]. Sensors and Actuators B: Chemical, 2005, 111/112: 45-51. |
| [11] |
MOHAMMED A A, KHODAIR Z T, KHADOM A A. Preparation and investigation of the structural properties of α-Al2O3 nanoparticles using the sol-gel method[J]. Chemical Data Collections, 2020, 29: 100531. |
| [12] |
REIKOWSKI F, MAROUN F, PACHECO I, et al. Operando surface X-ray diffraction studies of structurally defined Co3O4 and CoOOH thin films during oxygen evolution[J]. ACS Catalysis, 2019, 9(5): 3811-3821. |
| [13] |
DHACHAPALLY N, KALEVARU V N, MARTIN A. Ammoxidation of 2-methylpyrazine to 2-cyanopyrazine over Nb–V oxides: Marked effect of the Nb/V ratio on the catalytic performance[J]. Catalysis Science & Technology, 2014, 4(9): 3306-3316. |
| [14] |
SREENIVASULU K V, ROTTE N K, SRIKANTH V V S S, et al. Non-collinear ferromagnetic short range order in MgO decked multi-layered graphene[J]. Physical Chemistry Chemical Physics, 2017, 19(1): 854-862. |
| [15] |
LEE J, RYOU Y, CHAN X J, et al. How Pt interacts with CeO2 under the reducing and oxidizing environments at elevated temperature: The origin of improved thermal stability of Pt/CeO2 compared to CeO2[J]. The Journal of Physical Chemistry C, 2016, 120(45): 25870-25879. |
| [16] |
ZHAO T Q, GAO Q, LI H J, et al. Catalytic decomposition of N2O over Y-Co3O4 composite oxides prepared by one-step hydrothermal method[J]. Journal of Fuel Chemistry and Technology, 2019, 47(4): 446-454. |
| [17] |
LU S H, WANG F, CHEN C C, et al. Catalytic oxidation of formaldehyde over CeO2-Co3O4 catalysts[J]. Journal of Rare Earths, 2017, 35(9): 867-874. |
| [18] |
PENG Y, LI J H, CHEN L, et al. Alkali metal poisoning of a CeO2–WO3 catalyst used in the selective catalytic reduction of NOx with NH3: An experimental and theoretical study[J]. Environmental Science & Technology, 2012, 46(5): 2864-2869. |
| [19] |
BRODSKIY A, YASKEVICH V, KHUSSAIN B, et al. Studies of the reduction process of the Fe/γ-Al2O3 catalytic system[J]. EurAsian Journal of BioSciences, 2020, 14(1): 823-828. |
| [20] |
HU X C, WANG W W, SI R, et al. Hydrogen production via catalytic decomposition of NH3 using promoted MgO-supported ruthenium catalysts[J]. Science China Chemistry, 2019, 62(12): 1625-1633. |
| [21] |
CHEN X R, CHEN C L, XU N P, et al. Al- and Ga-promoted WO3/ZrO2 strong solid acid catalysts and their catalytic activities in n-butane isomerization[J]. Catalysis Today, 2004, 93/94/95: 129-134. |
| [22] |
黄秀兵, 王鹏, 陶进长, 等. CeO2修饰Mn-Fe-O复合材料及其NH3-SCR脱硝催化性能[J]. 无机材料学报, 2020, 35(5): 573-580. HUANG X B, WANG P, TAO J Z, et al. CeO2 modified Mn-Fe-O composites and their catalytic performance for NH3-SCR of NO[J]. Journal of Inorganic Materials, 2020, 35(5): 573-580. |
| [23] |
LI L L, JI J W, TAN W, et al. Enhancing low-temperature NH3-SCR performance of Fe–Mn/CeO2 catalyst by Al2O3 modification[J]. Journal of Rare Earths, 2022, 40(9): 1454-1461. |
| [24] |
SU Z A, SI W Z, LIU H, et al. Boosting the catalytic performance of CeO2 in toluene combustion via the Ce–Ce homogeneous interface[J]. Environmental Science & Technology, 2021, 55(18): 12630-12639. |
| [25] |
SUN Y G, LI N, XING X, et al. Catalytic oxidation performances of typical oxygenated volatile organic compounds (acetone and acetaldehyde) over MAlO (M = Mn, Co, Ni, Fe) hydrotalcite-derived oxides[J]. Catalysis Today, 2019, 327: 389-397. |
| [26] |
YANG Y, LI Y Z, ZHANG Q, et al. Novel photoactivation and solar-light-driven thermocatalysis on ε-MnO2 nanosheets lead to highly efficient catalytic abatement of ethyl acetate without acetaldehyde as unfavorable by-product[J]. Journal of Materials Chemistry A, 2018, 6(29): 14195-14206. |
| [27] |
TAYRABEKOVA S, MÄKI-ARVELA P, PEURLA M, et al. Catalytic dehydrogenation of ethanol into acetaldehyde and isobutanol using mono- and multicomponent copper catalysts[J]. Comptes Rendus Chimie, 2018, 21(3/4): 194-209. |
| [28] |
PSARRAS A C, MICHAILOF C M, ILIOPOULOU E F, et al. Acetic acid conversion reactions on basic and acidic catalysts under biomass fast pyrolysis conditions[J]. Molecular Catalysis, 2019, 465: 33-42. |
| [29] |
WANG F, JIANG J Z, WANG B. Recent in situ/operando spectroscopy studies of heterogeneous catalysis with reducible metal oxides as supports[J]. Catalysts, 2019, 9(5): 477. |
| [30] |
LAO Y J, JIANG X X, HUANG J, et al. Catalytic oxidation of ethyl acetate on Ce–Mn–O catalysts modified by La[J]. Rare Metals, 2021, 40(3): 547-554. |
| [31] |
DEY S, DHAL G C. The catalytic activity of cobalt nanoparticles for low-temperature oxidation of carbon monoxide[J]. Materials Today Chemistry, 2019, 14: 100198. |
| [32] |
ZHANG X D, LI H X, YANG Y, et al. Facile synthesis of new efficient Cu/MnO2 catalysts from used battery for CO oxidation[J]. Journal of Environmental Chemical Engineering, 2017, 5(5): 5179-5186. |
| [33] |
ZHANG X D, ZHANG X L, SONG L, et al. Enhanced catalytic performance for CO oxidation and preferential CO oxidation over CuO/CeO2 catalysts synthesized from metal organic framework: Effects of preparation methods[J]. International Journal of Hydrogen Energy, 2018, 43(39): 18279-18288. |
| [34] |
MAIRA A J, CORONADO J M, AUGUGLIARO V, et al. Fourier transform infrared study of the performance of nanostructured TiO2 particles for the photocatalytic oxidation of gaseous toluene[J]. Journal of Catalysis, 2001, 202(2): 413-420. |
| [35] |
PILKENTON S, HWANG S J, RAFTERY D. Ethanol photocatalysis on TiO2-coated optical microfiber, supported monolayer, and powdered catalysts: An in situ NMR study[J]. The Journal of Physical Chemistry B, 1999, 103(50): 11152-11160. |
| [36] |
MARTIN C, MARTIN I, RIVES V. Fourier-transform infrared study of the oxidation of ethene on MoO3/TiO2 catalysts doped with alkali metals[J]. Journal of the Chemical Society, Faraday Transactions, 1993, 89(22): 4131-4135. |
| [37] |
RODRÍGUEZ J L, PASTOR E, XIA X H, et al. Reaction intermediates of acetaldehyde oxidation on Pt(111) and Pt(100). An in situ FTIR study[J]. Langmuir, 2000, 16(12): 5479-5486. |
| [38] |
YEE A, MORRISON S J, IDRISS H. A study of the reactions of ethanol on CeO2 and Pd/CeO2 by steady state reactions, temperature programmed desorption, and in situ FT-IR[J]. Journal of Catalysis, 1999, 186(2): 279-295. |
| [39] |
YEE A, MORRISON S J, IDRISS H. The reactions of ethanol over M/CeO2 catalysts: Evidence of carbon–carbon bond dissociation at low temperatures over Rh/CeO2[J]. Catalysis Today, 2000, 63(2/3/4): 327-335. |




