椎间盘退行性疾病(degenerative disc disease;DDD)是引起老年人群慢性下腰背痛的主要原因,具有致残性。退变椎间盘内髓核细胞功能降低和数量减少,将导致Ⅱ型胶原、蛋白聚糖等细胞外基质大量丢失[1-2]。目前,对DDD治疗尚无良策,仅限于减轻症状和矫正畸形的被动保守创伤性治疗,而且效果欠佳[2-3]。椎间盘组织工程是近年来国内外生物治疗研究热点之一,通过模拟天然髓核组织结构特点,构建机械性能良好生物支架,在支架内包裹种子细胞及生物因子,用以修复退变髓核组织,恢复正常椎间盘功能,可为DDD治疗提供一种新的方法和策略。
尽管组织工程在临床试验中取得重大突破,但移植预成型支架引发的侵入性损伤和炎症反应等不可避免,大大限制其临床应用。可注射原位水凝胶,不仅能够克服这些缺陷,还能与周围组织衔接紧密,可用于修复形状复杂组织缺损[4-5],所形成三维多孔支架结构为细胞增殖、分化及细胞外基质的形成提供更好的机械支撑和生长环境[6-7],同时可兼具药物缓释载体的功能[8],在髓核再生领域受到广泛关注。
理想生物材料应来源于细胞外基质成分或其衍生物,且还能提供利于细胞黏附、增殖、分化及分泌细胞外基质的良好条件[9]。透明质酸(hyaluronic acid;HA)是一种可降解的生物相容性良好的天然高分子多糖物质[10],广泛存在于髓核及关节软骨内,是关节滑液和糖胺聚糖(glycosaminoglycans;GAGs)重要组成成分,广泛用于关节内注射治疗骨关节炎[11],具有促进细胞增殖及维持软骨细胞正常表型[12],有关研究表明HA水凝胶对于DDD修复治疗具有一定疗效[13]。壳聚糖(chitosan;CS)分子结构与GAG相似,是另一可用于修复NP及关节软骨的天然高分子材料[14]。由于壳聚糖具有良好的生物相容性、生物可降解性和很好的抗菌性,广泛用于药物缓释[15]。通过冷冻凝胶法制备的壳聚糖水凝胶生物支架更利于髓核细胞生长[16]。
选择合适生长因子对于组织再生同样至关重要。在2012年,一种新的小分子化合物kartogenin (KGN)被发现,它拥有极强的促软骨分化能力。能有效地促进间充质干细胞(mesenchymal stem cells,MSCs)向软骨细胞分化[17-18]。通过关节内注射KGN治疗小鼠骨关节炎可减缓软骨退化进程[19]。
本研究构建了一种机械强度类似天然髓核组织,生物相容性良好且包裹KGN分子的CS / HA水凝胶,对KGN持续稳定释放的同时,可促进脂肪干细胞(adipose-derived stem cell,ADSC)增殖及向髓核样细胞分化,促进工程化髓核样组织构建,为椎间盘退变治疗提供一种简单有效的技术方法。
2 实验(材料与方法) 2.1 整合KGN的CS / HA水凝胶制备壳聚糖CS(脱乙酰化90%,Sigma)溶解于0.1 mol·L-1盐酸制备2%CS溶液,用蒸馏水分别溶解GP(Sigma)和透明质酸HA(350 kDa,Huaxi Fureida)配制10% GP和1% HA,并将KGN分子溶解于10% GP。所有制备溶液4℃静置过夜,以除去气泡。随后在室温将2% CS,10% GP和1% HA按照不同体积比(6:3:1,5:3:2,4:3:3,3:3:4,2:3:5,1:3:6)分别制备总体积为5 mL共混溶液,且维持KGN浓度为50 μmol·L-1。
2.2 水凝胶物理化学特性检测使用Seven2Go pH测量计(Mettler Toledo)测量混合溶液的pH值。每组取4个样本,每个样本测量3次。在观察水凝胶表面结构之前,将水凝胶脱水、干燥、喷金后,置于扫描电子显微镜中(JCM-6000,JEOL)观察水凝胶表面及横截面形态结构。Alcian blue染色显示酸性黏多糖HA呈蓝色,评估水凝胶内HA与CS交联情况。水凝胶浸泡于0.5% alcian blue染液中轻轻震荡4 h,然后用2%的乙酸洗3遍,最后用PBS洗3遍。1 mL水凝胶成胶后称重,然后将水凝胶浸入5 mL PBS中,37℃浸泡12 h后,从溶液中取出水凝胶,用滤纸小心吸去表面多余的水分,称重.水凝胶溶胀性通过以下公式计算SR = (Ws-Wd)/ Wd式中,SR为溶胀度;Ws为溶胀12 h后水凝胶的重量;Wd为凝胶的初始重量。水凝胶制备完成后剪切成同样大小(直径6 mm,高度2 mm),无需PBS浸泡,室温条件下直接使用纳米拉伸测试系统(T150U UTM,Agilent)测量水凝胶杨氏模量, 每种水凝胶取3个平行样本,每个样本重复测量3次,得到平均杨氏模量。生物降解性评估:将冻干后的水凝胶(W0)浸润在3 mL酶溶液(100 U·mL-1透明质酸酶和10 mg·mL-1溶菌酶)中,37℃水浴,每隔一定时间,取出水凝胶,而后-80℃快速冷冻,-50℃下冻干并称重(Wt)绘出水浴时间-质量丢失曲线图。生物降解性计算公式为100%×(W0-Wt)/ W0。KGN体外释放动力学研究,将整合KGN分子水凝胶冷冻干燥后置于24孔培养板中滴加1 mL PBS。每隔一段时间(第1,2,3,4,5,6,7,8,10,14和16 d)收集PBS同时加入同体积的PBS。使用HPLC(Ultimate 3000,Dionex)光谱分析水凝胶中KGN释放量,每个时间点重复测量5次。
2.3 细胞生物相容性和细胞毒性检测GFP-SD大鼠从广东动物实验中心购得。根据本课题组改进的方法分离获得ADSC[20]。将GFP-ADSC以1×106个细胞·mL-1的浓度悬浮于CS / HA水凝胶溶液中混匀,接种到24孔微量培养板中,待其成胶后,添加1 mL生长培养基(含10%FBS的DMEM)。在37℃,5%CO2培养箱中培养14 d后,通过SEM观察水凝胶内细胞形态及分布特点,并对含有ADSC的水凝胶进行冷冻切片和H & E染色。
根据水凝胶细胞相容性实验结果,选择其中一(5:3:2)CS / HA水凝胶用于细胞增殖和分化实验研究。在37℃条件下,碘化丙啶(PI,Invitrogen)染色30 min后,使用荧光显微镜(leica microsystems)观察水凝胶中细胞存活情况。按照CCK-8试剂盒(cck-8,Biosource)说明书来检测凝胶中ADSC的增殖情况,37℃cck-8孵育3 h,采用535 nm激发波长和600 nm发射波长测定吸光度。每个监测点设置4个平行样本。
2.4 ADSC在水凝胶中的分化为了研究水凝胶中KGN对ADSC向髓核样细胞分化作用,本课题组设置了4个实验组:第1组将ADSC接种到整合KGN水凝胶中并采用分化培养基(加有10 ng·mL-1转化生长因子β3(TGF-β3)的高糖DMEM进行培养,均购自Life Technologies);第2组将ADSC接种到无KGN的水凝胶中并采用分化培养基进行培养;第3组将ADSC接种到整合KGN水凝胶中并采用生长培养基进行培养;第4组将ADSC接种到无KGN的水凝胶中并采用生长培养基进行培养,作为对照组。实验方法如下:将第5代后ADSC以1×106个细胞·mL-1浓度重悬于1 mL水凝胶混合溶液中,然后接种到24孔培养板中,37℃成胶后添加培养基,培养28 d后,通过组织学分析和生化定量检测ADSC向髓核样细胞分化情况。
2.5 髓核样分化分析分化后的细胞-水凝胶复合物PBS冲洗后,包埋于Tissue-Tek®(OCT)化合物中,液氮快速冷冻并储存在-20℃。制备20 mm连续冷冻切片并置于Superfrost-Plus显微镜载玻片上,室温下干燥24 h。切片用4℃预冷的甲醇/丙酮(1:1)固定30 min,PBS洗涤3次,10%的羊血清封闭20 min,一抗(抗胶原Ⅱ,抗聚集蛋白聚糖,抗CD24,Abcom) 4℃孵育过,PBS冲洗3次,辣根过氧化物酶标记的二抗(Invitrogen)室温孵育2 h,PBS冲洗细胞,DAB试剂盒显影,显微镜下观察(Olympus,日本)。
用Trizol (Invitrogen)试剂盒提取方法提取分化后细胞总RNA,而后按照第一链cDNA试剂盒(Takara)说明书反转录合成cDNA.使用SYBR Green PCR试剂盒(Takara)进行定量聚合酶链反应(qPCR)分析,以β-actin作为内参。
2.6 统计学分析数据结果都是以平均数±标准差(x±sD)形式计算。运用多因素方差分析比较不同组间差异(ANOVA)。当ANOVA检验显示出显著性差异,且组与组之间没有相互作用时,每个时间点和位点之间的差异通过post t检验(post hoc test),p < 0.05为有显著性差异.所有的数据都用SPSS15.0分析软件进行分析。
3 结果 3.1 水凝胶的特性在37℃水浴,采用小瓶倾斜方法测定成胶时间(图 1A)。结果发现在CS-GP-HA共混溶液中,随着HA浓度在一定范围内增加, 水凝胶成胶时间延长,但3:3:4, 2:3:5和1:3:6 CS-GP-HA溶液却无法成胶(表 1)。所有不同体积比的水凝胶溶液pH值均接近中性(表 1)。
|
|
表 1 不同比例水凝胶相关特性 Table 1 Characteristics of hydrogels with different material ratios. n=5 * p < 0.05 compared to 6:3:1 |
利用PBS测定的水凝胶的溶胀度,结果表明水凝胶HA含量与溶胀度成正相关(表 1,p < 005)。所有水凝胶在PBS中孵育7 d后,最终达到溶胀平衡。
通过静态压缩分析方法测定水凝胶的杨氏模量。6:3:1、5:3:2水凝胶与4:3:3相较,水凝胶杨氏模量更大,分别为2.9和1.6 MPa(表 1,p < 0.05)。人新鲜髓核组织杨氏模量(平均2 MPa)与5:3:2水凝胶杨氏模量相近.整合KGN后水凝胶压缩模量稍增大,但无统计学意义(结构未显示)。
Alcian blue染色评价水凝胶内CS与HA交联均匀性,染色后显示蓝色均匀分布于水凝胶中,表明CS与HA均匀交联(图 1B)。

|
图 1 水凝胶的制备与超微结构 Fig.1 Preparation and structures of hydrogels A. images of CS, GP and HA solutions before (sol) and after (gel) incubation at 37℃. The 3:3:4, 2:3:5 and 1:3:6 mixtures were unable to form gels even after an extended incubation time. B. macroscopic images of CS/HA hydrogels stained with alcian blue after incubation in PBS at 37℃. The diameter of the hydrogels is 1 cm. C. SEM micrographs of hydrogels. The structure of hydrogel 4:3:3 was too loose to be broken. Scale bar 100 µm |
SEM观察分析水凝胶的微观结构特点,发现水凝胶横截面出现连续性的多孔结构,6:3:1水凝胶孔径大小在10~40 μm,5:3:2为40~80 μm,而4:3:3为40~100 μm(图 1C)。随着CS含量增高,水凝胶内孔径变小。
3.2 水凝胶生物可降解性及KGN释放特性CS含量高的水凝胶在同等时间内相对于其他水凝胶降解更慢(图 2A),KGN累积释放量更少(图 2B)。根据CS/HA可降解性和KGN缓释特性,认为5:3:2的水凝胶最适作为KGN缓释载体。
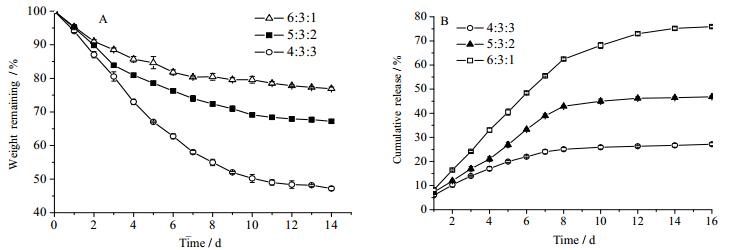
|
图 2 水凝胶体外降解特性与水凝胶内KGN释放特性 Fig.2 KGN release profiles and degradation properties of hydrogels A. in vitro degradation of hydrogels after incubation at different times. Significant mass loss was observed in hydrogels of 4:3:3. B. in vitro cumulative release profiles of KGN from different hydrogels. Hydrogels with 4:3:3 showed 80% KGN released after 2 weeks. |
电镜下观察到ADSC呈球形或成纤维样细胞形态,但5:3:2与4:3:3水凝胶内生长细胞更多(图 3A)。HE染色发现ADSC在水凝胶支架材料中分布相对均匀,根据蓝色的细胞核数量推测其与SEM观察结果基本一致(图 3B)。而4:3:3水凝胶由于结构脆弱,使操作很困难。
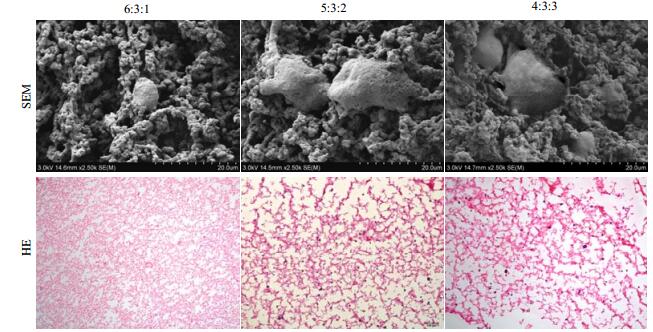
|
图 3 水凝胶中ADSC生长形态和活性的观察 Fig.3 Morphology of ADSCs in hydrogels A. SEM micrographs of ADSCs in different hydrogels. Cells were indicated with white arrows. Scale bar 20 µm; B. H&E stained images of encapsulated ADSCs in hydrogels after 14 days in culture. Violet dots indicate the nucleus of ADSCs. Scale bar 100 µm |
ADSC接种培养1 d后,荧光显微镜下观察到水凝胶内的多数ADSC形态为圆形;在培养14 d后发现ADSC在水凝胶内增殖,并呈现成纤维样细胞形态(图 4A)。在无KGN和整合KGN水凝胶内培养ADSC 14 d后,经PI染色后发现无KGN水凝胶中,死细胞数量更多(图 4B)。CCK-8细胞增殖实验发现整合KGN水凝胶中细胞数量更多(图 4C);此外,培养14 d后细胞代谢活性与前7 d相比明显增高(p < 0.005)。扫描电镜下,整合KGN水凝胶中可观察到更多细胞生长(图 5)。
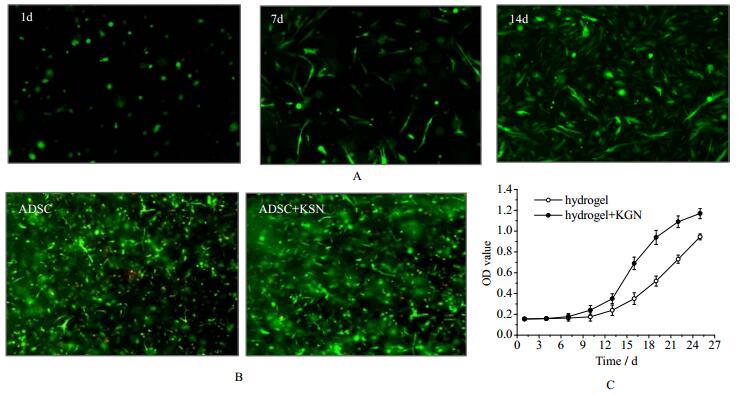
|
图 4 水凝胶中KGN对脂肪干细胞生长活性的作用 Fig.4 Effects of KGN on cell viability in hydrogels A. viability of encapsulated ADSCs in CS/HA hydrogels after 1, 7 and 14 days in culture. scale bar 200 µm; B. PI fluorescent staining for ADSCs in hydrogels with and without KGN. scale bar 500 µm; C. Proliferation assay of ADSCs in hydrogels by CCK-8. ADSC proliferation was significantly enhanced in the presence of KGN, * p < 0.05, compared to cells in hydrogel without KGN |
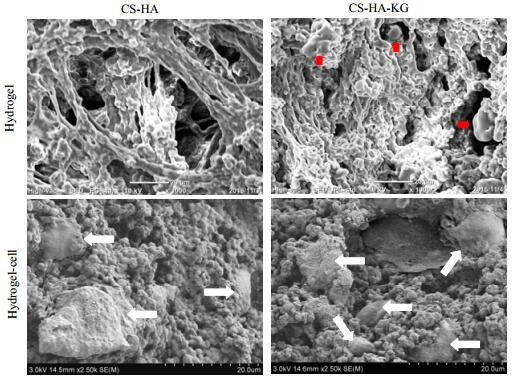
|
图 5 扫描电镜观察水凝胶中KGN和脂肪干细胞的形态结构 Fig.5 SEM micrographs of KGN and ADSCs in hydrogels. Small particles can be observed inside or on the surface of hydrogels (red arrows), ADSCs (white arrows) have better viability in hydrogels conjugated with KGN. CS-HA: hydrogel with 5:3:2, CS-HA-KGN: hydrogel conjugated with KGN. |
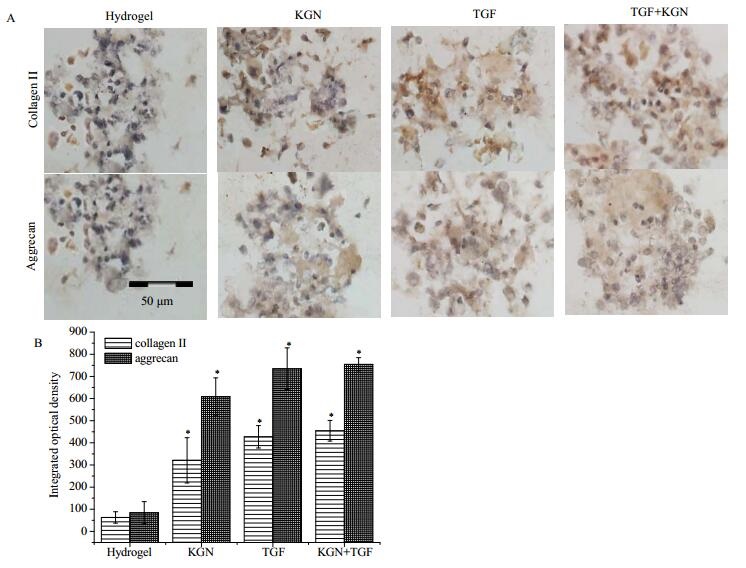
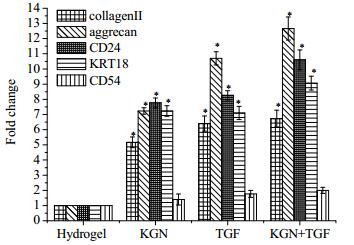
免疫组织化学方法结果显示经KGN、TGF-β及KGN+TGF-β诱导分化后都表达髓核细胞外基质Ⅱ型胶原和蛋白聚糖,且表达量明显高于未诱导组(图 6)。RT-qPCR结果显示诱导组髓核相关基因表达水平明显高于未诱导组(p < 0.05),但各诱导组间没有显著性差异(图 7)。
|
图 6 免疫组化染色检测水凝胶内干细胞分化collagen Ⅱ和aggrecan的表达情况 Fig.6 Expression of collagen Ⅱ and aggrecan measured by immunohistochemical staining. Both KGN and TGF-β can promote the differentiation of ADSCs in the hydrogel scaffold to similar extents. Semi-quantitative analysis was done to confirm the results. scale bar 50 µm |
|
图 7 分化28 d后髓核相关基因collagen Ⅱ, aggrecan, KRT18, CD24 and CD54的表达 Fig.7 RT-qPCR results for NP genes (collagen Ⅱ, aggrecan, KRT18, CD24 and CD54) on day 28. * significant difference compared to control group |
随着年龄增长,髓核组织内细胞密度降低,将导致蛋白聚糖和Ⅱ型胶原等细胞外基质成分减少[21]。CS分子结构与GAGs相似,而HA是髓核细胞外基质的重要组成成分[10, 12, 14]。由于HA的羟基可与CS的氨基发生反应生成亚胺基,在37℃水浴条件下可由液态变成凝胶,从而制备CS/HA温敏水凝胶[22]。理想的水凝胶除了具有温敏,还应具备高亲水性, 生物可降解性和适宜的机械强度[23],这些特性对移植后修复椎间盘力学功能,以及移植后细胞分泌的自身细胞外基质逐渐替代可降解的水凝胶组织尤为重要。具有较高HA含量的水凝胶表现出疏松结构,从而增加亲水基团的暴露, 最终导致吸水性增加和降解速度的加快。相应的,具有较多CS的水凝胶具有更致密的网状多孔结构和小的孔径。
既然5:3:2的CS/HA水凝胶具有与体内髓核组织类似的结构和力学特性,而且其成分与髓核细胞外基质成分相似,因此此类水凝胶可为细胞生长提供较好的生物微环境。本研究使用ADSC作为种子细胞进行工程化髓核组织再生,因为脂肪干细胞很容易从自体脂肪组织获得,而且其增殖分化能力强于骨髓间充质干细胞,已经被广泛用于软骨和其他组织的再生研究[24-26]。ADSC在CS/HA水凝胶内显示出较好的细胞形态和增殖特性,由于髓核细胞更适于生长在三维环境中,因此将ADSC接种于CS/HA水凝胶可能更利于ADSC增殖及向髓核细胞分化。而且水凝胶组织有利于机械负荷的传导,而这一力学刺激对于髓核细胞外基质合成是非常重要的[27]。由于髓核细胞外基质成分HA的加入使得CS/HA水凝胶创造一个类似体内髓核的微环境[28-32],而GAGs类似物CS和髓核细胞外基质HA可支持细胞增殖及调控髓核分化和功能[6, 13]。
CS / HA水凝胶作为载体不仅可将干细胞运送到注射部位,还能充当生物活性分子或生长因子的缓释载体。KGN是一种新型疏水的小分子化合物,拥有极强的促软骨分化能力KGN是一种新型疏水的小分子化合物,拥有极强的促软骨分化能力,KGN分子内部羧基可与CS的氨基共价结合[18]。本课题组将KGN整合到CS / HA水凝胶后可增加KGN的水溶性并能将其在水凝胶内持续释放,促进ADSC增殖及向髓核细胞分化。在干细胞分化过程中,KGN释放核结合因子-β(core-binding factor-β,CBF-β)与DNA转录因子RUNX1结合,继而激活蛋白聚糖和Ⅱ型胶原转录[17]。KGN与TGF-β具有相似促软骨分化能力,但KGN不能进一步提高TGF-β分化作用。因而,KGN很可能是髓核和软骨分化和再生中TGF-β的一个合适替代物。构建髓核样组织后,下一步就是进行移植。众所周知,炎症环境是DDD发生的关键,CD54在年轻的髓核组织中表达不明显,但在退变髓核中大量表达,因此被认为是评估炎症相关椎间盘退变的一个生物标记[33]。ADSC在水凝胶中分化后CD54表达没有明显增加,表明本课题组所构建的水凝胶组织并不会导致炎症反应的发生,移植后对体内髓核组织也不会产生任何危害。
5 结论用糖胺聚糖类似物CS和髓核细胞外基质成分之一HA构建了一种新型CS / HA可注射水凝胶,并发现所构建的水凝胶可促进ADSC增殖及向髓核分化,而且整合入水凝胶中的KGN可进一步促进ADSC增殖和分化,从而促进髓核样组织的构建。这样一种整合有ADSC和KGN的可注射水凝胶可在临床微创手术中进行注射治疗,填补和修复损伤的髓核组织。
| [1] | Mern D S, Beierfuß A, Thomé C, et al. Enhancing human nucleus pulposus cells for biological treatment approaches of degenerative intervertebral disc diseases:a systematic review[J]. Tissue Engineering & Regenerative Medicine, 2014, 8(12): 925-936. |
| [2] | Drazin D, Rosner J, Avalos P, et al. Stem cell therapy for degenerative disc disease[J]. Advances in Orthopedics, 2012, 2012(11): 1-8. |
| [3] | Oehme D, Goldschlager T, Rosenfeld J V, et al. The role of stem cell therapies in degenerative lumbar spine disease:a review[J]. Neurosurgical Review, 2015, 38(3): 429-445. DOI:10.1007/s10143-015-0621-7. |
| [4] | Söntjen S H, Nettle D L, Carnaha M A, et al. Biodendrimer-based hydrogel scaffolds for cartilage tissue repair[J]. Biomacromolecules, 2006, 7(1): 310-316. DOI:10.1021/bm050663e. |
| [5] | Tan H, Rubin J P, Marra K G, et al. Injectable in situ forming biodegradable chitosan-hyaluronic acid based hydrogels for adipose tissue regeneration[J]. Organogenesis, 2010, 6(3): 173-180. DOI:10.4161/org.6.3.12037. |
| [6] | Nair M B, Baranwal G, Vijayan P, et al. Composite hydrogel of chitosan-poly(hydroxybutyrate-co-valerate) with chondroitin sulfate nanoparticles for nucleus pulposus tissue engineering[J]. Colloids and Surfaces B:Biointerfaces, 2015, 136: 84-92. DOI:10.1016/j.colsurfb.2015.08.026. |
| [7] | Singh Y P, Bhardwaj N, Mandal B B, et al. Potential of agarose/silk fibroin blended hydrogel for in vitro cartilage tissue engineering[J]. ACS Applied Materials & Interfaces, 2016, 8(33): 21236-21249. |
| [8] | Atta S, Khaliq S, Islam A, et al. Injectable biopolymer based hydrogels for drug delivery applications[J]. International Journal of Biological Macromolecules, 2015, 80: 240-245. DOI:10.1016/j.ijbiomac.2015.06.044. |
| [9] | Ravindran S, Gao Q, Kotecha M, et al. Biomimetic extracellular matrix-incorporated scaffold induces osteogenic gene expression in human marrow stromal cells[J]. Tissue Engineering Part A, 2012, 18(3-4): 295-309. DOI:10.1089/ten.tea.2011.0136. |
| [10] | Tan H, Ramirez C M, Miljkovic N, et al. Thermosensitive injectable hyaluronic acid hydrogel for adipose tissue engineering[J]. Biomaterials, 2009, 30(36): 6844-6853. DOI:10.1016/j.biomaterials.2009.08.058. |
| [11] | Wang F, He X. Intra-articular hyaluronic acid and corticosteroids in the treatment of knee osteoarthritis:A meta-analysis[J]. Experimental and Therapeutic Medicine, 2015, 9(2): 493-500. DOI:10.3892/etm.2014.2131. |
| [12] | Ha C W, Park Y B, Chung J Y, et al. Cartilage repair using composites of human umbilical cord blood-derived mesenchymal stem cells and hyaluronic acid hydrogel in a minipig model[J]. Stem Cells Translational Medicine, 2015, 4(9): 1044-1051. DOI:10.5966/sctm.2014-0264. |
| [13] | Kim D H, Martin J T, Elliott D M, et al. Phenotypic stability, matrix elaboration and functional maturation of nucleus pulposus cells encapsulated in photocrosslinkable hyaluronic acid hydrogels[J]. Acta Biomaterialia, 2015, 12(1): 21-29. |
| [14] | Naderi-Meshkin H, Andreas K, Matin M M, et al. Chitosan-based injectable hydrogel as a promising in situ forming scaffold for cartilage tissue engineering[J]. Cell Biology International, 2014, 38(1): 72-84. DOI:10.1002/cbin.10181. |
| [15] | Shi Y, Xiong Z, Lu X, et al. Novel carboxymethyl chitosan-graphene oxide hybrid particles for drug delivery[J]. Journal of Materials Science:Materials in Medicine, 2016, 27(11): 169-177. DOI:10.1007/s10856-016-5774-6. |
| [16] | Karimi Z, Ghorbani M, Hashemibeni B, et al. Evaluation of the proliferation and viability rates of nucleus pulposus cells of human intervertebral disk in fabricated chitosan-gelatin scaffolds by freeze drying and freeze gelation methods[J]. Advanced Biomedical Research, 2015, 4(1): 251-260. DOI:10.4103/2277-9175.170676. |
| [17] | Johnson K, Zhu S, Tremblay M S, et al. A stem cell-based approach to cartilage repair[J]. Science, 2012, 336(6082): 717-721. DOI:10.1126/science.1215157. |
| [18] | Ono Y, Ishizuka S, Knudson C B, et al. Chondroprotective effect of kartogenin on CD44-mediated functions in articular cartilage and chondrocytes[J]. Cartilage, 2014, 5(3): 172-180. DOI:10.1177/1947603514528354. |
| [19] | Zhu Y, Liu T, Song K, et al. ADSCs differentiated into cardiomyocytes in cardiac microenvironment[J]. Molecular and Cellular Biochemistry, 2009, 324(1-2): 117-129. DOI:10.1007/s11010-008-9990-3. |
| [20] | Kepler C K, nderson D G, Tannoury C, et al. Intervertebral disk degeneration and emerging biologic treatments[J]. Journal of the American Academy of Orthopaedic Surgeons, 2011, 19(9): 543-553. DOI:10.5435/00124635-201109000-00005. |
| [21] | Kaderli S, Boulocher C, Pillet E, et al. A novel biocompatible hyaluronic acid-chitosan hybrid hydrogel for osteoarthrosis therapy[J]. International Journal of Pharmaceutics, 2015, 483(1-2): 158-168. DOI:10.1016/j.ijpharm.2015.01.052. |
| [22] | Xue S, Pei D, Jiang W, et al. A simple and fast formation of biodegradable poly(urethane-urea) hydrogel with high water content and good mechanical property[J]. Polymer, 2016, 99: 340-348. DOI:10.1016/j.polymer.2016.07.034. |
| [23] | Zhu Y, Liu T, Song K, et al. Adipose-derived stem cell:a better stem cell than BMSC[J]. Cell Biochemistry and Function, 2008, 26(6): 664-675. DOI:10.1002/cbf.v26:6. |
| [24] | Zhu Y, Liu T, Ye H, et al. Enhancement of adipose-derived stem cell differentiation in scaffolds with IGF-I gene impregnation under dynamic microenvironment[J]. Stem Cells and Development, 2010, 19(10): 1547-1556. DOI:10.1089/scd.2010.0054. |
| [25] | Kasir R, Vernekar V N, Laurencin C T, et al. Regenerative engineering of cartilage using adipose-derived stem cells[J]. Regenerative Engineering and Translational Medicine, 2015, 1(1): 42-49. |
| [26] | Francisco A T, Mancino R J, Bowles R D, et al. Injectable laminin-functionalized hydrogel for nucleus pulposus regeneration[J]. Biomaterials, 2013, 34(30): 7381-7388. DOI:10.1016/j.biomaterials.2013.06.038. |
| [27] | Park H, Choi B, Hu J, et al. Injectable chitosan hyaluronic acid hydrogels for cartilage tissue engineering[J]. Acta Biomaterialia, 2013, 9(1): 4779-4786. DOI:10.1016/j.actbio.2012.08.033. |
| [28] | Correia C R, Moreira-Teixeira L S, Moroni L, et al. Chitosan scaffolds containing hyaluronic acid for cartilage tissue engineering[J]. Tissue Engineering Part C Methods, 2011, 17(7): 717-730. DOI:10.1089/ten.tec.2010.0467. |
| [29] | Spiller K L, Maher S A, Lowman A M, et al. Hydrogels for the repair of articular cartilage defects[J]. Tissue Engineering Part B Review, 2011, 17(4): 281-299. DOI:10.1089/ten.teb.2011.0077. |
| [30] | Huang Y C, Leung V Y, Lu W W, et al. The effects of microenvironment in mesenchymal stem cell-based regeneration of intervertebral disc[J]. Spine Journal, 2013, 13(3): 352-362. DOI:10.1016/j.spinee.2012.12.005. |
| [31] | Huang Y C, Urban J P, Luk K D, et al. Intervertebral disc regeneration:do nutrients lead the way?[J]. Nature Reviews Rheumatology, 2014, 10(9): 561-566. DOI:10.1038/nrrheum.2014.91. |
| [32] | Tang X, Jing L, Richardson W J, et al. Identifying molecular phenotype of nucleus pulposus cells in human intervertebral disc with aging and degeneration[J]. Journal of Orthopaedic Research, 2016, 34(8): 1316-1326. DOI:10.1002/jor.23244. |




