L-薄荷醇为无色透明针状晶体,具有强烈的清凉作用和清新的甜刺激气味,在化妆品、医药、食品以及化工领域有重要的应用[1]。但L-薄荷醇熔点较低(44℃)、且易升华挥发,使其在需高温灭菌的食品应用中受到限制;加上其强烈的瞬时清凉刺激作用也影响其制剂在给药过程中的质量控制,因此提高其使用稳定性成为当前的研究热点。L-薄荷醇酯是L-薄荷醇与脂肪酸作用形成的酯类化合物,在体内酶的水解作用下转化成薄荷醇和相应脂肪酸,具有长效、良好的清凉作用,不易挥发,是一类具有广泛应用前景的新型清凉剂。
L-薄荷醇酯可通过化学法或酶法合成,但化学法反应条件苛刻,副产物多,产物分离成本高。酶法是一种“绿色”环境友好的合成工艺,利用脂肪酶催化酯合成已成为当前的研究热点[2]。目前酶法合成薄荷醇酯主要在有机溶剂中进行,唐功等[3]以脂肪酶Candida rugosa lipase (CRL)为催化剂,正己烷为溶剂,合成了乙酸薄荷酯,酯化率达到92.4%。Wang等[4]以固定化脂肪酶CRL为催化剂,以D,L-薄荷醇与戊酸为酰基供体在环己烷中催化酯化反应,酯化率可达85%。TaKashi等[4]在油-水两相反应体系中,酶法催化合成油酸薄荷醇酯,酯化率达到80%。但有机溶剂的挥发特性及残留问题有可能限制其在食品和药品领域的应用,虽然有采用离子液体作为反应溶剂酶促合成L-薄荷醇酯的报道[5],但离子液体仍存在制备过程复杂和成本高的缺点,因此,探索高效环保的L-薄荷醇酯合成工艺显得十分迫切[6]。
无溶剂反应体系在大多数情况下不添加溶剂(以反应底物为溶剂或熔融状底物),避免了有机溶剂的使用,是极具发展潜力的绿色合成体系。本文以脂肪酸为酰基供体,以大孔树脂固定化脂肪酶为催化剂,考察不同方法修饰的载体对固定化酶催化性能的影响,在无溶剂体系中催化合成L-薄荷醇酯,探索建立L-油酸薄荷醇酯的绿色合成工艺。
2 实验材料与方法 2.1 材料与试剂大孔吸附树脂NKA (交联-聚苯乙烯树脂,南开大学化工厂);大孔吸附树脂HA (交联-聚苯乙烯氨基树脂,南开大学化工厂);脂肪酶Candida rugosa lipase;(以下简称CRL,美国Sigma-Aldrich公司);L-薄荷醇(上海萨思化学技术公司);月桂酸、油酸、癸酸、丁酸、苯醌、聚乙二醇,多巴胺(国药试剂公司)。
2.2 实验仪器与设备Agilent 6890气相色谱仪(美国安捷伦公司);红外光谱仪(美国Thermo公司);THZ-D台式恒温振荡器(江苏太仓市实验设备厂);DZF-6020真空干燥箱(上海博迅实业公司)。
2.3 实验方法 2.3.1 大孔树脂NKA共价固定化脂肪酶的制备载体制备:取0.1 g大孔树脂NKA悬浮于10 mmol·L-1 Tris-HCl缓冲溶液(pH 8.5),平衡30 min,再加入2 mg·mL-1多巴胺,30℃,180 r·min-1,反应3 h。用pH 8.5缓冲溶液和蒸馏水冲洗修饰后的载体数次,得到的载体简写为NKA-PDA。
脂肪酶固定化:用0.02 mol·L-1 (pH 7.0)的磷酸缓冲液配置浓度为4 mg·mL-1的酶(CRL)溶液,于4℃、8000 r·min-1离心5 min,去除沉淀。取5 mL上述酶液,分别加入0.1 g大孔树脂NKA和多巴胺修饰的载体NKA-PDA,30℃、180 r·min-1反应5 h后,用5 mL,0.02 mol·L-1 (pH 7.0)的磷酸缓冲液洗涤固定化酶数次,于4℃存放,所得固定化酶简写为NKA-CRL和NKA-PDA-CRL。
2.3.2 大孔树脂HA共价固定化脂肪酶的制备载体活化:称取0.1 g大孔树脂HA,加入5 mL的1%的对苯醌乙醇溶液,30℃振荡反应1 h后,过滤得到的载体用20%的乙醇水溶液洗涤两次,所得活化载体标记为HA-BQ。
脂肪酶固定化:用0.02 mol·L-1 (pH 7.0)的磷酸缓冲液配置浓度为4 mg·mL-1的酶(CRL)溶液,于4℃,8000 r·min-1离心5 min,去除沉淀。取5 mL上述酶液,分别加入0.1 g大孔树脂HA和活化载体HA-BQ,30℃、180 r·min-1反应6 h后,用0.02 mol·L-1的磷酸缓冲液洗涤固定化酶数次,于4℃存放备用,所得固定化酶分别简写为HA-CRL和HA-BQ-CRL。另外,先分别在酶液中添加不同分子量的聚乙二醇(400、1000、2000、4000、10000和20000),聚乙二醇的最终浓度为0.75 mg·mL-1,然后加入活化的载体HA-BQ进行固定化,所得的固定化酶分别简写为HA-BQ-PEGX/CRL(X代表不同的分子量)。
2.3.3 L-薄荷醇酯的合成将油酸与L-薄荷醇(L-薄荷醇浓度为1 mol·L-1,反应体积25 mL)等摩尔比混合,在50℃摇床中预热使其成为熔融状态后,再加入1 U真空干燥后的固定化脂肪酶,混匀后添加4 μL去离子水。由于酯化反应是可逆反应为确保反应向酯合成的方向进行,反应2 h过后,需向体系中加入适量的分子筛去除生成的过量水。
2.3.4 酯化率的测定采用Agilent 7890AGC对酯化率进行定量分析,以氮气为载气,氢气为燃气,空气为助燃气,选用毛细管柱DB-5HT,氢火焰离子化检测器。氢焰温度为320℃,检测口温度为300℃,采用程序升温的方法,具体程序为:柱室的初始温度80℃,保持1 min,再以20℃·min-1升温至300℃维持3 min。通过内标法为对反应前后L-薄荷醇的含量进行分析,并根据酸醇反应比1:1对转化率进行计算。
2.3.5 脂肪酶活性的测定以对硝基苯基乙酸酯(p-NPA)为底物,采用比色法测定游离和固定化脂肪酶的水解活性。在37℃、pH值为7.0的条件下,1 min内水解产生1 μmol P-NP所需要的酶量定义为一个酶活单位(1 U)。
配置浓度为50 mmol·L-1的p-NPA的乙腈溶液,吸取5 mL加入到35 mL的磷酸缓冲液(pH7,0.02 mol·L-1)中,加入100 mg固定化酶。37℃、200 r·min-1摇床中反应10 min后,在400 nm处测定吸光度,计算脂肪酶活性。空白以100 mg空载体替代固定化酶。
2.3.6 产物的表征方法使用薄层层析和气相色谱法进行表征,具体参见文献[7]。
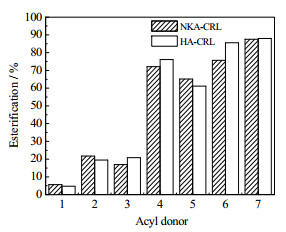
3 实验结果与讨论 3.1 酰基供体对酯化效果的影响以1 U干燥后的大孔树脂吸附固定化脂肪酶(NKA-CRL和HA-CRL)为催化剂,油酸和L-薄荷醇为底物,在无溶剂体系中酶法催化合成油酸薄荷醇酯。由于癸酸的熔点为31.5℃,L-薄荷醇的熔点为43~45℃,为了保证反应底物间的流动性,故选择无溶剂体系反应温度为50℃,比较了酰基供体对L-薄荷醇酯合成的影响。
由图 1可知,短链脂肪酸的酯化率均比较低,这主要是由于短链脂肪酸的极性和酸性较强,易剥夺酶的“需水”,破坏其空间结构的稳定,导致催化效率降低。CRL对长链脂肪酸具有较好的选择性[8],癸酸和月桂酸常温下为固体,50℃下虽可呈熔融状态,但是体系的黏度较大。辛酸在室温下虽为液体,但辛酸的logP = 2.43,极性仍较高。油酸在室温下为液体状态能够很好的与L-薄荷醇形成均一的液态体系,油酸薄荷醇的酯化率最高可达NKA-CRL 87.56%,HA-CRL 87.98%。
|
图 1 不同酰基供体对酯化效果的影响 Fig.1 Effects of different acyl donors on the esterification of L-menthyl esters 1. acetic acid 2. butyric acid 3. caproic acid 4. octanoic acid 5. decanoic acid 6. lauric acid 7. oleic acid |
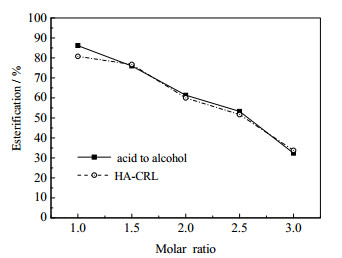
酶促反应中,适当的底物摩尔比是影响酶促反应最终产率的重要因素,在上述实验的基础上选择油酸与L-薄荷醇为酰基供体,在无溶剂体系中考察了不同油酸与L-薄荷醇的摩尔比对酯化效果的影响。结果如图 2所示,NKA-CRL与HA-CRL在酸醇摩尔比为1:1时,酯化率最高达到86.2%和80.8%。随着底物摩尔比的增大,醇过量会对脂肪酶产生抑制作用[9],因此在后续的反应中确定底物摩尔比为1:1。
|
图 2 底物摩尔比对酯化效果的影响 Fig.2 Effects of substrate molar ratios on the esterification of L-menthyl esters |
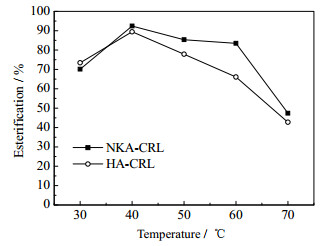
无溶剂体系中,反应物的流动性对酯合成效率至关重要。温度较低时,L-薄荷醇的溶解度较低,半固态与油酸的混合性差,温度升高则有利于L-薄荷醇与油酸的混合,图 3比较了温度对酯化效果的影响,结果分析后确定后续反应温度为50℃。
|
图 3 温度对酯化效果的影响 Fig.3 Effects of temperatures on the esterification of L-menthyl esters |
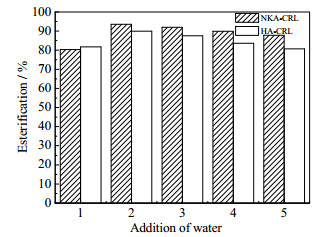
酯化反应是一个可逆反应,体系中水含量过多会导致酯水解,反应率降低。为此考察了不同水添加量4、10、25、50 μL对L-油酸薄荷醇酯合成的影响。结果如图 4所示,当水的添加量为4 μL,两种固定化酶的酯化率均最高分别可获得93.5%、89.9%,随着水含量的进一步增加酯化率逐步降低。同时油酸与L-薄荷醇在水中的溶解性较低,水在酶分子周围形成一层水化层,不利于底物和产物的扩散,增大催化过程中物质和能量传递的阻力,最终导致酯化率降低[10]。
|
图 4 初始水添加量对酯化效果的影响 Fig.4 Effects of initial water addition on the esterification of L-menthyl esters 1. control 2. 4 μL 3. 10 μL 4. 25 μL 5. 50 μL |
无溶剂体系不添加有机溶剂,反应底物呈熔融状态具有一定的黏性,传质阻力对酯化率的高低有很大的影响。转速在一定程度上可以促进底物接触,降低传质阻力,加快反应速率。不同转速对酯化反应效果的影响,结果如图 5所示。在摇床转速达到200 r·min-1时,酯化率最高,此时传质混合效果最佳。从节约能耗的角度考虑,后续研究中选用200 r·min-1。
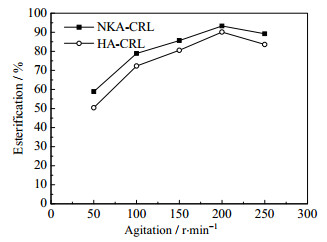
|
图 5 摇床转速对酯化效果的影响 Fig.5 Effects of agitation speeds on the esterification of L-menthyl esters |
以油酸和L-薄荷醇为模式底物,分别以NKA-CRL、NKA-PDA-CRL和HA-CRL、HA-BQ-CRL和HA-BQ-PEGX/CRL (X代表不同的分子量400、1000、2000、4000、10000和20000)为催化剂,并分别考察反应时间、PEG分子量对酶促反应性能的影响。
由图 6可看出,无论是用多巴胺还是聚乙二醇修饰得到的固定化脂肪酶均可提高酶促反应的速率。这主要是由于多巴胺和聚乙二醇均属于生物相容性良好的大分子,其亲水性有利于酶的活性中心富集底物,使底物向活性中性扩散,更有利于酶行使催化性能。同时修饰后的载体与酶为共价连接,酶结构的空间变化受到限制,促进蛋白质结构的稳定[11]。
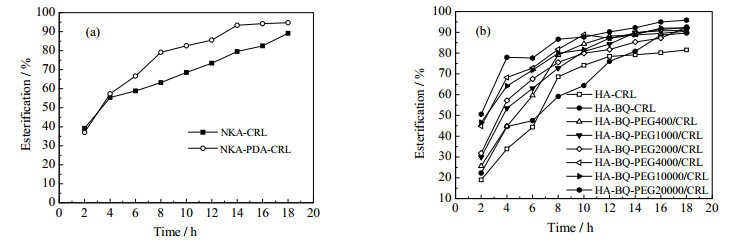
|
图 6 不同修饰固定化脂肪酶对酯化效果的影响 Fig.6 Profiles of esterification catalyzed by modified immobilized lipase |
在最优的反应条件下,加入酶活分别为1 U的固定化脂肪酶,反应18 h,使用修饰及未修饰的固定化CRL重复催化无溶剂体系中油酸薄荷醇酯合成反应,考察固定化酶的操作稳定性,结果如图 7所示。
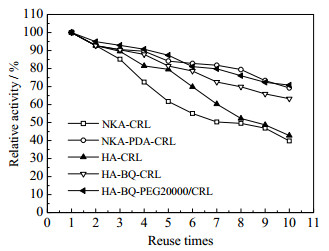
|
图 7 固定化酶的重复使用能力 Fig.7 Reusability of different immobilized lipase |
从图 7可以发现,共价固定化酶的重复使用能力明显优于物理吸附的固定化酶。这主要是由于共价结合较牢固,酶不易从载体上脱落。同时在固定化过程中加入生物相容性的大分子,酶与大分子共同组装在孔道结构中,生物大分子可以在酶的周围形成一层水化层,在催化反应碰撞过程中起到缓冲作用,孔道的剩余空间也进一步相对减少,酶蛋白的空间构象的变化受到限制,增加了酶的使用稳定性[12]。
4 结论以大孔树脂固定化脂肪酶为催化剂,在无溶剂体系中对酶促合成L-薄荷醇酯的反应工艺进行了优化。在L-薄荷醇浓度为1 mol·L-1,底物摩尔比为1:1,添加1.0 U的固定化脂肪酶和4 μL微量水的条件下,50℃,180 r·min-1反应24 h,油酸薄荷醇酯酯化率分别达91% (NKA)和89.8% (HA)。在最优条件下,分别以经多巴胺修饰的大孔树脂NKA固定化脂肪酶和以对苯醌活化的大孔树脂HA固定化脂肪酶为催化剂合成油酸薄荷醇酯,酶的共价固定化均有利于维持酶的构象和提高催化反应的速率,酯化率分别可达94.6%和95.8%。连续催化反应10次后,共价固定化酶的稳定性比吸附固定化酶提高了1.75倍,表明多巴胺和聚乙二醇对载体的修饰均能明显提升固定化脂肪酶的催化性能。
| [1] | REN Zhi-yao(任志尧), OUYANG Gui-ping(欧阳贵平), CHEN Kun(陈琨). Synthesis of L-menthyl glyoxylate catalyzed by SO42-/ZrO2 solid superacid SO42-/ZrO2(固体超强酸催化合成乙醛酸L-薄荷醇基酯)[J]. Chemical(化学通报), 2008, 71(11): 873-876. |
| [2] | Nishiot T, Takahashi K, Yoshimoto T, et al. Terpene alcohol ester synthesis by polyethylene glycol-modified lipase in benzene[J]. Biotechnology Letters, 1987, 9(3): 187-190. DOI:10.1007/BF01024562. |
| [3] | TANG Gong (唐功). Enzymatic synthesis of menthyl acetate in nonaqueous medium (非水相中脂肪酶催化合成乙酸薄荷酯)[D]. Lanzhou (兰州): College of Life Science of Northwest Normal University (西北师范大学), 2009. |
| [4] | LI Ming(李明), XU Xiao-feng(徐晓丰), LI Zai-jun(李在均), et al. Lipase-catalyzed enantioselective esterification of (±)-menthol in novel ionic liquids(新型离子液体中脂肪酶催化薄荷醇选择性酯化)[J]. Key Laboratory of Food Colloids and Biotechnology(食品与生物技术学报), 2015, 4(9): 935-942. DOI:10.3969/j.issn.1673-1689.2015.09.006. |
| [5] | Wang D L, Nag A, Lee G C, et al. Factors affecting the resolution of dl-menthol by immobilized lipase-catalyzed esterification in organic solvent[J]. Journal of Agricultural & Food Chemistry, 2002, 50(2): 262-265. |
| [6] | Kobayash I T, Nagao T, Watanab E Y, et al. Analysis of equilibrium state for synthesis of oleic acid L-menthyl ester in an oil-aqueous biphasic system with candida rugosa lipase[J]. Enzyme & Microbial Technology, 2007, 40(5): 1300-1304. |
| [7] | WANG Yu-lun(王羽伦), WANG Ke-bing(王科兵), ZHANG Guo-qing(张国庆), et al. Optimization lipase-catalyzed esterification of conjugated linoleic acid with L-menthyl in aqueous medium by dual response surface methodology(双响应面曲线法优化水相反应体系中共轭亚油酸和薄荷醇的酶催化酯化反应)[J]. Chinese Pharmaceutical Journal(中国药学杂志), 2011, 46(7): 500-504. |
| [8] | Qin H E, Yan X U, Teng Y, et al. Biodiesel production catalyzed by whole-cell lipase from[J]. Chinese Journal of Catalysis, 2008, 29(1): 41-46. DOI:10.1016/S1872-2067(08)60015-7. |
| [9] | ZHANG Lei-xia(张磊霞). New process for enzymatic synthesis of caffeic acid phenethyl ester via transesterification in ionic liquid(离子液体中酶促转酯化合成咖啡酸苯乙酯的新工艺)[J]. Journal of Jiangsu University of Science & Technology(江苏科技大学学报(自然科学版)), 2013, 28(6): 295-299. |
| [10] | YU Ming(余敏), ZHOU Hai-yan(周海燕), REN Li-wei(任立伟). Synthesis of citronellyl ester catalyzed by macroporous resin co-adsorbed immobilized dextran-lipase(大孔树脂共吸附固定葡聚糖一脂肪酶催化合成香茅酯)[J]. Biological processing(生物加工过程), 2015(6): 18-23. DOI:10.3969/j.issn.1672-3678.2015.06.004. |
| [11] | Ozyilmaz G. The effect of spacer arm on hydrolytic and synthetic activity of Candida Rugosa lipase immobilized on silica gel[J]. Journal of Molecular Catalysis B Enzymatic, 2009, 56(4): 231-236. DOI:10.1016/j.molcatb.2008.05.008. |
| [12] | Deng M, Zhao H, Zhang S, et al. High catalytic activity of immobilized laccase on core-shell magnetic nanoparticles by dopamine self-polymerization[J]. Journal of Molecular Catalysis B Enzymatic, 2015, 112: 15-24. DOI:10.1016/j.molcatb.2014.11.012. |




