化疗是重要的癌症治疗手段之一。在单药化疗中,随着用药量增加会给病人带来严重的毒副作用,且长时间化疗会使癌细胞出现耐药性,降低疗效[1-2]。临床上一般通过两种或多种药物协同给药,能一定程度上降低药物的毒副作用和癌细胞的耐药性,从而增强治疗效果[3-4]。然而大多数抗癌药物缺乏肿瘤组织靶向性,而且不同药物物化和药代动力学性质的差异使协同治疗效果大打折扣;此外,进入正常组织和器官的药物依然会造成严重的毒副作用[5]。将协同药物同时负载于纳米给药系统中,通过纳米粒的高渗透、长滞留效应(the enhanced permeability and retention effect, EPR)实现药物肿瘤组织靶向富集,精准调控协同药物比例,能有效增强疗效,降低毒副作用[6-8]。
盐酸阿霉素(doxorubicin hydrochloride, DOX)和紫杉醇(paclitaxel, PTX)是两种常用的癌症治疗药物。亲水性药物DOX能插入DNA双链并破坏其结构,从而抑制癌细胞增殖[9];疏水性药物PTX能促使微管蛋白形成聚集体并阻止其解聚而无法发挥正常功能,使得癌细胞停止有丝分裂和增殖[10]。DOX和PTX具有不同的性质和癌细胞抑制机制,两者协同作用能有效增强对多种癌症的治疗效果[11-12]。已有诸多报道将DOX和PTX同时负载于纳米给药系统中实现协同给药[13-14]。Wang等[12]通过两步化学反应将DOX和PTX分别偶联到三嵌段共聚物上,以两种药物为疏水核心形成双载药胶束。Zhao等[6]以二硫键为连接键将DOX和PTX分别接枝到甲氧基聚乙二醇上,通过疏水相互作用形成双载药胶束。He等[15]通过疏水相互作用将DOX和PTX同时负载到基于聚酰胺树枝状大分子的疏水核心上制备协同给药纳米系统。通常,DOX和PTX协同给药纳米系统的制备方法需多个步骤,工艺较繁琐,且使用大量有机溶剂,存在溶剂残留和环境污染等问题。因此开发绿色高效的DOX和PTX协同给药纳米系统制备方法极为必要。
超临界流体辅助雾化法(supercritical fluid assisted atomization, SAA)是一种基于超临界二氧化碳(supercritical carbon dioxide, SC-CO2)的微粒化技术,其操作条件温和、无有机溶剂残留、环境友好,受到研究者广泛关注[16-17]。在该技术中,首先SC-CO2与待处理液混合,再通过喷嘴经一次气动雾化和二次减压雾化形成小液滴,最后液滴在沉淀器中干燥形成微粒。本实验室对SAA技术进行了改进,建立了强化混合超临界流体辅助雾化(supercritical fluid assisted atomization introduced by a hydrodynamic cavitation mixer, SAA-HCM)技术[18],极大地增强了SC-CO2与待处理液的混合效果,得到的微粒形貌可控且粒径分布均匀,并应用于多种物质的微粒制备中[19-21]。2019年利用SAA-HCM技术成功制备了负载DOX的壳聚糖(chitosan, CS)纳米粒[22]。若将其应用于制备同时负载两种不同性质药物的纳米粒,则需要使用共溶剂体系。在共溶剂体系中,由于不同溶剂组分在SC-CO2中溶解度不同,混合过程中会使待处理液中各溶质溶解行为发生变化;此外,液滴干燥过程中各溶剂组分挥发速率不同会导致各溶质出现序列析出行为。以上现象使得共溶剂体系处理难度加大。
本研究以水-乙醇混合物作为共溶剂,CS为载体,利用SAA-HCM技术一步法制备同时负载亲水性药物DOX和疏水性药物PTX的纳米给药系统,详细考察各操作参数对双载药纳米粒形貌及粒径分布的影响,重点关注共溶剂体系与SC-CO2混合过程及液滴干燥过程,探讨成球机理,通过体外肿瘤细胞毒性实验验证DOX和PTX对癌细胞的协同抑制效果,为绿色高效的协同给药纳米系统开发奠定基础。
2 实验部分 2.1 材料DOX、PTX和cell counting Kit-8 (CCK-8)试剂盒购于大连美仑生物技术有限公司。CS购于浙江金壳药业有限公司,其相对分子质量分别为3 000、50 000和200 000,脱乙酰度约为90%。食品级CO2和氮气(N2)购于浙江今工气体有限公司,体积分数均高于99.0%。透析袋购于南通飞宇生物科技有限公司,截留分子量为8 000~14 000。人肺癌细胞系(A549)来源于ATCC细胞库(American Type Culture Collection, Manassas, USA),含1% (体积分数)青-链霉素双抗的RPMI 1640培养基购于杭州吉诺生物,胎牛血清(FBS)购于HyClone。其他化学试剂均为市售分析纯。
2.2 SAA-HCM设备及流程SAA-HCM技术流程图详见文献[23]。实验前,调整各个阀门,打开CO2钢瓶,检查各部件气密性。准备工作完毕后,打开冷却浴、热水浴及各加热器,等待温度达到设定值。钢瓶释放出来的CO2经冷却浴后变为液态,再通过CO2高压泵加压进入混合器,经热水浴升温达到超临界态。将CS溶于体积分数为1%的醋酸溶液、DOX溶于去离子水、PTX溶于乙醇,均搅拌形成均一溶液,依次将DOX水溶液和PTX乙醇溶液在搅拌下缓慢加入CS溶液中形成待处理液。混合器中压力达到预设值后,待处理液经柱塞高压泵送入混合器,经热水浴预热达到设定温度。待处理液与SC-CO2在混合器中充分混合,后经喷嘴(直径为200 μm)雾化进入沉淀器形成液滴,液滴中水和乙醇在热氮气加热下挥发,CS、DOX和PTX析出形成双载药纳米粒(DOX&PTX@CS纳米粒)。纳米粒通过沉淀器底部的筛网收集,溶剂蒸汽经冷凝器回收。
2.3 实验方法 2.3.1 纳米粒形貌及粒径分析使用扫描电子显微镜SEM(Sirion-100, FEI, the Netherlands)观察纳米粒形貌,并对其粒径进行分析。将DOX&PTX@CS纳米粒均匀分散在SEM样品台导电胶上,喷金处理60 s。随机拍摄不同视野处的纳米粒,图像经粒径分析软件(Nano Measurer 1.2, Fudan University, China)处理,至少分析1 000颗纳米粒,以便用于计算平均粒径和拟合粒径分布曲线。
2.3.2 载药效率精确称取一定量的DOX&PTX@CS纳米粒,将其分散于1% (体积分数)醋酸溶液中并搅拌,使CS和DOX充分溶解,加入等体积的乙醇溶解PTX,待形成均一溶液后,用紫外可见分光光度计(UV-1800, Shimadzu, Japan)在478 nm处测定DOX含量。PTX含量则通过高效液相色谱法HPLC (Agilent 1100, Agilent, USA)测定。色谱仪使用C18反相色谱柱ODS-2 Hypersil (4.6 mm × 250 mm, 5 μm, Thermo, USA),流动相为体积比V(乙腈): V(水)=1:1,体积流量为1 mL·min−1,进样量为20 μL,检测波长为227 nm。载药效率等于DOX&PTX@CS纳米粒中实际测定的药物质量与理论负载药物质量之比。
2.3.3 傅里叶变换红外光谱通过傅里叶变换红外光谱(fourier transform infrared spectroscopy, FT-IR, Nicolet 5700, Thermo Electron Corp., USA)分析CS、DOX、PTX经SAA-HCM技术处理前后的结构变化。将约1 mg待测样品与约100 mg溴化钾混合后充分研磨,使用压片机将该混合粉末压成透明薄片。每个样品在4 000~400 cm−1范围内扫描256次,分辨率为4 cm−1。
2.3.4 热重分析热重分析(thermogravimetric analysis, TGA)用于分析原料、DOX&PTX@CS纳米粒含水量和分解情况。将约3 mg样品置于TGA托盘上的干锅内,在N2氛围下以10 ℃·min−1的升温速度从50 ℃升温到500 ℃,程序自动记录样品质量随温度变化情况,以温度为横坐标、样品质量占初始质量的百分比为纵坐标作图,得到TGA曲线。
2.3.5 X-射线衍射X-射线衍射(X-ray diffraction, XRD) 用于分析样品的结晶行为。以Ni-filtered Cu为靶材,Kα发射,激发电压为40 kV,管电流为40 mA,2θ范围为5°~80°。
2.3.6 体外药物释放以pH分别为6.5和4.5、含30%乙醇(体积分数)的磷酸盐缓冲液(PBS, 0.1 mol·L−1)为释放介质,考察体外药物释放情况。精确称取一定量的DOX&PTX@CS纳米粒置于透析袋内,再加入1 mL释放介质,将透析袋浸入9 mL释放介质中,置于水浴摇床进行药物释放(37℃, 100 r·min−1)。在设定时间间隔点取出1 mL透析袋外释放介质,用紫外可见分光光度计在478 nm处测定DOX含量,HPLC测定PTX含量,同时向释放体系中补充1 mL新鲜释放介质,维持释放体积恒定。以时间为横坐标、累积释放率为纵坐标作图得到药物体外释放曲线。
2.3.7 体外肿瘤细胞毒性实验通过CCK-8法测定CS、DOX、PTX及DOX&PTX@CS纳米粒体外肿瘤细胞毒性。将96孔板中每孔铺入104个细胞,体积为100 μL,在CO2体积分数为5%的、相对湿度为95%及37℃培养箱中培养24 h,待细胞完全贴壁,每孔加入100 μL以相同培养基配制的样品溶液(质量浓度分别为0.01、0.1和1 μg·mL−1),在37℃培养箱中分别培养24、48和72 h后,每孔加入20 μL CCK-8试剂,继续孵育4 h,使用酶标仪(Infinite F50, Tecan, Switzerland)在450 nm处测定吸光度。
3 结果与讨论 3.1 操作参数对DOX&PTX@CS纳米粒形貌及粒径分布的影响由于CS和DOX能溶于水体系,而PTX为脂溶性药物,为了便于SAA-HCM技术一步制备同时负载DOX和PTX的CS纳米粒,本研究使用水-乙醇作为共溶剂。与水相比,乙醇在SC-CO2中具有更高的溶解度[24-25],在待处理液与SC-CO2混合过程中,水、乙醇在SC-CO2中溶解度的差异使得待处理液中各溶质溶解行为发生变化;此外,液滴干燥过程中,水、乙醇不同的挥发速率导致PTX、CS及DOX析出速度有差异,从而影响纳米粒形貌和粒径分布。在SAA-HCM技术中,以上过程均受到各操作参数的调控,本研究详细研究了各操作条件对DOX&PTX@CS纳米粒形貌及其粒径分布的影响。根据预实验结果,混合器温度和压力分别设置为70℃和12 MPa,m(CS): m(DOX): m(PTX) =3:1:1,其他条件如表 1所示。表中,ρ为待处理液质量浓度,g·L−1;R为CO2与待处理液质量流量之比;Mw为CS的相对分子质量;tp为沉淀器温度,℃。
|
|
表 1 SAA-HCM技术制备DOX&PTX@CS纳米粒过程各操作参数汇总 Table 1 Process parameters of SAA-HCM in the preparation of DOX&PTX@CS nanoparticles |
图 1为在不同的水、乙醇体积比V(water): V(ethanol)下制备得到的DOX&PTX@CS纳米粒SEM图。由图 1(a)和(b)可见,当V(water) : V(ethanol)=1:2和1:1时,纳米粒为均匀分布的球形结构;但当V(water) : V(ethanol)增大为2:1时,在球形纳米粒中混杂有一些棒状物,如图 1(c)所示,这主要是由于较高的水与乙醇体积比使待处理液体系稳定性降低所致。在制备DOX&PTX@CS纳米粒过程中还发现,当V(water) : V(ethanol)=2:1时,将CS、DOX和PTX溶液混合后放置一段时间会有絮状物析出。离心分离絮状物,测量上清液中各溶质质量,与初始待处理液比较发现,PTX的浓度有较大程度的降低,而CS和DOX的浓度几乎无变化,由此可知析出的絮状物主要是PTX;进而可推测,制备得到的纳米粒中混杂的棒状物应为析出的PTX。而在SAA-HCM技术制备DOX&PTX@CS纳米粒过程中,待处理液与SC-CO2混合过程会进一步降低水与乙醇体积比较高体系的稳定性。与水相比,乙醇在SC-CO2中具有更高的溶解度[24-25],当乙醇含量较低时,一部分乙醇溶于SC-CO2使体系中乙醇含量进一步降低,从而导致PTX析出。此外,研究结果表明,不同的水与乙醇体积比对其粒径分布影响不大。

|
图 1 溶剂中水与乙醇不同体积比条件下制备得到的DOX&PTX@CS纳米粒SEM图 Fig.1 SEM images of DOX&PTX@CS nanoparticles prepared under different water/ethanol volume ratios |
详细考察了待处理液质量浓度ρ (CS、DOX和PTX三者总浓度)对DOX&PTX@CS纳米粒形貌及其粒径分布的影响。当ρ > 3 g·L−1 (如4或5 g·L−1)时,将CS水溶液、DOX水溶液和PTX乙醇溶液混合会出现絮状物,无法形成均一溶液。图 2是ρ分别为1、2和3 g·L−1条件下制备得到的DOX&PTX@CS纳米粒的SEM图,由图可见,当ρ为1和2 g·L−1时,能得到分散性良好的球形纳米粒;而当ρ增大到3 g·L−1时,制备得到的纳米粒中出现了大量不规则的棒状和梭状结构。经过分析,主要原因是水与乙醇共溶剂体系对PTX溶解能力有限,当ρ > 3 g·L−1时,PTX析出形成絮状物。且ρ为3 g·L−1的待处理液放置一段时间后也会出现絮状物,说明该条件下待处理液处于拟稳态,拟稳态体系在SAA-HCM技术处理过程中极不稳定,会加剧PTX析出,形成棒状和梭状结构。

|
图 2 不同待处理液浓度制备得到的DOX&PTX@CS纳米粒SEM图 Fig.2 SEM images of DOX&PTX@CS nanoparticles prepared under different solution concentrations |
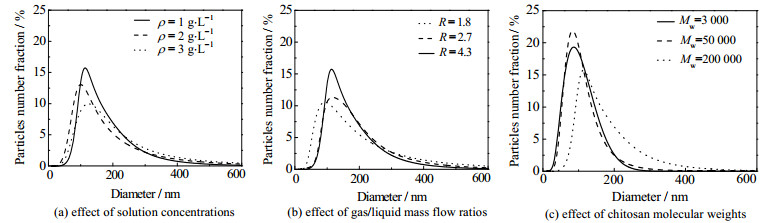
图 3(a)为不同ρ下制备得到的纳米粒粒径分布曲线。由图可见,当ρ从3降为1 g·L−1时,DOX&PTX @CS纳米粒粒径分布更集中,平均粒径变小为(173±6.6) nm。ρ较低时,一方面会降低溶液黏度和表面张力,使得雾化更剧烈,另一方面会使单液滴中溶质量减少,这两方面因素综合影响的结果使得制备的纳米粒分布更均匀,平均粒径更小。
|
图 3 不同条件下制备得到的DOX&PTX@CS纳米粒粒径分布曲线 Fig.3 Size distributions of DOX&PTX@CS nanoparticles prepared under different conditions |
图 4是CO2与待处理液质量流量之比R分别为1.8、2.7和4.3条件下制备得到了DOX&PTX@CS纳米粒SEM图。由图可见,纳米粒均为分散性良好的球形颗粒,随着R从1.8变为4.3,DOX&PTX@CS纳米粒粒径越来越小。而从图 3(b)的粒径分布曲线也可看出,R=4.3时,粒径分布更集中。在实验过程中,保持CO2质量流量不变,随着R增大,处理液质量流量变小,雾化过程中喷嘴处液膜厚度变薄,雾化更剧烈,得到更小液滴,从而制备得到更小的DOX&PTX@CS纳米粒。

|
图 4 不同气液质量流量比条件下制备得到的DOX&PTX@CS纳米粒SEM图 Fig.4 SEM images of DOX&PTX@CS nanoparticles prepared under different gas/liquid mass flow ratios |
本实验以Mw分别为3 000、50 000和200 000的CS为载体,制得了球形度良好、分散均匀的DOX&PTX@CS纳米粒。从图 3(c)的粒径分布曲线可以发现,当Mw从3 000增大为200 000时,纳米粒的平均粒径变大,且粒径分布变宽。CS的相对分子质量变大会使待处理液黏度和表面张力增大,不利于雾化进行,导致形成的液滴较大且不均匀,从而使纳米粒平均粒径变大、粒径分布变宽。
3.1.5 沉淀器温度的影响与之前SAA-HCM技术制备微球和纳米粒研究中使用单一溶剂体系不同,本研究两种药物使用水-乙醇作为共溶剂,而共溶剂体系液滴在不同干燥温度下其溶剂挥发速率会存在差异,因此有必要详细研究沉淀器温度tp对制备DOX&PTX@CS纳米粒形貌的影响。图 5为不同tp下制备得到的DOX&PTX@CS纳米粒SEM图。由图可见,当tp为50、90和100 ℃时,纳米粒为表面光滑的球形,但是当tp为60、70和80℃时,纳米粒表面出现较多小突起。该现象主要是由于在不同tp下水和乙醇沸点和挥发速率不同所致。当tp为90和100 ℃时,热氮气温度在100与120 ℃之间,高于水和乙醇的沸点,使得小液滴中的水和乙醇均迅速挥发,而两者挥发速率差异较小,CS、DOX和PTX同步析出形成表面光滑的球形颗粒。同理,当tp为50 ℃时,热氮气温度为70 ℃,低于水和乙醇的沸点,水和乙醇挥发速率均较慢,最后形成的纳米粒依然呈现表面光滑的球形颗粒。而当tp为60、70和80 ℃时,热氮气温度介于80与100 ℃之间,高于乙醇沸点但低于水的沸点,使得液滴中乙醇和水的挥发速率出现较大差异,乙醇首先挥发使PTX率先析出,导致纳米粒表面形成突起结构。总体而言,由于DOX&PTX@CS纳米粒制备过程中雾化产生的液滴粒径较小,具有较大比表面积,有利于液滴干燥过程传热和传质;此外,乙醇的加入使共溶剂体系沸点降低,水和乙醇能在较低干燥温度下挥发。当R为4.3时,同时雾化进入沉淀器的待处理液量较少,沉淀器又具有较高干燥效率,因此,如图 5(a)所示,能在较低干燥温度下(tp=50 ℃)制备得到球形度和分散性良好的干燥纳米粒。

|
图 5 不同沉淀器温度下制备得到的DOX&PTX@CS纳米粒SEM图 Fig.5 SEM images of DOX&PTX@CS nanoparticles prepared under different precipitator temperatures |
通过紫外可见分光光度法和HPLC测定DOX和PTX的载药效率。DOX和PTX均具有较高载药效率,分别为(80.94±15.25)%和(76.16±14.53)%。在SAA-HCM技术制备DOX&PTX@CS纳米粒过程中,在热氮气加热下,随着液滴中溶剂挥发,药物和载体共同析出形成载药纳米粒,因此大部分DOX和PTX能负载于CS纳米粒中实现较高载药效率。
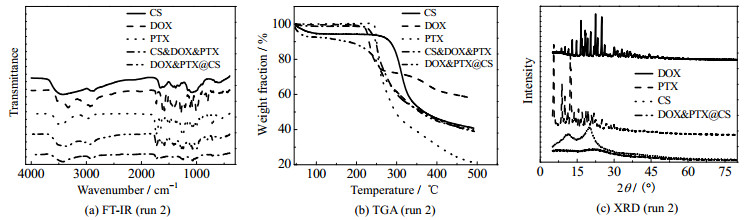
3.3 DOX&PTX@CS纳米粒固态表征 3.3.1 DOX&PTX@CS纳米粒的FT-IR表征图 6(a)为原料及DOX&PTX@CS纳米粒的FT-IR图。图中1 726 cm−1处的峰为DOX和PTX中C═O双键的伸缩振动,802.2 cm−1处的峰为DOX中芳香环C─H键面外弯曲振动,709.7 cm−1处的峰为PTX中苯基C─H键面外弯曲振动。由图可见,以上DOX和PTX的特征峰在三者的物理混合物CS & DOX&PTX和DOX&PTX@CS纳米粒中均有出现,未发生位移,说明经过SAA-HCM技术处理后,DOX和PTX结构均未发生变化。
|
图 6 DOX&PTX@CS纳米粒固态表征结果 Fig.6 Solid state characterization results of DOX&PTX@CS nanoparticles prepared by SAA-HCM |
通过TGA曲线对原料及DOX&PTX@CS纳米粒含水量和热稳定性进行分析,如图 6(b)所示。由图可见,原料含水量较低,而DOX&PTX@CS纳米粒含水量大约为6% (质量分数),纳米粒含水量变大主要与其具有较大比表面积有关。由图还可见,DOX&PTX@CS纳米粒热分解曲线与物理混合物CS & DOX&PTX热分解曲线几乎一致,说明经SAA-HCM技术处理后,CS、DOX及PTX的热稳定性没有发生变化。
3.3.3 DOX&PTX@CS纳米粒的XRD分析如图 6(c)所示,通过原料及DOX&PTX@CS纳米粒XRD图谱对其结晶行为进行研究。DOX和PTX出现极强的衍射峰,说明其为晶体结构;CS未出现明显衍射峰,说明其主要为无定形态;而DOX&PTX@CS纳米粒中DOX和PTX的衍射峰均消失,说明经SAA-HCM技术处理后其转变为无定形态,这有利于药物释放后快速溶解。上述DOX&PTX@CS纳米粒制备条件为V(water) : V(ethanol)=1:1、ρ =1 g·L−1、tp = 90 ℃、热氮气温度为110 ℃。在此条件下,液滴干燥过程中水和乙醇迅速挥发,药物分子快速析出,来不及重排形成晶体结构,因此形成无定形态的DOX&PTX@CS纳米粒。XRD图谱中PTX衍射峰消失也进一步说明,在此制备条件下PTX没有提前析出形成棒状晶体结构,与图 5(e)的结果一致。
3.4 DOX&PTX@CS纳米粒体外药物释放分别以pH值为6.5和4.5的释放介质模拟肿瘤微环境和肿瘤细胞器内的pH环境。图 7为不同pH条件下DOX&PTX@CS纳米粒中药物体外释放情况。由图可见,在相同pH条件下,DOX的释放速率快于PTX。DOX在释放初期就表现出较强pH响应性,pH为6.5时,最大累积释放率为(43.8±3.3)%;当pH减小到4.5时,最大累积释放率达到(90.0±3.5)%。PTX在释放初期受pH影响较小,随着释放时间延长,pH值较低的PTX释放速率加快,也表现出pH响应性。纳米粒中药物pH响应性释放主要是因为CS链在低pH下质子化、链间距增大,纳米粒中出现较大孔隙,药物随孔隙快速扩散进入释放体系。与DOX相比,PTX的释放速率较低,推测是PTX为疏水性药物,在该体系中溶解速率较慢,其释放过程除取决于扩散速率外,还受溶解速率影响。总体而言,负载于DOX&PTX@CS纳米粒中的协同药物在模拟肿瘤细胞器pH条件下均能成功释放,且相比于较高pH条件,pH值较低时具有更大累积释放率,表明DOX&PTX@CS纳米粒具有肿瘤细胞器微环境响应协同药物输送的应用潜力。

|
图 7 DOX&PTX@CS纳米粒体外药物释放 Fig.7 In vitro drug release profiles of DOX&PTX@CS nanoparticles |
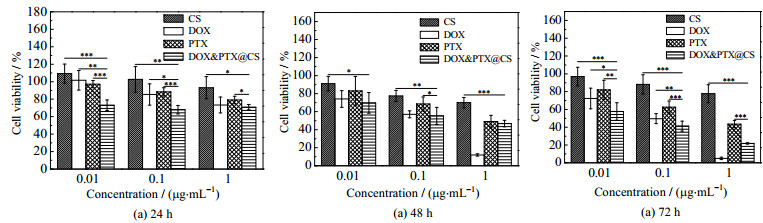
图 8为不同处理时间下CS、DOX、PTX及DOX&PTX@CS纳米粒对A549细胞毒性的影响,其中DOX&PTX@CS给药浓度定义为DOX和PTX等效剂量之和。由图可见,不同浓度的CS处理A549细胞一段时间后,细胞的相对活力仍保持在80%以上,说明CS对细胞毒性较小。与CS相比,不同浓度的DOX&PTX@CS纳米粒处理A549细胞一段时间后,细胞的相对活力下降明显,说明DOX&PTX@CS纳米粒对A549细胞系存在明显毒性。与单药DOX及PTX相比,同等剂量的DOX&PTX@CS纳米粒在相同处理时间下对A549细胞的毒性影响相当,甚至观察到毒性有增强现象。一方面表明经SAA-HCM技术处理后,DOX及PTX生物活性保持良好,另一方面表明,DOX及PTX协同作用后,能在单药用药量降低情况下达到相同的癌细胞杀灭效果,甚至能实现增效,该结果与文献报道一致[26]。需要指出的是,给药剂量为1 μg·mL−1、处理48 h以上时,单药DOX对A549细胞毒性比DOX&PTX@CS纳米粒稍强,主要原因是高剂量DOX长时间作用下对细胞毒性较强。虽然使用高剂量的单药DOX具有较强癌细胞毒性,但在相同处理时间下,DOX&PTX@CS纳米粒在DOX和PTX给药剂量均减半的情况下协同作用对A549细胞依然存在较强毒性,单药用药量减少能显著降低对正常组织的副作用。
|
图 8 不同处理时间下DOX&PTX@CS纳米粒对A549细胞毒性影响 Fig.8 Relative cell viability of A549 after treated by DOX&PTX@CS nanoparticles for different times(*P < 0.05, **P < 0.01, ***P < 0.001) |
本研究利用SAA-HCM技术一步法将具有不同溶解特性的DOX和PTX同时负载于CS中,制备得到DOX&PTX@CS纳米粒,并通过SAA-HCM操作参数优化对DOX&PTX@CS纳米粒形貌及粒径分布进行调控。共溶剂体系的引入,使得纳米粒的形貌及粒径更易受SAA-HCM操作参数影响,也就是说,待处理液与SC-CO2混合过程中需选择合适的溶剂组分及待处理液浓度,以确保该过程中待处理液的稳定性;此外,在液滴干燥过程中,由于共溶剂体系各成分挥发速率差异及各溶质溶解度不同,需调整沉淀器温度,以便获得形貌良好的DOX&PTX@CS纳米粒。由于SAA-HCM技术操作过程简单、操作条件温和,可一步制备得到载药效率高、DOX和PTX药物活性能保持良好的DOX&PTX@CS纳米粒。该纳米粒具有癌细胞协同抑制效果。SAA-HCM技术在共溶剂体系及双载药纳米系统制备中的成功应用,将进一步促进该技术在其他协同给药纳米系统的绿色高效制备中的应用。
| [1] |
GAO Y, CHEN Y, JI X F, et al. Controlled intracellular release of doxorubicin in multidrug-resistant cancer cells by tuning the shell-pore sizes of mesoporous silica nanoparticles[J]. ACS Nano, 2011, 5(12): 9788-9798. DOI:10.1021/nn2033105 |
| [2] |
FAN W P, SHEN B, BU W B, et al. A smart upconversion-based mesoporous silica nanotheranostic tem for synergetic chemo-/radio-/photodynamic therapy and simultaneous MR/UCL imaging[J]. Biomaterials, 2014, 35(32): 8992-9002. DOI:10.1016/j.biomaterials.2014.07.024 |
| [3] |
ANWER K, KELLY F J, CHU C, et al. Phase Ⅰ trial of a formulated IL-12 plasmid in combination with carboplatin and docetaxel chemotherapy in the treatment of platinum-sensitive recurrent ovarian cancer[J]. Gynecologic Oncology, 2013, 131(1): 169-173. DOI:10.1016/j.ygyno.2013.07.081 |
| [4] |
LI N N, ZHAO L X, QI L S, et al. Polymer assembly: Promising carriers as co-delivery systems for cancer therapy[J]. Progress in Polymer Science, 2016, 58: 1-26. DOI:10.1016/j.progpolymsci.2015.10.009 |
| [5] |
LV S X, TANG Z H, LI M Q, et al. Co-delivery of doxorubicin and paclitaxel by PEG-polypeptide nanovehicle for the treatment of non-small cell lung cancer[J]. Biomaterials, 2014, 35(23): 6118-6129. DOI:10.1016/j.biomaterials.2014.04.034 |
| [6] |
ZHAO D J, WU J L, LI C X, et al. Precise ratiometric loading of PTX and DOX based on redox-sensitive mixed micelles for cancer therapy[J]. Colloids and Surfaces B: Biointerfaces, 2017, 155: 51-60. DOI:10.1016/j.colsurfb.2017.03.056 |
| [7] |
WANG Y W, ZHANG H Y, HAO J, et al. Lung cancer combination therapy: Co-delivery of paclitaxel and doxorubicin by nanostructured lipid carriers for synergistic effect[J]. Drug Delivery, 2016, 23(4): 1398-1403. DOI:10.3109/10717544.2015.1055619 |
| [8] |
ZHAO Z H, XU K, FU C, et al. Interfacial engineered gadolinium oxide nanoparticles for magnetic resonance imaging guided microenvironment-mediated synergetic chemodynamic/photothermal therapy[J]. Biomaterials, 2019, 219: 119379. DOI:10.1016/j.biomaterials.2019.119379 |
| [9] |
LEE S, BAEK M, KIM H Y, et al. Mechanism of doxorubicin-induced cell death and expression profile analysis[J]. Biotechnology Letters, 2002, 24(14): 1147-1151. DOI:10.1023/A:1016174800956 |
| [10] |
HUANG Y, JOHNSON K, NORRIS J, et al. Nuclear factor-kappa B/I kappa B signaling pathway may contribute to the mediation of paclitaxel-induced apoptosis in solid tumor cells[J]. Cancer Research, 2000, 60(16): 4426-4432. |
| [11] |
JIANG Y H, ZHOU Y J, ZHANG C Y, et al. Co-delivery of paclitaxel and doxorubicin by pH-responsive prodrug micelles for cancer therapy[J]. International Journal of Nanomedicine, 2020, 15: 3319-3331. DOI:10.2147/IJN.S249144 |
| [12] |
WANG W, ZHAO B Y, MENG X Y, et al. Preparation of dual-drug conjugated polymeric micelles with synergistic anti-cancer efficacy in vitro[J]. Journal of Drug Delivery Science and Technology, 2018, 43: 388-396. DOI:10.1016/j.jddst.2017.11.007 |
| [13] |
WANG Y L, WANG J M, YANG L Y, et al. Redox dual-responsive paclitaxel-doxorubicin heterodimeric prodrug self-delivery nanoaggregates for more effective breast cancer synergistic combination chemotherapy[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2019, 21: 102066. DOI:10.1016/j.nano.2019.102066 |
| [14] |
CUI Y N, XU Q X, CHOW P K H, et al. Transferrin-conjugated magnetic silica PLGA nanoparticles loaded with doxorubicin and paclitaxel for brain glioma treatment[J]. Biomaterials, 2013, 34(33): 8511-8520. DOI:10.1016/j.biomaterials.2013.07.075 |
| [15] |
HE H, WANG Y, WEN H, et al. Dendrimer-based multilayer nanocarrier for potential synergistic paclitaxel-doxorubicin combination drug delivery[J]. RSC Advances, 2014, 4(7): 3643-3652. DOI:10.1039/C3RA43803A |
| [16] |
REVERCHON E. Supercritical-assisted atomization to produce micro- and/or nanoparticles of controlled size and distribution[J]. Industrial & Engineering Chemistry Research, 2002, 41(10): 2405-2411. |
| [17] |
超临界辅助雾化法制备红霉素超细微粒[J]. 高校化学工程学报, 2007, 21(1): 43-47. LI Z Y, ZHAO S X, JIANG J Z, et al. Preparation of erythromycin micro-particles by supercritical assisted atomization[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(1): 43-47. |
| [18] |
CAI M Q, GUAN Y X, YAO S J, et al. Supercritical fluid assisted atomization introduced by hydrodynamic cavitation mixer (SAA-HCM) for micronization of levofloxacin hydrochloride[J]. The Journal of Supercritical Fluids, 2008, 43(3): 524-534. DOI:10.1016/j.supflu.2007.07.008 |
| [19] |
SHEN Y B, DU Z, TANG C, et al. Formulation of insulin-loaded N -trimethyl chitosan microparticles with improved efficacy for inhalation by supercritical fluid assisted atomization[J]. International Journal of Pharmaceutics, 2016, 505(1/2): 223-233. |
| [20] |
HONG D X, YUN Y L, GUAN Y X, et al. Preparation of micrometric powders of parathyroid hormone (PTH1-34)-loaded chitosan oligosaccharide by supercritical fluid assisted atomization[J]. International Journal of Pharmaceutics, 2018, 545(1/2): 389-394. |
| [21] |
强化混合超临界辅助雾化法制备玉米醇溶蛋白微粒[J]. 高校化学工程学报, 2017, 31(5): 1135-1142. JIANG S S, ZHANG Q L, GUAN Y X, et al. Preparation of zein microparticles via supercritical fluid assisted atomization with an enhanced mixer[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(5): 1135-1142. |
| [22] |
PENG H H, HONG D X, GUAN Y X, et al. Preparation of pH-responsive DOX-loaded chitosan nanoparticles using supercritical assisted atomization with an enhanced mixer[J]. International Journal of Pharmaceutics, 2019, 558: 82-90. DOI:10.1016/j.ijpharm.2018.12.077 |
| [23] |
SHEN Y B, DU Z, WANG Q, et al. Preparation of chitosan microparticles with diverse molecular weights using supercritical fluid assisted atomization introduced by hydrodynamic cavitation mixer[J]. Powder Technology, 2014, 254: 416-424. DOI:10.1016/j.powtec.2014.01.054 |
| [24] |
SABIRZYANOV A N, IL'IN A P, AKHUNOV A R, et al. Solubility of water in supercritical carbon dioxide[J]. High Temperature, 2002, 40(2): 203-206. DOI:10.1023/A:1015294905132 |
| [25] |
CHANG C J, DAY C Y, KO C M, et al. Densities and P-x-y diagrams for carbon dioxide dissolution in methanol, ethanol, and acetone mixtures[J]. Fluid Phase Equilibria, 1997, 131(1/2): 243-258. |
| [26] |
MA X D, ÖZLISELI E, ZHANG Y Z, et al. Fabrication of redox-responsive doxorubicin and paclitaxel prodrug nanoparticles with microfluidics for selective cancer therapy[J]. Biomaterials Science, 2019, 7(2): 634-644. DOI:10.1039/C8BM01333K |




