结肠癌由于其较高的发病率和致死率,对人类的生命健康造成严重威胁[1-2]。化学疗法是治疗结肠癌的主要方法之一。然而,单一给药的临床效果不理想,易对机体造成毒副作用及产生多药耐药性[3]。将两种或多种药物组合协同给药可以作用于不同的代谢通路,抑制癌细胞的增殖,有效降低药物的给药剂量,增强药物的治疗效果,避免引发耐药性[4]。常规的协同治疗是在同一疗程内注射或服用多种药物,因而难以调控药物在机体内的分布。为了最大限度地发挥药物的协同作用,需要保证两种药物能够同时递送到肿瘤细胞内,共同发挥抑癌效果。目前,关于纳米载药体系如乳浊液、脂质体、前药胶束等用于构建协同给药体系,以实现药物的同步递送,均有报道[5-8]。
聚合物前药是将疏水性的药物通过化学键偶联于亲水性的聚合物分子主链上形成的两亲性偶联物。其中,羟乙基淀粉(HES)等多糖化合物作为生物可降解的天然高分子材料,在前药体系中得到了广泛的应用[9]。两亲性的多糖前药通过自组装形成胶束,其内部的疏水核心能够借助疏水作用负载另一种疏水性化疗药物[10]。前药胶束的亲水性外壳作为“保护层”,可以有效地将疏水核心与外部环境隔开,避免药物在循环过程中被酶降解而失活[11]。在这种协同给药体系中,前药胶束既可以通过化学键合的方式偶联疏水性药物,也可作为载体通过物理作用包埋另一种疏水性药物,兼具多糖前药体系和协同给药的优势,在癌症治疗中具有良好的应用前景[12-15]。
姜黄素(CUR)是一种天然化合物,具有良好的抗炎和抗癌特性[16-17]。研究表明,CUR能够参与调节抑癌基因及癌细胞转移的相关通路,与化疗药物伊利替康、5-氟尿嘧啶、奥沙利铂等协同给药可以增强对结肠癌的治疗效果[18-21]。7-乙基-10-羟基喜树碱(SN38)是伊利替康的活性代谢产物,由于其水溶性差难以在临床上直接应用,亟须构建化疗药物的理想药物递送体系,实现CUR和SN38的协同给药。值得注意的是,对于通过物理作用负载化疗药物的协同给药系统,化疗药物与CUR之间的作用力强弱对体系稳定性起着至关重要的作用,有必要进行深入探讨。
本研究基于季铵盐羟乙基淀粉-姜黄素(QHES-S-CUR)前药,拟于其内核负载SN38,构建协同给药胶束。首先,借助分子动力学模拟手段,计算CUR与SN38共混体系的相互作用参数,包括Lennard-Jones势能、库仑力、总能量及质心距离,预测CUR与SN38共混体系的稳定性。在此基础上,在QHES-S-CUR疏水内核负载SN38,构建协同给药体系SN38@QHES-S-CUR胶束,研究QHES-S-CUR与SN38的质量比对协同给药胶束形貌及粒径分布的影响,测定其在模拟的肿瘤微环境中的药物释放行为。最后,以小鼠结肠癌细胞为模型,对协同给药胶束的细胞毒性进行评价,旨在为前药胶束在协同给药上的应用提供参考。
2 实验部分 2.1 材料SN38 (质量分数为99%)购于北京百灵威科技有限公司;CUR (质量分数为95%)购于上海源叶生物科技有限公司;HES(平均分子量为130 kDa,摩尔取代度为0.4)购于上海吉至生化科技有限公司;3, 3'-硫代二丙酸(TDPA,质量分数为95%)、1-羟基苯并三唑(HOBT,质量分数为97%)购于上海阿拉丁生化科技股份有限公司;4-二甲氨基吡啶(DMAP,质量分数为99%)购于上海麦克林生化科技有限公司;二环己基碳二亚胺(DCC,质量分数为99%)购于生工生物工程(上海)股份有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDCL,质量分数为97%)购于北京华威锐科化工有限公司;维生素E聚乙二醇琥珀酸酯(TPGS,试剂级)购于北京伊诺凯科技有限公司;小鼠结肠癌细胞CT-26来源于ATCC细胞库;DMEM高糖培养基购于浙江吉诺生物医药技术有限公司;细胞计数试剂盒(CCK-8)购于大连美仑生物技术有限公司。其他试剂均为市售分析纯。
2.2 实验方法 2.2.1 CUR与SN38共混体系的分子动力学模拟方法本研究模拟采用GRMOMS 54A7力场。CUR与SN38的分子结构文件从ATB网站(Automated Topology Builder and Repository)获得。利用分子动力学模拟预测CUR与SN38之间的相互作用。具体步骤如下:
(1) 用Gromacs 2019构建1个空盒子,依次向盒子中添加1个CUR分子及1个SN38分子;
(2) 向盒子中添加水分子溶剂化后,建立能量最小化平衡体系,利用最陡下降法进行5万步的能量最小化;
(3) 建立NVT平衡体系,积分步长为0.002 ps,步数为5 000;
(4) 建立NPT平衡体系,积分步长为0.002 ps,步数为5 000;
(5) 进行成品模拟,积分步长为0.002 ps,步数为5 000 000;
(6) 经过处理后,对CUR与SN38之间的作用力、能量、质心距离和主要构象进行计算和分析。
2.2.2 QHES-S-CUR的合成首先,通过醚化反应合成季铵盐羟乙基淀粉(QHES)[22],然后,由两步酯化法制备QHE-S-CUR前药,具体过程如下。第1步:TDPA的羧基与QHES的羟基发生酯化反应,得到末端羧基化的QHES-S-COOH。将TDPA (1.426 g,8 mmol)和DMAP (0.464 g,4 mmol)共溶于15 mL二甲基亚砜溶液中,将DCC (1.03 g,5 mmol)充分溶解于10 mL二甲基亚砜溶液中,将后者逐滴加入前者,室温下反应0.5 h。随后,向体系内加入1 g QHES,在氮气保护下室温反应48 h。反应结束后,抽滤除去不溶性副产物,所得滤液置于透析袋(MWCO 3 500 Da),在二甲基亚砜中透析48 h。第2步:CUR的羟基与QHES-S-COOH发生酯化反应。收集透析后的溶液,加入EDCL (0.230 4 g,1.2 mmol)与HOBT (0.168 g,0.12 mmol),室温下反应0.5 h。随后,向体系中加入0.147 g CUR,在氮气保护下避光反应24 h。将反应液置于透析袋(MWCO 3 500 Da),在去离子水中透析48 h,透析液冻干,得到的粉末为QHES-S-CUR。
2.2.3 基于QHES-S-CUR的协同给药胶束制备负载SN38的协同给药胶束SN38@QHES-S-CUR是通过两亲性前药分子QHES-S-CUR与SN38自组装得到的。将QHES-S-CUR (10、20或40 mg)与SN38 (1 mg)共溶于1 mL二甲基亚砜溶液中,在磁力搅拌下逐滴加入15 mL浓度为1 g·L−1的TPGS溶液中。所得溶液置于透析袋(MWCO 3 500 Da),在去离子水中透析48 h,以除去有机溶剂和游离的SN38,冻干后密封保存。
2.2.4 SN38@QHES-S-CUR胶束形貌及粒径分析用透射电镜法(TEM)观察SN38@QHES-S-CUR胶束形貌。将制得的SN38@QHES-S-CUR胶束水溶液滴加到专用铜网上,于室温下自然风干,用TEM (HT-770,Hitachi Corp.,Japan)观察其形貌。SN38@QHES-S-CUR胶束粒径和表面电势通过纳米粒度仪(Nano-ZS,Malvern Instruments Ltd.,UK)测定,每组样品重复测定3次。
2.2.5 SN38@QHES-S-CUR固态表征方法用傅里叶变换红外光谱法(FT-IR)对SN38@QHES-S-CUR胶束、QHES-S-CUR和SN38的化学结构进行表征。将待测样品与溴化钾充分研磨混合,压片法制成薄片,置于傅里叶变换红外光谱仪(Nicolet 5700,Thermo Electron Corp.,USA)中,扫描范围为4 000~400 cm−1,扫描256次,分辨率为4 cm−1。用X-射线衍射法(XRD)分析样品的晶型状态。以Ni-filtered Cu为靶材,Kα发射,X-射线衍射仪(X-pert Powder,PANalytical B.V. Corp.,Netherlands)激发电压为40 kV,管电流为40 mA,扫描角度2θ为5º~ 80º。
2.2.6 SN38@QHES-S-CUR胶束体外药物释放分析分别在含10 g·L−1吐温-80的磷酸缓冲液(PBS)介质、含10 g·L−1吐温-80和10 mmol·L−1 H2O2的PBS介质中考察SN38@QHES-S-CUR胶束的体外释放行为,释放介质的pH值为7.4。将SN38@QHES-S-CUR透析液加入1 mL的释放介质中,并装入密闭的透析袋(MWCO 8 000-14 000 Da),浸没于9 mL的释放介质中,然后置于37 ℃恒温摇床内,摇床的转速为100 r·min−1。按不同时间间隔取1 mL释放介质样品,分别测定其在371 nm及420 nm处的吸光度,并向释放体系中补充1 mL新鲜的释放介质以维持其体积恒定。由标准曲线计算出CUR和SN38的累积释放量。
2.2.7 体外细胞毒性评价体外细胞毒性试验以小鼠结肠癌细胞CT-26为细胞模型。细胞培养于含有质量分数为1% 的青-链霉素双抗及质量分数为10% 胎牛血清的DMEM高糖培养基中,培养条件为温度37 ℃、CO2的体积分数为5% 的气体环境,相对湿度为95%。SN38及SN38@QHES-S-CUR胶束对CT-26的细胞毒性通过CCK-8法测定。将处于对数生长期的CT-26细胞悬浮平铺于96孔板中,向每孔加入100 μL含1×104个细胞的细胞悬液;在CO2培养箱中孵育至细胞完全贴壁,再向每孔加入10 μL的待测样品溶液。不同实验组中SN38的等效质量浓度分别为5、10、25和50 μg·mL−1。给药后分别培养24 h和48 h,弃去原培养液,每孔加入100 μL新鲜的细胞培养液,并加入10 μL CCK-8试剂,孵育2 h后,用酶标仪(Infinite F50,Tecan Corp.,Australia)测定450 nm处的吸光度。样品组吸光度与空白对照组吸光度的比值定义为相对细胞活率,显然,空白对照组的相对细胞活率为100%。
3 结果与讨论 3.1 CUR与SN38共混体系的分子动力学模拟基于QHES-S-CUR的协同给药体系中,SN38通过疏水作用负载于前药胶束的疏水内核中。由于QHES-S-CUR的疏水内核是由CUR构成的,故CUR与SN38分子间的相互作用对化疗药物的负载及体系的稳定性起着至关重要的作用。通过分子动力学模拟手段,对CUR与SN38分子间的相互作用进行了探究。CUR与SN38共混体系的相互作用参数包括Lennard-Jones势能、库仑力、总能量及质心距离,这些参数随时间变化如图 1所示。经计算可得,共混体系的Lennard-Jones势能均值为(−59.26±1.93) kJ·mol−1(见图 1(a))、库仑力均值为(−4.00±0.93) kJ·mol−1 (见图 1(b))、总能量均值为(−63.8±1.68) kJ·mol−1(见图 1(c)),由此可知,CUR与SN38主要是靠范德华力结合在一起,体系能量较低,具有良好的稳定性。由图 1(d)可见,两者平均质心距离为(0.537±0.118) nm,即质心距离小于1 nm的可能性为100%,表明共混体系中两种分子可以充分靠近。
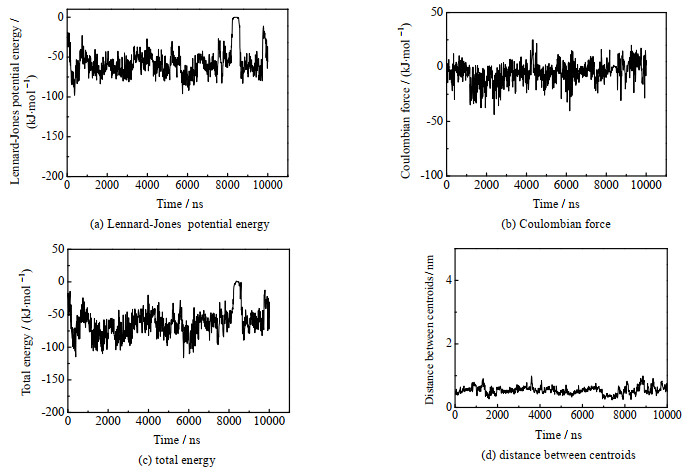
|
图 1 CUR与SN38共混体系的分子动力学模拟 Fig.1 Molecular dynamics simulation of curcumin and SN38 mixture |
在QHES-S-CUR与SN38不同质量比下纳米沉淀法制备的SN38@QHES-S-CUR胶束的形貌、胶束的光强随粒径的分布分别如图 2、3所示。由图 2(a)、3(a)可见,当QHES-S-CUR与SN38质量比m(QHES-S-CUR): m(SN38)=10:1时,SN38@QHES-S-CUR胶束呈棒状结构,其平均粒径为(869.74±37.79) nm,多分散性系数(PDI)为0.655±0.117,粒径分布较宽。由图 2(b)、3(b)可见,当m(QHES-S-CUR): m(SN38)增大到20:1时,SN38@QHES-S-CUR胶束呈球形结构,其平均粒径为(258.76±28.76) nm,PDI为0.148±0.018,粒径分布较窄。由图 2(c)、3(c)可见,当m(QHES-S-CUR): m(SN38)进一步增大到40:1时,SN38@QHES-S-CUR胶束的平均粒径为(142.88±21.81) nm,PDI为0.206±0.085,平均粒径小且粒径分布均一。

|
图 2 QHES-S-CUR与SN38不同质量比下SN38@QHES-S-CUR胶束的TEM图 Fig.2 TEM images of SN38@QHES-S-CUR prepared at different QHES-S-CUR/SN38 weight ratios |
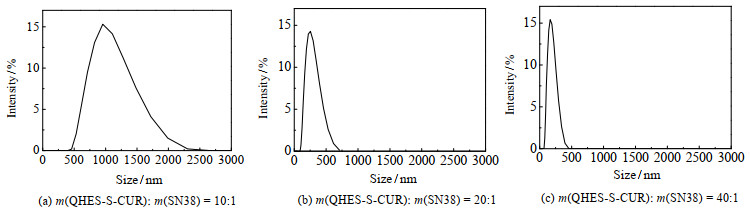
|
图 3 QHES-S-CUR与SN38不同质量比下SN38@QHES-S-CUR胶束的光强随粒径的分布图 Fig.3 Sizes and size distributions of SN38@QHES-S-CUR prepared at different QHES-S-CUR/SN38 weight ratios |
SN38@QHES-S-CUR胶束的形成机理如图 4所示。由图 4可见,当m(QHES-S-CUR): m(SN38)=10:1时,体系中SN38的占比相对较高,将QHES-S-CUR和SN38的二甲基亚砜溶液滴入TPGS水溶液中时,SN38结晶析出,QHES-S-CUR吸附在棒状SN38晶体表面,使得形成的SN38@QHES-S-CUR胶束为棒状结构,与文献报道一致[23]。当m(QHES-S-CUR): m(SN38)增大到20:1时,QHES-S-CUR占比增大,SN38被充分地包埋于QHES-S-CUR胶束疏水内核中,从而形成球形胶束结构。在季铵根基团的修饰下,SN38@QHES-S-CUR胶束呈正电性,经纳米粒度仪检测,表面电势为(14.63±2.68) mV。研究表明[24],呈正电性的协同给药胶束可与负电性的线粒体膜发生静电相互作用,促进胶束靶向递送到线粒体内,实现药物的亚细胞精准分布。由于m(QHES-S-CUR): m(SN38)大于20:1时均能制备出形貌良好、粒径分布均一的纳米胶束,因此后续实验中将m(QHES-S-CUR): m(SN38)固定为20:1。
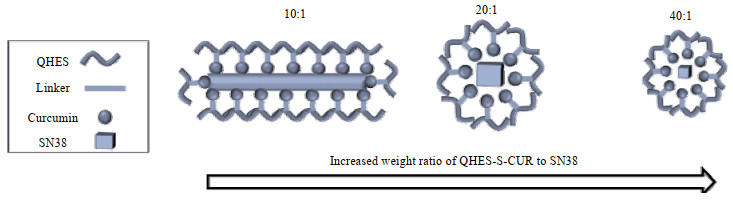
|
图 4 SN38@QHES-S-CUR胶束形成机理示意图 Fig.4 Self-assembly mechanism of SN38@QHES-S-CUR micelles Increased weight ratio of QHES-S-CUR to SN38 |
图 5为SN38、QHES-S-CUR及SN38@QHES-S-CUR胶束的FT-IR光谱。SN38在1 735 cm−1处的峰是C═O伸缩振动引起的,1 173 cm−1处的峰是C─O伸缩振动产生的[15]。QHES-S-CUR在1 514 cm−1处的特征峰是由C═C伸缩振动引起的,1 024 cm−1处的峰是C─O─C伸缩振动峰。SN38@QHES-S-CUR胶束在1 734、1 514与1 024 cm−1处有特征峰,且无新的峰出现,表明SN38是通过物理作用负载于QHES-S-CUR的,未发生化学反应。
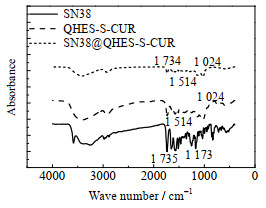
|
图 5 SN38、QHES-S-CUR及SN38@QHES-S-CUR胶束的FT-IR图 Fig.5 FT-IR spectra of SN38, QHES-S-CUR and SN38@QHES-S-CUR |
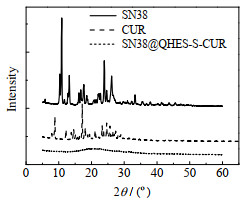
SN38、CUR及SN38@QHES-S-CUR胶束的XRD图谱如图 6所示。由图 6可见,SN38及CUR具有明显的衍射峰,说明SN38及CUR呈晶体结构;但SN38@QHES-S-CUR胶束的XRD图谱则为平缓且宽泛的曲线,没有明显的特征峰。由此可见,SN38负载于前药胶束疏水内核后,晶型结构被破坏,呈现无定型态。晶型状态转变为无定型态有利于增加药物的溶解度[25]。
|
图 6 SN38、CUR及SN38@QHES-S-CUR胶束的XRD图 Fig.6 XRD patterns of SN38, CUR and SN38@QHES-S-CUR |
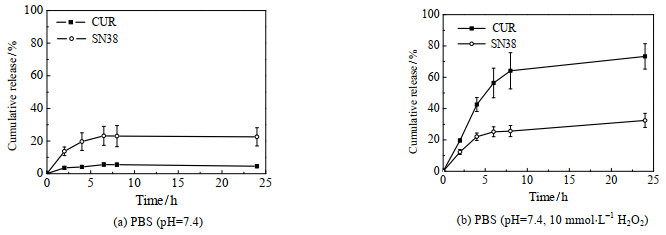
满足给药要求的抗癌药物递送体系应在到达肿瘤部位前保持良好的稳定性,避免药物泄漏引发毒副作用;且应在肿瘤微环境的刺激下能够迅速释放出活性药物,以便发挥药效。SN38@QHES-S-CUR胶束24 h内的体外药物释放行为如图 7所示。由图 7(a)可见,在不含H2O2的PBS缓冲液这一释放介质中,24 h内CUR和SN38的累积释放量均较低,分别为(4.52±0.85)%和(22.56±5.56)%。这是因为,CUR通过化学键偶联于QHES上,在PBS缓冲液中能够保持良好的稳定性,只有少量的CUR释放出来;SN38靠疏水相互作用负载于前药胶束的内核中,由于疏水相互作用属于物理作用,相对较弱,在长时间的孵育过程中,部分SN38会从胶束内核扩散到释放介质中,因此其累积释放量稍高于CUR的累积释放量。由图 7(b)可见,在含有H2O2的PBS缓冲液这一释放介质中,CUR和SN38的累积释放量24 h内分别迅速增大到(73.31±8.09) %和(32.47±4.52) %,均显著高于不含H2O2的释放介质的累积释放量。这是因为,在H2O2的作用下,QHES-S-CUR中的硫醚键发生氧化断裂,促进了邻位酯键的水解及CUR的释放;且随着QHES-S-CUR胶束结构被破坏,内核中负载的SN38释放了出来。综上所述,SN38@QHES-S-CUR胶束在模拟的正常组织液(不含H2O2的PBS缓冲液)中可保持良好的稳定性,在模拟的肿瘤微环境中(含有H2O2的PBS缓冲液)能够实现药物的响应性释放。
|
图 7 SN38@QHES-S-CUR的体外药物释放 Fig.7 In vitro drug release profiles of SN38@QHES-S-CUR |
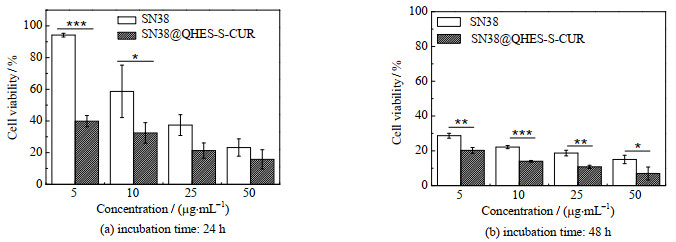
图 8为孵育时长分别为24 h、48 h时SN38及SN38@QHES-S-CUR胶束对小鼠结肠癌细胞CT-26的细胞毒性,图中SD为标准差,n为样本数,p为显著性检验值。由图 8(a)可见,与SN38相比,SN38@QHES-S-CUR胶束表现出更强的细胞毒性。当孵育时长为24 h、SN38的等效质量浓度为5 μg·mL−1时,SN38@QHES-S-CUR的相对细胞活率为(39.88±3.59)%,而SN38的相对细胞活率很高,为(94.20±1.17)%。当SN38的等效质量浓度提高到50 μg·mL−1时,SN38@QHES-S-CUR的相对细胞活率减小到(15.74± 6.03) %,SN38的相对细胞活率也降低到(23.23±5.47)%。根据文献报道,CUR与喜树碱类化合物协同给药可以激活促凋亡前体蛋白Bax,促进活性氧的产生与积累,抑制CD24、CD44和EpCAM蛋白的表达,增强对结肠癌的治疗效果[26-27]。因此,SN38@QHES-S-CUR胶束协同给药体系与SN38单独给药相比,对结肠癌增殖的抑制作用明显增强。此外,由图 8(a)、(b)对照可见,SN38@QHES-S-CUR胶束的细胞毒性还与药物作用时长(即孵育时长)有关,例如,SN38的等效质量浓度为10 μg·mL−1时,随着孵育时长从24 h延长到48 h,SN38@QHES-S-CUR的相对细胞活率从(32.43±6.45)%下降到(13.98±0.52)%。综上所述,SN38@QHES-S-CUR胶束能够发挥协同作用,对CT-26的细胞毒性呈浓度和药物作用时长依赖性。
|
图 8 SN38及SN38@QHES-S-CUR胶束对CT-26的细胞毒性 Fig.8 Cytotoxicity of SN38 and SN38@QHES-S-CUR to CT-26 cells after different incubation periods |
本研究评估了CUR与SN38共混体系的稳定性,分子动力学模拟结果表明,CUR与SN38有良好的结合能力。用纳米沉淀法制备了负载SN38的协同给药体系SN38@QHES-S-CUR胶束,通过优化QHES-S-CUR与SN38的质量比,可制备出形貌良好、平均粒径小且分布均一的协同给药胶束。SN38@QHES-S-CUR胶束在模拟的正常组织液中累积药物释放量小,在模拟的肿瘤微环境中累积药物释放量显著提高,能够实现肿瘤微环境中的药物响应性释放。与SN38相比,SN38@QHES-S-CUR胶束表现出对CT-26更强的细胞毒性,说明协同给药能够有效提高化疗药物对结肠癌细胞的抑制作用。本研究基于QHES-S-CUR前药负载疏水性化疗药物SN38,构建出具有肿瘤微环境响应性释放的协同给药体系,在结肠癌治疗中具有潜在的应用前景。
| [1] |
GANGIREDDY V G R, COLEMAN T, KANNEGANTI P, et al. Polypectomy versus surgery in early colon cancer: Size and location of colon cancer affect long-term survival[J]. International Journal of Colorectal Disease, 2018, 33(10): 1349-1357. |
| [2] |
DERAKHSHANKHAH H, IZADI Z, ALAEI L, et al. Colon cancer and specific ways to deliver drugs to the large intestine[J]. Anti-Cancer Agents in Medicinal Chemistry, 2017, 17(10): 1317-1327. |
| [3] |
QI S S, SUN J H, YU H H, et al. Co-delivery nanoparticles of anti-cancer drugs for improving chemotherapy efficacy[J]. Drug Delivery, 2017, 24(1): 1909-1926. |
| [4] |
MIAO L, GUO S T, LIN C M, et al. Nanoformulations for combination or cascade anticancer therapy[J]. Advanced Drug Delivery Reviews, 2017, 115: 3-22. |
| [5] |
LIU K, CHEN Y Y, PAN L H, et al. Co-encapsulation systems for delivery of bioactive ingredients[J]. Food Research International, 2022, 155: 111073. |
| [6] |
LIU Y P, WU K, WANG J X, et al. Continuous production of antioxidant liposome for synergistic cancer treatment using high-gravity rotating packed bed[J]. Chemical Engineering Journal, 2018, 334: 1766-1774. |
| [7] |
LI Y Q, JIANG Y T, ZHENG Z Y, et al. Co-delivery of precisely prescribed multi-prodrug combination by an engineered nanocarrier enables efficient individualized cancer chemotherapy[J]. Advanced Materials, 2022, 34(12): 2110490. |
| [8] |
彭虎红, 芮金州, 关怡新, 等. 超临界CO2一步法制备载盐酸阿霉素和紫杉醇壳聚糖纳米粒[J]. 高校化学工程学报, 2022, 36(1): 76-84. PENG H H, RUI J Z, GUAN Y X, et al. One-step preparation of doxorubicin hydrochloride and paclitaxel co-loaded chitosan nanoparticles using supercritical carbon dioxide[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 76-84. |
| [9] |
HU H, LI Y H, ZHOU Q, et al. Redox-sensitive hydroxyethyl starch-doxorubicin conjugate for tumor targeted drug delivery[J]. ACS Applied Materials & Interfaces, 2016, 8(45): 30833-30844. |
| [10] |
SAURAJ, KUMAR V, KUMAR B, et al. Redox responsive xylan-SS-curcumin prodrug nanoparticles for dual drug delivery in cancer therapy[J]. Materials Science and Engineering: C, 2020, 107: 110356. |
| [11] |
HA W, ZHAO X B, CHEN X Y, et al. Prodrug-based cascade self-assembly strategy for precisely controlled combination drug therapy[J]. ACS Applied Materials & Interfaces, 2018, 10(25): 21149-21159. |
| [12] |
DUARTE D, VALE N. Combining repurposed drugs to treat colorectal cancer[J]. Drug Discovery Today, 2022, 27(1): 165-184. |
| [13] |
DHANESHWAR S S, VADNERKAR G. Rational design and development of colon-specific prodrugs[J]. Current Topics in Medicinal Chemistry, 2011, 11(18): 2318-2345. |
| [14] |
GE Y X, MA Y K, LI L B. The application of prodrug-based nano-drug delivery strategy in cancer combination therapy[J]. Colloids and Surfaces B: Biointerfaces, 2016, 146: 482-489. |
| [15] |
HUANG Q, LIU X, WANG H Y, et al. A nanotherapeutic strategy to overcome chemoresistance to irinotecan/7-ethyl-10-hydroxy-camptothecin in colorectal cancer[J]. Acta Biomaterialia, 2022, 137: 262-275. |
| [16] |
KONG W Y, NGAI S C, GOH B H, et al. Is curcumin the answer to future chemotherapy cocktail?[J]. Molecules, 2021, 26(14): 4329. |
| [17] |
RAVINDRAN J, PRASAD S, AGGARWAL B B. Curcumin and cancer cells: How many ways can curry kill tumor cells selectively?[J]. The AAPS Journal, 2009, 11(3): 495-510. |
| [18] |
HE W T, ZHU Y H, ZHANG T, et al. Curcumin reverses 5-fluorouracil resistance by promoting human colon cancer HCT-8/5-FU cell apoptosis and down-regulating heat shock protein 27 and P-glycoprotein[J]. Chinese Journal of Integrative Medicine, 2019, 25(6): 416-424. |
| [19] |
LU Y, ZHANG R Z, ZHANG X J, et al. Curcumin may reverse 5-fluorouracil resistance on colonic cancer cells by regulating TET1-NKD-Wnt signal pathway to inhibit the EMT progress[J]. Biomedicine & Pharmacotherapy, 2020, 129: 110381. |
| [20] |
ZHANG P, LAI Z L, CHEN H F, et al. Curcumin synergizes with 5-fluorouracil by impairing AMPK/ULK1-dependent autophagy, AKT activity and enhancing apoptosis in colon cancer cells with tumor growth inhibition in xenograft mice[J]. Journal of Experimental & Clinical Cancer Research, 2017, 36(1): 190. |
| [21] |
YIN J H, WANG L, WANG Y, et al. Curcumin reverses oxaliplatin resistance in human colorectal cancer via regulation of TGF-β/Smad2/3 signaling pathway[J]. OncoTargets and Therapy, 2019, 12: 3893-3903. |
| [22] |
RUTKAITE R, BENDORAITIENE J, KLIMAVICIUTE R, et al. Cationic starch nanoparticles based on polyelectrolyte complexes[J]. International Journal of Biological Macromolecules, 2012, 50(3): 687-693. |
| [23] |
SUN X R, ZHU D B, CAI Y, et al. One-step mechanochemical preparation and prominent antitumor activity of SN-38 self-micelle solid dispersion[J]. International Journal of Nanomedicine, 2019, 14: 2115-2126. |
| [24] |
BATTOGTOKH G, CHO Y Y, LEE J Y, et al. Mitochondrial-targeting anticancer agent conjugates and nanocarrier systems for cancer treatment[J]. Frontiers in Pharmacology, 2018, 9: 922. |
| [25] |
WANG Y J, LIU D, ZHENG Q C, et al. Disulfide bond bridge insertion turns hydrophobic anticancer prodrugs into self-assembled nanomedicines[J]. Nano Letters, 2014, 14(10): 5577-5583. |
| [26] |
SU P F, YANG Y, WANG G X, et al. Curcumin attenuates resistance to irinotecan via induction of apoptosis of cancer stem cells in chemoresistant colon cancer cells[J]. International Journal of Oncology, 2018, 53(3): 1343-1353. |
| [27] |
HUANG Y F, ZHU D J, CHEN X W, et al. Curcumin enhances the effects of irinotecan on colorectal cancer cells through the generation of reactive oxygen species and activation of the endoplasmic reticulum stress pathway[J]. Oncotarget, 2017, 8(25): 40264-40275. |




