单克隆抗体(简称单抗,mAb)是最重要的生物技术药物,具有靶向性好、疗效高、毒副作用小等特点,已有超过70种单抗类药物被批准上市[1-2]。对于抗体生产,随着上游细胞表达量增长和生产规模扩大[3-6],下游分离过程的高效性、经济性和稳健性越来越受到关注,新型分离过程的研发成为热点[7]。基于蛋白A亲和捕获的三步层析工艺是单抗制备的平台技术,不过,常规批次层析分离的过程效率有限,难以匹配快速增长的上游产量。另一方面,蛋白A亲和介质价格昂贵,其成本约占下游过程的35%[8-12]。提高产能和降低成本是下游过程变革的关键,若改批次层析为连续分离过程,可提高蛋白A亲和介质的介质利用率和产率,降低缓冲液消耗,从而降低生产成本。
连续分离技术由Broughton在1961年提出,主要采用模拟移动床(simulated moving bed,SMB)进行小分子分离[13]。1992年起SMB技术开始应用于手性化合物和食品工业中糖类物质的分离[14-20]。之后,基于SMB原理,多项连续分离技术相继开发并应用于生物大分子分离,通常称为连续流层析(continous chromatography)。不同连续流层析系统主要区别在于层析柱的使用数量和操作模式。Novasep公司的BioSC系统采用SMCC (sequential multi-column chromatography)技术,利用多柱串联(2~6柱)方式进行免疫球蛋白G(Immunoglobulin G,IgG)亲和分离,通过建立模型、优化操作参数,产量提高了38%[21]。ChromaCon公司的CUBE系统应用Capture SMB技术,采用双柱连续流层析对IgG进行分离,考察不同蛋白浓度及层析柱长度,优化发现连续层析产率比批次层析增加了35%,介质利用率提高了45%[22-23]。GE Healthcare公司根据层析介质的载量及工艺参数的不同提出3C-PCC和4C-PCC(periodic counter-current chromatography)技术,使用3柱或者4柱进行连续流层析,单抗亲和分离的介质利用率和缓冲液消耗量均优于批次层析过程[24-26]。Pall公司的BioSMB系统将一次性技术和连续流层析技术相结合,根据工艺需要层析柱数可从3柱增加到16柱,亲和捕获抗体的介质利用率显著提高,缓冲液消耗大幅度降低,生产成本降低了约30%[27-28]。总的来说,与批次层析过程相比,不同操作模式的连续流层析的产率和介质利用率均有明显提高,缓冲液消耗大幅度下降,分离成本降低。目前,部分连续流层析工艺已完成中试,结果表明相关技术具有良好的线性放大特性,显示出广阔的应用前景[29-30]。
与常规批次层析相比,连续流层析过程较为复杂,特别是新型的双柱连续流层析,合适的操作参数和合理的过程设计是提高过程效率的关键,可是文献中对于操作参数的考察均不够完善,也未提出明确的过程设计策略。因此,针对双柱连续流层析,本文以两种蛋白A亲和介质(MabSelect SuRe和UniMab)为典型对象,考察不同保留时间和蛋白浓度条件下IgG的穿透行为;依据穿透曲线进行连续流层析工艺设计,考察系列因素对产率和介质利用率的影响,确定合适的分离条件;最后应用于细胞培养液中捕获单抗,考察连续流层析工艺的可行性。
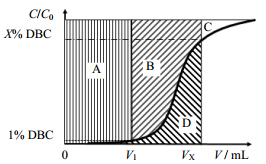
2 双柱连续流层析原理图 1是蛋白穿透曲线示意图,横坐标为上样体积,纵坐标为层析柱流出液蛋白浓度,虚线标注为动态结合载量(dynamic binding capacity,DBC)。图中曲线以上部分(A+B+C)代表介质的最大吸附量,曲线以下部分(D)则代表流穿的蛋白量。对于常规批次层析,上样量通常选择在蛋白1%穿透点(如图中V1所示),此时流穿部分较少,避免目标蛋白损失,但介质的利用率较低,仅A部分吸附容量被利用。对于双柱连续流层析,两根层析柱串联上样(见图 2的Step 1),使用第二根层析柱承接并吸附从第一根层析柱中流穿的蛋白,因此第一根层析柱可以持续上样到更高的蛋白穿透点(如图中VX所示),从而显著提高层析柱的载量(对应于图 1中A+B),进而提高介质利用率。该策略对于价格昂贵的介质和穿透曲线比较平坦的体系尤为重要,如蛋白A亲和分离捕获抗体时。
|
图 1 蛋白穿透曲线示意图 Fig.1 Schematic diagram of a breakthrough curve in protein chromatographic separation |
|
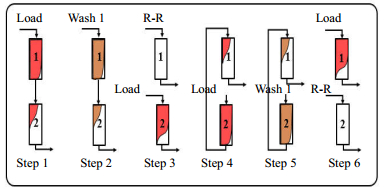
图 2 连续流层析分离过程示意图 Fig.2 Schematic diagram of a continuous chromatographic process |
双柱连续流层析的具体步骤如图 2所示。首先是两根层析柱(1#和2#)以串联方式上样(如图 2中Step 1),称为连接模式(interconnect,IC)上样,1#层析柱流穿的蛋白被2#层析柱吸附;当1#层析柱达到设定的穿透点,将1#层析柱未吸附的蛋白冲洗到2#层析柱(如图 2中Step 2);然后将两根层析柱断开,1#层析柱进行淋洗、洗脱、再生、再平衡等步骤,与此同时2#层析柱上样直至1%蛋白穿透(如图 2中Step 3所示),该过程称为断开模式(disconnect,DC),通常此时2#层析柱的上样流速比连接模式上样时的流速低,以保证此阶段内蛋白不会从2#层析柱中流穿;待1#层析柱完成所有洗脱和再生步骤(recovery-regeneration,R-R),将1#层析柱串联至2#层析柱后,2#层析柱持续上样,该过程与Step 1的连接模式上样类似,只是两层析柱调换了位置;然后重复以上Step 2和Step 3步骤,即图 2中Step 5和Step 6。从Step 1到Step 6完成了一个循环,如此通过双柱交替上样,便可以实现连续层析分离。
为使系统快速达到稳定状态,通常会在最前面添加一个启动阶段,即将两根层析柱串联上样,终点为上述循环操作的起始点,即1#层析柱1%穿透。此外,一般会在连续流层析分离结束前添加一个终止阶段,将最后一个循环中2#层析柱承接的蛋白进行分离操作。
3 材料和方法 3.1 主要材料与仪器双柱连续流层析系统,Contichrom®CUBE Combined,瑞士ChromaCon AG公司;MabSelect SuRe预装柱,1mL,购自GE Healthcare公司;UniMab预装柱,1mL,苏州纳微科技股份有限公司;静注人免疫球蛋白(hIgG,50 mg·mL-1),分子量约150 kDa(1000g·mol-1),华兰生物工程重庆有限公司;中国仓鼠卵巢细胞(chinese hamster ovary, CHO)细胞培养上清液,单抗浓度约2.8 mg·mL-1;OneDrop OD-1000+分光光度计,南京五义科技有限公司;高效液相色谱仪LC3000,北京创新通恒科技有限公司;宿主细胞蛋白检测试剂盒CHO HCP ELISA Kit 3G,Cygnus公司;其他试剂均为分析纯。
3.2 实验方法 3.2.1 蛋白穿透曲线测定蛋白穿透实验采用前沿分析法,比较MabSelect SuRe和UniMab两种1 mL预装柱。样品采用hIgG,用平衡缓冲液(20 mmol·L-1磷酸盐缓冲液,pH 7.4,0.15 mol·L-1 NaCl)稀释至一定浓度,调节至pH 7.4。首先用5倍柱体积(column volume,CV)平衡缓冲液平衡层析柱,然后进行蛋白上样,紫外检测器280 nm在线监测层析柱出口的蛋白浓度,得到穿透曲线。采用2 mg·mL-1的hIgG溶液作为上样液,考察不同保留时间(0.5、1、2、3、4 min)的穿透曲线;以及在保留时间1 min条件下,考察不同蛋白浓度(0.5、1、2、5和10 mg·mL-1)的穿透曲线。
3.2.2 批次层析分离批次层析分离的工艺条件通过前期优化得到。首先用5 CV平衡缓冲液平衡层析柱,上样量根据1%蛋白穿透的80%确定。上样结束后,用4 CV平衡缓冲液冲洗,然后用4 CV高盐缓冲液(20 mmol·L-1磷酸盐缓冲液,pH 6.0,1.0 mol·L-1 NaCl)淋洗,再用3 CV平衡缓冲液冲洗,然后用5 CV柠檬酸盐缓冲液(0.1 mol·L-1,pH 3.0)进行洗脱,3 CV醋酸溶液(1.0 mol·L-1)充分清洗,2 CV平衡缓冲液平衡层析柱,再用0.1 mol·L-1 NaOH对层析柱再生15 min,最后用5CV平衡缓冲液进行平衡。分离过程中上样的保留时间与3.2.1节穿透实验保持一致,冲洗步骤步骤的保留时间与上样一致,再生步骤的保留时间固定为3 min,其他步骤(包括平衡、淋洗、洗脱等)的保留时间都为0.5 min。
3.2.3 双柱连续流层析分离双柱连续流层析的设计参数主要包括连接模式(如图 2中Step 1)和断开模式(如图 2中Step 3)的上样流速uIC、uDC及相应操作时间tIC、tDC。在断开模式阶段,前柱的淋洗、洗脱和再生等步骤的操作参数与3.2.2节批次层析过程相同,因此tDC可通过批次层析的工艺来确定。其余参数需要依据穿透曲线进行优化设计。对于连接模式上样阶段,两根层析柱通过串联方式上样至2#层析柱1%穿透,从1#层析柱中穿透的蛋白会被2#层析柱吸附,这部分穿透的蛋白量称为2#层析柱的预上样量(QPL),对应于图 1中的区域D,QPL可以通过式(1)计算:
| $ {{Q}_{\text{PL}}}\text{=}\frac{{{A}_{{{\text{V}}_{\text{min}}}}}\cdot {{c}_{\text{feed}}}}{{{V}_{\text{col}}}} $ | (1) |
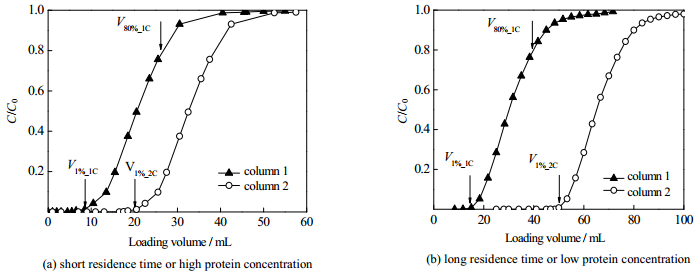
式中,cfeed表示蛋白浓度,Vcol表示柱体积,AVmin表示第一根层析柱穿透曲线从0至Vmin的积分,Vmin为V80%_1C和V1%_2C二者中的较小值。在实际分离过程中,可能会出现两种情况:当保留时间较短或蛋白浓度较高时,如图 3(a)所示,V80%_1C > V1%_2C,此时连接模式的上样终点可选择在2#层析柱1%穿透点,即V1%_2C,;当保留时间较长或蛋白浓度较低时,如图 3(b)所示,1#层析柱需要达到接近100%穿透时,2#层析柱才开始穿透,若仍按照2#层析柱1%穿透点设置上样终点不是很合理,一般选择1#层析柱80%穿透时停止上样。
|
图 3 双柱串联上样的穿透曲线 Fig.3 Breakthrough curves of protein loading with two columns in series V1%_1C: 1% breakthrough of the first column; V80%_1C: 80% breakthrough of the first column; V1%_2C: 1% breakthrough of the second column |
对于断开模式的上样阶段(如图 2中Step 3的下图),2#层析柱会持续上样至1%穿透,这部分的上样量QDL可通过式(2)计算:
| $ Q{}_{{\rm{DL}}}{\rm{ = }}\frac{{{V_{1{\rm{\% \_}}1{\rm{C}}}} \cdot {c_{{\rm{feed}}}}-Q{}_{{\rm{PL}}}}}{{{V_{{\rm{col}}}}}} \cdot Z $ | (2) |
式中,Z 表示安全系数,依据建议设为0.9。
断开模式上样阶段的上样流速uDC则可以通过式(3)计算:
| $ {u_{{\rm{DC}}}}{\rm{ = }}\frac{{{Q_{{\rm{DL}}}} \cdot {V_{{\rm{col}}}}}}{{{c_{{\rm{feed}}}} \cdot {t_{{\rm{DC}}}}}} $ | (3) |
连接模式上样阶段的上样流速uIC依据保留时间设定,该阶段所需时间tIC可由式(4)计算:
| $ {t_{{\rm{IC}}}}{\rm{ = }}\frac{{{V_{{\rm{min}}}}-{V_{1\% \_1{\rm{C}}}}}}{{{u_{{\rm{IC}}}}}} $ | (4) |
连续流层析中冲洗阶段为连接模式冲洗(如图 2中Step 2),冲洗液4 CV,采用连接模式上样相同的流速;其他步骤(包括淋洗、洗脱、再生等)采用断开模式,操作参数与3.2.2节中批次层析实验过程相同。
3.2.4 细胞培养液中分离单抗经过上述hIgG模型蛋白的优化实验,选择合适的双柱连续流层析操作条件,从CHO细胞培养液中分离单抗,料液含单抗2.8 mg·mL-1。首先进行料液的穿透实验,穿透组分采用分布收集,通过体积排阻高效液相色谱(SEC-HPLC)检测收集液的单抗含量,得到穿透曲线,确定介质对单抗的动态载量。其次进行批次层析分离,方法与3.2.2节基本相同,上样量为1%穿透的80%,将三步淋洗的体积增加至5 CV,洗脱缓冲液pH由3.0改为3.5,洗脱液用预装有500 μL的2.0 mol·L-1三羟甲基氨基甲烷(Tris)溶液进行中和。最后,进行双柱连续流层析分离,过程设计按照3.2.3节方法,淋洗、洗脱和再生等步骤的操作条件与批次层析过程保持一致。
3.2.5 分析方法纯hIgG溶液浓度由OneDrop OD -1000+分光光度计测定;单抗浓度及纯度由SEC-HPLC分析,色谱柱为TSK G3000SWXL,流动相为0.1 mol·L-1磷酸盐缓冲液(含1%异丙醇),流速为0.5 mL·min-1;宿主细胞蛋白(HCP)含量通过ELISA方法测定,具体方法参照试剂盒说明书。
3.2.6 分离过程评价比较批次层析和连续流层析的分离性能,包括单抗纯度、收率和HCP含量,以及过程参数指标,产率P、介质利用率CU和缓冲液消耗BC,具体计算如下。
(1) 产率P
批次层析的产率PBatch计算如式(5):
| $ {P_{{\rm{Batch}}}}{\rm{ = }}Y \cdot \frac{{c \cdot {V_{\rm{L}}}}}{{{t_{{\rm{all}}}}{V_{{\rm{col}}}}}} $ | (5) |
式中,Y表示收率,tall表示整个层析过程需要的时间;c为单抗浓度;VL表示上样体积;Vcol表示柱体积。
连续流层析的产率PC可通过式(6)计算:
| $ {P_{\rm{C}}}{\rm{ = }}Y \cdot \frac{{c \cdot \left( {{t_{{\rm{DC}}}}{u_{{\rm{DC}}}} + {t_{{\rm{IC}}}}{u_{{\rm{IC}}}}} \right)}}{{2{V_{{\rm{col}}}}\left( {{t_{{\rm{DC}}}} + {t_{{\rm{IC}}}} + {t_{{\rm{wash}}\;{\rm{1}}}}} \right)}} $ | (6) |
式中,twash 1表示层析过程中wash 1阶段的时间,见图 2中Step 2。
(2) 介质利用率CU
介质利用率CU计算如式(7):
| $ {\rm{CU = }}{Y} \cdot \frac{{\int_0^{{V_{\rm{L}}}} {\left( {1 - C/{C_0}} \right){\rm{d}}{V}} }}{{\int_0^{{V_{100\% \_1{\rm{C}}}}} {\left( {1 - C/{C_0}} \right){\rm{d}}{V}} }} $ | (7) |
式中,VL表示批次层析或连续流层析过程中的上样体积,V100%_1C表示100%穿透时上样体积。
(3) 缓冲液消耗BC
缓冲液消耗BC由式(8)计算:
| $ {\rm{BC}}{\rm{ = }}\frac{{{V_{{\rm{B\_all}}}}}}{{Y \cdot {c_{{\rm{feed}}}}{V_{\rm{L}}}}} $ | (8) |
式中,VB_all表示整个层析过程中平衡、淋洗、洗脱、再生等步骤所消耗缓冲液的总体积。
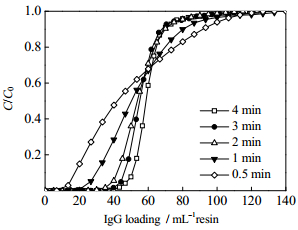
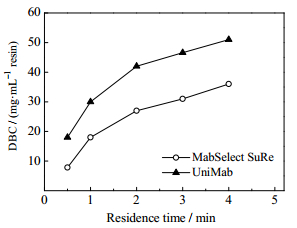
4 结果与讨论 4.1 动态载量比较考察了两种蛋白A亲和介质MabSelect SuRe和UniMab在不同保留时间和不同IgG浓度下的穿透曲线。两种介质呈现相同的规律,不同蛋白浓度的穿透曲线都较为接近,即在一定浓度范围内IgG浓度对蛋白A亲和介质的穿透行为影响较小。UniMab介质在不同保留时间的穿透曲线如图 4所示,随着保留时间减小,流速增大,穿透曲线变得平缓,穿透点前移,动态载量下降,与文献报道[31-32]相似。两种介质的动态载量比较如图 5所示,可以发现UniMab具有较高的动态载量,特别是在高流速下(低保留时间)gq更加明显。
|
图 4 UniMab介质在不同保留时间条件下的IgG穿透曲线 Fig.4 Breakthrough curves of IgG at different residence times with UniMab |
|
图 5 两种介质不同保留时间的动态载量比较 Fig.5 Dynamic binding capacities of the two resins under different residence times |
根据不同操作条件下的穿透曲线可以确定介质的动态载量,并用于连续流层析过程的设计,具体见3.2.3节。实际分离过程中,选择合适的穿透点非常重要,本文选择80%作为最大穿透量。以UniMab介质为例,不同IgG浓度和保留时间的操作参数如表 1所示。可以发现,在保留时间较长(> 1 min)或蛋白浓度较低(< 2 mg·mL-1)条件下,两柱的穿透曲线呈现出图 3(b)所示的情况,因此选择第一根层析柱80%穿透作为双柱连接模式上样的终点。随着保留时间减小(< 1 min)和蛋白浓度增加(> 2 mg·mL-1),两柱穿透曲线开始呈现图 3(a)所示的情况,选择第二根层析柱1%穿透作为双柱连接模式上样的终点。
|
|
表 1 介质连续流层析过程和批次层析的操作参数 Table 1 Operation parameters of continuous chromatography with UniMab |
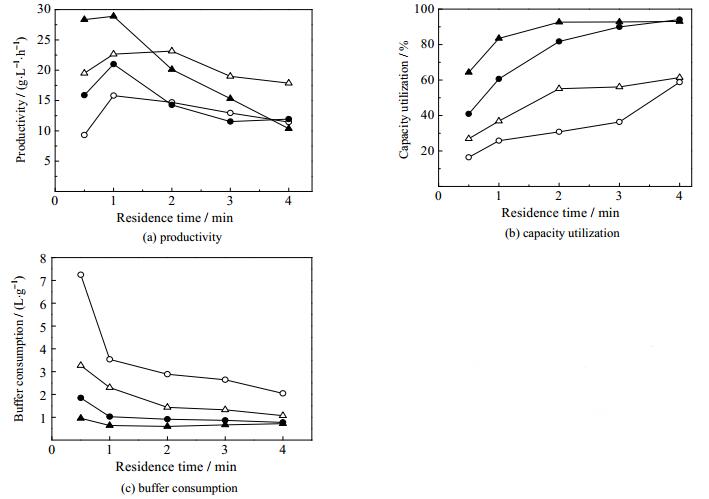
层析分离中保留时间是影响穿透曲线和吸附性能的重要因素,也是连续流层析的关键影响因素。本文考察了不同保留时间下(0.5~4 min)双柱连续流层析的分离性能,以产率、介质利用率和缓冲液消耗作为评判指标,并与批次层析进行比较,结果见图 6。
|
图 6 连续流层析和批次层析在不同保留时间下的性能比较 Fig.6 Comparison of process performance between continuous and batch chromatography under different residence times ○ MabSelect SuRe_batch ● MabSelect SuRe_continuous △ UniMab_batch ▲ UniMab_continuous |
产率比较见图 6(a)。随着保留时间增加,两种介质、两种分离模式的产率都呈现先上升后下降的趋势,与文献报道[22, 25]相似。相比较而言,连续流层析的最高产率出现在较低的保留时间(1 min)。保留时间对产率的影响是双方面的,一方面,保留时间增加,穿透曲线变陡,介质动态载量提高,产率有增大趋势;另一方面,流速减慢,造成操作时间增加,产率有减小趋势。如表 1所示,对于批次层析,保留时间从0.5 min提高至2 min时,载量提高更加显著,产率呈现上升趋势;当保留时间继续增加至4 min,动态载量虽然有所提高,但过程时间却成倍增加,导致产率下降,因此2 min处出现产率最大值。对于连续流层析,随着保留时间由0.5 min增加至1 min,上样量显著提高,产率上升;再进一步增大至4 min,上样量仅仅从52.3 mL提高至58.2 mL,而每个循环的时间却由107 min增至266 min,因此产率出现大幅度下降。比较发现,两种分离模式的产率随保留时间变化曲线存在一个相交点,大约在2 min处,低于这个保留时间,连续流层析拥有更高的产率;高于该保留时间,批次层析拥有更高的产率。这主要是由于在低保留时间下,双柱串联上样使得介质载量显著提高,产率提升明显;当保留时间较大时,连续流层析的上样量提升有限,而循环时间却明显提高,造成产率略低于批次层析过程。相比之下,双柱连续流层析在低保留时间下具有明显优势,可以实现高流速操作,显著提升产率。
介质利用率的比较见图 6(b)。随保留时间增加,批次层析和连续流层析的介质利用率都不断提高,不过连续流层析的介质利用率远远高于批次层析过程。主要原因是随着保留时间的增加,穿透曲线更陡,介质的动态载量提高。在实际应用过程中,由于蛋白A亲和介质价格昂贵,通常要求介质利用率高于50%,对于批次层析就需要保留时间达到4 min以上,而此时的产率较低(见图 6(a))。对于连续流层析,在较低的保留时间(1 min)下介质利用率就能达到60%以上,且具有较高的产率。比较两种介质可以发现,在相同保留时间下,UniMab介质具有更高的介质利用率。
缓冲液消耗的比较见图 6(c)。可以发现,连续流层析的缓冲液消耗远远低于批次层析过程。保留时间1 min时,连续流层析过程的缓冲液消耗仅仅为批次层析的20%左右;随着保留时间增加,该比例会提高至40%~60%,与文献报道[22, 25]相一致。
整体而言,随着保留时间增加,两种分离模式的产率先增加后减小,介质利用率持续增加,缓冲液消耗持续减少,在低保留时间条件下,双柱连续流层析拥有更优越的分离性能,在保留时间1 min时拥有最高的产率。
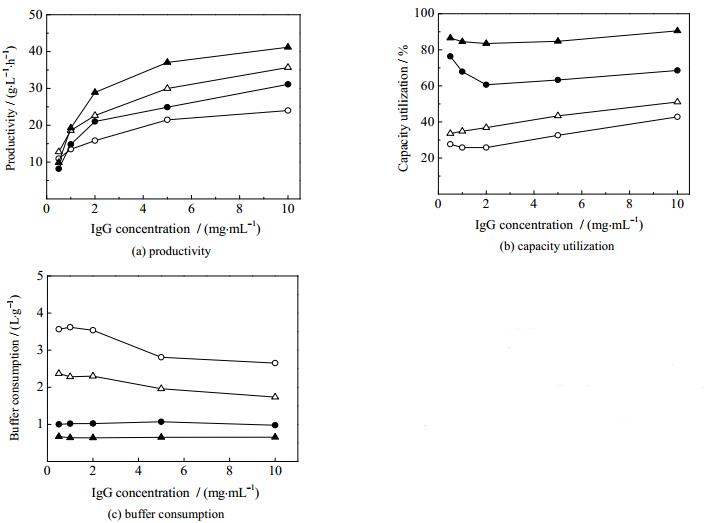
4.3.2 蛋白浓度影响上样蛋白浓度是影响吸附过程的另一重要因素。选择保留时间1 min,考察不同IgG浓度(0.5~10 mg·mL-1)对两种分离模式的影响,结果见图 7。
|
图 7 连续流层析和批次层析在不同蛋白浓度下的性能比较 Fig.7 Comparison of process performance between continuous and batch chromatography under different protein concentrations ○ MabSelect SuRe_batch ● MabSelect SuRe_continuous △ UniMab_batch ▲ UniMab_continuous |
产率比较见图 7(a)。随着蛋白浓度升高,两种介质在两种不同层析模式下的产率都不断提高,与文献报道[22, 25]相符。由于蛋白浓度上升,上样体积减少,上样时间减少,产率提高。如表 1所示,IgG浓度为0.5 mg·mL-1时,连续流层析每个循环的上样量为204.8 mL,完成一个循环的时间为247 min;当浓度提高至10 mg·mL-1时,每个循环的上样量降为12.8 mL,循环时间降为73.6 min,虽然每个循环得到的蛋白量差不多,但是操作时间却降为原来的1/3左右,因此产率提高。两种模式比较发现,连续流层析的产率优于批次层析过程,特别是对于高蛋白浓度(> 2 mg·mL-1)。比较两种介质,可以发现UniMab介质优于MabSelect SuRe介质,这是由于UniMab介质具有较高的动态载量,特别是在高流速、低保留时间条件下。
介质利用率的比较见图 7(b)。可以发现,不同蛋白浓度条件下,双柱连续流层析的介质利用率都远远高于批次层析过程,这主要是由于连续流层析中,每根层析柱的吸附量都远远大于批次层析过程。此外,还发现蛋白浓度对介质利用率影响较小,这是因为在相同保留时间的条件下,不同蛋白浓度的穿透曲线较为接近。
缓冲液消耗比较见图 7(c),连续流层析的缓冲液消耗远低于批次层析过程。无论连续流层析还是批次层析,随蛋白浓度增加,缓冲液消耗的变化幅度均不大,这主要是因为不同蛋白浓度条件下的穿透曲线较为接近,每个批次或循环得到的产品接近,导致缓冲液消耗变化不大。
整体而言,随着蛋白浓度增大,产率持续增大,介质利用率和缓冲液消耗变化幅度均较小。对于高蛋白浓度(> 2 mg·mL-1),连续流层析的分离性能明显高于批次层析过程。
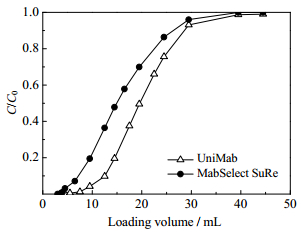
4.3.3 细胞培养液中捕获单抗CHO细胞培养液中单抗浓度为2.8 mg·mL-1、纯度约为26.7%。依据前文,在上样IgG浓度为2 mg·mL-1、保留时间1 min时,双柱连续流层析拥有最佳的分离性能,产率高、介质利用率高、缓冲液消耗少,因此,实际料液的单抗分离中选择保留时间1 min。图 8是两种介质的穿透曲线比较,与前文的hIgG穿透实验类似,UniMab介质的动态载量高于MabSelect SuRe介质,二者的1%穿透载量分别为21和12.6 mg·mL-1,10%穿透载量分别为35和22.4 mg·mL-1。
|
图 8 两种层析介质的单抗料液穿透曲线 Fig.8 Breakthrough curves of mAb from CHO cell culture broth studied with the two resins |
分离结果列于表 2,单抗纯度均大于97%。可以发现,双柱连续流层析捕获抗体的效果良好,单抗纯度、收率、聚集体含量、HCP含量、HCP对数减少值(log reduction values, LVR)等指标均与批次层析过程类似,产率和介质利用率显著提高,缓冲液消耗明显下降。对于MabSelect SuRe介质和UniMab介质,产率分别提高了67%和37%,介质利用率从20%~ 30%提高到70%~80%, ,缓冲液消耗下降为常规批次层析过程的1/5~1/4。
|
|
表 2 两种层析介质的分离效果 Table 2 Process performance of two different resins |
基于上述实验结果,进行了2000 L单抗料液的模拟计算。连续流层析选用1 min保留时间,批次层析采用4 min保留时间,料液处理时间设定为36 h。根据前文中每个批次处理时间或连续流层析每个循环所需时间,得到36 h内的批次或循环次数,然后计算每个批次或循环处理量,最后得到所需的介质使用量,结果如表 3所示。可以看出,双柱连续流层析具有更好的分离性能,产率和介质利用率显著提高,缓冲液消耗明显下降。对于MabSelect SuRe介质和UniMab介质,产率分别提高了46%和39%,介质利用率分别提高了21%和28%,缓冲液消耗分别下降了45%和36%。综合而言,采用双柱连续流层析,一方面拥有更高的产率和更高的介质利用率,可以使用更小的层析柱,相同时间内蛋白A亲和介质可进行更多的生产循环,提高了介质的使用寿命,介质用量比常规批次层析减少30%~40%,显著降低了蛋白A介质成本。此外,使用更小的层析柱、匹配更小的层析设备和厂房空间,则进一步降低了生产成本。
|
|
表 3 单抗料液分离的模拟计算 Table 3 Simulation results of mAb capture from cell culture broth using batch and continuous processes |
针对双柱连续流层析,以两种蛋白A亲和介质MabSelect SuRe和UniMab为典型介质,比较分析了双柱连续流层析和常规批次层析过程的差异,考察了保留时间和蛋白浓度的影响,实现了细胞培养液中单抗的分离。通过比较不同保留时间和IgG浓度下的穿透曲线,得到了双柱连续流层析的合适操作参数,分析了保留时间和蛋白浓度对产率、介质利用率和缓冲液消耗的影响。结果表明,在载量和连续流层析分离性能方面,UniMab介质整体优于MabSelect SuRe介质。随保留时间增加,产率呈现先增加后减小的趋势,介质利用率持续增加,缓冲液消耗持续减少;在低保留时间条件下,双柱连续流层析拥有更优越的分离性能,适合于高流速操作;随着蛋白浓度增大,产率显著增大,介质利用率和缓冲液消耗变化不大。对于从细胞培养液中分离单抗,单抗纯度达到97%以上、收率87%以上、聚集体含量低于2%、HCP含量低于300 ppm,产率和介质利用率显著提高,缓冲液消耗下降,显示出良好的应用前景。
符号说明:
|
|
| [1] |
ECKER D M, JONES S D, LEVINE H L. The therapeutic monoclonal antibody market[J]. MAbs, 2015, 7(1): 9-14. DOI:10.4161/19420862.2015.989042 |
| [2] |
GRILO A L, MANTALARIS A. The increasingly human and profitable monoclonal antibody market[J]. Trends in Biotechnology, 2019, 37(1): 9-16. DOI:10.1016/j.tibtech.2018.05.014 |
| [3] |
NATARAJAN V, ZYDNEY A L. Protein a chromatography at high titers[J]. Biotechnology and Bioengineering, 2013, 110(9): 2445-2451. DOI:10.1002/bit.v110.9 |
| [4] |
HUANG Y, HU W, RUSTANDI E, et al. Maximizing productivity of CHO cell-based fed-batch culture using chemically defined media conditions and typical manufacturing equipment[J]. Biotechnology Progress, 2010, 26(5): 1400-1410. DOI:10.1002/btpr.436 |
| [5] |
YANG W C, MINKLER D F, KSHIRSAGAR R, et al. Concentrated fed-batch cell culture increases manufacturing capacity without additional volumetric capacity[J]. Journal of Biotechnology, 2016, 217: 1-11. DOI:10.1016/j.jbiotec.2015.10.009 |
| [6] |
PAPATHANASIOU M M, QUIROGA-CAMPANO A L, STEINEBACH F, et al. Advanced model-based control strategies for the intensification of upstream and downstream processing in mAb production[J]. Biotechnology Progress, 2017, 33(4): 966-988. DOI:10.1002/btpr.2483 |
| [7] |
WALTHER J, GODAWAT R, HWANG C, et al. The business impact of an integrated continuous biomanufacturing platform for recombinant protein production[J]. Journal of Biotechnology, 2015, 213: 3-12. DOI:10.1016/j.jbiotec.2015.05.010 |
| [8] |
卢慧丽, 林东强, 姚善泾. 抗体药物分离纯化中的层析技术及进展[J]. 化工学报, 2018, 69(1): 341-351. LU H L, LIN D Q, YAO S J. Chromatographic technology in antibody purification and its progress[J]. CIESC Journal, 2018, 69(1): 341-351. |
| [9] |
史策, 虞骥, 高栋, 等. 单抗制备的过程模拟和经济性分析[J]. 化工学报, 2018, 69(7): 3198-3207. SHI C, YU J, GAO D, et al. Process simulation and economic evaluation of monoclonal antibody production[J]. CIESC Journal, 2018, 69(7): 3198-3207. |
| [10] |
KELLEY B. Very large scale monoclonal antibody purification:the case for conventional unit operations[J]. Biotechnology Progress, 2007, 23(5): 995-1008. |
| [11] |
VARADARAJU H, SCHNEIDERMAN S, ZHANG L, et al. Process and economic evaluation for monoclonal antibody purification using a membrane-only process[J]. Biotechnology Progress, 2011, 27(5): 1297-1305. DOI:10.1002/btpr.639 |
| [12] |
KLUTZ S, HOLTMANN L, LOBEDANN M, et al. Cost evaluation of antibody production processes in different operation modes[J]. Chemical Engineering Science, 2016, 141: 63-74. DOI:10.1016/j.ces.2015.10.029 |
| [13] |
BROUGHTON B D, GERHOLD G C. Continuous sorption process employing fixed bed of sorbent and moving inlets and outlets: US 2985589A[P]. 1961-05-23.
|
| [14] |
彭奇均, 徐玲. 木糖醇母液色谱分离性能优化[J]. 高校化学工程学报, 2002, 16(3): 270-274. PENG Q J, XU L. The optimization of chromatographic separate performance for xylitol mother liquor[J]. Journal of Chemical Engineering of Chinese Universities, 2002, 16(3): 270-274. DOI:10.3321/j.issn:1003-9015.2002.03.007 |
| [15] |
危凤, 赵迎宪. 间歇色谱与模拟移动床色谱分离奥美拉唑对映体的比较[J]. 高校化学工程学报, 2009, 23(2): 303-308. WEI F, ZHAO Y X. Comparison of enantioseparation of omeprazole by simulated moving bed and batch chromatography[J]. Journal of Chemical Engineering of Chinese Universities, 2009, 23(2): 303-308. DOI:10.3321/j.issn:1003-9015.2009.02.022 |
| [16] |
危凤, 沈波, 陈明杰. 奥美拉唑对映体的模拟移动床色谱分离过程模拟[J]. 高校化学工程学报, 2005, 19(4): 456-460. WEI F, SHEN B, CHEN M J. Simulation of omeprazole resolution by simulated moving bed chromatography[J]. Journal of Chemical Engineering of Chinese Universities, 2005, 19(4): 456-460. DOI:10.3321/j.issn:1003-9015.2005.04.006 |
| [17] |
JUZA M, MAZZOTTI M, MORBIDELLI M. Simulated moving-bed chromatography and its application to chirotechnology[J]. Trends in Biotechnology, 2000, 18(3): 108-118. DOI:10.1016/S0167-7799(99)01419-5 |
| [18] |
NICOUD R M, FUCHS G, ADAM P, et al. Preparative scale enantioseparation of a chiral epoxide:comparison of liquid chromatography and simulated moving bed adsorption technology[J]. Chirality, 2010, 5(4): 267-271. |
| [19] |
NEGAWA M, SHOJI F. Optical resolution by simulated moving-bed adsorption technology[J]. Journal of Chromatography A, 1992, 590(1): 113-117. DOI:10.1016/0021-9673(92)87011-V |
| [20] |
BUBNIK Z, POUR V, GRUBEROVA A, et al. Application of continuous chromatographic separation in sugar processing[J]. Journal of Food Engineering, 2004, 61(4): 509-513. DOI:10.1016/S0260-8774(03)00221-8 |
| [21] |
ROUSSET F, VALERY E, et al. Design of high productivity sequential multi-column chromatography for antibody capture[J]. Food & Bioproducts Processing, 2014, 92(2): 233-241. |
| [22] |
ANGARITA M, MÜLLER-SPÄTH T, BAUR D, et al. Twin-column CaptureSMB:a novel cyclic process for protein A affinity chromatography[J]. Journal of Chromatography A, 2015, 1389: 85-95. DOI:10.1016/j.chroma.2015.02.046 |
| [23] |
BAUR D, ANGARITA M, MÜLLER-SPÄTH T, et al. Comparison of batch and continuous multi-column protein A capture processes by optimal design[J]. Biotechnology Journal, 2016, 11(7): 920-931. DOI:10.1002/biot.v11.7 |
| [24] |
GODAWAT R, BROWER K, JAIN S, et al. Periodic counter-current chromatography-design and operational considerations for integrated and continuous purification of proteins[J]. Biotechnology Journal, 2012, 7(12): 1496-1508. DOI:10.1002/biot.201200068 |
| [25] |
POLLOCK J, BOLTON G, COFFMAN J, et al. Optimising the design and operation of semi-continuous affinity chromatography for clinical and commercial manufacture[J]. Journal of Chromatography A, 2013, 1284: 17-27. DOI:10.1016/j.chroma.2013.01.082 |
| [26] |
GODAWAT R, KONSTANTINOV K, ROHANI M, et al. End-to-end integrated fully continuous production of recombinant monoclonal antibodies[J]. Journal of Biotechnology, 2015, 213: 13-19. DOI:10.1016/j.jbiotec.2015.06.393 |
| [27] |
GJOKA X, GANTIER R, SCHOFIELD M. Transfer of a three step mAb chromatography process from batch to continuous:optimizing productivity to minimize consumable requirements[J]. Journal of Biotechnology, 2017, 242: 11-18. DOI:10.1016/j.jbiotec.2016.12.005 |
| [28] |
GJOKA X, ROGLER K, MARTINO R A, et al. A straightforward methodology for designing continuous monoclonal antibody capture multi-column chromatography processes[J]. Journal of Chromatography A, 2015, 1416: 38-46. DOI:10.1016/j.chroma.2015.09.005 |
| [29] |
NAJERA M. Selecting a multicolumn chromatography solution:overcoming the challenges of traditional chromatography solutions with technology[J]. Genetic Engineering & Biotechnology News Gen, 2017, 37(1): 20-21. |
| [30] |
GIRARD V, HILBOLD N J, NG C K, et al. Large-scale monoclonal antibody purification by continuous chromatography from process design to scale-up[J]. Journal of Biotechnology, 2015, 213: 65-73. DOI:10.1016/j.jbiotec.2015.04.026 |
| [31] |
FAHRNER R L, IYER H V, BLANK G S. The optimal flow rate and column length for maximum production rate of protein A affinity chromatography[J]. Bioprocess Engineering, 1999, 21(4): 287-292. DOI:10.1007/s004490050677 |
| [32] |
HAHN R, BAUERHANSL P, SHIMAHARA K, et al. Comparison of protein A affinity sorbents[J]. Journal of Chromatography A, 2005, 1093(1-2): 98-110. DOI:10.1016/j.chroma.2005.07.050 |




