2. 南京工业大学 材料化学工程国家重点实验室,江苏 南京 210009
2. State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
近年来,越来越多的研究者致力于乙醇的多途径生产研究,由于乙醇作为汽车发动机的可替代燃料比传统的汽油燃料拥有更多的优势[1, 2],它不仅拥有良好的抗爆震性能[3, 4],而且还可以减少温室气体的排放,是理想的清洁能源。当前由于醋酸行业的产能过剩,由醋酸和丙烯直接酯化生成醋酸异丙酯,再由醋酸异丙酯加氢生成乙醇的研究也越来越多[5~8]。
Cu基催化剂是最有效的加氢催化剂之一,近年来已得到了广泛的研究和认可,Cu/ZnO催化剂又因其具有良好的催化转化率和选择性而倍受青睐,Sung等[9]研究使用ZnO作助剂的Cu/ZnO/Al2O3催化剂用于丁酸丁酯加氢反应,发现添加的ZnO表现出双重作用,既增加了铜的分散程度,又降低了界面反应的活化能,大大提高了丁酸丁酯的转化率和丁醇的选择性,使得最佳反应温度降低到200℃。Fujita等[10]认为在CO2加氢反应中Cu和ZnO都是重要的催化活性组分,因此研究Cu和ZnO材料表面的相互作用对加氢反应体系的影响将会变得十分重要;研究表明[11, 12],通过控制前驱体溶液的浓度可以制备一系列不同形貌的六棱柱状ZnO晶体,它有两个{001}六边形底面和6个{100}侧面,两个{001}平面连接着Zn2+或O2-因而具有极性,而六个{100}侧面同时连接这两种离子,因而具有非极性。Tsang等[13, 14]提出不同ZnO的形貌将会与Cu之间产生明显不同的相互作用,对CO2加氢反应也将产生明显影响。Lei等[15]认为除了CuO的晶粒尺寸外,Cu和ZnO之间的相互作用以及氧空位的数量也将会影响催化性能。对于不同形貌的ZnO晶体,其极性面所占的比例与催化性能之间的关系鲜见报道,尤其用于醋酸异丙酯催化加氢合成乙醇和异丙醇的反应体系则未见报道。
为了进一步研究Cu在不同形貌ZnO界面上的相互作用及对醋酸异丙酯催化加氢反应的影响,拟通过控制前驱体溶液的浓度,调节ZnO晶体的生长习性,合成不同形貌规则的ZnO晶体[16, 17];然后将这些不同形貌的ZnO晶体作为铜基催化剂的载体,制备不同形貌的Cu/ZnO催化剂,用于醋酸异丙酯 (IA) 加氢合成乙醇和异丙醇的反应,以探索不同形貌ZnO晶体与Cu之间的相互作用及对酯加氢合成乙醇和异丙醇反应催化性能的影响。
2 实验部分 2.1 不同形貌ZnO晶体的合成不同形貌ZnO的制备方法是通过文献[18]报道的方法改性而来的,首先将3.0 g的二水合乙酸锌Zn (CH3COO)2·2H2O与1.92 g六亚甲基四胺溶于分别盛有36、120、240和360 mL的去离子水的烧杯中;将烧杯放置于超声器中超声15 min;取出后盖上保鲜膜在90℃的恒温烘箱中放置12 h;取出烧杯静置到室温后,将白色沉淀离心分离,然后再用醇洗,最后水洗至中性;60℃下干燥过夜;最后在200℃空气氛围下焙烧2 h。按照前驱体浓度从大到小的顺序依次命名制备好的ZnO晶体名称为ZnO-a,ZnO-b,ZnO-c和ZnO-d。
2.2 不同形貌Cu/ZnO催化剂的制备将制备好的不同形貌ZnO晶体缓慢倒入溶解于去离子水的Cu (NO3)2∙3H2O水溶液中,放置在电磁搅拌仪中搅拌10 h,然后将悬浮液倒入圆底烧瓶于旋转蒸发仪上旋转蒸干,得到的沉淀物在在90℃下干燥过夜,最后500℃下焙烧3 h。制得铜负载量为20%(wt) 的Cu/ZnO催化剂,根据ZnO晶体的不同形貌依次命名为Cu/ZnO-a,Cu/ZnO-b,Cu/ZnO-c和Cu/ZnO-d。
2.3 催化剂的表征XRD在日本Rigaku公司SarmtLab衍射仪上进行检测,采用CuKα为射线源 (λ=0.15406 nm),激发电压为40 kV,电流100 mA,扫描速率20°×min-1,扫描范围2θ=20°~80°。样品中CuO的平均晶粒尺寸通过谢乐公式估算,,其中波长λ=0.15406 nm,β为衍射峰半高宽,θ为衍射角。
SEM是在Hitachi公司的S-4800N型场发射环境扫描电子显微镜上进行的。
TEM是在日本JEM-2100型透射电子显微镜上进行测试的。
Raman光谱是在Confocal Renishaw公司的RM-1000型表面增强激光拉曼光谱仪上进行测试,激光光源采用He-Cd光源器,波长为514 nm,扫描范围200~800 cm-1。
H2-TPR、CuO分散度的测定是在美国麦克公司AutoChem II 2920上进行,TCD检测器检测并记录信号。称取约50 mg样品置于石英反应管中,通入高纯Ar并升温至200℃预处理1 h,冷却至50℃,然后再通入H2(10%)/Ar的还原气,开始程序升温还原至500℃,气体流速30 mL×min-1,升温速率10℃×min-1。将此过程消耗的H2量记为X,然后经过He气吹扫降温至50℃后,以30 mL×min-1的速度通入N2O (20%)/N2的混合气将催化剂表面分散的Cu原子氧化为Cu2O,并保持1 h;再以He气进行吹扫,以H2(10%)/Ar的混合还原气对氧化后的Cu+进行还原,并将此过程消耗的H2量记为Y。CuO的分散度可由以下公式得到:
催化剂的催化性能评价是在天津先权科贸仪器有限公司生产的WFSM-3060固定床反应器中进行,不锈钢反应管,装填催化剂 (40~60目)1.5 g,在催化剂上下方各装填一定量的石英砂 (45~60目)。催化剂在2.0 MPa下用100 mL×min-1的H2,以5℃×min-1的速度从室温升至310℃进行原位还原5 h。还原结束后,将温度降至规定的反应温度,同时升至反应压力,然后开始催化性能评价。反应时,醋酸异丙酯通过高压计量泵计量后与H2进入混合器,再经汽化器,随后在反应器内反应,反应产物气体经过冷凝,气液分离,得到液体样品。反应时控制压力为5.0 MPa、氢气与醋酸异丙酯摩尔比30、酯流量0.03 m L×min-1不变,反应稳定后取样,气相色谱分析,内标法定量。具体分析条件:色谱柱温度:65℃;检测器温度:200℃;汽化室温度:200℃;载气:高纯99.99%的N2;载气压力:0.06 MPa;氢气压力:0.05 MPa;柱前压 (N2):0.05 MPa。
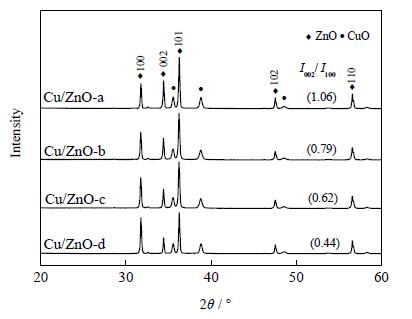
3 结果与讨论 3.1 催化剂形貌表征 3.1.1 XRD表征如图 1所示为还原前四种不同形貌的Cu/ZnO催化剂的XRD谱图,图中可以观察到所有的ZnO衍射峰对应六角纤锌矿结构 (JCPDS 36-1451),强烈而又尖锐的衍射峰表明这些ZnO拥有很高的结晶度,无杂峰。值得注意的是不同形貌ZnO的 (002) 与 (100) 衍射峰之间的相对强度有很大的差异,通过JADE软件计算结果表明:随着前驱体浓度的降低,I(002)/I(100)强度比按1.06>0.79>0.62>0.44逐渐降低,较高的I(002)/I(100)比值就意味着盘状ZnO拥有更大的极性面比例[16]。其中六亚甲基四胺与醋酸锌反应的结果为纳米ZnO六棱柱,(002) 等数字为ZnO各晶面指数。强度高低和结晶好坏、成膜厚度、颗粒大小基本上是正相关。另外还可以看到CuO (JCPDS 44-0706) 的衍射峰 (2θ=35.6°,38.8°,48.9°),通过谢乐公式估算出还原前Cu/ZnO催化剂中CuO的平均晶粒尺寸由盘状到棒状催化剂依次为23.3、25.7、30.1、32.2 nm,晶粒尺寸逐渐增大。
|
图 1 还原前Cu/ZnO-a, b, c, d催化剂的X射线衍射图 (XRD) Fig.1 XRD patterns of Cu/ZnO-a, b, c, d catalysts before reduction |
如图 2所示,扫描电镜结果更加清晰的证明ZnO晶体的形状随着前驱体浓度的降低由六边形盘状逐渐变为六棱柱状。通过图 2(a)可以清晰的看到由高浓度前驱体制备得到外形一致的完美六边形ZnO晶体。通过降低前驱体的浓度,六边形的直径逐渐减小,长度逐渐增长,逐渐长成六棱柱状。这种由于前驱体浓度变化而形状发生变化的结果与Vayssieres[19]的观察结果相一致。根据ZnO晶体的形状不同 (图 (a)、图 (b)、图 (c) 和图 (d)),分别将ZnO晶体标记为ZnO-a,ZnO-b,ZnO-c和ZnO-d。

|
图 2 ZnO晶体的扫描电镜图 Fig.2 SEM micrographs of ZnO crystals |
如图 3为负载活性组分之后的盘状Cu/ZnO催化剂的扫描电镜图及相应Cu元素和Zn元素的元素分析图。由图 3(a)可以看到负载了活性组分之后,ZnO晶体依然保持规则的六边形盘状晶体形貌。图 3(b)为相应的Cu元素的元素分析图,可以看到Cu元素的分布较为均匀,因此可以证明经过浸渍法负载的CuO在盘状ZnO晶体的表面分散很均匀。图 3(c)为Zn元素的元素分析图,图中依然可以看到由ZnO构成的规则的六边形的晶体形貌。

|
图 3 Cu/ZnO-a催化剂的SEM图及其对应的EDX图 Fig.3 SEM and EDX micrographs of Cu/ZnO |
ZnO晶体的微观结构通过透射电镜进行表征,如图 4所示,使用a型和d型样品分别进行表征,图 4(a)所示的是ZnO-a的平面视图,也更加清晰的验证了与扫描电镜的结果一致,都是规律的六边形形状,插图中的选区电子衍射图案 (SAED) 可以被索引到沿[001]带轴的衍射,这反映了盘状ZnO六边形{001}极性平面的单结晶性质。如图 4(b)所示是该样品的高分辨率电镜照片,在晶体边缘可以看到清晰的晶格条纹和0.282 nm的纳米晶面间距,这可以归结为纤锌矿ZnO晶体的{100}非极性面。图 4(c)展示了ZnO-d样品的侧面视图,相应的选区电子衍射图案被索引为[100]区的斑点,这也证明了这种ZnO纳米棒的结晶度很高[18]。图 4(d)所示该样品的高分辨率电镜图显示出了有序的晶格条纹与0.263 nm的晶面间距,这也与纤锌矿ZnO的{002}面一致[20, 21],同时也确定了ZnO纳米棒的生长方向。

|
图 4 ZnO晶体的透射电镜图、选区电子衍射图以及高倍透射电镜图; Fig.4 TEM and HRTEM micrographs of ZnO crystals with SAED patterns |
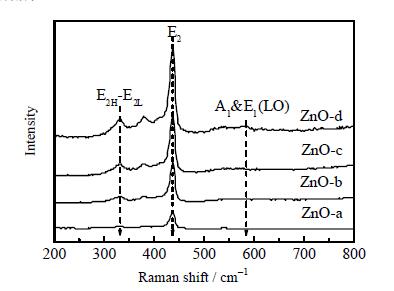
如图 5所示的是ZnO晶体的拉曼光谱图,所有的光谱在437 cm-1处都有一个突出的峰,这是由于六边形纤锌矿ZnO拉曼活性光学声子E2模式的特征[17]。在333 cm-1处也可以观察到一些比较弱的特征峰,是由于多声子E2H-E2L模式,在550~600 cm-1处的衍射峰是由于A1和E1(LO) 模式的叠加,同时也证明了ZnO晶相良好的纯度[18],同时也观察到ZnO-d在E2模式下变得更强的纵横比,这也证明ZnO晶体良好的结晶性。
|
图 5 ZnO-a, b, c, d晶体的Raman谱图 Fig.5 Raman spectra of the ZnO-a, b, c, d crystals |
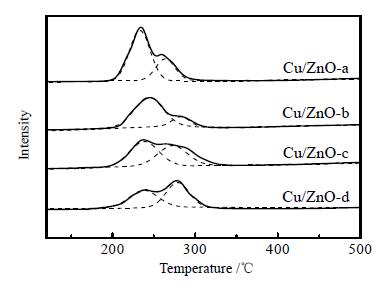
如图 6所示为四种不同形貌的Cu/ZnO催化剂的H2-TPR图,从图中可以看出所有的催化剂都有较宽的还原峰,这些还原峰归结于不同类型的CuO的还原峰 (ZnO的还原峰不会低于300℃),可以发现分散在ZnO表面上的CuO其还原温度比单纯的CuO的还原温度 (340℃左右)[22, 23]要低很多,因此也可以证明ZnO晶体与活性组分Cu之间的相互作用,增强了CuO的还原性。250℃左右的低温还原峰归结为与ZnO晶体有强相互作用且高度分散的CuO的还原峰,280℃左右的高温还原峰归结于与ZnO有较弱相互作用的CuO的还原峰[24-25]。通过拟合结果可以更清晰的看出低温还原峰逐渐减小,低温还原峰面积占总还原峰面积的比例由盘状催化剂Cu/ZnO-a到柱状催化剂Cu/ZnO-d依次为0.75,0.67,0.56,0.46逐渐降低,说明盘状催化剂拥有最多的分散度高且易还原的CuO。
|
图 6 Cu/ZnO-a, b, c, d催化剂的H2-TPR图谱 Fig.6 H2-TPR spectra of the ZnO-a, b, c, d samples |
四种不同形貌的Cu/ZnO催化剂在醋酸异丙酯加氢制备乙醇和异丙醇反应中催化性能如表 1所示。反应条件为T=270℃,p=5.0 MPa,n(H2)/n(IA)=30,重时空速 (WHSV)=1.04 h-1。其中Cu/ZnO-a催化剂的加氢活性最高,IA的转化率为78.9%,乙醇和异丙醇的选择性分别达到了86.6%和96.5%,副产物乙酸乙酯 (EA) 的选择性为2.9%。由盘状催化剂到柱状催化剂,催化活性依次下降,乙醇和异丙醇的选择性也依次下降;Cu/ZnO-d催化剂的催化活性最低,IA转化率仅69.5%,乙醇和异丙醇的选择性下降至80.2%和89.9%,EA选择性则增大到7.5%。由此可看出Cu/ZnO-a催化剂拥有最好的催化活性,这可能是因为盘状催化剂拥有更多的分散度好且易还原的CuO,促进了酯加氢催化反应的进行,这也与H2-TPR表征结果相吻合。
| 表 1 不同形貌Cu/ZnO催化剂对应的醋酸异丙酯加氢活性比较 Table 1 Comparison of Cu/ZnO catalyst activity for isopropyl acetate hydrogenation |
表 2定量地表示出了四种形貌ZnO晶体的结构尺寸以及相应的极性面所占的比例。由表 2可见,随着ZnO晶体从盘状到棒状,ZnO晶体极性面面积所占总面积的比例逐渐减小,同时可以看到CuO分散度从盘状催化剂到棒状催化剂也在逐渐减小,CuO的晶粒尺寸 (通过谢乐公式估算) 也在逐渐增大。
| 表 2 四种不同形貌ZnO晶体颗粒尺寸、极性面所占比例一览表 Table 2 Comparison of particle size and polar surface proportion of different Cu/ZnO catalysts |
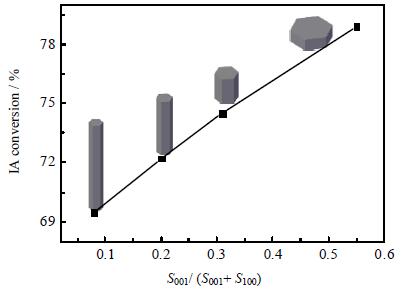
为了更直观的说明催化活性与ZnO极性面所占比例之间的关系,作出了它们之间的线性关系图,如图 7所示,由图可见催化剂活性与ZnO极性面所占比例呈良好的线性关系,随着ZnO极性面所占比例的增大,IA转化率显著提高,说明ZnO晶体极性面所占比例的大小对Cu/ZnO催化剂的催化活性有显著的影响。
|
图 7 催化活性与ZnO晶体极性面所占比例的关系图 Fig.7 Relationship between ZnO polar surface proportion and catalytic activity |
这归因于盘状Cu/ZnO-a催化剂拥有最高的极性面比例,随着晶体极性面比例的升高,活性组分Cu和ZnO晶体极性面之间的相互作用会更强,从而使得表面CuO的分散度由柱状催化剂的4.8%到盘状催化剂的7.5%逐渐增大,晶粒尺寸逐渐减小,同时增强了CuO的加氢还原能力,CuO的低温还原峰比例由柱状催化剂的0.46到盘状催化剂的0.75逐渐增大,更有助于氢气的解离和醋酸异丙酯的活化,因此盘状催化剂Cu/ZnO-a拥有更高的醋酸异丙酯加氢性能。
4 结论采用水热法并通过控制前驱体溶液的浓度制备了四种不同形貌的ZnO晶体,并分别作为铜基催化剂的载体负载活性组分Cu,用于醋酸异丙酯催化加氢合成乙醇和异丙醇。发现四种不同形貌ZnO的 (002) 与 (100) 衍射峰之间的相对强度有很大的差异,从盘状到柱状,I(002)/I(100)强度比按1.06>0.79>0.62>0.44逐渐降低,I(002)/I(100)比值越大,意味着ZnO拥有的极性面比例越高;同时盘状Cu/ZnO催化剂拥有最高的醋酸异丙酯转化率和产物选择性,这是因为盘状ZnO-a晶体拥有最高的极性面比例,极性面比例越高,与Cu之间的相互作用越强,进而增大活性组分在极性面上的分散度,降低晶粒尺寸,从而使催化加氢活性得到提高。
| [1] | Nan Z, Tan Z, Sun L. Investigation on thermodynamic properties of ethanol+gasoline blended fuel[J]. Energy & Fuels , 2004, 18(1): 84-89. |
| [2] | Balabin R M, Syunyaev R Z, Karpov S A. Molar enthalpy of vaporization of ethanol-gasoline mixtures and their colloid state[J]. Fuel , 2007, 86(3): 323-327. DOI:10.1016/j.fuel.2006.08.008. |
| [3] | Celik M B. Experimental determination of suitable ethanol-gasoline blend rate at high compression ratio for gasoline engine[J]. Applied Thermal Engineering , 2008, 28(5-6): 396-404. DOI:10.1016/j.applthermaleng.2007.10.028. |
| [4] | Yüksel F, Yüksel B. The use of ethanol-gasoline blend as a fuel in an SI engine[J]. Renewable Energy , 2004, 29(7): 1181-1191. DOI:10.1016/j.renene.2003.11.012. |
| [5] | Kenichi S, Nishiyama M, Suzuki T, et al. Process for preparation of lower fatty acid ester:US, 5189201[P]. 1993-02-23. |
| [6] | LI You-lin(李有林), CUI Mi-fen(崔咪芬), QIAO Xu(乔旭), et al. Study on the formation kinetics of isopropyl acetate synthesized from acetic acid and propylene(丙烯和乙酸一步加成酯化生成乙酸异丙酯反应动力学研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25(3): 430-436. |
| [7] | Yada S, Takasaki K, Suzuki Y, et al. Catalytic esterification process for producing (meth) acrylate esters:US, 20050209481[P]. 2005-09-22. |
| [8] | DING Yun-jie (丁云杰), DIAO Cheng-ji (刁成际), CHEN Wei-miao (陈维苗), et al. Method for preparing isopropanol and ethanol from propylene and acetic acid (一种以丙烯和醋酸为原料制备异丙醇和乙醇的方法): CN, 103880591A[P]. 2014-06-25. |
| [9] | Kim S M, Lee M E, Choi J W, et al. Role of ZnO in Cu/ZnO/Al2O3 catalyst for hydrogenolysis of butyl butyrate[J]. Catalysis Communications , 2011, 12(14): 1328-1332. DOI:10.1016/j.catcom.2011.05.006. |
| [10] | Fujita S, Usui M, Ito H, et al. Mechanisms of methanol synthesis from carbon dioxide and from carbon monoxide at atmospheric pressure over Cu/ZnO[J]. Journal of Catalysis , 1995, 157(2): 403-413. DOI:10.1006/jcat.1995.1306. |
| [11] | Garcia S P, Semancik S. Controlling the Morphology of Zinc Oxide Nanorods Crystallized from Aqueous Solutions:The Effect of Crystal Growth Modifiers on Aspect Ratio[J]. Chemistry of Materials , 2007, 19(16): 4016-4022. DOI:10.1021/cm061977r. |
| [12] | Wang Z L. Zinc oxide nanostructures:growth, properties and applications[J]. Journal of Physics:Condensed Matter , 2004, 16(25): 829-858. DOI:10.1088/0953-8984/16/25/R01. |
| [13] | Liao F L, Huang Y Q, Ge J W, et al. Morphology-dependent interactions of ZnO with Cu nanoparticles at the materials' interface in selective hydrogenation of CO2 to CH3OH[J]. Angewandte Chemie International Edition , 2011, 50(9): 2162-2165. DOI:10.1002/anie.v50.9. |
| [14] | Narayanan R, El-Sayed M A. Catalysis with transition metal nanoparticles in colloidal solution:nanoparticle shape dependence and stability[J]. The Journal of Physical Chemistry B , 2005, 109(26): 12663-12676. DOI:10.1021/jp051066p. |
| [15] | Lei H, Nie R, Wu G, et al. Hydrogenation of CO2 to CH3OH over Cu/ZnO catalysts with different ZnO morphology[J]. Fuel , 2015, 154: 161-166. DOI:10.1016/j.fuel.2015.03.052. |
| [16] | Li G R, Hu T, Pan G L, et al. Morphology-function relationship of ZnO:polar planes, oxygen vacancies, and activity[J]. The Journal of Physical Chemistry C , 2008, 112(31): 11859-11864. DOI:10.1021/jp8038626. |
| [17] | Peng Y, Xu A, Deng B, et al. Polymer-controlled crystallization of zinc oxide hexagonal nanorings and disks[J]. The Journal of Physical Chemistry B , 2006, 110(7): 2988-2993. DOI:10.1021/jp056246d. |
| [18] | Hu J, Fan Y, Pei Y, et al. Shape effect of ZnO crystals as cocatalyst in combined reforming-hydrogenolysis of glycerol[J]. ACS Catalysis , 2013, 3(10): 2280-2287. DOI:10.1021/cs400526s. |
| [19] | Vayssieres L. Groeth of arrayed nanorods and nanowires of ZnO from aqueous solutions[J]. Advanced Materials , 2003, 15(5): 464-466. DOI:10.1002/adma.200390108. |
| [20] | Wang G, Deng Y, Guo L. Single-crystalline ZnO nanowire bundles:synthesis, mechanism and their application in dielectric composites[J]. Chemistry-A European Journal , 2010, 16(33): 10220-10225. DOI:10.1002/chem.200902973. |
| [21] | Xu F, Zhang P, Navrotsky A, et al. Hierarchically assembled porous ZnO nanoparticles:synthesis, surface energy, and photocatalytic Activity[J]. Chemistry of Materials , 2007, 19(23): 5680-5686. DOI:10.1021/cm071190g. |
| [22] | Wang L C, Liu Y M, Chen M, et al. Production of hydrogen by steam reforming of methanol over Cu/ZnO catalysts prepared via a practical soft reactive grinding route based on dry oxalate-precursor synthesis[J]. Journal of Catalysis , 2007, 246(1): 193-204. DOI:10.1016/j.jcat.2006.12.006. |
| [23] | Nie R F, Lei H, Pan S Y, et al. Core-shell structured CuO-ZnO@H-ZSM-5 catalysts for CO hydrogenation to dimethyl ether[J]. Fuel , 2012, 96(1): 419-425. |
| [24] | Zhai X F, Shamoto J, Xie H J, et al. Study on the deactivation phenomena of Cu-based catalyst for methanol synthesis in slurry phase[J]. Fuel , 2008, 87(4-5): 430-434. DOI:10.1016/j.fuel.2007.07.008. |
| [25] | Yuan Z L, Wang L N, Wang J H, et al. Hydrogenolysis of glycerol over homogenously dispersed copper on solid base catalysts[J]. Applied Catalysis B Environmental , 2011, 101(3-4): 431-440. DOI:10.1016/j.apcatb.2010.10.013. |




