2. 中国石油天然气股份有限公司 石油化工研究院,北京 102206
2. Petrochemical Research Institute, PetroChina Co. Ltd., Beijing 102206, China
石油作为人类生产生活中最主要的能源,广泛应用于交通运输、机械制造等相关产业。而石油炼制、使用过程中,大量含硫化合物会造成环境污染、设备腐蚀及催化剂中毒等一系列问题[1, 2]。因此有效脱除硫化物中的硫元素、开发高效脱硫技术是当前清洁能源生产研究的热点。目前,加氢脱硫(HDS)技术已经成为生产洁净燃料的重要手段[3],而在众多HDS催化剂中,钼基硫化物催化剂由于其较高的脱硫活性、较低的生产成本而被广泛应用[4~7]。
对于MoS2表面的脱硫机理,目前广泛接受的是配位不饱和理论,即催化剂的活性位是处于MoS2晶体边缘上的配位不饱和位(CUS)[8, 9]。该理论反应过程包括[10]:(1) MoS2晶体边缘位置上的S原子脱附,形成CUS位;(2)含硫化合物在CUS位吸附;(3) C‒S键断裂完成催化脱硫。Paul等[11]利用动力学的方式研究了MoS2稳定边缘上空穴产生的机理,发现少量硫空穴能够短暂存在,空穴的形成和消失(饱和)之间存在动力学平衡。对于MoS2表面的HDS机理,Todorova等[12]对甲硫醇在周期性MoS2模型的钼边缘的吸附、脱硫反应机理进行了研究,并考虑了钼边缘的硫覆盖度的影响,发现CUS的存在有效提高了硫化物的吸附及催化脱硫效果。Todorova等[13]研究了乙硫醇在周期性MoS2钼边缘上反应生成乙烷和乙烯的反应过程,也得到了相似的结论。
虽然目前实验和理论上对MoS2脱硫催化剂开展了一系列研究[14~16],但对于MoS2在HDS环境下的三角形团簇[17]结构上的催化脱硫机理研究相对较少。因此,深入且系统地研究此形貌MoS2催化剂表面含硫化合物脱硫过程反应机理及规律非常必要。基于此,本文采用密度泛函理论研究了MoS2团簇上CUS生成、CH3SH的吸附、脱硫反应路径以及氢气对于脱硫反应的影响,明确CH3SH在CUS位上的脱硫反应机理。
2 计算方法本文所有量化计算基于Accelry Inc公司的Materials-Studio软件包中的Dmol3模块[18~20]。广义梯度近似(GGA)和交换相关泛函PW91描述电子交换相关作用[21~23]。对于Mo原子的核内电子采用DFT半核心贋势(DSPP)近似,对于其他原子,如碳、氢、硫原子采用全电子近似。综合考虑计算精度和计算效率,体系能量、自洽场(SCF)、梯度和位移的收敛标准分别设置为1×10-5 Hartree/Å 、2×10-5 Hartree/Å 、4×10-3 Hartree/Å 和5×10-3 Å 。双数值型基组加极化函数(DNP)处理价电子波函数,热轨道占据与截断半径分别设置为0.01 Hartree和4.4 Å 。所有的计算结果都经过了零点能矫正。
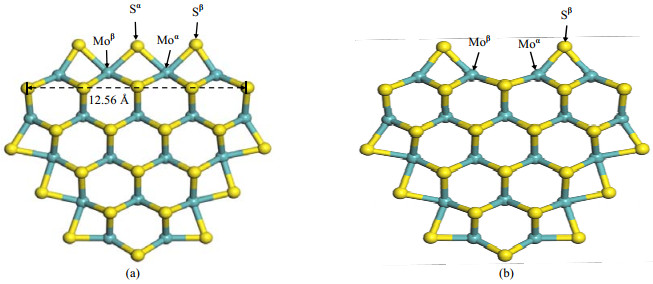
参考相关文献,构建了如图 1(a)所示的MoS2三角形团簇催化剂模型(Mo18S39)[24, 25],活性边缘均为Mo边缘,边缘终端为HDS条件下最稳定的50%硫原子覆盖[26, 27],边界长度为12.56 Å ,与实验中测得的MoS2粒子尺寸基本吻合[28]。图 1(b)为钼边缘CUS模型,两模型均进行了结构优化。为方便描述,作者对不同的Mo及S原子进行了标记和区分。在本文中,吸附能的计算公式表示为:
| $ {E_{{\text{ads}}}} = {E_{{\text{molecule}}}} - {E_{{\text{molecule(g)}}}} - {E_{{\text{cluster}}}} $ | (1) |
|
图 1 MoS2和CUS-MoS2团簇模型 Fig.1 Structures of the optimized MoS2 and CUS-MoS2 cluster |
其中,Eads是分子在团簇边缘的吸附能,Emolecule/cluster是分子吸附后体系的总能量。Emolecule(g)和Ecluster分别代表气态分子和清洁团簇的能量。
本文过渡态的搜索利用LST/QST方法[27]。对于团簇表面的反应,反应能垒Eact和反应能ΔE分别采用下面计算公式:
| $ {E_{\text{a}}} = {E_{{\text{TS}}}} - {E_{{\text{IS}}}} $ | (2) |
| $ \Delta E = {E_{{\text{FS}}}} - {E_{{\text{IS}}}} $ | (3) |
其中,EIS、ETS和EFS分别对应MoS2团簇表面上反应初态(IS)、过渡态(TS)和反应末态(FS)的体系总能量。
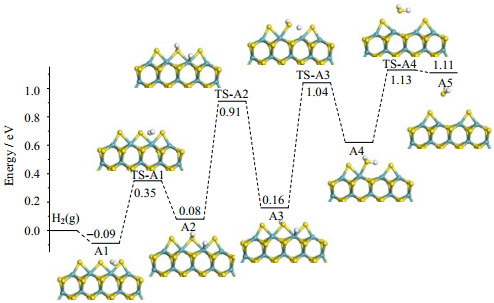
3 结果与讨论 3.1 MoS2团簇的CUS形成过程本节研究了在MoS2团簇上H2异裂及均裂两种可能的裂解方式。异裂过程中,两个H原子向Moα和Sα原子移动,形成Mo−H和S−H键,反应过程中能垒为0.44 eV,与文献数据(0.48 eV)[30]吻合;均裂过程中,H2中两H原子分别与两S原子结合形成两−SH基团,其反应能垒为2.27 eV,远高于异裂反应,从动力学角度说明异裂较均裂更易发生。因此本文只考虑H2在MoS2团簇边缘上异裂的反应及后续CUS形成过程,并将此路径命名为A。反应中各基元步骤中间体构型、反应能垒、反应能、300 K时反应速率常数如表 1和图 2所示。反应路径A分为四个步骤,第一步为H2的裂解吸附过程;第二步为H原子在边缘上的异构化;第三步中H原子转移生成−SH2基团;第四步为H2S的脱附产生CUS空位的过程。其中二、三两步均属于H原子的转移过程。第一步反应即为H2的异裂,TS-A1中,H−H键由A1中的0.73 Å 伸长至0.75 Å ,反应吸热0.17 eV。第二步为A2到A3的异构体转换反应。相对于第一步反应,此基元步骤能垒更高(Ea = 0.83 eV),吸热更少(0.08 eV)。第三步反应过程中Mo−H键断裂,H原子转移到S原子形成−SH2基团,此过程需克服0.88 eV的能垒,并吸收0.46 eV的热量。中间体A4的Mo−S的键长分别是2.62 Å 和3.59 Å ,其中Moα−Sα键已经发生断裂。最后一步反应中Moβ−Sα键断裂形成CUS空位,反应能垒Ea = 0.52 eV,反应能ΔE = 0.49 eV。
|
|
表 1 MoS2团簇上脱硫过程各基元反应的反应能垒Ea、反应能ΔE及速率常数k Table 1 Energy barriers Ea, reaction energies ΔE, and reaction rate constants k for elementary reactions during desulfurization on MoS2 cluster |
|
图 2 MoS2团簇上CUS形成过程势能面 Fig.2 Potential energy surfaces (PES) for CUS formation on MoS2 cluster |
CUS完整形成过程中,包括H2的离解、H原子的转移、Mo−S键断裂以及H2S脱附在内的四基元反应均为吸热反应,与Bollinger[31]得到H2离解吸热的结论相似。对比各基元步骤的速率常数发现,氢气解离后的异构体转换步速率常数k为3.08×10-1 s-1,是整个过程的速率控制步骤。
3.2 CH3SH在MoS2团簇上的脱硫过程CH3SH在MoS2团簇边缘上的吸附
MoS2团簇上通过H2解离与H2S脱附在边缘上形成了CUS位,对于CH3SH的脱硫过程,CUS是吸附及反应活性位。通过研究甲硫醇在CUS的吸附,优化得到了两种稳定的吸附构型,见图 3;表 2中给出了两结构中甲硫醇的吸附能和结构参数。CH3SH的两种吸附位分别是Mo原子的顶位(Mo-top位)和两个Mo原子的桥位(Bridge位),如图 3所示。CH3SH吸附于Mo-top位与Bridge位时,C−S键长均为1.81 Å ,略小于气态CH3SH的C−S键长(1.82 Å ),对应的吸附能分别是-0.91和-1.16 eV,因此CH3SH的Bridge位吸附为最稳定吸附构型,研究在此构型基础上进行了后续脱硫反应的计算。
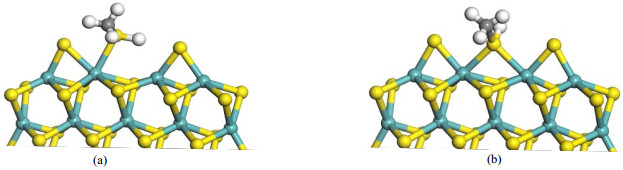
|
图 3 MoS2团簇CUS位CH3SH吸附构型 Fig.3 Optimized configuration of CH3SH adsorbed on CUS of MoS2 cluster |
|
|
表 2 甲硫醇在MoS2团簇边缘CUS上的吸附位、结构参数和吸附能Eads Table 2 Adsorption sites, structural parameters, and adsorption energies Eads for CH3SH on CUS at the edge of MoS2 triangular cluster |
CH3SH在MoS2团簇上的脱硫反应
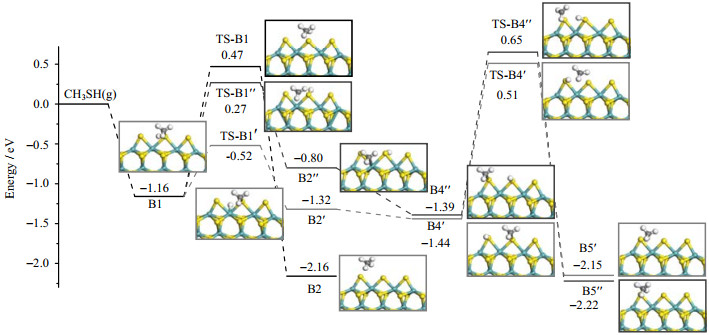
CH3SH吸附于CUS位之后,后续的脱硫路径包括以下三种可能:(1) S−H键和C−S键同时断裂直接生成甲烷;(2) S−H的优先断裂;(3) C−S键的优先断裂。对于三种路径,通过系统计算研究,得到三种CH3SH脱硫路径中涉及到的各中间体的构型、反应势垒、反应能、在300 K时反应速率常数及反应势能面(见表 1和图 4),其中,B1表示CH3SH最稳定的Bridge位吸附。
|
图 4 MoS2团簇边缘CH3SH脱硫反应势能面 Fig.4 PES for CH3SH desulfurization on MoS2 cluster |
对于反应(1),S−H和C−S键同时断裂(TS-B1)直接生成CH4(B2)。该基元步吸热1.00 eV,并需要克服1.63 eV的活化能垒,在300 K时反应速率常数为1.15 × 10-12 s-1。
甲硫醇S−H键的优先断裂的脱硫反应(2)中,S−H键经过断裂(TS-B1’)产生的H原子吸附于Mo原子上(B2’)。该断键反应放热0.16 eV,相应的能垒为0.64 eV,此反应较容易发生。生成甲烷前,H原子需要在团簇表面转移,此过程反应能垒较低,对整个路径决定性较小,其B2’到B4’的基元反应结构如图S1(见Supporting Information)所示。最终CH3基团脱离团簇表面与H原子结合成键形成甲烷分子并完成脱硫。此基元反应活化能垒高达1.95 eV并放热0.71 eV。300 K时反应速率常数为1.06 × 10-16 s-1,是整个反应的速率控制步骤。
反应(3)中C−S键的优先断裂的脱硫路径中,形成的CH3基团优先移动到边缘Mo原子上,得到中间体B2”。对应的基元反应需要吸收0.36 eV的热量,而反应势垒为1.43 eV,远远高于S−H键断裂的能垒。后续H原子与甲基的转移与上述路径相似,其反应能垒较低,对整个反应影响较小,具体结构如图S1所示。最终CH3基团和H原子分别吸附于边缘上的Sα和Sβ原子得到中间体B4”。最后一步反应中CH3与H结合生成甲烷,该基元步放热0.83 eV,活化能垒高达2.04 eV,反应速率常数k为3.29×10-18 s-1,为整个反应过程的速率控制步骤。
对比CH3SH三种可能的脱硫路径,虽然S−H键较易发生优先断裂,但三条路径中CH3基团和H原子结合生成甲烷的基元步才是决定脱硫反应的速控步。比较各速控步发现,CH3SH吸附后直接反应生成CH4的路径在300 K时具有最高的反应速率,且需要克服的能垒最小并释放出更多热量。因此,CH3SH吸附于MoS2团簇CUS活性位后,通过同时断裂S−H和C−S键直接生成CH4为最优脱硫路径。
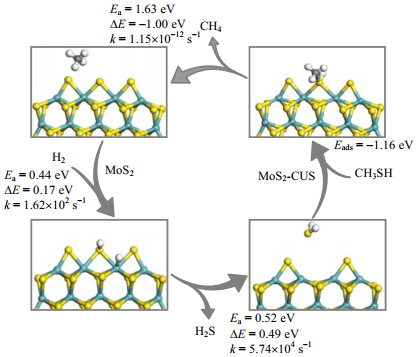
3.3 MoS2团簇CH3SH完整脱硫过程对上述两个反应过程进行总结归纳,在MoS2团簇边缘上总脱硫反应过程如图 5所示。完整脱硫反应可以分成活性位形成及甲硫醇脱硫两个步骤,在整个过程中,配位不饱和位CUS起着重要的作用。
|
图 5 MoS2团簇边缘完整脱硫示意图 Fig.5 Schematic diagram of the desulfurization process on MoS2 cluster |
MoS2团簇边缘上首先进行活性位的形成,MoS2边缘上的S原子最终以H2S的形式脱除形成CUS位。H2的裂解吸附和H2S脱附过程所需要的能垒比较低,分别为0.44和0.52 eV,对应的反应速率常数也较大,说明对脱硫过程影响较小。反应过程中,H原子的转移决定活性位的形成,对应的反应速率为3.08×10-1 s-1。
CH3SH与H2S在CUS位上的吸附能分别为1.16和0.73 eV,相比之下CH3SH吸附更为稳定。由上文得到的最优脱硫路径为直接裂解生成CH4的反应。其反应速率常数为1.15×10-12 s-1,远低于CUS形成过程中H原子转移的反应速率。说明对于CH3SH完整的脱硫过程,S−H和C−S键的断裂生成CH4的基元步决定了整个反应的反应速率。
3.4 氢气对CH3SH脱硫的影响考虑到实际脱硫工艺是在氢气氛围中进行的,而不饱和活性中心CUS又具有一定的活性,不可避免地会有氢原子与甲硫醇在团簇边缘CUS位发生共吸附。而H原子的吸附会对CH3SH的脱硫过程产生影响,对于这种影响,作者进行了探索性研究。
首先考虑氢原子的存在对于CH3SH吸附的影响,研究氢气氛下,CH3SH吸附状态的改变;然后研究H原子存在对CH3SH脱硫过程的影响。为方便描述,将参与反应的H原子进行了标记,如图 6所示。
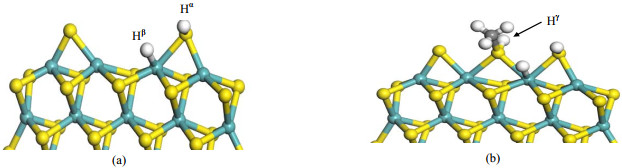
|
图 6 MoS2团簇CUS位甲硫醇和氢原子共吸附构型 Fig.6 Optimized configuration of methanthiol and H co-adsorbed on CUS of MoS2 cluster |
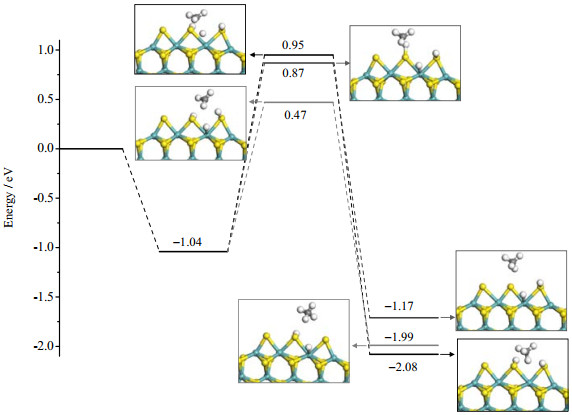
H存在的团簇边缘上,甲硫醇在Bridge位的吸附如图 6(b)所示,吸附能为-1.04 eV,略小于其在清洁表面的吸附能-1.16 eV,说明H原子的共吸附增大了空间位阻效应,对CH3SH的吸附有一定的抑制作用。为对比清洁表面最优脱硫路径,对三种相似的脱硫反应进行了研究-CH3基团分别与Hα、Hβ和Hγ结合生成甲烷,所得势能面如图 7所示。三个脱硫反应能垒分别是1.51,1.99和1.91 eV。甲硫醇中S−H和C−S键同时断裂生成甲烷的基元步能垒为1.91 eV,相比于清洁表面提高了0.28 eV。然而CH3与相邻S原子上吸附的Hα结合生成甲烷的反应具有最低的活化能垒(1.51 eV),小于清洁表面上的脱硫反应,表明共吸附的H原子更易与CH3基团反应实现脱硫。总体而言,共吸附H原子使得CH3SH吸附能减小了0.12 eV,却有效降低了脱硫反应能垒(1.51 eV vs 1.63 eV)。
|
图 7 氢氛围下MoS2团簇边缘CH3SH脱硫反应势能面 Fig.7 PES for CH3SH desulfurization processes on MoS2 cluster under hydrogen atmosphere |
运用密度泛函理论系统研究了MoS2团簇边缘上的加氢生成CUS位的过程、甲硫醇在CUS位的吸附及脱硫反应。探索了氢气分解吸附的方式,发现氢分子是以异裂方式生成两个H原子,分别吸附于团簇Mo原子和S原子上。分析CUS的形成过程发现,CUS的存在只能是短暂的动态平衡,且降低H2S分压可以促进CUS形成。甲硫醇吸附于CUS的Bridge位是最稳定的吸附构型。通过对Bridge位吸附后续可能存在的脱硫路径进行研究,发现生成甲烷的基元反应是整个脱硫过程中的速率控制步,而甲硫醇吸附后S−H和C−S键的同时断裂生成CH4的反应是最优路径。最后,探索性地研究了氢气氛围下,共吸附H原子对脱硫反应的影响。研究发现,共吸附H原子对甲硫醇的吸附有抑制作用,却能够有效促进甲硫醇的脱硫。
| [1] | LIANG Chao-lin(梁朝林). Processing of high sulfur crude oil(高硫原油加工)[M].Beijing(北京): China Petrochemical Press(中国石化出版社), 2001. |
| [2] | QU Guo-hua(瞿国华). Important orientation of China's refining industry in 21th century-processing heavy and superheavy crude oil, sino-global energy((21世纪中国炼油工业的重要发展方向-重质(超重质)原油加工))[J]. Sino-Global Energy(中外能源), 2007, 12(3): 54-62. DOI:10.3969/j.issn.1673-579X.2007.03.014. |
| [3] | SHI Ya-hua(石亚华), LI Da-dong(李大东). Technical progress in hydrodesulfurization, petroleum refinery engineering(加氢脱硫的技术进展)[J]. Petroleum Refinery Engineering(炼油设计), 1999, 29(8): 16-22. DOI:10.3969/j.issn.1002-106X.1999.08.004. |
| [4] | Prins R, De Beer V, Somorjai G. Structure and function of the catalyst and the promoter in Co-Mo hydrodesulfurization catalysts[J]. Catalysis Reviews-Science and Engineering, 1989, 31(1-2): 1-41. DOI:10.1080/01614948909351347. |
| [5] | Lauritsen J V, Besenbacher F. Atom-resolved scanning tunneling microscopy investigations of molecular adsorption on MoS2 and CoMoS hydrodesulfurization catalysts[J]. Journal of Catalysis, 2015, 328: 49-58. DOI:10.1016/j.jcat.2014.12.034. |
| [6] | Orita H, Uchida K, Itoh N. Adsorption of thiophene on an MoS2 cluster model catalyst:ab initio density functional study[J]. Journal of Molecular Catalysis A:Chemical, 2003, 193(1-2): 197-205. DOI:10.1016/S1381-1169(02)00467-3. |
| [7] | Tuxen A, Kibsgaard J, Gøbel H, et al. Size threshold in the dibenzothiophene adsorption on MoS2 nanoclusters[J]. ACS Nano, 2010, 4(8): 4677-4682. DOI:10.1021/nn1011013. |
| [8] | Delmon B. A new hypothesis explaining synergy between two phases in heterogeneous catalysis the case of hydrodesulfurization catalysts[J]. Bulletin des Societes Chimiques Belges, 1979, 88(12): 979-987. |
| [9] | Asua J, Delmon B. Separation of the kinetic terms in catalytic reactions with varying number of active sites (case of the remote control model)[J]. Applied Catalysis, 1984, 12(2): 249-262. DOI:10.1016/S0166-9834(00)80295-X. |
| [10] | Zheng P, Duan A J, Chi K B, et al. Influence of sulfur vacancy on thiophene hydrodesulfurization mechanism at different MoS2 edges:a DFT study[J]. Chemical Engineering Science, 2017, 164: 292-306. DOI:10.1016/j.ces.2017.02.037. |
| [11] | Paul J F, Payen E. Vacancy formation on MoS2 hydrodesulfurization catalyst: DFT study of the mechanism[J]. Journal of Physical Chemistry B, 2003, 107(17): 4057-4064. DOI:10.1021/jp027668f. |
| [12] | Todorova T, Prins R, Weber T. A density functional theory study of the hydrogenolysis reaction of CH3SH to CH4 on the catalytically active (100) edge of 2H-MoS2[J]. Journal of Catalysis, 2005, 236(2): 190-204. DOI:10.1016/j.jcat.2005.09.032. |
| [13] | Todorova T, Prins R, Weber T. A density functional theory study of the hydrogenolysis and elimination reactions of C2H5SH on the catalytically active (100) edge of 2H-MoS2[J]. Journal of Catalysis, 2007, 246(1): 109-117. DOI:10.1016/j.jcat.2006.11.023. |
| [14] | Moses P G, Hinnemann B, Topsøe H, et al. The hydrogenation and direct desulfurization reaction pathway in thiophene hydrodesulfurization over MoS2 catalysts at realistic conditions:a density functional study[J]. Journal of Catalysis, 2007, 248(2): 188-203. DOI:10.1016/j.jcat.2007.02.028. |
| [15] | WANG Wei(王薇), ZHAO Xiao-guang(赵晓光), LI Hui-feng(李会峰), et al. MoS2-based hydrodesulphurization catalysts:structure of active phase and mechanism of catalytic reaction(硫化钼基加氢脱硫催化剂活性位的研究进展)[J]. Computers and Applied Chemistry(计算机与应用化学), 2014, 31(11): 1281-1286. |
| [16] | Ding S J, Jiang S J, Zhou Y S, et al. Catalytic characteristics of active corner sites in CoMoS nanostructure hydrodesulfurization -a mechanism study based on DFT calculations[J]. Journal of Catalysis, 2017, 345: 24-38. DOI:10.1016/j.jcat.2016.11.011. |
| [17] | Lauritsen J V, Kibsgaard J, Helveg S, et al. Size-dependent structure of MoS2 nanocrystals[J]. Nature Nanotechnology, 2007, 2(1): 53-58. DOI:10.1038/nnano.2006.171. |
| [18] | Delley B. An all-electron numerical method for solving the local density functional for polyatomic molecules[J]. Journal of Chemical Physics, 1990, 92(1): 508-517. DOI:10.1063/1.458452. |
| [19] | Delley B. Fast calculation of electrostatics in crystals and large molecules[J]. Journal of Chemical Physics, 1996, 100(15): 6107-6110. DOI:10.1021/jp952713n. |
| [20] | Delley B. From molecules to solids with the DMol3 approach[J]. Journal of Chemical Physics, 2000, 113(18): 7756-7764. DOI:10.1063/1.1316015. |
| [21] | Perdew J P. Density-functional approximation for the correlation energy of the inhomogeneous electron gas[J]. Physical Review B, 1986, 33(12): 8822-8824. DOI:10.1103/PhysRevB.33.8822. |
| [22] | Perdew J P, Wang Y. Accurate and simple analytic representation of the electron-gas correlation energy[J]. Physical Review B, 1992, 45(23): 13244-13249. DOI:10.1103/PhysRevB.45.13244. |
| [23] | Perdew J P, Burke K, Ernzerhof M. Generalized gradient approximation made simple[J]. Physical Review Letters, 1996, 77(18): 3865. DOI:10.1103/PhysRevLett.77.3865. |
| [24] | Mcbride K L, Head J D. DFT investigation of MoS2, nanoclusters used as desulfurization catalysts[J]. International Journal of Quantum Chemistry, 2009, 109(15): 3570-3582. DOI:10.1002/qua.v109:15. |
| [25] | Joo P H, Cheng J, Yang K. Size effects and odd-even effects in MoS2 nanosheets:first-principles studies[J]. Physical Chemistry Chemical Physics, 2017, 19(44): 29927-29933. DOI:10.1039/C7CP05402E. |
| [26] | Raybaud P, Hafner J, Kresse G, et al. Ab initio study of the H2-H2S/MoS2, gas-solid interface:the nature of the catalytically active sites[J]. Journal of Catalysis, 2000, 189(1): 129-146. DOI:10.1006/jcat.1999.2698. |
| [27] | Sun M, Nelson A E, Adjaye J. On the incorporation of nickel and cobalt into MoS2-edge structures[J]. Journal of Catalysis, 2004, 226(1): 32-40. DOI:10.1016/j.jcat.2004.05.005. |
| [28] | Travert A, Nakamura H, Van Santen R A, et al. Hydrogen activation on Mo-based sulfide catalysts, a periodic DFT study[J]. Journal of the American Chemical Society, 2002, 124(24): 7084-7095. DOI:10.1021/ja011634o. |
| [29] | Halgren T A, Lipscomb W N. The synchronous-transit method for determining reaction pathways and locating molecular transition states[J]. Chemical Physics Letters, 1977, 49(2): 225-232. DOI:10.1016/0009-2614(77)80574-5. |
| [30] | Prodhomme P Y, Raybaud P, Toulhoat H. Free-energy profiles along reduction pathways of MoS2 M-edge and S-edge by dihydrogen:a first-principles study[J]. Journal of Catalysis, 2011, 280(2): 178-195. DOI:10.1016/j.jcat.2011.03.017. |
| [31] | Bollinger M V, Jacobsen K W, Nørskov J K. Atomic and electronic structure of MoS2 nanoparticles[J]. Physical Review B, 2003, 67(8): 085410. DOI:10.1103/PhysRevB.67.085410. |




