2. 大连理工大学 物理与光电工程学院, 辽宁 大连 116023;
3. 大连理工大学 生命科学与技术学院, 辽宁 大连 116024
2. School of Physics and Optoelectronic Technology, Dalian University of Technology, Dalian 116023, China;
3. School of Life Science and Biotechnology, Dalian University of Technolgoy, Dalian 116024, China
大气压冷等离子体是近年新兴最有前途的绿色技术之一。等离子体在放电过程中可以产生多种活性因子,如紫外线、带电粒子、活性粒子、热效应等,这使其同时具有物理-化学活性[1]。在等离子体与微生物相互作用过程中,等离子体活性因子的协同效应较单一物理或化学方法对微生物的作用效果更为显著。由于大气压冷等离子体具有高效性、无毒性、简便性和节能性,近年,该技术被广泛应用于生物化学工程与技术领域,如等离子体灭菌技术、等离子体诱变技术、等离子体强化技术等[1~5]。
等离子体放电参数不同,其产生活性因子种类不相同[1, 6]。不同种类活性因子对不同种类微生物作用程度和引起生物学效应(杀灭、诱变和激活效应)也是不一样的。Laroussi等对大气压空气等离子体放电中,热效应、紫外线辐射、活性氧和活性氮粒子进行测定,结果表明当放电功率为25 W时,大气压空气等离子体放电过程中主要生成活性氧和活性氮粒子[1]。Soloshenko等发现在低气压、N2-O2混合气体放电中,紫外辐射和活性氧在等离子体灭活细菌过程中起主要作用[7]。Moisna等深入研究紫外辐射和活性氧对菌体作用,结果表明活性氧在对孢子处理中处于次级作用[8]。活性氧可以激活细胞膜上离子通道开放,调控胞内离子浓度,从而影响细胞生长与发育[9~11]。
Dong等人前期研究表明,大气压介质阻挡放电等离子体电源电压在26 V时,处理1 min的真核微生物酿酒酵母接种体乙醇转化率达到最大值0.48 g⋅g-1[4]。她们近期研究表明,大气压介质阻挡放电等离子体可以使酿酒酵母细胞膜电位去极化和超极化,从而提高细胞膜通透性[12]。细胞膜是物质进出细胞的屏障,膜通透性提高有助于底物输入和产物输出,从而解除底物和产物对细胞造成的多元抑制,提高微生物细胞转化效率[13]。但是当电源电压为26 V,大气压介质阻挡放电等离子体产生活性因子种类和其对原核微生物细胞膜的影响还不清楚。
本论文以空气作为气源,考察电源电压为26 V的大气压介质阻挡放电等离子体产生主要活性因子种类及其对克雷伯氏菌(Klebsiella pneumoniae)细胞膜影响,并对其可能作用机制和潜在应用做一讨论。克雷伯氏菌是一株重要工业微生物,可以转化甘油生产1,3-丙二醇,而后者是合成新型聚酯的重要单体[3]。此外,克雷伯氏菌是原核微生物,其细胞外壳(细胞壁和细胞膜)的组成和结构不同于作者之前报道的酿酒酵母。对其进行研究有利于更深入、广泛地揭示等离子体活性因子与微生物细胞膜相互作用机制,为建立和发展大气压冷等离子体调控和强化微生物发酵技术提供一定理论依据。
2 材料与方法 2.1 实验菌种克雷伯氏杆菌(Klebsiella pneumoniae)购买于中国微生物菌种保藏管理中心(CGMCC),编号为 2028。
2.2 培养基种子培养基成分[3]和LB培养基。
2.3 等离子体放电装置本论文采用的介质阻挡放电(dielectric barrier discharge,DBD)实验装置同文献[4]。
2.4 实验方法 2.4.1 样品制备克雷伯氏菌在250 mL三角瓶中培养,培养液体积为100 mL,棉塞封口保持微氧条件,恒温振荡培养箱转速150 r⋅min-1,温度为37℃,培养时间8~10 h,调整菌液OD650=2.0。
2.4.2 等离子体预处理样品将去离子水、磷酸钾缓冲溶液,种子液体培养基,含有克雷伯氏菌的磷酸钾缓冲溶液和含有克雷伯氏菌的种子培养液分别取3 mL,放置于直径为6 cm石英培养皿中,置于等离子体下电极上。等离子体放电间隙3 mm,放电电源电压为26 V,处理时间1、2、3、4、5 min,未处理样品为对照组。
2.5 分析方法 2.5.1 紫外线和羟基自由基测定发射光谱在线测定法。光谱强度绝对值数据来源于紫外线或羟基自由基光谱值与307.7 nm羟基自由基光谱值之比。
2.5.2 样品温度测定[14]数字温度计分别测定对照组克雷伯氏菌菌液温度和处理组克雷伯氏菌菌液温度。
2.5.3 pH测定[15]采用PHS-3C型精密pH计分别测定对照组克雷伯氏菌菌液pH值和处理组克雷伯氏菌菌液pH值。
2.5.4 活性氧自由基测定[16, 17]克雷伯氏菌菌液中氧自由基测定采用SBA-50型葡萄糖分析仪;克雷伯氏菌胞内氧自由基测定采用活性氧检测试剂盒,光谱扫描多功能读数仪测定其荧光强度,激发波长为488 nm,发射波长为525 nm。
2.5.5 细胞膜电位和膜通透性测定[12]取克雷伯氏菌细胞悬浮液,生理盐水洗涤一次,加入Rh123储备液至终质量浓度为10 μg⋅mL-1,37℃避光孵育30 min,用于细胞膜电位分析;细胞悬浮液加入2 mg⋅mL-1FAD储备液至终质量浓度为0.5 mg⋅mL-1,37℃避光孵育5 min,用于细胞膜通透性分析。将孵育后的细胞悬浮液离心,用生理盐水清洗1次,重悬于1 mL生理盐水中。荧光分光光度计分别检测孵育后菌细胞Rh123和FAD的荧光强度。 Rh123激发波长为488 nm,发射波长为523 nm;FAD激发波长为492 nm,发射波长为513 nm。
2.6 统计学方法实验结果采用mean±SEM表示,统计学处理使用origin 7.0软件通过单因素方差分析。与对照组相比,P<0.05认为统计学差异显著,P<0.01认为统计学差异极显著、P<0.001认为统计学差异极其显著。
本论文克雷伯氏菌实验数据是在同一活细胞浓度(OD650=2.0)条件下得到的,实验数据来源于三次实验平均值。
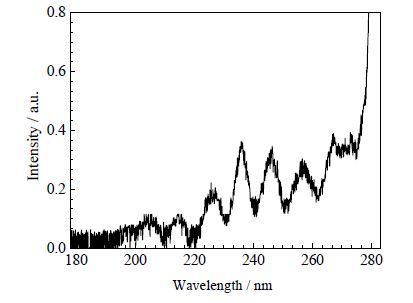
3 结果与讨论 3.1 冷等离子体中紫外线生成图 1显示在200~280 nm波长范围内紫外光谱,说明本实验物理参数条件下可以产生紫外线,这一结果与文献报道一致[18~21]。
|
图 1 大气压空气冷等离子体在200~280 nm 波长范围 内紫外光谱 Fig.1 A UV spectrum (200~280 nm) of the cold air plasma at atmospheric pressure |
近年来,对大气压空气等离子体放电过程中,紫外线是否起主要作用众说纷纭。Hermann、Trompeter、Montie、Kuamichev等发现大气压低温等离子体在200~350 nm波长范围内有紫外发射,并在对枯草芽孢杆菌的杀灭中起主要作用[18~21]。Larrious等人在空气非热能等离子体放电过程中没有检测到紫外线存在,因而认为紫外线在低温空气等离子体处理细菌过程中并不起主要作用[22]。更多学者认为,等离子体在与微生物的相互作用过程中,紫外线起协同作用[23]。
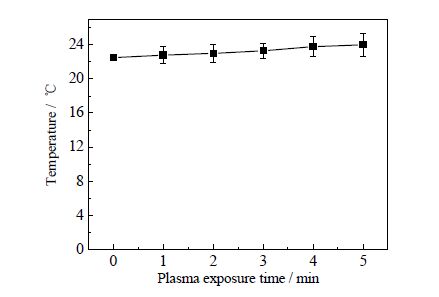
3.2 冷等离子体对样品温度影响等离子体在放电过程中会产生热量,为了考察热量对生物样品的影响,本研究对等离子体处理后样品温度进行测定。如图 2所示,随着等离子体处理时间延长,样品温度并无明显增加(P>0.05),几乎与对照相同,均在22~24℃。这说明本实验的等离子体是接近室温的,对样品无热效应影响。Laroussi和Deng等在对大气压冷等离子体灭活细菌研究中,也检测到等离子体放电温度接近室温,对微生物没有明显热效应[1, 24]。
|
图 2 大气压空气冷等离子体不同处理时间 样品温度变化 Fig.2 Temperature profiles of samples under different plasma exposure times |
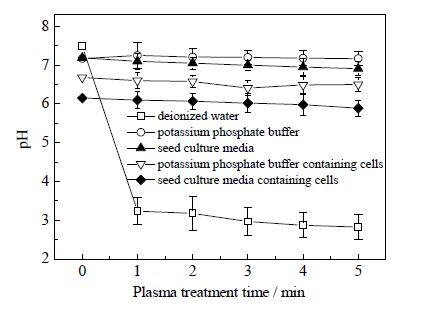
等离子体具有酸碱特性,能够增加水的酸度。酸性环境是引起微生物生物学效应的关键[15, 25]。因此,分别考察去离子水、磷酸钾缓冲溶液、液体种子培养基、含有克雷伯氏菌的磷酸钾缓冲溶液和含有克雷伯氏菌的种子培养液,这五种样品在不同等离子体处理时间pH值变化。如图 3所示,去离子水在等离子体处理1 min时,pH值明显下降(P<0.01),由7.49下降至3.24,随着等离子体处理时间延长(2~5 min),pH值缓慢降低。但是,其它四种样品pH值随着等离子体处理时间延长,并无明显减少(P>0.05) 。
|
图 3 大气压空气冷等离子体不同处理时间样品pH 变化 Fig.3 pH profiles of samples under different plasma exposure times |
等离子体能够引起去离子水pH值减少,这主要是由于在等离子体放电过程中产生的高能电子能够与液体样品界面水分子发生非弹性碰撞,从而引起H2O解离,形成氢自由基H"和羟基自由基"OH,"OH之间相互碰撞生成H2O2[26],余下的H"积累逐渐增多,导致去离子水中pH值显著下降。
除去离子水,实验中其它四种样品pH值在等离子体处理过程中并没有明显变化,可能是这四种样品溶液中的磷酸盐溶液缓冲作用的结果。本实验所用的磷酸盐缓冲溶液是由K2HPO4和KH2PO4组成,当溶液中H"富积时,会与K2HPO4反应生成KH2PO4,从而维持样品溶液pH稳定。所以,后四种样品溶液pH值随等离子体处理时间延长,并无明显变化。
综上所述,在本研究中大气压介质阻挡放电等离子体可以降解液体样品中H2O,引起H"积累,但是磷酸盐的缓冲作用,保证液体样品pH稳定。所以,本研究中pH不是引起微生物细胞产生生物学效应的主要原因。
3.4 冷等离子体诱导活性氧自由基生成活性氧自由基(reactive oxygen species,ROS)是生物体内一类活性含氧化合物总称,包括羟基自由基("OH)、过氧化氢(H2O2)和超氧阴离子(O2-·)等活性氧基团。文献报道,ROS在等离子体与生物体相互作用中起主导作用[27]。因此,作者对电源电压26 V的放电等离子体放电间隙间的气相环境、克雷伯氏菌菌液和克雷伯氏菌胞内的ROS进行检测。
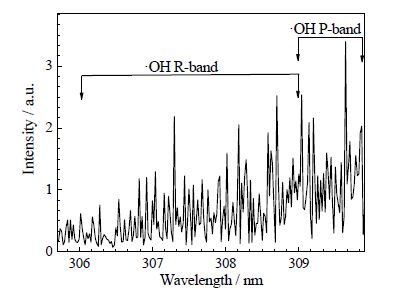
3.4.1 等离子体中羟基自由基生成在大气压下,处于激发态的"OH半衰期短(10-9 s)且浓度低,与其它气体分子频繁碰撞,在极短时间内很容易被猝灭,因此,通过发射光谱在线验证冷等离子体放电气相环境中"OH的存在。由图 4可知,本文的实验条件下,放电等离子体在305~310.5 nm波谱范围可以产生羟基自由基谱带。这一谱带是由306.6 nm附近R谱带和309.2 nm附近P谱带组 成[1]。
|
图 4 大气压空气冷等离子体发射光谱显示羟基自由基谱带 Fig.4 An emission spectrum showing -OH bands studied by cold air plasma at atmospheric pressure |
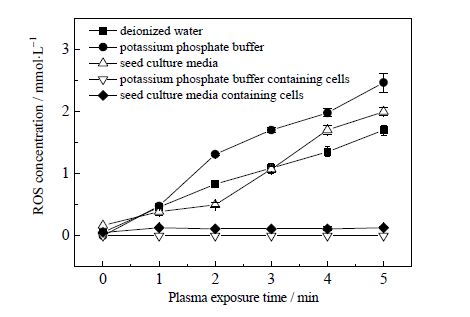
图 5显示随着等离子体不同处理时间,不同种类液体样品中活性氧粒子浓度变化。由图可知,随着等离子体处理时间延长,去离子水、磷酸钾缓冲溶液、液体种子培养基中活性氧粒子浓度显著增加(P<0.001);含有克雷伯氏菌的液体种子培养基中活性氧浓度虽然比对照显著增加(P<0.01),但是不如前三组活性氧浓度增加范围大;含有克雷伯氏菌的磷酸钾缓冲溶液中活性氧粒子浓度几乎没有变化,与对照样品一致(P>0.05)。
|
图 5 大气压空气冷等离子体不同处理时间胞外介质活性氧变化 Fig.5 ROS profiles of extracellular media under different plasma exposure times |
等离子体处理液体样品过程中,气液界面会产生许多初级和次级粒子,主要包括"OH、O"、O3、H2O2,它们渗透和溶解到液体中,促发液体样品的化学反应和生物学反应[25]。也有文献报道,当周围放电环境潮湿时,亚稳态O(1D)原子与H2O反应生成大量"OH[28]。因此,随着等离子体处理时间延长,去离子水、磷酸钾缓冲溶液和液体种子培养基中活性氧粒子浓度会显著增加。活性氧粒子的氧化活性促使它们迅速而直接与菌体细胞外壳磷脂上不饱和脂肪酸发生过氧化 反应,或是直接进入细菌胞内,从而使样品溶液中活性氧粒子浓度减少。因此,在含有克雷伯氏菌的液体样品中检测到的活性氧较少或检测不到活性氧粒子。
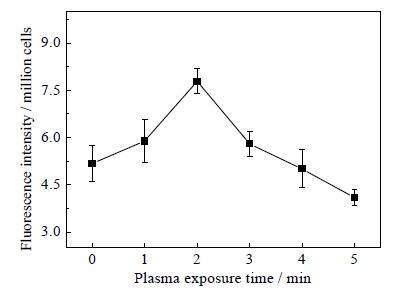
3.4.3 等离子体诱导克雷伯氏菌胞内氧自由基生成由图 6可知,随着等离子体处理时间延长,菌体荧光强度首先是逐渐增加,在处理2 min时达到最大(P<0.01),然后开始下降,直至4 min和5 min时,荧光强度低于对照。菌体荧光强度变化趋势反映菌体内活性氧浓度变化,说明等离子体能改变菌体内活性氧浓度。
|
图 6 大气压空气冷等离子体诱导克雷伯氏菌细胞 内活性氧累积 Fig.6 ROS accumulation in K. pneumoniae cells induced by cold air plasma under atmospheric pressure |
正常情况下,细胞内活性氧水平被控制在很低范围。但是当细胞受到等离子体刺激时,等离子体产生的电子(e)沉淀转移进入液体环境,与水(H2O)反应形成超氧阴离子(O2-⋅);这激活细菌体内抗氧化体系中的超氧化歧化酶(SOD)、过氧化氢酶和其它一些过氧化物酶活性。其中的SOD迅速催化O2-⋅和H+超氧化歧化,转化成危害性较小的H2O2[23]。H2O2进一步被过氧化氢酶分解形成H2O和O2[29]。菌体中ROS浓度与SOD活性呈正相关,与过氧化氢酶活性呈负相关。随着等离子体处理时间延长,SOD和过氧化氢酶的活性均呈现出逐渐升高趋势[16]。因此推断,在等离子体处理1~3 min,克雷伯氏菌细胞内SOD酶促进ROS浓度上升;随着等离子体处理时间延长(4~5 min),过氧化氢酶不断降解ROS,菌体胞内ROS浓度呈降低的变化趋势。
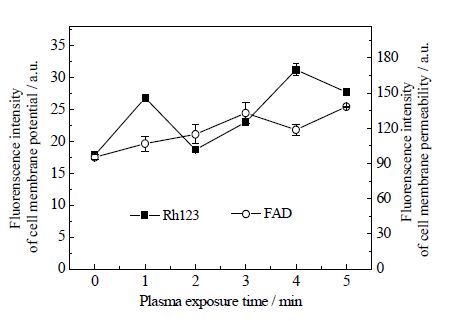
3.5 冷等离子体对克雷伯氏菌细胞膜通透性影响由图 7可知,随着等离子体处理时间延长,克雷伯氏菌细胞内Rh123荧光强度虽然有较大波动,但是总体趋势高于对照(P<0.01);而克雷伯氏菌细胞内FDA荧光强度波动较小,且始终高于对照组(P<0.01)。Rh123荧光强度与细胞膜电位呈正相关;FAD荧光强度与细胞膜通透性呈正相关;上述结果分别说明大气压介质阻挡放电等离子体可以改变克雷伯氏菌细胞膜电位和提高细胞膜通透性。
|
图 7 大气压空气冷等离子体对克雷伯氏菌细胞膜 通透性影响 Fig.7 Effects of cold plasma on Klebsiella pneumoniae cell membrane permeability |
本研究所用大气压冷等离子体来源于电源电压为26 V的空气介质阻挡放电,在气相环境、气液界面、液相环境和克雷伯氏菌菌体内产生的活性因子主要为UV、"OH和ROS(图 1、图 4和图 5)。根据文献报道[1, 23, 25, 26],作者推测这些活性因子间相互关系和产生的可能机制,如公式所示:
| $\begin{align} & \text{UV}+{{\text{O}}_{2}}\to \text{O}\cdot \\ & e+{{\text{O}}_{2}}\to e+\text{O}\cdot +\text{O}\left( ^{1}\text{D} \right) \\ & \text{O}\left( ^{1}\text{D} \right)+{{\text{H}}_{2}}\text{O}\to 2\cdot \text{OH} \\ & \text{O}\cdot +{{\text{H}}_{2}}\text{O}\to 2\cdot \text{OH} \\ & e+{{\text{H}}_{2}}\text{O}\to e+\text{H}\cdot +\cdot \text{OH} \\ & \cdot \text{OH}+\cdot \text{OH}\to {{\text{H}}_{2}}{{\text{O}}_{2}} \\ & {{e}_{\left( {{\text{H}}_{2}}\text{O} \right)}}+{{\text{O}}_{2\left( {{\text{H}}_{2}}\text{O} \right)}}\to \text{O}_{2}^{-}{{\cdot }_{\left( {{\text{H}}_{2}}\text{O} \right)}} \\ & \text{O}_{2}^{-}+2{{\text{H}}^{+}}\overset{[SOD]}{\mathop{\to }}\,{{\text{H}}_{2}}{{\text{O}}_{2}} \\ & 2{{\text{H}}_{2}}{{\text{O}}_{2}}\overset{[Catalase]}{\mathop{\to }}\,{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O} \\ \end{align}$ |
气体放电等离子体产生的活性因子寿命极短,但是放电等离子体与气液界面的液体接触时,其产生的活性因子可以迅速进入液相环境中,与液体进行初级和次级反应,不断再生新的活性因子,使等离子体活性因子的生物学效应得以保持和延续,如羟基自由基虽然是一个短暂的活性因子,但是它能够与另一个羟基自由基重组,生成过氧化氢。因此,与液面接触的放电等离子体可以在气液界面和液相环境不断产生"OH和H2O2[17]。
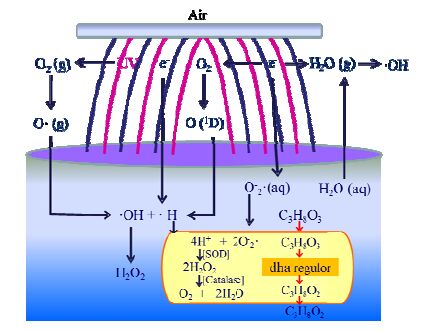
大气压冷等离子体产生的活性因子改变液相环境和克雷伯氏菌体内活性因子种类和数量,从而影响菌体细胞膜内、外表面正、负电荷分布,导致细胞膜电位升高,使细胞膜超极化,细胞膜通透性增强[12, 30~32](图 7)。细胞膜通透性提高促使更多的发酵底物甘油进入细胞内,诱导位于dha调控子上代谢关键酶(甘油脱氢酶、甘油脱水酶和1,3-丙二醇氧化还原酶)基因和蛋白表达,提高克雷伯氏菌甘油代谢关键酶活性,强化菌体生产1,3-PD能力[33]。大气压冷等离子体活性因子产生及其对克雷伯氏菌细胞膜和代谢影响的机制如图 8所示。这一研究为大气压冷等离子体发展为一种新型调控代谢和强化发酵方法提供等离子体物理学和生物学理论依据。
|
图 8 大气压空气冷等离子体活性因子产生及其对克雷伯氏菌细胞膜和代谢影响的机制图 Fig.8 Formation of reactive species with cold air plasma under atmospheric pressure and its effect on K. pneumoniae cell membrane and metabolism (g): gas phase interface, (aq): aqueous phase interface |
(1) 大气压空气冷等离子体电源电压26 V时,等离子体放电电极间气相环境产生活性因子为紫外线、羟基自由基(包括R谱带和P谱带)。
(2) 大气压空气冷等离子体电源电压26 V时,等离子体诱导克雷伯氏菌菌液样品的液相环境和菌体内产生活性因子为ROS。
(3) 大气压空气冷等离子体电源电压26 V时,等离子体增强雷伯氏菌细胞膜电位,使细胞膜超极化,促使细胞膜通透性提高。
| [1] | Laroussi M, Leipold F . Evaluation of the roles of reactive species, heat, and UV radiation in inactivation of bacterial cells by air plasmas at atmospheric pressure[J]. International Journal of Mass Spectrometry , 2004, 233 (1-3) : 81-86 DOI:10.1016/j.ijms.2003.11.016 |
| [2] | Jiang M, Wan Q, Liu R . Succinic acid production from corn stalk hydrolysate in an E. coli mutant generated by atmospheric and room-temperature plasmas and metabolic evolution strategies[J]. Journal of Industrial Microbiology & Biotechnology , 2014, 41 (1) : 115-123 |
| [3] | Dong X Y, Xiu Z L, Li S . Dielectric barrier discharge plasma as a novel approach for improving 1,3-propanediol production[J]. Biotechnology Letters , 2010, 32 (9) : 1245-1250 DOI:10.1007/s10529-010-0284-y |
| [4] | Dong X Y, Yuan Y L, Tang Q . Parameter optimization for enhancement of ethanol yield by atmospheric pressure DBD-treated Saccharomyces cerevisiae[J]. Plasma Science and Technology , 2014, 16 (1) : 73-78 DOI:10.1088/1009-0630/16/1/16 |
| [5] | SUN Hong-wei(孙宏伟), CHEN Jian-feng(陈建峰) . Advances in fundamental study and application of chemical process intensification technology in China(我国化工过程强化技术理论与应用研究进展)[J]. Chemical Industry and Engineering Progress(化工进展) , 2011, 30 (1) : 1-15 |
| [6] | Lu X P, Jiang Z H, Xiong Q . A single electrode room-temperature plasma jet device for biomedical applications[J]. Applied Physics Letters , 2008, 92 (151504) : 1504-1506 |
| [7] | Soloshenko I A, Tsiolko V V, Khomich V A . Sterilization of medical products in low-pressure glow discharge[J]. Plasma Physics Reports , 2000, 26 (9) : 792-800 DOI:10.1134/1.1309476 |
| [8] | Moisan M, Barbeau J, Moreau S . Low-temperature sterilization using gas plasmas:a review of the experiments and an analysis of the inactivation mechanisms[J]. International Journal of Pharmaceutics , 2001, 226 (1-2) : 1-21 DOI:10.1016/S0378-5173(01)00752-9 |
| [9] | Popa C V, Dumitru I, Ruta L L . Exogenous oxidative stress induces Ca2+ release in the yeast Saccharomyces cerevisiae[J]. FEBS Journal , 2010, 277 (19) : 4027-4038 DOI:10.1111/j.1742-4658.2010.07794.x |
| [10] | Bogeski I, Kappl R, Kummerow C . Redox regulation of calcium ion channels:chemical and physiological aspects[J]. Cell Calcium , 2011, 50 (5) : 407-423 DOI:10.1016/j.ceca.2011.07.006 |
| [11] | Clapham D E . Calcium signaling[J]. Cell , 2007, 131 (6) : 1047-1058 DOI:10.1016/j.cell.2007.11.028 |
| [12] | Dong X Y . Enhanced membrane permeability of Saccharromyces cerevisiae induced by dielectric barrier discharge plasma at atmospheric pressure[J]. Advanced Materials Research , 2014, 1033-1034 (4) : 229-235 |
| [13] | Chen R R . Permeability issues in whole-cell bioprocesses and cellular membrane engineering[J]. Applied Microbiology and Biotechnology , 2007, 74 (4) : 730-738 DOI:10.1007/s00253-006-0811-x |
| [14] | Mok C, Lee T, Puligundla P . Afterglow corona discharge air plasma (ACDAP) for inactivation of common food-borne pathogens[J]. Food Research International , 2015, 69 : 418-423 DOI:10.1016/j.foodres.2014.11.034 |
| [15] | Yu H, Xiu Z L, Ren C S . Inactivation of yeast by dielectric barrier discharge (DBD) plasma in helium at atmospheric pressure[J]. IEEE Transactions on Plasma Science , 2005, 33 (4) : 1405-1409 DOI:10.1109/TPS.2005.851961 |
| [16] | Chen H, Bai F, Xiu Z . Oxidative stress induced in Saccharomyces cerevisiae exposed to dielectric barrier discharge plasma in air at atmospheric pressure[J]. IEEE Transactions on Plasma Science , 2010, 38 (8) : 1885-1891 DOI:10.1109/TPS.2010.2046755 |
| [17] | Zhang H, Yang L, Yu Z . Inactivation of Microcystis aeruginosa by DC glow discharge plasma:impacts cell integrity, pigment contents and nicrocystins[J]. Journal of Hazardous Material , 2014, 268 : 33-42 DOI:10.1016/j.jhazmat.2014.01.001 |
| [18] | Herrmann H W, Henins I, Park J . Decontamination of chemical and biological warfare (BW) agents using an atmospheric pressure plasma jet (APPJ)[J]. Physics of Plasmas , 1999, 6 (5) : 2284-2289 DOI:10.1063/1.873480 |
| [19] | Trompeter F J, Neff W J, Franken O . Reduction of Bacillus subtilis and Aspergillus niger spores using nonthermal atmospheric gas discharges[J]. IEEE Transactions on Plasma Science , 2002, 30 (4) : 1416-1423 DOI:10.1109/TPS.2002.804182 |
| [20] | Montie T C, Kelly-Wintenberg K, Roth J R . An overview of research using the one atmosphere uniform glow discharge plasma (OAUGDP) for sterilization of surfaces and materials[J]. IEEE Transactions on Plasma Science , 2000, 28 (1) : 41-50 DOI:10.1109/27.842860 |
| [21] | Kuzmichev A I, Soloshenko I A, Tsiolko V V. Feature of sterilization by different type of atmospheric pressure discharge[C]. Process International Symposium High Pressure Low Temperature Plasma Chemistry. Greifswald, Germany, 2001, 88:402-406. |
| [22] | Laroussi M . Low temperature plasma-based sterilization:overview and state-of-the-art[J]. Plasma Processes and Polymers , 2005, 2 (2) : 391-400 |
| [23] | Fridman G, Dobrynin D, Friedman G . Physical and biological mechanisms of direct plasma interaction with living tissue[J]. New Journal of Physics , 2009, 11 (115020) : 1-26 |
| [24] | Deng X, Shi J, Kong M G . Physical mechanisms of inactivation of Bacillus subtilis spores using cold atmospheric plasmas[J]. IEEE Transactions on Plasma Science , 2006, 34 (4) : 1310-1316 DOI:10.1109/TPS.2006.877739 |
| [25] | Lukes P, Dolezalova E, Sisrova I . Aqueous-phase chemistry and bactericidal effects from an air discharge plasma in contact with water:evidence for the formation of peroxynitrite through a pseudo-second-order post-discharge reaction of H2O2 and HNO2[J]. Plasma Sources Science & Technology , 2014, 23 (1) : 1-15 |
| [26] | Malik M A, Ghaffar A, Malik S A . Water purification by electrical discharges[J]. Plasma Sources Science & Technology , 2001, 10 (1) : 82-91 |
| [27] | Gaunt L F, Beggs C B, Georghiou G E . Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure:a review[J]. IEEE Transactions on Plasma Science , 2006, 34 (4) : 1257-1269 DOI:10.1109/TPS.2006.878381 |
| [28] | Ono R, Oda T . Measurement of hydroxyl radicals in an atmospheric pressure discharge plasma by using laser-induced fluorescence[J]. IEEE Transactions on Plasma Science , 2000, 36 (1) : 82-86 |
| [29] | Storz P . Forkhead homeobox type O transcription factors in the responses to oxidative stress[J]. Antioxidants & Redox Signaling , 2011, 14 (4) : 593-605 |
| [30] | Stoffels E, Sakiyama Y, Graves D B . Cold atmospheric plasma:charged species and their interactions with cells and tissues[J]. IEEE Transactions on Plasma Science , 2008, 36 (4) : 1441-1457 DOI:10.1109/TPS.2008.2001084 |
| [31] | Laroussi M, Mendis D A, Rosenberg M . Plasma interaction with microbes[J]. New Journal of Physics , 2003, 5 (41) : 1-10 |
| [32] | Yonson S, Coulombe S, Leveille V . Cell treatment and surface functionalization using a miniature atmospheric pressure glow discharge plasma torch[J]. Journal of Physics D:Applied Physics , 2006, 39 (16) : 3508-3513 DOI:10.1088/0022-3727/39/16/S08 |
| [33] | DONG Xiao-yu(董晓宇), LIU Ting-ting(刘婷婷), DOU Shao-hua(窦少华) . Enhanced fermentation in Klebsiella pneumoiae with dielectric barrier plasma at atmospheric pressure(大气压介质阻挡放电等离子体强化克雷伯氏菌发酵)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29 (4) : 881-889 |




