无水氯化镁是电解金属镁的原料,也是众多催化剂和医药的中间体[1]。传统生产无水氯化镁的方法有:Dow工艺,Farben工艺,Magnola工艺等[2],但都存在着工艺耗能高,污染腐蚀严重的问题。因此开发低成本、环境友好的绿色工艺是目前亟待解决的问题。
柴达木盆地的察尔汗盐湖含有丰富的钾镁等矿产资源。该盐湖主要以提钾为主,但在盐湖提钾后的老卤中含有大量的氯化镁。每生产1吨的氯化钾废弃老卤(含氯化镁质量分数33%)40立方米。察尔汗盐湖现氯化钾的生产规模为450万吨/年,理论上副产氯化镁2400~3000万吨/年,作为氯化镁初级产品年销售仅30~50万吨,大量氯化镁没有利用[3, 4]。该现象不仅存在改变盐湖物质构成结构的危险,还会对盐湖地区生态环境和物种保护造成威胁。察尔汗盐湖钾、镁资源的综合开发迫在眉睫。
用盐湖水氯镁石直接脱水制备无水氯化镁在理论上不可取。为了充分利用我国的盐湖镁资源,制备出氧化镁含量低,适合于电解炼镁的原料无水氯化镁,提出了用盐湖水氯镁石和氯化铵溶液为原料,先合成铵光卤石,之后脱水成低水铵光卤石,再与氨气反应制备无水氯化镁的工艺[5]。本课题组王硕[6],吴静雪[7]分别对0和60℃时KCl-MgCl2-NH4Cl-H2O四元体系相图做了研究,并提出光卤石为原料,氯化铵为盐析剂制备铵光卤石的工艺路线。为了降低能耗,优化光卤石为原料制备铵光卤石工艺路线,目前还需要25℃时KCl-MgCl2-NH4Cl-H2O四元体系相图做理论指导。鉴于此,本文对25℃时KCl-MgCl2-NH4Cl-H2O四元体系相平衡进行了研究,基于25℃该四元体系相图,优化设计了两条工艺路线。并与文献中提出的制备铵光卤石的工艺进行了对比,选出最佳的工艺路线。
2 实验 2.1 实验试剂实验所用的六水氯化镁,氯化铵,氯化钾及分析所用试剂均为分析纯试剂,纯度均≥98%,不用进行二次纯化,见表 1。实验中用水均为二次蒸馏水,电导率 < 5 μS·cm-1。
|
|
表 1 实验试剂 Table 1 Chemicals used in the study |
本实验采用常压下等温溶解平衡法[8],温度波动控制在±0.1℃。平衡器采用固定在电动搅拌机上并用橡胶塞密封的试管。
实验时先将水浴温度控制在25℃,然后根据配比称取一定量的药品和蒸馏水于试管中(管内药品约为试管体积的2/5),密封摇匀后固定在电动搅拌机上。达到平衡后,将试管在水浴中静置约20 min,待固液相明显分层后,垂直取出试管,使其1/3于水面之上并用滤纸擦去管外水分,拔掉橡胶塞,开始取样。
清液取样:用处于室温(25℃)下的胶头滴管取出部分液相于已恒重的称量瓶中,然后把液相移至250 mL容量瓶中定容,待测。
湿渣取样:清液取样后,清除大部分上层液,将余下的湿渣倒入已恒重的称量瓶中,同样把湿渣移至250 mL容量瓶中定容,待测。
X射线衍射法:将湿渣用布氏漏斗抽滤,滤去上层清液,将得到的固相用乙醇洗涤,经自然晾干后进行XRD分析。
2.3 分析方法铵根离子含量采用甲醛法测定[9];镁离子的含量采用EDTA络合滴定法确定[10],氯离子含量采用硝酸银滴定法测定[11~13];钾离子含量用差减法计算;固相鉴定采用湿渣法并结合X射线衍射法共同确定。
2.4 相平衡时间的测定四元体系的相平衡时间可以通过测定其任意三元子体系的共饱点的平衡时间来确定。按质量为10 g液相和1 g固相配料,将试管固定在搅拌器上并放入超级恒温水浴中,然后开启搅拌装置。记录反应开始的时间,之后每隔一段时间取出一定量的液相,测定液相中各物质的含量,待前后两次测定的液相组成不再变化,且与所对应文献中的溶解度数据一致时,则可认为该三元体系反应已达平衡,同时可以认为是对应四元体系的相平衡时间。
3 结果与讨论 3.1 相平衡时间的测定本文选用NH4Cl-MgCl2-H2O三元体系作为实验参照值,反应开始6 h后每隔2 h取出一组反应物,测定其液相中各化合物含量,具体实验数据见表 2。
|
|
表 2 不同反应时间各化合物含量 Table 2 Chemical compositions in liquid phase after different reaction times under 25℃, 1 atm |
经过五组实验之后可知,25℃时NH4Cl-MgCl2-H2O三元体系在6 h以后各物质含量基本不再发生变化,且与文献值[14]一致,说明该三元体系达到平衡状态。也即四元体系在6 h后达到平衡状态。实验时为了确保该体系的每一个点都达到液固平衡,本实验采用的平衡时间为10 h。
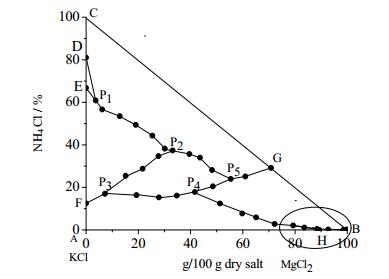
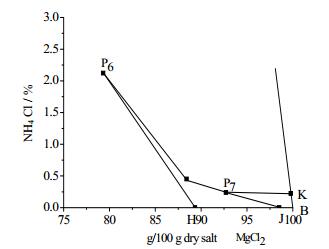
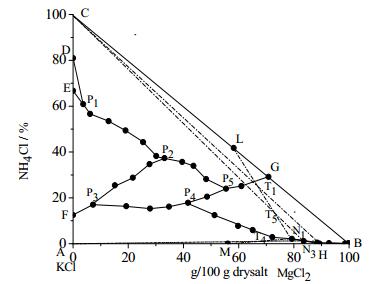
3.2 25℃时KCl-MgCl2-NH4Cl-H2O四元体系的溶解度数据及相图根据表 3中的数据可绘制相图,如图 1和图 2所示(图 2为图 1椭圆区域的放大图)。由图 1可知25℃时KCl-MgCl2-NH4Cl-H2O四元体系存在7个共饱和点、8个结晶区以及14条单变度曲线。8个结晶区分别是:AHP4P3FA为KCl结晶区;CGP5P2P1DC为NH4Cl结晶区;FP3P2P1EF为(K1-m, NH4m)Cl结晶区;DP1ED为(NH4n,K1-n)Cl结晶区;KP7JBK为MgCl2·6H2O结晶区;GP5P4P6P7KG为NH4Cl·MgCl2·6H2O的结晶区;P6HJP7P6为KCl·MgCl2·6H2O结晶区;P2P3P4P5P2为(NH4n,K1-n)Cl·MgCl2·6H2O结晶区。
|
|
表 3 25℃时KCl-MgCl2-NH4Cl-H2O四元体系相平衡实验数据 Table 3 Phase equilibrium data of the KCl-MgCl2-NH4Cl-H2O quaternary system at 25℃ |
|
图 1 25℃时四元体系KCl-MgCl2-NH4Cl-H2O相图 Fig.1 Phase diagram of the KCl-MgCl2-NH4Cl-H2O quaternary system at 25℃ |
|
图 2 25℃时四元体系KCl-MgCl2-NH4Cl-H2O的局部放大相图 Fig.2 Partially enlarged phase diagram of the KCl-MgCl2-NH4Cl-H2O system at 25℃ |
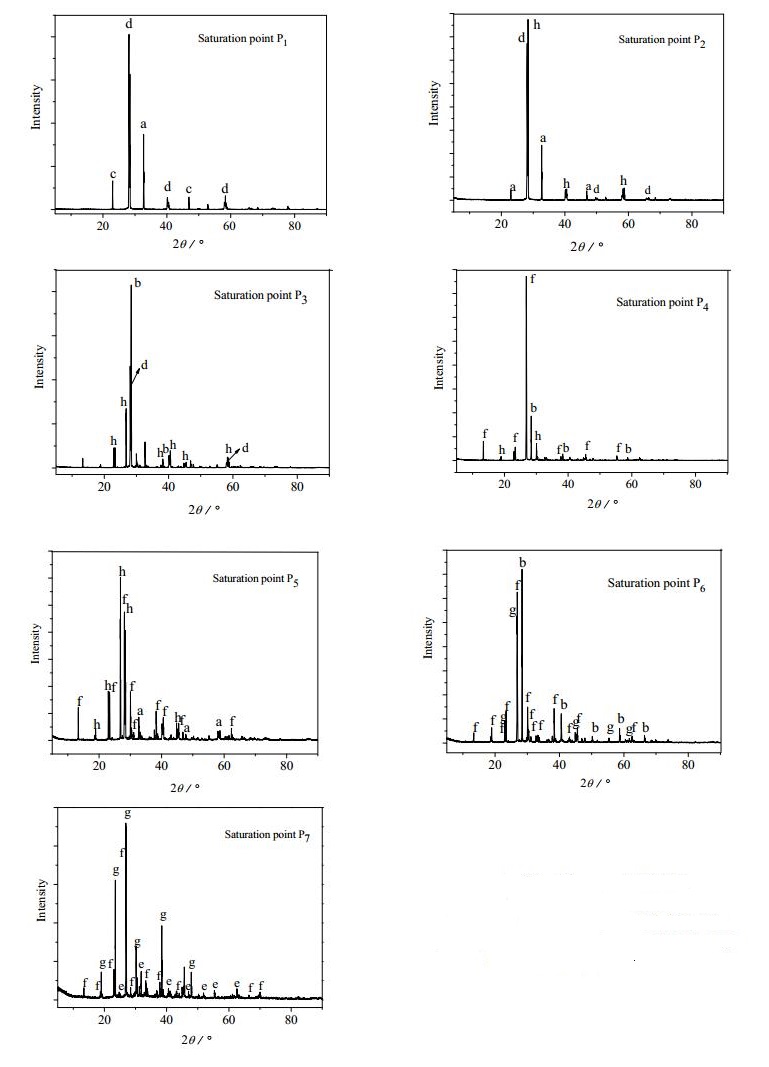
图 3为各共饱点对应的平衡固相的XRD谱图。将各个谱图与标准卡片一一对比,检索可知:点P1为NH4Cl、(NH4n, K1-n)Cl和(K1-m, NH4 m)Cl的共饱点,P2为NH4Cl、(K1-m, NH4 m)Cl和(NH4 n, K1-n)Cl·MgCl2·6H2O的共饱点,P3为KCl、(K1-m, NH4 m)Cl和(NH4 n, K1-n)Cl·MgCl2·6H2O的共饱点,P4为KCl、NH4Cl·MgCl2·6H2O和(NH4 n, K1-n)Cl·MgCl2·6H2O的共饱点,P5为NH4Cl、NH4Cl·MgCl2·6H2O和(NH4 n, K1-n)Cl·MgCl2·6H2O的共饱点,P6为KCl、KCl·MgCl2·6H2O和NH4Cl·MgCl2·6H2O的共饱点,P7为MgCl2·6H2O、KCl·MgCl2·6H2O和NH4Cl·MgCl2·6H2O的共饱点。
|
图 3 共饱点对应的平衡固相的XRD谱图 Fig.3 XRD patterns of solid phases at saturation points a: NH4Cl b: KCl c: (NH4 n, K1-n)Cl d: (K1-m, NH4 m)Cl e: MgCl2·6H2O f: NH4Cl·MgCl2·6H2O g: KCl·MgCl2·6H2O h: (NH4 n, K1-n)Cl·MgCl2·6H2O |
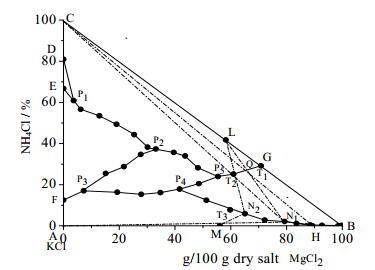
通过对25℃时KCl-MgCl2-NH4Cl-H2O四元体系相图及其各共饱点和结晶区的分析可知,25℃条件下该四元体系存在极小的MgCl2·6H2O结晶区,难以结晶析出。而25℃时该四元体系中铵光卤石结晶区较大,易于结晶析出,这使得将MgCl2以铵光卤石的形式从提钾母液中分离出来成为可能,铵光卤石再经脱水脱氨可制备MgCl2,因此本文设计了以光卤石为原料,氯化铵为盐析剂制备铵光卤石并副产氯化钾的工艺路线,有效解决了盐湖镁资源浪费的问题。图 4中M点为光卤石的组成点(wt):KCl 26.83%, MgCl2 34.27%;L点为铵光卤石组成点(wt):NH4Cl 20.83%, MgCl2 37.08%;H点为KCl和光卤石的共饱点(wt):KCl 3.7%,MgCl2 27.7%。实线表示结晶区边界线,虚线表示工艺流程线。工艺分析过程如下:
|
图 4 以25℃ KCl-MgCl2-NH4Cl-H2O为基础制备铵光卤石工艺(a)相图 Fig.4 Phase diagram of the KCl-MgCl2-NH4Cl-H2O system for NH4Cl·MgCl2·6H2O and KCl production (a) at 25℃ |
根据三元体系KCl-MgCl2-H2O相图可知,当向光卤石中加入一定量的水后,体系会析出氯化钾,母液组成为点H,此时母液中含有大量的氯化镁;为充分利用镁资源,向点H中加入NH4Cl为盐析剂,体系点落在HC连线上,随着NH4Cl量的增加体系点由H向C移动,当体系点落在HQ上时就会有铵光卤石析出,Q点是HC与P5G的交点。当体系点移动至T1处,结晶析出NH4Cl·MgCl2·6H2O后母液组成点刚好到达HP4上的N1点;分离出铵光卤石后向N1中再加入一定量的NH4Cl,体系会继续析出铵光卤石,当体系点移至T2时,结晶析出NH4Cl·MgCl2·6H2O后母液组成点为N2;向母液N2中加入一定量的光卤石和水,体系点落在N2M连线上且位于KCl的结晶区内,当体系点移至T3时,结晶析出氯化钾后母液组成为点恰好为N1;N1可返回系统使用构成稳定循环生产。工艺流程示意图见图 5。
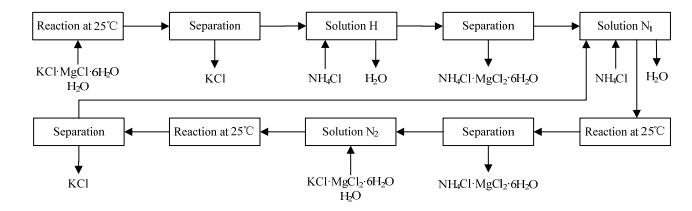
|
图 5 以25℃ KCl-MgCl2-NH4Cl-H2O相图为基础制备铵光卤石工艺(a)示意图 Fig.5 Flow chart of NH4Cl·MgCl2·6H2O production (a) based on the phase diagram of the KCl-MgCl2-NH4Cl-H2O system at 25℃ |
以1000 kg KCl·MgCl2·6H2O投入量为基准,根据杠杆原则和物料守恒计算,结果如表 4所示。
|
|
表 4 以光卤石为原料制备铵光卤石和氯化钾的相图计算 Table 4 Phase diagram calculation for KCl and NH4Cl·MgCl2·6H2O production using KCl·MgCl2·6H2O and NH4Cl |
为了使四元体系KCl-MgCl2-NH4Cl-H2O相图更好地指导工业生产,本文又设计了工艺路线(b)。图中M点为光卤石的组成点(wt):KCl 43.91%, MgCl2 56.09%;L为铵光卤石组成点(wt):NH4Cl 41.77%, MgCl2 58.23%;H点为25℃时KCl和光卤石共饱点(wt):KCl 3.7%,MgCl2 27.7%。实线代表结晶区边界线,虚线代表工艺流程线,具体工艺流程如下:
工艺路线(b)的第一步和第二步与工艺路线(a)相同,不同之处为工艺(b)中向母液N1不再加入盐析剂,而直接加入光卤石和水。此时体系点落在直线N1M上,随着光卤石量的增多,体系点由N1向M移动。当体系点移至T4时,结晶析出氯化钾后母液组成点为N3;向母液N3中加入氯化铵做盐析剂,体系点落在直线N3M上,当体系点移至T5时,结晶析出铵光卤石后剩余母液组成为点N1;N1可继续加入光卤石和水构成稳定循环生产。工艺流程示意图见图 7。
|
图 6 以25℃ KCl-MgCl2-NH4Cl-H2O为基础制备铵光卤石工艺(b)相图 Fig.6 Phase diagram of the KCl-MgCl2-NH4Cl-H2O system for NH4Cl·MgCl2·6H2O and KCl production (b) at 25℃ |
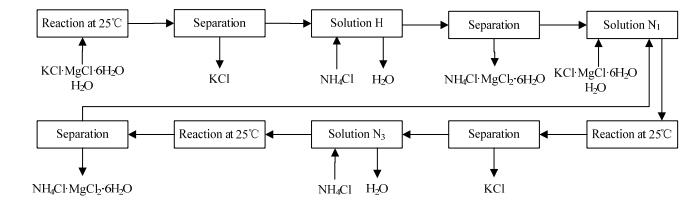
|
图 7 以25℃ KCl-MgCl2-NH4Cl-H2O相图为基础制备铵光卤石工艺(b)示意图 Fig.7 Flow chart of NH4Cl·MgCl2·6H2O production (b) based on the phase diagram of the KCl-MgCl2-NH4Cl-H2O system at 25℃ |
以1000 kg KCl·MgCl2·6H2O为基准,根据物料守恒原理,对整个工艺流程进行了计算,计算结果如表 5所示。
|
|
表 5 基于相图制备KCl和NH4Cl·MgCl2·6H2O的工艺(b)计算结果 Table 5 Phase diagram calculation for the KCl and NH4Cl·MgCl2·6H2O production process (b) |
通过对本文提出的工艺路线(a)和工艺路线(b)分析可知:两工艺都是以光卤石为原料氯化铵为盐析剂制备铵光卤石。不同之处在于工艺(a)加入两次盐析剂,两次析出铵光卤石后,剩余母液返回系统循环使用,铵光卤石收率较高;而工艺(b)在只加入一次盐析剂,析出铵光卤石后,母液N1即返回系统循环使用,工艺流程简单,操作方便。
3.3.3 光卤石为原料制备铵光卤石工艺比较本课题组吴静雪[7],王硕[6]分别提出了基于60和0℃ KCl-MgCl2-NH4Cl-H2O相图以光卤石为原料,氯化铵为盐析剂制备铵光卤石的工艺。本文以光卤石1000 kg的投料量为基准对各个工艺进行了比较,各项比较结果如表 6所示:
|
|
表 6 不同工艺路线的比较 Table 6 Comparison of different processes |
由表 6的各项数据可以看出,王硕[6]提出的基于0℃ KCl-MgCl2-NH4Cl-H2O相图的工艺虽然产品产量较高,但其蒸发水分量和母液循环量都很大,基于0℃下的反应需要消耗很大的冷量,且低温条件不利于反应的进行;吴静雪[7]提出的基于60℃ KCl-MgCl2-NH4Cl-H2O相图的工艺母液循环量较小,产品产量也较高,但反应温度很高,821.6 kg母液从25℃升温至60℃,约消耗1.2×105 kJ的能量,该工艺路线需维持高温反应,耗能较大;本文提出的基于25℃ KCl-MgCl2-NH4Cl-H2O相图制定的工艺路线(b)蒸发水分较少,但母液循环量也较大,NH4Cl·MgCl2·6H2O产量较低;工艺路线(a)蒸发水分量,母液循环量都较少,且在常温下反应,整个过程工艺操作简单,能耗低。综合比较以上四个工艺,从节能降耗和产品产量角度考虑,本文认为工艺路线(a)较其他工艺有明显的优势,有利于实现察尔汗盐湖钾镁资源的综合开发利用。
早期的基于氯化钾-氯化镁-水三元体系制备氯化钾,联产氯化镁的方法主要有冷分解-正浮选法,热分解正浮选法[15]。本文将工艺路线(a)与上述两个方法进行了比较,结果见表 7,氯化钾收率和液相中氯化镁质量分数以形成稳定循环后为基准计算的。
|
|
表 7 工艺路线(a)与传统工艺路线的比较 Table 7 Comparison of traditional and (a) processes |
传统的生产氯化钾的工艺路线都要用到浮选剂(如十八胺等)将氯化钾以泡沫形式刮出,再浮选得到氯化钾精矿,本文提出的工艺路线(a)反应原料为光卤石和氯化铵,无需使用浮选药剂。且传统工艺在生产无水氯化镁的过程中会产生一定量的氧化镁[16],而氧化镁对电解练镁有害,而本文提出的工艺(a)通过制得中间产物铵光卤石,铵光卤石经脱水、水解、热分解等反应可以制得纯无水氯化镁产品,符合电解练镁的要求。本文提出的以光卤石为原料、氯化铵为盐析剂的工艺路线(a)氯化钾收率较高,25℃下反应能耗较低,不需要加入浮选剂,因此工艺路线(a)更符合工业生产要求。
4 结论采用等温溶解平衡法测定了25℃时KCl-MgCl2-NH4Cl-H2O体系溶解度数据并绘制了相图,分析相图可知,常温下该体系有7个共饱点,8个结晶区。结晶区分别是:KCl结晶区;NH4Cl结晶区;(K1-m, NH4 m)Cl结晶区;(NH4n, K1-n)Cl结晶区;MgCl2·6H2O结晶区;NH4Cl·MgCl2·6H2O结晶区;KCl·MgCl2·6H2O结晶区;(NH4n, K1-n)Cl·MgCl2·6H2O结晶区。
提出了以25℃时KCl-MgCl2-NH4Cl-H2O四元体系相图为基础,以光卤石为原料,氯化铵为盐析剂制备铵光卤石的两条工艺流程,并与文献提出的两条工艺路线做了对比。从节能降耗和产品产量角度考虑,本文提出的工艺路线(a)相对于其他工艺路线有明显优势,为察尔汗盐湖钾镁资源的综合开发利用提供了新思路。
| [1] | ZHOU Huan(周桓), YUAN Jian-jun(袁建军). Progress in preparation technology of high purity anhydrous magnesium chloride(高纯无水氯化镁制备技术的进展)[J]. The Chinese Journal of Process Engineering(过程工程学报) , 2004, 4(3): 276-281. |
| [2] | LIU Ji-ling(刘积灵), ZHANG Yu-kun(张玉坤). Preparation techniques and development trend of anhydrous magnesium chloride(无水氯化镁的制备技术及发展趋势)[J]. Inorganic Chemicals Industry(无机盐工业) , 2007, 39(8): 10-12. |
| [3] | ZHOU Yuan(周园), LI Li-juan(李丽娟), WU Zhi-jian(吴志坚), et al. Exploitation and comprehensive utilization for Qinghai Salt Lakes(青海盐湖资源开发及综合利用)[J]. Progress in Chemistry(化学进展) , 2013, 25(10): 1613-1624. |
| [4] | WU Zhi-ming(乌志明), LI Fa-qiang(李法强). Development of magnesium chloride resources in salt lakes of Qinghai(青海盐湖氯化镁资源开发)[J]. Journal of Salt Lake Research(盐湖研究) , 2001, 9(2): 61-65. |
| [5] | ZHOU Ning-bo(周宁波), CHEN Bai-zhen(陈白珍), HE Xin-kuai(何新快), et al. The preparation and representation of anhydrous magnesium chloride of ammonium carnallite ammonia method(铵光卤石氨法无水氯化镁的制备与表征)[J]. Journal of Functional Materals(功能材料) , 2005(7): 129-131. |
| [6] | 王硕, 赵斌, 郭宏飞, 等. 0℃时NH4Cl-MgCl2-KCl-H2O四元体系相平衡研究及应用[J]. 高校化学工程学报, 2017, 31(3): 515-520. http://kns.cnki.net/kcms/detail/33.1141.TQ.20170306.1605.008.html. WANG Shuo, ZHAO Bin, GUO Hong-fei, et al. Solid-liquid equilibrium in the NH4Cl-MgCl2-KCl-H2O system at 0℃ and their application[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(3): 515-520. http://kns.cnki.net/kcms/detail/33.1141.TQ.20170306.1605.008.html. |
| [7] | WU Jing-xue, ZHANG Guo-cheng, ZHAO Bin et al. Phase diagrams of the quaternary system KCl-MgCl2-NH4Cl-H2O at t = 60. 00℃ and their application[J/OL]. Journal of Solution Chemistry, 2017, 46(1): 58-69. |
| [8] | DOU S Y, Zhao B, Cao J L, et al. Phase diagrams of the quaternary Mg2+, NH4+//Cl-, SO42--H2O system at 25℃ and their application[J]. Fluid Phase Equilibria , 2015, 2(385): 54-61. |
| [9] | Department of Chemistry, Zhejiang University (浙江大学化学系). Analytical chemistry experiment(分析化学实验)[M].Beijing(北京): Higher Education Press(高等教育出版社), 2003. |
| [10] | GONG Chuang-zhou(弓创周), WANG Shui-zan(王水赞), DING Lin(丁灵), et al. Improvement on main content determination method in industrial magnesium sulfate standard(工业硫酸镁标准中主含量测定方法的改进)[J]. Inorganic Chemicals Indystry(无机盐工业) , 2009, 41(12): 61-62. DOI:10.3969/j.issn.1006-4990.2009.12.020. |
| [11] | LI Ji-tao(李计涛), CUI Qin(崔钦), LI Feng-mei(李风梅). Comparison of determination method of sulfate radical in glauber salt production(芒硝生产中硫酸根测定方法的比较)[J]. China Chlor-Alkali(中国氯碱) , 2008(7): 33-35. |
| [12] | LI Yi-gui(李以圭). Metallic solvent extraction thermodynamic(金属溶剂萃取热力学)[M].Beijing(北京): Tsinghua University Press(清华大学出版社), 1988. |
| [13] | YANG Sheng(杨胜). Determination of chlorion in water by silver measuring method(银量法测定水中氯离子)[J]. Sichuan Electric Power Technol(四川电力技术) , 1996(5): 33-35. |
| [14] | Stephen H, Stephen T. Solubilities of inorganic and organic compounds: vol.2[M].Oxford: Pergamon Press, 1979. |
| [15] | CHEN Xia(陈侠), ZOU Yan-shuang(邹艳爽), Mo Jia(么佳), et al. Research on production of potassium chloride and coproduction of magnesium chloride by thermal decomposition of carnallite(光卤石热分解生产氯化钾联产氯化镁实验研究)[J]. Inorganic Chemicals Industry(无机盐工业) , 2015, 47(10): 19-22. |
| [16] | ZHOU Ning-bo(周宁波), CHEN Bai-zhen(陈白珍), HE Xin-kuai(何新快), et al. The preparation of anhydrous magnesium chloride with ammonium carnallite gas-solid reaction method(铵光卤石气固反应法制备无水氯化镁)[J]. Chinese Journal of Applied Chemistry(应用化学) , 2005, 22(8): 874-878. |




