2. 浙江大学衢州研究院,浙江 衢州 324000;
3. 宁波永顺精细化工有限公司,浙江 宁波 315204
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China;
3. Ningbo Yongshun Fine Chemical Co. Ltd., Ningbo 315204, China
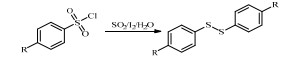
二苯二硫醚[1-2]是重要的精细化工产品,广泛应用于医药、农用化学品、染料、光学材料和高性能的高分子材料等领域[3-5],具有广阔的市场前景。
目前,工业上常用以下几种方法来合成二苯二硫醚:硫酚氧化法[6-7]、卤苯/二硫化钠取代法[8-9]和苯磺酰氯还原法[10-11]。其中常用的硫酚氧化法,过程简单,但存在着原料价格高、气味大和废水较多等问题[12];卤苯/二硫化钠取代法由于卤苯反应活性较低,需要引入相转移催化剂,存在催化剂回收困难和后处理复杂等问题[9];苯磺酰氯法由于原料来源简单,应用较广[13]。
文献报道由苯磺酰氯制备二苯二硫醚的方法有肼还原法[14]、金属/酸还原法[15]、金属/TiCl4还原法[16]和低价态亲氧性d-区金属还原法[10-11]等。其中,肼还原法所用还原剂价格较高;金属/酸和金属/TiCl4还原法需要消耗大量的金属,工艺不清洁,后处理复杂,且收率不高;卤代硼/碘化钾还原法需要加入相转移催化剂TBAI且反应时间(16 h)较长;低价态亲氧性d-区金属还原法所用还原剂对空气氧化敏感,大规模存储困难,还原剂成本也相应较高。
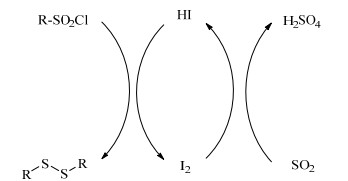
综合上述工艺的优缺点,本课题组曾提出SO2/KI/H2SO4/H2O还原法(图 1)[17]。但该方法仍存在一定问题而未工业化:1)以KI/H2SO4为催化剂,还原体系复杂,不仅碘元素回收再利用困难,也造成了钾元素的浪费;2)使用较大量的水作溶剂,产生了对应水量的硫酸、苯磺酸、苯亚磺酸的混合稀酸。
|
图 1 SO2/KI/H2SO4还原法 Fig.1 Scheme of the SO2/KI/H2SO4 reduction method |
针对上述主要问题,本文提出了进一步优化方法:1)以SO2/I2/H2O代替SO2/KI/H2SO4/H2O,减少体系的复杂性;2)使用有机溶剂,反应完后回收溶剂,减少釜底的硫酸、苯磺酸和苯亚磺酸的酸液体积;3)通过萃取回收碘,解决碘回收困难等问题;4)建立强化传质的气-液-液相反应设备,使得体系溶解有较高浓度的SO2,促进反应的高效进行,减少SO2的损失;5)优化反应条件(包括溶剂、水量、碘量、反应温度和反应时间),提高目标产物的收率。
2 实验(材料与方法) 2.1 主要试剂苯磺酰氯(CP,上海阿拉丁生化科技股份有限公司);碘(AR,上海麦克林生化科技有限公司);蒸馏水(上海泰坦生化科技股份有限公司);乙二醇二甲醚(CP,上海麦克林生化科技有限公司)和SO2(99.9%,上海通辉特种气体有限公司)。
2.2 分析方法检测仪器为安捷伦7820A气相色谱仪(30 m长SE-54毛细管色谱柱;氢气和载气氮气的柱前压为0.1 MPa;空气柱前压为0.03 MPa;进样量0.2 μL;进样温度260 ℃;FID检测温度260 ℃;程序升温:100 ℃保持2 min,然后以20 ℃·min-1的速度升至260 ℃),采用Avarice DMX400核磁共振仪、TRACE GC 2000/TRACE MS气相色谱-质谱联用仪、WRS-2熔点仪进行分析。
2.3 实验过程图 2为实验装置图,实验操作如下:

|
图 2 反应装置图 Fig.2 Schematic diagram of the experimental setup 1.SO2 cylinder 2.SO2 buffer balloon 3.reduction coupled reactor 4.gas circulating pump |
250 mL三口瓶中加入40.0 g(0.226 6 mol)苯磺酰氯、20.0 mL(1.113 2 mol)水、4.0 g(0.015 6 mol)碘和60.0 mL乙二醇二甲醚。反应前用SO2气体置换装置内原有的空气,反应过程中以SO2缓冲气球的体积衡量体系SO2的剩余量。当SO2缓冲气球体积变小时,及时补充SO2气体。60 ℃下反应8 h,GC检测原料几乎转化完。升温至100 ℃,进行常压蒸馏,收集83~85 ℃的馏分,得到乙二醇二甲醚,回收率为82.2%。降温至-10 ℃放置2 h使产品析出。抽滤,得到滤饼和滤液。滤液用二氯甲烷萃取(3×200 mL),合并二氯甲烷相,浓缩得棕色碘固体3.14 g,回收率为78.5%。滤饼用100 g 95%乙醇重结晶,得到二苯二硫醚产品23.7 g,收率为95.8%,纯度为99.0%。熔点(m.p.) 58.5~59.3 ℃,与文献[18]报道相符合;MS(EI, 70 eV),m/z(rel abundance): 218(M+, 100), 203(1), 185(52), 171(1), 154(4.6), 140(61), 109(99), 97(33), 77(23), 65 (72), 51(20);1H NMR (400 MHz, Chloroform-d) δ 7.56~7.46 (m, 4H), 7.32 (td, J = 6.7, 6.3, 1.6 Hz, 4H), 7.26 ~7.16 (m, 2H);13C NMR (101 MHz, Chloroform-d) δ 137.03, 129.07, 127.51, 127.16。
3 实验结果与讨论 3.1 反应原理分析本体系以I2为催化剂,SO2为还原剂,高效还原苯磺酰氯偶联成二苯二硫醚。原料苯磺酰氯性质较为活泼,易与体系中的SO2和H2O反应生成副产物苯亚磺酸和苯磺酸。
反应式:
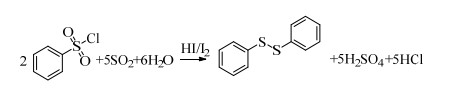
|
副反应:
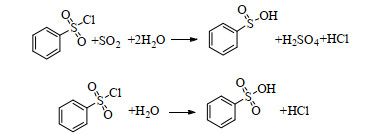
|
为了避免副产物的生成,需要控制体系中SO2和水量。因此,本文优化了溶剂、水量、碘量、温度、时间和SO2投料方式等实验条件,还考察了碘和溶剂回收再用对实验结果的影响以及本工艺对其他底物的适用性。
3.2 影响反应的因素 3.2.1 溶剂的影响本体系是一个气-液-液反应体系,需要选取合适的溶剂来溶解SO2、苯磺酰氯和水三相。本文在苯磺酰氯:水:碘的摩尔比为1:5:0.05,每20 g原料配用30 g溶剂,60 ℃下考察了溶剂对反应的影响,得到如表 1的反应结果。
|
|
表 1 溶剂对二苯二硫醚收率的影响 Table 1 Effects of solvents on phenyl disulfide yields |
表 1说明,改进后的工艺条件,以醚作溶剂,产品收率较好,其中乙二醇二甲醚尤为突出,醇溶剂次之,水作溶剂和无溶剂结果较差。这是由于醇类溶剂易与磺酰氯发生酯化反应生成磺酸酯,位阻越小,越容易酯化;短链醇的极性较好,对水和SO2的溶解量远多于反应需要的量,使原料与水和SO2的直接接触可能性增大,促使副反应加剧。水为溶剂时,同样因为原料与水和SO2的直接接触可能性增大而发生副反应。无溶剂和卤代烃作为溶剂时,体系对水和SO2的溶解量远少于反应需要的量,介质I2再生为HI被抑制,促使主反应被抑制。因此,选用乙二醇二甲醚作溶剂。
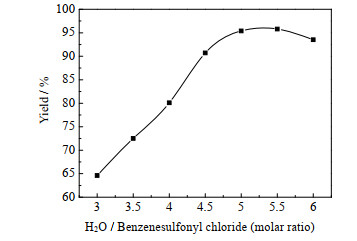
3.2.2 水量的影响体系中水量是SO2还原I2再生为HI步骤的关键因素之一。水量过多易使原料苯磺酰氯被水直接水解为苯磺酸;水量过少将会抑制HI的生成。本文在苯磺酰氯:碘的摩尔比为1:0.05,每20 g原料配用30 g乙二醇二甲醚,60 ℃下反应8 h,考察了水量对反应的影响,得到如图 3所示的结果。
|
图 3 水量对二苯二硫醚收率的影响 Fig.3 Effects of H2O consumption on phenyl disulfide yields |
图 3说明,随着水量的增加,产品的收率先增加后减少。当水量过少时,体系缺水,抑制I2再生为HI;当水量过多时,原料与水和SO2的直接接触机会增多而发生副反应。因此,选用苯磺酰氯:水的摩尔比为1:5。
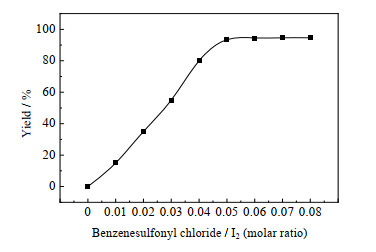
3.2.3 碘量的影响本反应实际上是HI起直接还原作用,体系中碘元素的量决定了体系中HI的循环再生量。在苯磺酰氯:水的摩尔比为1:5,每20 g原料配用30 g乙二醇二甲醚,60 ℃下反应8 h,考察了碘量对反应的影响,得到如图 4的反应结果。
|
图 4 碘量对二苯二硫醚收率的影响 Fig.4 Effects of I2 consumption on phenyl disulfide yields |
由图 4可知,随着碘量的提高,收率先逐渐提高,后趋于稳定。这是因为碘量过少时,循环体系中HI量较少,原料苯磺酰氯与HI的接触机会变小,与水和SO2的直接接触机会变相提高而发生副反应。考虑到碘价格昂贵,因此选用苯磺酰氯:碘的摩尔比为1:0.05。
3.2.4 温度和时间的影响反应温度和反应时间是影响反应效果的重要因素。在苯磺酰氯:水:碘的摩尔比为1:5:0.05,每20 g原料配用30 g乙二醇二甲醚,考察了温度和时间对反应的影响,得到如表 2的反应结果。
|
|
表 2 温度和时间对反应的影响 Table 2 Effects of temperature and time on the reaction |
由表 2可知,改进后的工艺可以在较低的温度下进行反应。相比改进前的工艺,以乙二醇二甲醚作溶剂,促进了气-液-液反应的传质速度,减少了相间阻力,因而对反应温度的要求降低。当温度达到60 ℃时,反应8 h,收率可达95.8%。温度进一步升高,时间进一步延长,收率基本稳定。因此,选择反应温度60 ℃,反应时间8 h。
3.2.5 气相循环本反应需要消耗还原计量倍的SO2,体系中溶解的SO2浓度会逐渐降低,需要向体系中持续补充SO2,并维持SO2处于较高浓度状态,推动反应进行。在实际反应中,往往通入过量的SO2保证液相SO2浓度,若不进行循环利用,会造成大量SO2浪费,增加废物污染。因此,需要对其循环利用,以提高SO2的利用率,表 3对比了气相循环前后的实验结果,其中SO2利用率为理论所需的SO2量/实际消耗的SO2量。
|
|
表 3 气相循环对反应的影响 Table 3 Effects of gas phase circulation on the reaction |
由表 3可知,通过气体循环泵对SO2气体循环,SO2利用率提高了32%,有效地减少了SO2气体的损失。
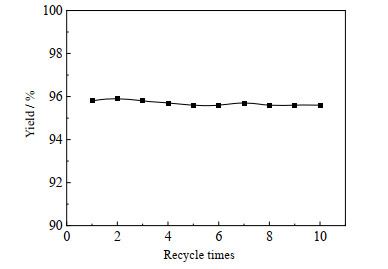
3.2.6 碘、溶剂回收本文开发的工艺是对SO2/KI/H2SO4还原法[18]的改进,两法均采用碘元素催化SO2还原苯磺酰氯合成二苯二硫醚。而碘元素是一种价格比较高的元素,其单耗是重要的技术经济指标。研究对碘和溶剂进行了回收。将回收所得溶剂(回收率82.2%)和碘(回收率78.5%)补充至100%后进行套用,得到了图 5的反应结果。
|
图 5 溶剂、碘套用对反应的影响 Fig.5 Effects of solvent and I2 circulation on the reaction |
由图 5可知,溶剂和碘套用10次,产品的收率仍维持稳定,即每生产23.7 g产品消耗0.9 g碘,10.7 g乙二醇二甲醚。相比于SO2/KI/H2SO4还原法[18](表 4),本工艺碘元素用量(摩尔量)降低了72.5%,废酸产生量降低了48.9%。
|
|
表 4 工艺对比 Table 4 Process comparison |
将上述工艺进行底物拓展。分别以4-甲基苯磺酰氯、4-甲氧基苯磺酰氯、4-氟苯磺酰氯、4-氯苯磺酰氯、4-氨基苯磺酰氯和4-羟基苯磺酰氯为原料,在原料:水:碘的摩尔比为1:5:0.05,每20 g原料配用30 g乙二醇二甲醚,60 ℃条件下反应8 h,合成4, 4-二甲基二苯二硫醚、4, 4-二甲氧基二苯二硫醚、4, 4-二氟二苯二硫醚、4, 4-二氯二苯二硫醚、4, 4-二氨基二苯二硫醚和4, 4-二羟基二苯二硫醚,结果如表 5所示。
|
|
表 5 底物拓展结果 Table 5 The results of substrate development |
对比收率,发现不同取代基的产品收率不同,其原因主要受底物苯环上基团的电子效应的影响,芳香族环上的吸电子基团比供电子基团更容易引起芳磺酰氯和二芳基二硫醚的还原。
4 结论本文构建了SO2/I2/H2O还原体系,通过使用有机溶剂代替较大量的水,反应完后蒸馏溶剂并萃取碘回用,解决了酸量多、碘回收困难等问题;通过强化传质的气-液-液相反应设备将SO2气体强制循环鼓入反应器液相,使得体系溶解有较高浓度的SO2,促进反应的高效进行。优化后的工艺条件为:反应体系中苯磺酰氯:水:碘的摩尔比为1:5:0.05,反应温度为60 ℃,反应时间为8 h,反应溶剂为乙二醇二甲醚。提纯后目标产物收率为95.8%,纯度为99.0%。碘的回收率为78.5%,溶剂的回收率为82.2%。回收后的碘、溶剂套用10次,结果仍稳定。相比于SO2/KI/H2SO4还原法[18],反应碘元素物料利用率高,废酸产生量少,工艺成本低。底物拓展性研究证明该工艺适用于其他芳基磺酰氯合成芳基二硫醚,可供工业化生产参考。
| [1] |
ZHAO J N, YANG F, Yu Z Y, et al. Visible light-mediated selective a-functionalization of 1, 3-dicarbonyl compounds via disulfide induced aerobic oxidation[J]. Chemical Communications, 2019, 55(86): 13008-13011. DOI:10.1039/C9CC06544J |
| [2] |
GUO Y J, TANG R Y, LI J H, et al. Palladium-catalyzed annulation of 2-(1-alkynyl)benzenamines with disulfides:Synthesis of sulfenylindoles[J]. Advanced Synthesis & Catalysis, 2009, 351(16): 2615-2618. |
| [3] |
HUANG W, CHEN W, WANG G, et al. Thiyl-radical-catalyzed photoreductive hydrodifluoroacetamidation of alkenes with hantzsch ester as a multifunctional reagent[J]. ACS Catalysis, 2016, 6(11): 7471-7474. DOI:10.1021/acscatal.6b02420 |
| [4] |
PHADKE S, COADOU E, ANOUTI, et al. Catholyte formulations for high-energy Li-S batteries[J]. The Journal of Physical Chemistry Letters, 2017, 8(23): 5907-5914. DOI:10.1021/acs.jpclett.7b02936 |
| [5] |
NABESHIMA T, AOKI T, HARUVAMA T, et al. Synthesis and metal transport ability of a new series of thiamacrocycles containing thiol and disulfide groups inside the ring[J]. Heteroatom Chemistry, 2010, 32(45): 276-281. |
| [6] |
ARAI K, OSAK Y, HANEDA M, et al. Cyclic telluride reagents with remarkable glutathione peroxidase-like activity for purification-free synthesis of highly pure organodisulfides[J]. Catalysis Science & Technology, 2019, 9(14): 3647-3655. |
| [7] |
PATRA A K, DUTTA A, PRAMANIK M, et al. Synthesis of hierarchical mesoporous Mn-MFI zeolite nanoparticles:A unique architecture of heterogeneous catalyst for the aerobic oxidation of thiols to disulfides[J]. ChemCatChem, 2014, 6(1): 220-229. DOI:10.1002/cctc.201300850 |
| [8] |
KAMYSHNY A, EKELTCHIK I, GUN J, et al. Method for the determination of inorganic polysulfide distribution in aquatic systems[J]. Analytical Chemistry, 2006, 78(8): 2631-2639. DOI:10.1021/ac051854a |
| [9] |
SONAVANE S U, CHIDAMBARAM M, ALMOG J, et al. Rapid and efficient synthesis of symmetrical alkyl disulfides under phase transfer conditions[J]. Tetrahedron Letters, 2007, 48(34): 6048-6050. DOI:10.1016/j.tetlet.2007.06.074 |
| [10] |
FIROUZABADI H, IRANPOR N, JAFARPOUR M. ZrCl4/NaI and ZrOCl2·8H2O/NaI as effective systems for reductive coupling of sulfonyl chlorides and chemoselective deoxygenation of sulfoxides[J]. Sulfur Chemistry, 2005, 26(4): 313-324. |
| [11] |
FIROUZABADI H, JAMALIAN A. Deoxygenation of sulfoxides to thioethers by molybdenum pentachloride(MoCl5) and reductve coupling of sulfonyl chlorides to disulfides[J]. Phosphorus and Sulfur and the Related Elements, 2001, 170(1): 211-220. DOI:10.1080/10426500108040599 |
| [12] |
MANDAL B, BASU B. Recent advances in S-S bond formation[J]. RSC Advances, 2014, 4(27): 13854-13881. DOI:10.1039/c3ra45997g |
| [13] |
ZHENG Y, QING F L, HUANG Y, et al. Tunable and practical synthesis of thiosulfonates and disulfides from sulfonyl chlorides in the presence of tetrabutylammonium iodide[J]. Advanced Synthesis & Catalysis, 2016, 358(21): 3477-3481. |
| [14] |
ENGELS H D. Process for the preparation of thiophenols: US, 4006186[P]. 1977-02-01.
|
| [15] |
张柱朋.官能化二硫化物的合成及应用[D].青岛: 青岛科技大学, 2016. ZHANG Z P. Synthesis and application of functional disulfide[D]. Qingdao: Qingdao University of Science and Technology, 2016. |
| [16] |
HU Y, DU Z, WANG J X, et al. Reductive coupling of aldehydes, ketones and aroyl chlorides induced by LVT prepared from TiCl4/Al system[J]. Synthetic Communications, 1998, 28(18): 3299-3304. DOI:10.1080/00397919808004438 |
| [17] |
ZHAO Q, QIAN C, CHEN X Z. Investigation on the reduction of sulfonyl chlorides with sulfur dioxide in water as solvent[J]. Monatshefte Fuer Chemie, 2013, 144(10): 1547-1550. DOI:10.1007/s00706-013-1027-2 |
| [18] |
LIU Y J, ZHANG Y M. Temperature-controlled selective reduction of arenesulfonyl chlorides promoted by samarium metal in DMF[J]. Tetrahedron Letters, 2003, 44(22): 4291-4294. DOI:10.1016/S0040-4039(03)00814-1 |
| [19] |
GHORBANI-CHOGHAMARANI A, NIKOORAZM M, GOUDARZIAFSHAR H, et al. ChemInform abstract:Metal-free oxidative coupling of thiols to disulfides using guanidinium nitrate or nitro urea in the presence of silica sulfuric acid[J]. Journal of Chemical Sciences, 2011, 123(4): 453-457. DOI:10.1007/s12039-011-0094-3 |
| [20] |
KARAMI B, MONTAZEROZOHORI M, HABIBI M H. Bis(salicylaldehyde-1, 2-phenylene diimine)Mn(Ⅲ) chloride (Mn(Ⅲ)-salophen) catalysed oxidation of thiols to symmetrical disulfides using urea hydrogen peroxide (UHP) as mild and efficient oxidant[J]. Journal of Chemical Research, 2007, 38(1): 490-492. |
| [21] |
KARAMI B, MONTAZEROZOHORI M, HABIBI M H. Silica-supported ICl as a novel heterogeneous system for the rapid and selective oxidation of thiols to symmetrical disulfides[J]. Journal of Sulfur Chemistry, 2011, 32(5): 483-488. DOI:10.1080/17415993.2011.606625 |
| [22] |
HAJIPOUR A R, MOSTAFAVI M, RUOHO A E. Oxidation of thiols using K2S2O8 in ionic liquid[J]. Phosphorus Sulfur and Silicon and the Related Elements, 2009, 184(7): 1920-1923. DOI:10.1080/10426500802417000 |
| [23] |
PERVEEN S, ALI M, TAHA M, et al. A mild and alternative approach towards symmetrical disulfides using H3IO5/NaHSO3 combination[J]. Letters in Organic Chemistry, 2009, 6(4): 319-320. DOI:10.2174/157017809788489963 |