亚胺及其衍生物是有机合成中一类重要的中间体,可以发生还原、加成、环化等多种反应[1-3],因此被广泛用于合成药物、生物活性成分及精细化学品等。例如,一种从高等茄科植物Solanum congestiflorum中分离得到的甾类生物碱solacongestidine,就是一种典型的亚胺类化合物,其已被证实针对多种真菌病原体有着良好的抗菌活性[4-5]。在传统合成方法中,亚胺通常是在Lewis酸或脱水剂的存在下,通过伯胺与羰基化合物之间脱水缩合制备。近年来,人们探索出多种新的亚胺合成方法,包括伯胺氧化偶联法[6],醇-胺氧化偶联法[7],仲胺氧化脱氢法[8]等。其中,伯胺氧化偶联法吸引了广泛的关注,并且取得了众多卓有成效的成果。目前,针对这一反应,已报道了包括贵金属催化[9]、非贵金属催化[10]、无金属催化[11]、光催化[12]、锰-卟啉配合物[13-15]等在内的众多催化体系。尽管这些方法十分有效,但依旧存在一些缺点,例如催化剂制备过程复杂或成本较高;反应条件较为苛刻,需要较高反应温度或较长的反应时间;催化产率或选择性仍旧较低等。因此,针对该反应开发出更为高效并且能够使反应在较温和条件下进行的催化体系依旧是迫切需要解决的问题。
作为另一种常用有机配体,Salen类配体(Salen, Salophen……)与卟啉有着类似结构与性质。相较于卟啉配合物,Salen配合物具有成本更低,制备更简单,结构更加容易调控等优点[16],因此被广泛用于配位化学研究。此外,Salen配合物还可催化多种有机反应,如Diels-Alder反应[17]、Suzuki-Miyaura反应[18]及氧化反应等。在氧化反应中,Salen配合物被证明对包括烯烃[19]、醇类[20]、吡啶[21]在内的多种底物的氧化都具有良好的催化效果,但在伯胺氧化偶联合成亚胺反应中的应用还鲜见报道。
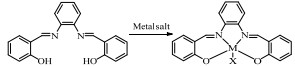
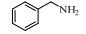
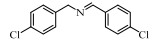
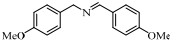
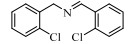
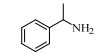
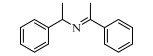
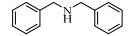
基于Salen配体与卟啉配体在结构上的相似性及独特优势,以及Salen配合物在众多氧化反应中良好的催化性能。在此尝试将Salen配合物用于常温催化伯胺氧化偶联合成亚胺的反应,并以TBHP(叔丁基过氧化氢)氧化苄胺作为探针反应(图 1),探究催化剂的催化性能。
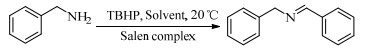
|
图 1 苄胺催化氧化偶联反应 Fig.1 Catalytic oxidative self-coupling of benzylamine |
本实验所用试剂为水杨醛(AR,Aladdin)、邻苯二胺(CP,沪试)、四水乙酸锰(AR,沪试)、苄胺(CP,沪试)、叔丁基过氧化氢(70% solution in water,萨恩化学)等。
2.2 仪器分析熔点用WRS-1B数字熔点仪测定;1H NMR用AVANCE DMX500型核磁共振仪(TMS为内标)测定;元素分析用Vario MICRO Cube元素分析仪测定。
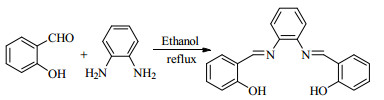
2.3 催化剂的制备 2.3.1 Salophen配体的制备如图 2所示,50 mL三口瓶中加入3.66 g(30 mmol)水杨醛,1.62 g(15 mmol)邻苯二胺,20 mL乙醇溶解,磁力搅拌回流反应2 h,反应过程中可以观察到有固体析出。反应结束后,将反应液冷冻,然后真空抽滤,滤饼以冷无水乙醇洗涤,真空烘干,得橙色固体4.17 g,产率88%。
|
图 2 Salophen配体的制备 Fig.2 Synthesis of the Salophen ligand |
m.p. 159.7~160.7 ℃;1H NMR (500 MHz, DMSO) δ 12.94 (s, 2H, OH), 8.94 (s, 2H, CH=N), 7.67 (dd, J= 7.6, 1.6 Hz, 2H, ArH), 7.50~7.45 (m, 2H, ArH), 7.44~7.39 (m, 4H, ArH), 7.01~6.94 (m, 4H, ArH).
2.3.2 Salophen配合物的制备本文中所研究的配合物如表 1所示。
|
|
表 1 配合物的合成及结构 Table 1 Synthesis and structure of the complexes |
Mn (Salophen)配合物的制备参考文献方法[22]并作适当改进。100 mL三口瓶中加入0.32 g(1 mmol) Salophen配体,25 mL乙腈,磁力搅拌下,先后加入0.25 g(1 mmol)四水合乙酸锰-5 mL乙腈及0.20 g(2 mmol)三乙胺-5 mL乙腈溶液,反应液由橙色悬浊液变为棕色,继续常温磁力搅拌3 h,真空浓缩部分溶剂,抽滤,滤饼以少量无水乙醇洗涤,烘干得固体0.33 g,产率78%。
Anal. Calcd for C22H17N2O4Mn(428.33): C 61.69, H 4.00, N 6.54. Found: C 61.75, H 4.11, N 6.82。
2.4 催化剂活性评价25 mL三口瓶中依次加入0.54 g(5 mmol)苄胺,一定量的配合物催化剂,氧化剂TBHP及5 mL溶剂。室温磁力搅拌4 h。反应结束后,产物组成由安捷伦Agilent 6820气相色谱仪测定,FID检测器,30 m HP-5色谱柱。产物结构由Agilent 6890/5973气质联用仪(GC-MS)测定,30 m ZB-5ms色谱柱。
3 实验结果与讨论 3.1 工艺条件优化以图 1所示苄胺的氧化为探针反应,对配合物种类、溶剂、催化剂用量、氧化剂用量等因素进行了优化。
3.1.1 配合物种类对收率的影响首先考察了不同配合物对收率的影响,结果如表 2所示。在无催化剂存在时,反应较难进行。而在反应中加入10 mg(2.3×10-2 mmol) Mn(Salophen)时,就可以起到非常好的催化效果,底物几乎完全转化,产物收率96.7%,少量副产物如苯甲醛、苯甲腈、苯甲酰胺等由GC-MS检测。另外通过不同配合物催化产率对比可以得出,配合物的催化能力主要取决于中心金属性质。Fe(Salophen)作为催化剂同样可以催化该反应,但效果稍逊于Mn(Salophen)。
|
|
表 2 配合物种类对收率的影响 Table 2 Effects of different complexes on reaction yields |
其他金属配合物对该反应没有明显的催化效果。值得注意的是,据文献报道这些配合物的衍生物有对其他一些底物的氧化具有良好催化性能的实例[26-28],但在此并不适用。综上,针对该反应,Mn(Salophen)配合物是最适宜的催化剂。
3.1.2 溶剂对收率的影响溶剂种类也是影响收率的重要因素之一,由表 3可知,乙腈是最适宜溶剂。在很多关于Salen配合物催化氧化反应的报道中,乙腈都被用作反应溶剂[29-31],这一点也与本文结论吻合。此外,反应在甲苯中也可获得较高收率,但稍逊于乙腈。在二氯甲烷、四氢呋喃(THF)和1, 4-二氧六环中,反应效果稍差。反应以水为溶剂时,底物同样可以基本完全转化,但选择性不好。气相结果显示反应液中有大量副产物苯甲醛的存在,这可能是由于产物亚胺的水解导致的。
|
|
表 3 溶剂种类对收率的影响 Table 3 Effects of solvents on reaction yields |
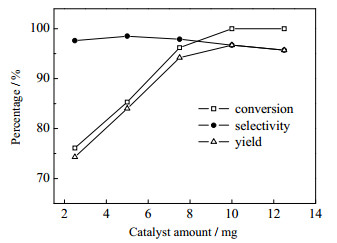
实验还考察了催化剂用量对收率的影响,由图 3可知,当Mn(Salophen)催化剂用量由2.5 mg升至7.5 mg时,底物转化率与产物收率分别由76.1%和74.3%升至96.2%和94.2%。进一步提高催化剂用量至10 mg时,可以使原料苄胺基本完全转化,产率进一步提升至96.7%。继续提高催化剂用量,产率反而略有下降。综合考虑转化率和产率两种因素,10 mg Mn(Salophen)是最佳催化剂用量。
|
图 3 催化剂用量对收率的影响 Fig.3 Effects of catalyst dosages on reaction yields |
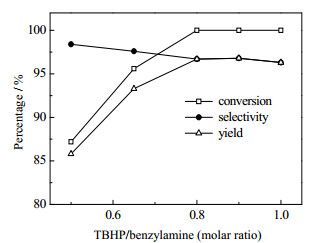
氧化剂用量同样是影响收率的重要因素。首先需要说明的是,在该反应中,氧化剂/底物摩尔比理论值为0.5。这是因为尽管氧化1分子苄胺需要1分子TBHP提供活性氧,但底物苄胺中有一半当量是不经氧化,直接与苄胺被氧化形成的中间体反应生成最终的亚胺产物,所以该比值的理论值为0.5。因此,氧化剂/底物摩尔比选定在0.5~1.0。如图 4所示,TBHP与苄胺最佳摩尔比为0.8,低于该值时,底物苄胺无法完全转化。高于该值时,产率没有明显的变化。相较于许多其他以TBHP氧化苄胺制备亚胺的报道[15, 32-33],本文中氧化剂用量是相对较低的。
|
图 4 氧化剂用量对收率的影响 Fig.4 Effects of oxidant amounts on reaction yields |
在以苄胺的氧化偶联反应作为模型得到适宜的工艺条件后,对Mn(Salophen)催化剂的普适性进行了探究,结果如表 4所示。对于对位取代苄胺衍生物(Entries 2~5),在该反应条件下,无论底物苯环上含有吸电子取代基(Entries 2, 3)还是供电子取代基(Entries 4, 5),催化剂都显示出良好的催化效果,证明该催化剂对底物的电子效应具有很强的耐受能力。相较而言,含有供电子取代基底物的产率要略逊于含有吸电子取代基产物,气相色谱结果显示这是由于反应液中有较多副产物醛的存在。这可能是由于在产物形成过程中,最后一个步骤是底物与氧化产物醛脱水缩合形成亚胺,而苯环对位连有供电子基时,对应的醛上碳原子相对不容易被胺上的氮原子亲核进攻,从而导致选择性较低。
|
|
表 4 催化剂普适性研究 Table 4 Applicability of the catalyst |
相对而言,底物的位阻效应对反应结果影响更大。同样是苯环上连有吸电子取代基,当底物由4-氯苄胺变为2-氯苄胺时,产物产率有明显的下降(Entry 2 vs. 6)。另外,当底物为α-苯乙胺时,即便提高氧化剂用量至1当量并延长反应时间至7 h,产率也仅有52.7% (Entry 7)。这两组实例都证明了位阻效应对产率的巨大影响。
实验中还以二苄胺为例,对催化剂在仲胺氧化脱氢反应中的应用进行了探索。结果显示,当氧化剂用量与底物比为1时(此时该比值的理论值为1),就可以获得较好的收率(Entry 8)。尽管其氧化产物与苄胺氧化产物相同,但气相结果显示在二苄胺氧化反应产物中,有一定量的副产物苯甲醛的存在。最后,苯乙胺作为不含苄基胺结构单元的底物,对其进行了氧化尝试。结果显示催化剂对该类底物适用性较差(Entry 9)。分析结果表明,体系中反应产物较复杂,这可能是由于底物中不含有苄基胺中非常活泼的α-H,因此在多个反应位点上发生了几乎无选择性的氧化[34]。GC-MS结果显示主产物为N-苄亚甲基苯乙胺,证明在反应过程中可能发生了C─C键氧化断裂的情况[14]。
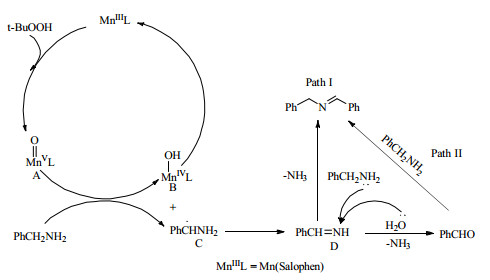
3.3 催化剂催化机理分析基于以上实验结果与规律,参考相关研究报道[14-15],提出了Mn(Salophen)催化伯胺氧化偶联合成亚胺反应可能的机理,图 5为催化氧化机理图。尽管实验中未能分离出任何中间体,但普遍认为“高价锰-氧”配合物(MnⅤ=O)是Mn(Salen)配合物催化氧化反应中关键的中间体[35]。因此,推测反应由TBHP与Mn(Salophen)之间形成中间体A开始。进而,高价锰中间体A与底物作用,使底物α-H转移到中间体A上,形成中间体B与C。中间体B与C进一步发生反应,使氨基氮原子上氢原子转移,中间体C形成中间体D,而中间体B脱除一分子水,再经TBHP氧化得到A,完成一个催化剂循环。
|
图 5 Mn(Salophen)催化剂催化伯胺氧化偶联合成亚胺反应机理推测图 Fig.5 Possible mechanism for oxidative self-coupling of primary amines to imines catalyzed by Mn(Salophen) |
此后,反应可能经由两种不同的路径继续,在图中用“Path I”和“Path II”表示。在“Path I”路径中,中间体D直接被底物胺分子中的氮原子亲核进攻,脱除一分子NH3后形成最终产物。后一条路径中,中间体D首先发生水解反应,脱除一分子NH3后形成苯甲醛,进而发生醛胺脱水缩合反应,形成最终产物。由于在反应过程中或多或少检测到副产物醛的存在,在某些情况下醛的含量还很高(如底物的苯环连有供电子基)。因此推测在反应历程中,“Path II”占据主导地位。
3.4 催化剂催化性能比较最后,将Mn(Salophen)与其他针对该反应报道的催化剂进行了比较。如表 5所示,Mn(Salophen)催化剂拥有与其他一些比较高效的催化剂相近的催化效果。相对而言,Mn(Salophen)催化剂可以使反应在较温和的反应条件下进行,不需要较高的反应温度或比较长的反应时间。另外,催化剂的制备也相对简单,并且原料易得,操作过程也不需要特殊的反应装置。
|
|
表 5 苄胺氧化偶联反应催化剂对比 Table 5 Comparison of catalyst performance in oxidative self-coupling of benzylamine |
证明了Salen配合物,尤其是Mn(Salophen),对TBHP氧化伯胺偶联制备亚胺的反应具有良好的催化效果,拓展了该类催化剂的应用领域。以苄胺的氧化为探针反应,对反应的影响因素进行了研究,得到较适宜工艺条件为:10 mg Mn(Salophen)为催化剂,乙腈为溶剂,氧化剂TBHP与底物摩尔比为0.8,20 ℃下反应4 h,产物收率为96.7%。催化剂还对多种底物具有很好的普适性,并通过催化实验结果提出了可能的反应机理。该催化剂具有制备简单,催化效率高,反应条件温和等优势。
| [1] |
ADAMS J P. Imines, enamines and oximes[J]. Journal of the Chemical Society, Perkin Transactions 1, 2000, 2: 125-139. |
| [2] |
KOBAYASHI S, ISHITANI H. Catalytic enantioselective addition to imines[J]. Chemical Reviews, 1999, 99(5): 1069-1094. DOI:10.1021/cr980414z |
| [3] |
KOBAYASHI S, MORI Y, FOSSEY J S, et al. Catalytic enantioselective formation of C-C bonds by addition to imines and hydrazones:a ten-year update[J]. Chemical Reviews, 2011, 111(4): 2626-2704. DOI:10.1021/cr100204f |
| [4] |
YAN Y J, AN Y, WANG X Z, et al. Synthesis and antimicrobial evaluation of fire ant venom alkaloid based 2-methyl-6-alkyl-Δ1, 6-piperideines[J]. Journal of Natural Products, 2017, 80(10): 2795-2798. DOI:10.1021/acs.jnatprod.7b00625 |
| [5] |
DAI L Y, JACOB M R, KHAN S I, et al. Synthesis and antifungal activity of natural product-based 6-alkyl-2, 3, 4, 5-tetrahydropyridines[J]. Journal of Natural Products, 2011, 74(9): 2023-2026. DOI:10.1021/np200644s |
| [6] |
ZHANG C H, ZHAO P S, ZHANG Z L, et al. Co-N-C supported on SiO2:A facile, efficient catalyst for aerobic oxidation of amines to imines[J]. RSC Advances, 2017, 7(75): 47366-47372. DOI:10.1039/C7RA09516C |
| [7] |
MOHAN D C, SADHUKHA A, MAAYAN G. A metallopeptoid as an efficient bioinspired cooperative catalyst for the aerobic oxidative synthesis of imines[J]. Journal of Catalysis, 2017, 355: 139-144. DOI:10.1016/j.jcat.2017.09.018 |
| [8] |
JIANG D M, MALLAT T, KRUMEICH F, et al. Polymer-assisted synthesis of nanocrystalline copper-based metal-organic framework for amine oxidation[J]. Catalysis Communications, 2011, 12(7): 602-605. DOI:10.1016/j.catcom.2010.12.010 |
| [9] |
JAWALE D V, GRAVEL E, VILLEMIN E, et al. Co-catalytic oxidative coupling of primary amines to imines using an organic nanotube-gold nanohybrid[J]. Chemical Communications, 2014, 50(96): 15251-15254. DOI:10.1039/C4CC07951E |
| [10] |
GOPALAIAH K, SAINI A. A solvent-free process for synthesis of imines by iron-catalyzed oxidative self-or cross-condensation of primary amines using molecular oxygen as sole oxidant[J]. Catalysis Letters, 2016, 146(9): 1648-1654. DOI:10.1007/s10562-016-1789-3 |
| [11] |
DONG C P, HIGASHIURA Y, MARUI K, et al. Metal-free oxidative coupling of benzylamines to imines under an oxygen atmosphere promoted using salicylic acid derivatives as organocatalysts[J]. ACS Omega, 2016, 1(5): 799-807. DOI:10.1021/acsomega.6b00235 |
| [12] |
AGUIRRE-DIAZ L M, SNEJKO N, IGLESIAS M, et al. Efficient rare-earth-based coordination polymers as green photocatalysts for the synthesis of imines at room temperature[J]. Inorganic Chemistry, 2018, 57(12): 6883-6892. DOI:10.1021/acs.inorgchem.8b00465 |
| [13] |
ZHOU X T, REN Q G, JI H B. Mimicking the environment of living organisms to achieve the oxidative coupling of amines to imines catalyzed by water-soluble metalloporphyrins[J]. Tetrahedron Letters, 2012, 53(26): 3369-3373. DOI:10.1016/j.tetlet.2012.04.096 |
| [14] |
YUAN Q L, ZHOU X T, JI H B. Efficient oxidative coupling of amines to imines catalyzed by manganese(Ⅲ)-tetraphenylporphyrin chloride under ambient conditions[J]. Catalysis Communications, 2010, 12(3): 202-206. |
| [15] |
KIM S S, THAKUR S S. Oxidative coupling of benzylamines into N-benzylbenzaldimines with MnTPPCl/t-BuOOH[J]. Bulletin of the Korean Chemical Society, 2005, 26(10): 1600-1602. DOI:10.5012/bkcs.2005.26.10.1600 |
| [16] |
KLEIJ A W. Zinc-centred salen complexes:versatile and accessible supramolecular building motifs[J]. Dalton Transactions, 2009, 24: 4635-4639. |
| [17] |
LI L, LI Y, PANG D, et al. Highly asymmetric hetero-Diels-Alder reaction using helical silica-supported Mn (Ⅲ)-salen catalysts[J]. Tetrahedron, 2015, 71(42): 8096-8103. DOI:10.1016/j.tet.2015.08.045 |
| [18] |
LIU Y S, GU N N, LIU P, et al. Water-soluble salen-Pd complex as an efficient catalyst for Suzuki-Miyaura reaction of sterically hindered substrates in pure water[J]. Tetrahedron, 2015, 71(42): 7985-7989. DOI:10.1016/j.tet.2015.08.070 |
| [19] |
ZHANG W, LOEBACH J L, WILSON S R, et al. Enantioselective epoxidation of unfunctionalized olefins catalyzed by (salen)manganese complexes[J]. Journal of the American Chemical Society, 1990, 112(7): 2801-2803. DOI:10.1021/ja00163a052 |
| [20] |
AZAR A R J, SAFAEI E, MOHEBBI S. A novel Schiff base of Mn (Ⅲ) complex supported on magnetic cobalt nanoparticles as a highly efficient retrievable heterogeneous catalyst in oxidation of alcohols and sulfides compounds[J]. Materials Research Bulletin, 2015, 70: 753-761. DOI:10.1016/j.materresbull.2015.05.016 |
| [21] |
DAI L Y, ZHANG J, WANG X Z, et al. The direct assembly of Mg-Al LDH nanosheets and Mn(Ⅱ)-salen complex into sandwich-structured materials and their enhanced catalytic properties[J]. RSC Advances, 2013, 3(43): 19885-19888. DOI:10.1039/c3ra42837k |
| [22] |
BISWAS S, MITRA K, SCHWALBE C H, et al. Synthesis and characterization of some Mn(Ⅱ) and Mn(Ⅲ) complexes of N, N'-o-phenylenebis(salicylideneimine)(LH2) and N, N'-o-phenylenebis(5-bromosalicylideneimine)(L'H2). Crystal structures of[Mn(L)(H2O)(ClO4)], [Mn(L)(NCS)] and an infinite linear chain of[Mn(L)(OAc)][J]. Inorganica Chimica Acta, 2005, 358(8): 2473-2481. DOI:10.1016/j.ica.2005.01.026 |
| [23] |
ABD-ELZAHER M M. Synthesis and spectroscopic characterization of some tetradentate Schiff bases and their nickel, copper and zinc complexes[J]. Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry, 2000, 30(9): 1805-1816. DOI:10.1080/00945710009351870 |
| [24] |
PIZZOLATO E, NATALI M, POSOCCO B, et al. Light driven water oxidation by a single site Cobalt Salophen catalyst[J]. Chemical Communications, 2013, 49(85): 9941-9943. DOI:10.1039/c3cc45457f |
| [25] |
KADWA E, FRIEDRICH H B, BALA M D. Base metal Schiff base complexes applied as catalysts for the oxidation of n-octane[J]. Inorganica Chimica Acta, 2017, 463: 112-117. DOI:10.1016/j.ica.2017.04.032 |
| [26] |
RAYATI S, KHODAEI E, JAFARIAN M, et al. Ni(Ⅱ) and V(Ⅳ) Schiff base complexes derived from 2, 2'-dimethylpropandiamine:the crystal structure, electrochemical properties and catalytic activities in oxidation of sulfides[J]. Journal of Coordination Chemistry, 2017, 70(8): 1424-1437. DOI:10.1080/00958972.2017.1295306 |
| [27] |
CHEN L J, MEI F M, LI G X. Co(Ⅱ) Schiff base complexes on silica by sol-gel method as heterogeneous catalysts for oxidative carbonylation of aniline[J]. Catalysis Communications, 2009, 10(6): 981-985. DOI:10.1016/j.catcom.2008.12.047 |
| [28] |
BLACK C C, GORDEN A E V. Propargylic C-H activation using a Cu(Ⅱ) 2-quinoxalinol salen catalyst and tert-butyl hydroperoxide[J]. Tetrahedron Letters, 2018, 59(9): 803-806. DOI:10.1016/j.tetlet.2018.01.030 |
| [29] |
CHAKRABORTY A, DASGUPTA S, CHATTERJEE S, et al. Oxidation of organic functionalities by PhI(OAc)2 catalysed by magnetically separable Fe3O4@dopa-supported Mn(Ⅲ) complexes:combined experimental and theoretical approach[J]. Chemistryselect, 2017, 2(27): 8686-8700. DOI:10.1002/slct.201701236 |
| [30] |
CARNEIRO L, SILVA A R. Selective direct hydroxylation of benzene to phenol with hydrogen peroxide by iron and vanadyl based homogeneous and heterogeneous catalysts[J]. Catalysis Science & Technology, 2016, 6(22): 8166-8176. |
| [31] |
NIKOORAZM M, GHORBANI-CHOGHAMARANI A, GHORBANI F, et al. Bidentate salen Cu(Ⅱ) complex functionalized on mesoporous MCM-41 as novel nano catalyst for the oxidative coupling of thiols into disulfides using urea hydrogen peroxide (UHP)[J]. Journal of Porous Materials, 2015, 22(1): 261-267. DOI:10.1007/s10934-014-9892-6 |
| [32] |
ZHANG Z, WANG F, WANG M, et al. tert-Butyl hydroperoxide (TBHP)-mediated oxidative self-coupling of amines to imines over a α-MnO2 catalyst[J]. Green Chemistry, 2014, 16(5): 2523-2527. DOI:10.1039/C3GC42312C |
| [33] |
GE D H, QU G L, LI X M, et al. Novel transition bimetal-organic frameworks:Recyclable catalyst for the oxidative coupling of primary amines to imines at mild conditions[J]. New Journal of Chemistry, 2016, 40(6): 5531-5536. DOI:10.1039/C5NJ03544A |
| [34] |
LANG X J, JI H W, CHEN C C, et al. Selective formation of imines by aerobic photocatalytic oxidation of amines on TiO2[J]. Angewandte Chemie-International Edition, 2011, 50(17): 3934-3937. DOI:10.1002/anie.201007056 |
| [35] |
SRINIVASAN K, MICHAUD P, KOCHI J K. Epoxidation of olefins with cationic (salen)MnⅢ complexes. The modulation of catalytic activity by substituents[J]. Journal of the American Chemical Society, 1986, 108(9): 2309-2320. DOI:10.1021/ja00269a029 |
| [36] |
KO J H, KANG N, PARK N, et al. Hollow microporous organic networks bearing triphenylamines and anthraquinones:diffusion pathway effect in visible light-driven oxidative coupling of benzylamines[J]. Acs Macro Letters, 2015, 4(7): 669-672. DOI:10.1021/acsmacrolett.5b00323 |
| [37] |
CHU G B, LI C B. Convenient and clean synthesis of imines from primary benzylamines[J]. Organic & Biomolecular Chemistry, 2010, 8(20): 4716-4719. |
| [38] |
YE J L, NI K, LIU J, et al. Oxygen-rich carbon quantum dots as catalysts for selective oxidation of amines and alcohols[J]. Chemcatchem, 2018, 10(1): 259-265. DOI:10.1002/cctc.201701148 |
| [39] |
HUANG H, HUANG J, LIU Y M, et al. Graphite oxide as an efficient and durable metal-free catalyst for aerobic oxidative coupling of amines to imines[J]. Green Chemistry, 2012, 14(4): 930-934. DOI:10.1039/c2gc16681j |