2. 天通控股股份有限公司, 浙江 海宁 314400;
3. 中国科学院 山西煤炭化学研究所, 山西 太原 030001
2. TDG Holding Company Limited, Haining 314400, China;
3. Institute of Coal Chemistry, Chinese Academy of Sciences, Taiyuan 030001, China
将CO2绿色高效地转化为含碳化学品,对于实现我国“双碳”目标具有重要意义[1-3]。CO2可转化为CO[4]、烃类[5-6]和甲醇[7-8]等,其中甲醇在未来化工和能源产业中具有独特地位。甲醇可转化为汽油[5]、烯烃[6]、芳烃[9]、含氧化学品[10]等;它还是安全高效的储氢分子。因此,CO2加氢制甲醇技术具有广阔的应用前景。铜基体系是这一过程最常用的催化剂[4-5, 7-8, 11],但它在此过程中也催化逆水煤气变换反应(CO2+H2↔CO+H2O, reverse water-gas-shift reaction, RWGS),导致CO选择性(以摩尔分数计,下同)常在50%~80%[7, 12]。抑制铜基催化剂的RWGS活性,提高甲醇选择性,是这一过程的关键技术挑战之一。
多年来,研究者致力于铜基催化剂的选择性调控研究,取得了诸多突破性进展。Gao等[12]通过调控Cu/Zn/Zr/Al催化剂表面碱性位点数,可将甲醇选择性从41.7% 提高至54.5%。Arena等[13]将ZrO2引入Cu/ZnO,通过增大催化剂表面活性铜的量,将甲醇选择性从50% 提高至约75%。Larmier等[14]发现,Cu与ZrO2间的强相互作用有利于提高Cu基催化剂的甲醇选择性。Mao等[15]在Cu/ZrO2中引入La,将甲醇选择性从58% 提高到72%。Yao等[16]将In2O3引入Cu/ZrO2,可将甲醇选择性从32%显著提高至80%左右。Gao等[17]还在Cu/Zn/Al/Zr中引入F−,将甲醇选择性从46% 提高至53%。Chen等[18]采用CuBr2修饰Cu/Zn/Zr表面,可将甲醇选择性从52.6% 显著提高至97.1%。
为降低CO选择性,提高甲醇选择性,在铜基催化剂中常含ZrO2组分。而对于Cu/ZnO体系,其甲醇选择性不太理想,往往在20%~50%。Cu/ZnO体系价格比Cu/ZrO2低廉,也是合成气制甲醇的工业催化剂,有效降低CO选择性,更有利于CO2加氢制甲醇技术的应用。本研究通过多种工艺调控铜在载体上的分散度,结合高倍透射电镜(high-resolution transmission electron microscopy, HRTEM)、高角环形暗场像-扫描透射电镜像(high-angle annular dark field-scanning transmission electron microscopy, HAADF-STEM)和原位X-射线光电子能谱(X-ray photoelectron spectroscopy, XPS)等证明,调控铜在载体上的分散度能有效抑制RWGS活性,降低CO选择性,显著提高甲醇选择性。
2 实验(材料与方法) 2.1 实验材料与仪器所用催化剂前驱体为工业Cu/ZnO/Al2O3催化剂(CZA),由中石化南化集团研究院提供,其Cu、Zn、Al和C的质量分数分别为46.2%、19.5%、4.8%和2.7%;SiO2(M-5)购自Cabot公司;无水乙醇(分析纯) 购自国药集团化学试剂有限公司;去离子水为实验室自制。
2.2 催化剂制备催化剂制备见图 1。CZA-S制备:将6.0 g CZA与10.5 g ZSM-5晶种液混合(晶种:质量分数为5.0%),在室温下超声分散5 h,然后封装入30 mL不锈钢水热合成釜,在170 ℃下水热合成2 d,所得固体经去离子水洗涤、100 ℃干燥40 h(详见文献[7])。CZA/SiO2-x(x=1, 2)的质量比mCZA/mSiO2=1:2,制备如下:将2.0 g CZA和4.0 g SiO2加入1 167.0 g去离子水中,在室温下搅拌并分别超声3 h(x=1)和8 h(x=2)。CZA-S/SiO2-x(x=1, 2, 3)的mCZA-S/mSiO2=1:2,制备如下:将2.0 g CZA-S和4.0 g SiO2加入1 167.0 g去离子水中,在室温下搅拌、超声8 h(x=1);将1.0 g(x=2)、0.6 g(x=3) CZA-S加入1 000 mL无水乙醇中,在室温下搅拌、超声8 h,再分别加入2.0 g(x=2)、1.2 g(x=3) SiO2,搅拌、超声2 h,再加入800.0 g去离子水,搅拌、超声5 h。所得混合物体系,经离心分离和旋转蒸发、80 ℃干燥过夜、330 ℃焙烧3 h,得到最终催化剂。
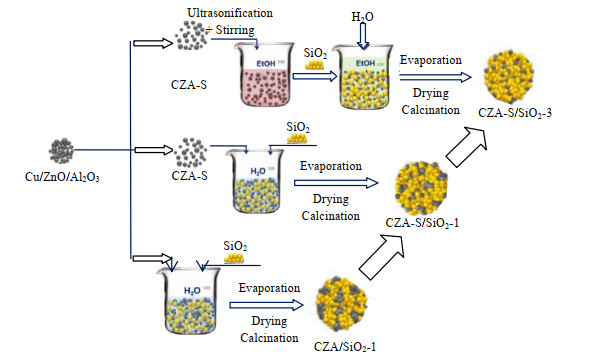
|
图 1 催化剂的制备流程图 Fig.1 Preparation procedures of the catalyst |
X-射线衍射(X-ray diffraction, XRD)在Rigaku的MiniFlex II型X射线衍仪(5°~80°, 4(°)·min−1)上测定,射线源为Cu Kα。HRTEM和HAADF-STEM在JEOL JEM-2100F高分辨透射电子显微镜上测得,工作电压是200 kV。XPS和俄歇电子谱(Auger electron spectroscopy, AES)在Kratos的AXIS ULTRA DLD上测定。以Al Kα靶为X射线辐射源,以表面污染碳的C 1s结合能校正其他元素的结合能。在原位XPS中,催化剂在测量前经体积比为10% 的H2/Ar混合气体流速为30 mL·min−1及250 ℃下还原2 h。反应性能采用固定床反应器评价。将0.86 g催化剂(粒径为0.43~0.85 mm)与石英砂混合,在常压、体积比为5.6% 的H2/Ar混合气体及250 ℃下还原10 h,标准状况下,每小时每克Cu上流过的气体体积为23.8 L;还原结束后,将温度降至180 ℃,采用原料气(H2、CO2体积比为5:1)对体系充压至3.4 MPa,再将温度升至210 ℃,在标准状况下,每小时每克Cu上流过的气体体积为10.7 L,反应开始。尾气采用在线气相色谱分析(7890A,Agilent),该色谱TCD的5A分子筛柱分析H2、CO2、CO和CH4等;其FID的GS-OxyPLOT柱分析CH3OH和CH3OCH3。液体产物中的CH3OH和CH3OCH3采用另一Agilent 7890A气相色谱仪分析。CO2转化率和产物碳选择性采用外标法计算。
3 实验结果与讨论 3.1 催化剂的制备和表征以工业Cu/ZnO/Al2O3催化剂(CZA)为铜源制备CuO晶粒在SiO2上分散度不同的催化剂。所有催化剂的CuO都来源于CZA,因而能保证这些CuO晶粒的形貌、尺寸和化学性质都是相当的。通过调控溶剂种类、超声和搅拌时间等对CZA中的CuO晶粒进行分散。首先在H2O体系中,通过调控超声和搅拌时间(3 h和8 h),逐渐分散CZA,制得CZA/SiO2-1和CZA/SiO2-2;为了更好地分散CuO晶粒,利用ZSM-5晶种液对CZA预分散(CZA-S),再在H2O或乙醇/H2O中分散,制得CZA-S/SiO2-x(x=1, 2, 3)。
HRTEM和XRD结果显示,CZA中CuO晶粒分布均匀,尺寸约为5.8 nm(图 2(a)、(b))。利用HRTEM考察CZA在不同条件下的分散度。结果显示,在水体系中改变超声和搅拌时间,当超声和搅拌的时间延长至8 h时,CZA的微米团簇分散程度不高,所得团簇尺寸较大,在几百纳米,且团簇中的纳米晶粒彼此间结合较为紧密(图 2(c))。在水体系中,利用ZSM-5晶种液对CZA预处理,CZA的纳米团簇进一步分散,尺寸变小,且其中的纳米颗粒彼此间开始变得松散,小部分纳米颗粒孤立分散(图 2(d));以乙醇为溶剂时,CZA中绝大部分纳米晶粒彼此分散,以孤立或以亚纳米团簇形式存在(图 2(e)、(f))。
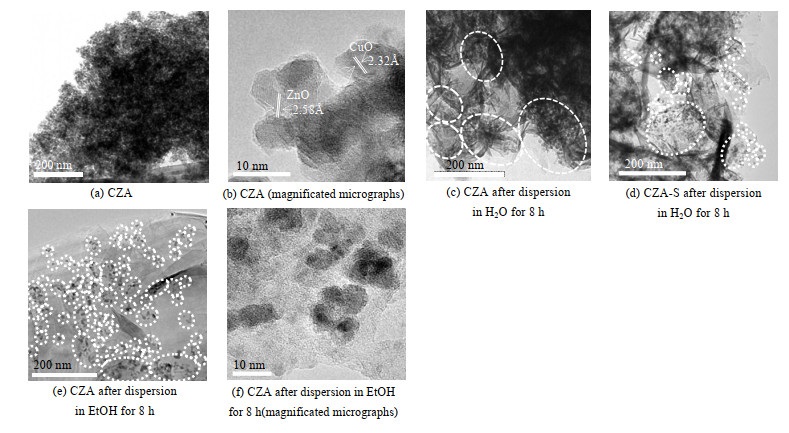
|
图 2 氧化态催化剂的TEM图 Fig.2 TME images of the oxidation state catalysts |
采用HAADF-STEM表征催化剂中纳米CuO晶粒的分散度,结果见图 3。催化剂中CuO颗粒为结晶型,而载体SiO2颗粒为无定形,可被HAADF-STEM表征有效区分。图 3(a)~图 3(a)(d)为HRTEM模式下的催化剂;图 3(e)~(h)为HAADF-STEM模式下的催化剂,其中白色亮点为纳米CuO晶粒。在CZA/SiO2-1中,CuO晶粒在SiO2上的分散度较低,彼此团聚在一起,形成几百纳米的团簇(图 3(e));在CZA-S/SiO2-1中,CuO晶粒在SiO2上的分散度有所提高,部分CuO晶粒彼此间分散(图 3(f));在CZA-S/SiO2-2,CuO晶粒在SiO2上的分散度明显提高(图 3(g));特别是CZA-S/SiO2-3,其CuO晶粒基本分散开,鲜有团簇存在(图 3(h))。对图片中CuO晶粒间的距离进行统计和平均(图 3(i))。随着CuO晶粒分散度的提高,CuO在SiO2上的平均距离从28.7 nm逐渐增大到66.5 nm。这些结果说明,调控制备条件,可有效调控CuO晶粒在SiO2上的分散度。进一步比较了催化剂中纳米CuO晶粒的形貌和尺寸。HRTEM和HAADF-STEM表征表明,纳米CuO晶粒的形貌和尺寸近似(图 3);XRD结果也证实了这一点,系列催化剂中的CuO晶粒特征衍射峰[7-8]的位置相近、相对高度和半峰宽相似(图 4(a))。
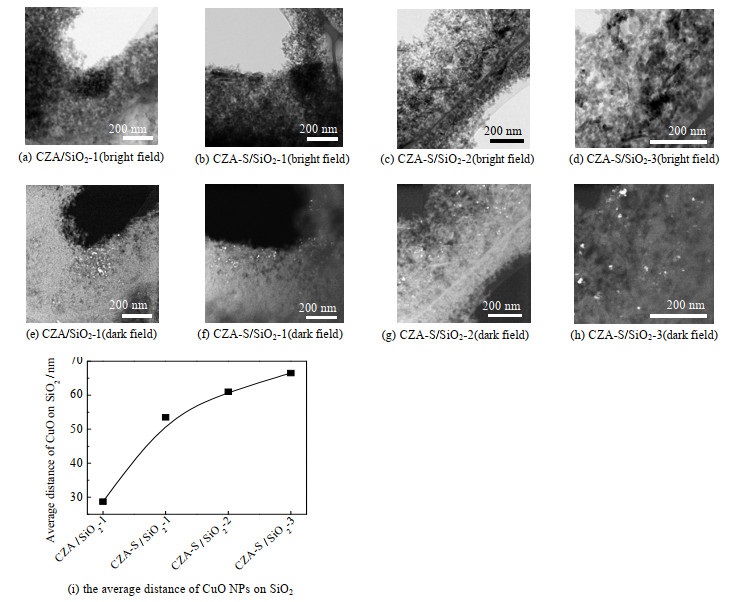
|
图 3 催化剂的HRTEM和HAADF-STEM图以及CuO晶粒在SiO2上的平均距离 Fig.3 HRTEM and HAADF-STEM images of catalysts and average distances of CuO NPs on SiO2 |
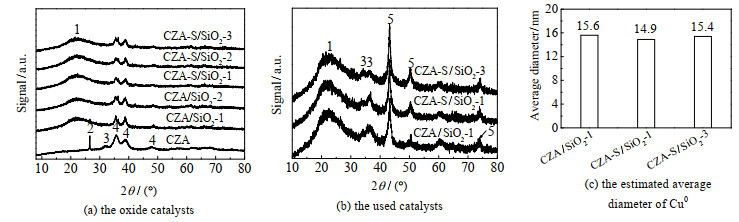
|
图 4 催化剂的XRD谱图 Fig.4 XRD patterns of the catalysts 1. SiO2 2. graphite 3. ZnO 4. CuO 5. metallic Cu (Cu0) |
催化剂在反应前需经还原。CuO晶粒在SiO2上分散度不同时,其还原状态可能存在差异。为了排除这一可能,选取铜晶粒在SiO2上分散度相差最大的CZA/SiO2-1和CZA-S/SiO2-3,采用原位XPS表征两者在还原后表面各元素的化学状态。2个催化剂中Cu 2p3/2出峰位置分别在931.7和931.5 eV,峰值相差0.2 eV(图 5(a)),该差值在XPS仪器测量误差范围内(±0.1 eV),可以认为2个催化剂的出峰位置接近;同时,在940~947 eV和961~966 eV没有卫星峰,说明还原后催化剂表面没有Cu2+物种[7]。由于Cu0和Cu+物种的Cu 2p XPS谱图难以区分,因此选择AES分析催化剂表面Cu0和Cu+分布。如图 5(b)所示,2个催化剂在918.5和914.4 eV处出峰,分别对应Cu0和Cu+物种[7, 10]。对比Cu0和Cu+峰的相对强度,可以看出2个催化剂中表面铜分布近似,主要为Cu0。此外,2个催化剂表面Zn和Al的XPS谱图也相似(图 5(c)~5(d))。其中,Zn 2p3/2出峰位置十分接近(1 022.0、1 021.9 eV),对应Zn2+(ZnO)物种[7];Al 2p出峰位置也相差很小(74.6、74.7 eV),对应于Al3+(Al2O3)物种[8]。这些结果说明还原催化剂表面各元素的化学状态相当,没有明显区别。
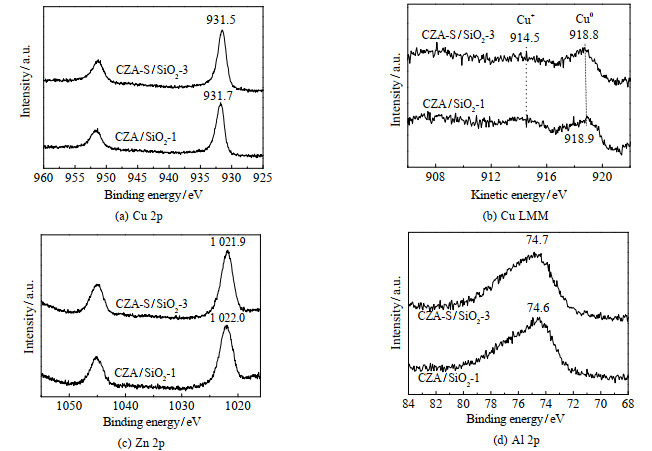
|
图 5 还原催化剂的原位XPS谱图 Fig.5 In situ XPS spectra of the reduced catalysts |
催化剂的CO2转化率和各产物碳选择性(以摩尔分数计)见图 6和图 7(a)。随着铜晶粒在SiO2上的分散度逐渐提高,CH3OH选择性SM和CH3OCH3选择性SD逐渐升高;由于CH3OCH3是CH3OH在催化剂上脱水而得,可将其与CH3OH加合,得到CH3OH和CH3OCH3的总选择性SD+M。随着铜晶粒在SiO2上的分散度逐渐增大,SD+M从43.4% 上升至71.4%;CO选择性SCO从56.5% 降低至28.6%;同时,CO2转化率也从12.9% 逐渐降至7.7%。CO2转化率的高低可能影响选择性。为了排除这一因素的影响,选择选择性最高的CZA-S/SiO2-3,通过降低反应空速、提高反应的转化率,反应评价结果见图 6的CZA-S/SiO2-3-LSV曲线。当反应空速降至原来的一半时,CO2转化率可提高至11.7%,与CZA/SiO2-1相近(12.9%),但其SD+M达62.8%(SM: 48.0%;SD: 14.8%),明显高于CZA/SiO2-1的SD+M(43.4%)。因此CO2转化率的高低不是造成选择性差异的主要原因。另外,由图 7(b)可见,随着铜晶粒在SiO2上的分散度逐渐增大,生成CH3OH和CH3OCH3的总本征活性(TOFD+M)基本保持不变;而生成CO的RWGS反应本征活性(TOFCO)显著下降,降幅高达70% 左右,单位时间每摩尔Cu生成CO物质的量从370.7降低至112.4 mmol,最终导致CO选择性明显降低,CH3OH和CH3OCH3选择性显著提高。
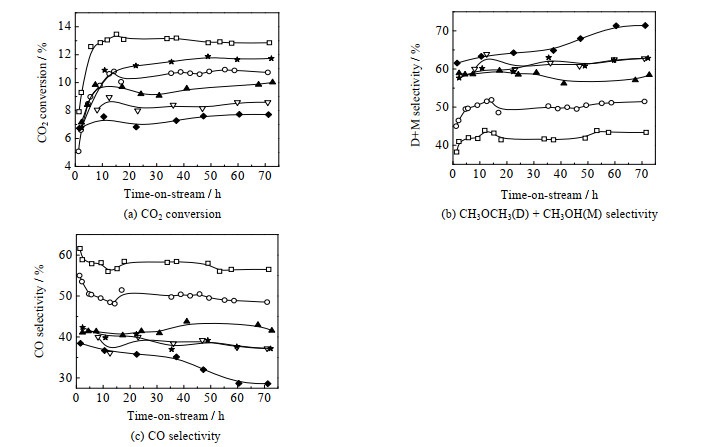
|
图 6 催化剂的固定床反应性能
Fig.6 Catalytic performance of the catalysts in a fixed-bed reactor
□ CZA/SiO2-1 ○ CZA/SiO2-2 ▲ CZA-S/SiO2-1 ▽ CZA-S/SiO2-2 ◆ CZA-S/SiO2-3 ★ CZA-S/SiO2-3-LSV |
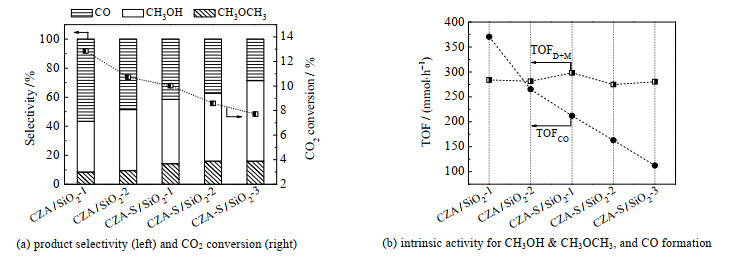
|
图 7 Cu的分散度对CO2加氢制甲醇反应性能的影响 Fig.7 Effects of Cu dispersion on methanol production via CO2 hydrogenation |
Cu0催化CO2加氢生成CH3OH[7-8]。反应过程中Cu0晶粒可能聚集长大,导致选择性的差异。对反应后催化剂中的活性Cu0进行XRD表征。由图 4(b)可见,各催化剂都在2θ=43.2°处出现Cu0特征峰[7],且峰形近似,说明各催化剂中Cu0晶粒尺寸分布近似;采用谢乐公式计算Cu0晶粒的尺寸,结果见图 4(c);各催化剂Cu0晶粒尺寸接近,在14.9~15.6 nm。因此催化剂选择性的差异不是由于Cu0晶粒大小不同导致的。XPS结果表明(图 8),催化剂的Cu 2p3/2特征峰位于932.5~932.7 eV,电子结合能差值在XPS仪器误差范围内;Zn 2p3/2特征峰没有明显差异,位于1 021.6~1 021.9 eV,对应于Zn2+(ZnO)[7];同时Al 2p特征峰峰位相近、峰形相似,都位于76.1 eV附近,对应于Al3+物种(Al2O3)[8];Si 2p特征峰在103.3~103.6 eV,差值(0.3 eV)接近XPS仪器误差范围。这些说明反应后催化剂表面各元素化学状态近似,没有明显差别。因而催化剂表面元素的化学状态不是导致选择性差别显著的原因。由此,催化剂选择性的差异主要是由于铜晶粒在SiO2上分散度不同所致。

|
图 8 反应后催化剂的XPS谱图 Fig.8 XPS spectra of the used catalysts |
活性金属分散度影响加氢反应选择性的本质原因有以下几种:1)金属分散度高,有利于缓解金属的聚集和烧结[7, 11];2)金属分散度调变金属-载体相互作用[3, 7];3)金属分散度影响活性中间物种,特别是活性氢,在催化剂上的扩散,进而调变反应路径[3-4, 19]。本研究XRD结果表明,Cu分散度不同的催化剂在反应后,其Cu0晶粒尺寸都接近,而XPS结果显示,不同Cu分散度的催化剂,其Cu和Si的电子结合能都没有明显差别,说明Cu-SiO2相互作用是接近的;因此,活性铜金属的聚集烧结以及Cu-SiO2相互作用不是其选择性差异的本质原因。基于此本研究推测在不同Cu分散度的催化剂上,Cu0上产生的活性氢能溢流到载体SiO2上,而铜的分散度影响溢流氢在载体上的浓度,从而影响加氢反应路径,改变选择性。
4 结论采用不同工艺将工业Cu/ZnO/Al2O3中的纳米CuO晶粒分散到SiO2载体上,制备纳米CuO晶粒分散度不同的催化剂;HRTEM、HADDF-STEM和原位XPS等证实,在所有催化剂中,除了铜晶粒在SiO2上分散度不同外,其他参数基本接近(催化剂物相结构、铜的形貌尺寸、表面元素化学状态等);固定床评价结果表明,铜晶粒在SiO2上的分散度能有效调控选择性。随着铜晶粒在SiO2上的分散度逐渐提高,生成CO的本征活性显著受到抑制,导致CH3OH和CH3OCH3选择性显著提高,CO选择性明显降低。
| [1] |
林春绵, 丁春晓, 张平, 等. 金属醋酸盐复配催化剂催化超临界CO2一步法合成碳酸二甲酯[J]. 高校化学工程学报, 2012, 26(2): 320-325. LIN C J, DING C X, ZHANG P, et al. One-pot synthesis of dimethyl carbonate from supercritical CO2 catalyzed by using metal acetates formulation catalyst[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(2): 320-325. DOI:10.3969/j.issn.1003-9015.2012.02.023 |
| [2] |
杜智美, 姚佩芳, 房鼎业, 等. 压力对甲醇合成本征反应速率常数的影响[J]. 高校化学工程学报, 1992, 6(1): 81-86. DU Z M, YAO P F, FANG D Y, et al. Influence of pressures upon reaction rate constants of intrinsic reaction kinetics of methanol synthesis[J]. Journal of Chemical Engineering of Chinese Universities, 1992, 6(1): 81-86. |
| [3] |
LI C M, CHEN K, WANG X Y, et al. Understanding the role of Cu/ZnO interaction in CO2 hydrogenation to methanol[J]. Acta Physico-Chimica Sinica, 2021, 37(5): 201-212. |
| [4] |
WANG C T, GUAN E, WANG L, et al. Product selectivity controlled by nanoporous environments in zeolite crystals enveloping Rhodium nanoparticles catalysts for CO2 hydrogenation[J]. Journal of the American Chemical Society, 2019, 141(21): 8482-8488. DOI:10.1021/jacs.9b01555 |
| [5] |
GAO P, LI S, BU X, et al. Direct conversion of CO2 into liquid fuels with high selectivity over a bifunctional catalyst[J]. Nature Chemistry, 2017, 9: 1019-1024. DOI:10.1038/nchem.2794 |
| [6] |
WANG S, ZHANG L, ZHANG W, et al. Selective conversion of CO2 into propene and butene[J]. Chem, 2020, 6(12): 3344-3363. DOI:10.1016/j.chempr.2020.09.025 |
| [7] |
CUI X, YAN W J, YANG H, et al. Preserving the active Cu-ZnO interface for selective hydrogenation of CO2 to dimethyl ether and methanol[J]. ACS Sustainable Chemistry & Engineering, 2021, 9(7): 2661-2672. |
| [8] |
CUI X, CHEN S, YANG H, et al. Improving methanol selectivity in CO2 hydrogenation by tuning the distance of Cu on catalyst[J]. Applied Catalysis B: Environmental, 2021, 298: 120590. DOI:10.1016/j.apcatb.2021.120590 |
| [9] |
NI Y, ZHEN Z, FU Y, et al. Selective conversion of CO2 and H2 into aromatics[J]. Nature Communications, 2018, 9: 3457. DOI:10.1038/s41467-018-05880-4 |
| [10] |
YANG H, CHEN Y, CUI X, et al. A highly stable copper-based catalyst for clarifying the catalytic roles of Cu0 and Cu+ species in methanol dehydrogenation[J]. Angewandte Chemie International Edition, 2018, 130(7): 1854-1858. |
| [11] |
CHEN K, FANG H, WU S, et al. CO2 hydrogenation to methanol over Cu catalysts supported on La-modified SBA-15: The crucial role of Cu-LaOx interfaces[J]. Applied Catalysis B: Environmental, 2019, 251: 119-129. DOI:10.1016/j.apcatb.2019.03.059 |
| [12] |
GAO P, LI F, ZHAN H, et al. Influence of Zr on the performance of Cu/Zn/Al/Zr catalysts via hydrotalcite-like precursors for CO2 hydrogenation to methanol[J]. Journal of Catalysis, 2013, 298: 51-60. DOI:10.1016/j.jcat.2012.10.030 |
| [13] |
ARENA F, BARBERA K, ITALIANO G, et al. Synthesis, characterization and activity pattern of Cu-ZnO/ZrO2 catalysts in the hydrogenation of carbon dioxide to methanol[J]. Journal of Catalysis, 2007, 249(2): 185-194. DOI:10.1016/j.jcat.2007.04.003 |
| [14] |
KIM L, WEI-CHIH L, SHOHEI T, et al. CO2-to-Methanol Hydrogenation on Zirconia-Supported Copper Nanoparticles: Reaction Intermediates and the Role of the Metal-Support Interface[J]. Angewandte Chemie International Edition, 2017, 56(9): 2318-2323. DOI:10.1002/anie.201610166 |
| [15] |
GUO X, MAO D, LU G, et al. The influence of La doping on the catalytic behavior of Cu/ZrO2 for methanol synthesis from CO2 hydrogenation[J]. Journal of Molecular Catalysis A: Chemical, 2011, 345(1/2): 60-68. |
| [16] |
YAO L, SHEN X, PAN Y, et al. Synergy between active sites of Cu-In-Zr-O catalyst in CO2 hydrogenation to methanol[J]. Journal of Catalysis, 2019, 372: 74-85. DOI:10.1016/j.jcat.2019.02.021 |
| [17] |
GAO P, LI F, ZHAN H, et al. Fluorine-modified Cu/Zn/Al/Zr catalysts via hydrotalcite-like precursors for CO2 hydrogenation to methanol[J]. Catalysis Communications, 2014, 50: 78-82. DOI:10.1016/j.catcom.2014.03.006 |
| [18] |
CHEN S, ZHANG J, SONG F, et al. Induced high selectivity methanol formation during CO2 hydrogenation over a CuBr2- modified CuZnZr catalyst[J]. Journal of Catalysis, 2020, 389: 47-59. DOI:10.1016/j.jcat.2020.05.023 |
| [19] |
李剑, 何思达, 楚爽, 等. 纳米微晶纤维素辅助合成加氢脱芳催化剂[J]. 高校化学工程学报, 2021, 35(4): 675-682. LI J, HE S D, CHU S, et al. Synthesis of hydrodearomatization catalyst using nano-cellulose as the auxiliary template[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(4): 675-682. DOI:10.3969/j.issn.1003-9015.2021.04.012 |




