含钾岩石是一种由[SiO4]4−、[AlO4]5−所组成的具有三维立体网状结构的硅铝酸盐矿物[1],对其进行资源化利用时通常需要活化分解。目前,含钾岩石活化的处理方法有:低温酸解法[2]、焙烧法[3-4]、微生物分解法[5]、碱性水热法[6-7]和亚熔盐活化法[8-9]等。相比于其他方法,亚熔盐通常是由高浓度NaOH或KOH组成的可以提供高化学活性负氧离子的一种电离介质[10],可高效分解难溶性矿物质,避免母液的大量产生,同时具有活化反应温度低、操作简单等优点,被广泛应用于天然矿物的活化分解[11-12]和提取矿物中的高附加值金属元素[13]。以含钾岩石为原料合成分子筛,是含钾岩石资源综合利用较为理想的选择,它可以避免钾硅铝组分分离的难题,同时可以提升产品的价值。目前,以活化后的含钾岩石为原料已经制备了K-ZSM-5分子筛[14]、W分子筛[9]以及A型分子筛[15]等。
羟基钙霞石是一类具有CAN沸石拓扑结构的钙霞石,其骨架由六元环组成的小ε笼和12元环以ABAB方式堆叠组成[16]。骨架外的Na+、K+以及H2O都可以进入钙霞石的孔道中[17]。由于其特殊的结构以及良好的稳定性,钙霞石被广泛应用于Cu2+、Pb2+等重金属离子的吸附[18–19]。以天然矿物为原料合成钙霞石引起人们的广泛关注,以黄土[20]、硅藻土[21]为原料水热反应制备钙霞石时,合成反应时间长,而且需要补加化学试剂作为铝源。以含钾岩石为原料,采用混合亚熔盐法,制备棱柱状的钙霞石同时利用滤液制备W沸石时[22],虽然在较短的反应时间内制备了钙霞石,但也存在碱矿比过大,工艺流程复杂,以及对滤液的综合利用程度不足等问题。上述报道合成的钙霞石形貌为棱柱状和针状且未对合成后的滤液进行充分的利用。
鉴此,对含钾岩石的资源化利用,采用亚熔盐为活化方法,在不补加其他化学试剂的条件下,以活化后的含钾岩石为原料,考察水热反应条件对合成球形羟基钙霞石的影响。探讨球形羟基钙霞石的合成机理,并对合成后的滤液进行充分利用。此外,将合成的羟基钙霞石作为低成本吸附剂用于吸附Cu(Ⅱ)的性能研究。
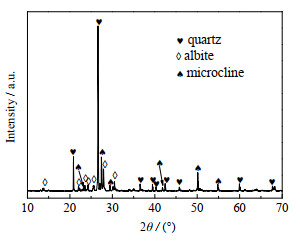
2 实验部分 2.1 原料本实验所用的含钾岩石来自河北省邢台市太行山,粉碎后过孔径为0.075 mm的标准筛备用。X射线衍射仪(XRD)分析表明其主要成分为石英、钾长石和钠长石(图 1),相应的化学组成见表 1。氢氧化钠(NaOH,分析纯),氢氧化钾(KOH,分析纯),硝酸铜(Cu(NO3)2·9H2O,分析纯),以上药品均购自天津市科密欧试剂有限公司。
|
图 1 含钾岩石的XRD图 Fig.1 XRD pattern of potassic rocks |
|
|
表 1 含钾岩石主要的化学组成 Table 1 Chemical compositions of potassic rocks(mass fraction) |
称取22.8 g的NaOH和12.04 g的KOH溶解在8 mL去离子水中,形成质量分数为80% 的碱溶液。按照碱与含钾岩石的质量比2:1,称取16.06 g含钾岩石加入上述碱溶液中,搅拌均匀后移入110 mL反应釜内。将反应釜放入均相反应器中于190 ℃活化3 h,设置转速为30 r·min−1。反应结束后立即用冷水将反应釜冷却至室温,即可得到活化料浆。
将一定量去离子水加入反应釜,与活化料浆混合搅拌均匀后放入烘箱中,在设定温度下静态反应一定时间。反应结束后,将反应釜取出,冷却至室温,分离得到的固相产品经洗涤至中性,于100 ℃干燥12 h。
2.3 Cu(Ⅱ)吸附实验在25 ℃下,用合成的羟基钙霞石吸附溶液中的Cu(Ⅱ)。为防止Cu(Ⅱ)沉淀,将溶液的pH值调至6。在吸附动力学研究中,将100 mg羟基钙霞石加入50 mL质量浓度为100 mg·L−1的Cu(Ⅱ)溶液中(由1 g·L−1的Cu(NO3)2溶液稀释获得),使用磁力搅拌在400 r⋅min−1的转速下搅拌不同时间(0~480 min)后,用直径为0.22 μm的尼龙过滤器进行固液分离,然后使用火焰原子吸收分光光度计(AAS)测定其Cu(Ⅱ)的质量浓度。在等温吸附研究中,Cu(Ⅱ)溶液的初始质量浓度设置为60、100、150、200、250 mg·L−1,吸附时间为360 min,其他实验条件与动力学研究中使用的条件相同。
2.4 表征分析方法采用XRD (德国Bruker D8 Focus Powder)分析产品的物相组成,扫描范围为10°~70°。采用扫描电子显微镜(SEM,美国FEI Nova Nano SEM 45)观察产物的形貌。采用AAS (上海精密科学仪器公司AA320CRT)测定溶液中Cu(Ⅱ)、Na(Ⅰ)和Ca(Ⅱ)的质量浓度。采用化学分析方法测定滤液中SiO2(GB/T4209-2008)和Al2O3(GB/T8574-2010)、K2O(GB/T8574-2010)的物质的量。
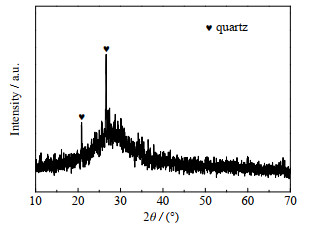
3 结果与讨论 3.1 含钾岩石矿粉活化固相产物分析图 2为含钾岩石活化后固体产物的XRD图。活化产物主要为无定形物质,仅有少量石英的衍射峰,未出现钠长石和钾长石的衍射峰,说明含钾岩石已基本被分解。
|
图 2 活化产物的XRD图 Fig.2 XRD pattern of the activated product |
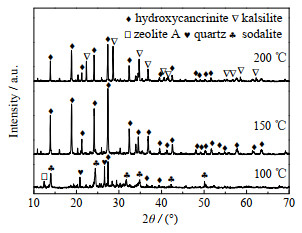
在反应时间为12 h、H2O与K2O物质的量比n(H2O)/n(K2O) = 38.62时,不同温度下合成产物的XRD图和SEM图分别如图 3和4所示。当反应温度为100 ℃时,XRD图和SEM图表明固相产品主要是立方体形状的A型沸石和球形的SOD沸石,并存在少量未分解的石英。当反应温度增加至150 ℃时,归属于石英的衍射峰已消失,产物为大小均匀、尺寸为4~5 μm的球形羟基钙霞石。当反应温度为200 ℃时,产物的XRD图不仅出现了羟基钙霞石的衍射峰还出现了钾霞石的衍射峰,从相应的SEM图中可以观察到球形的羟基钙霞石以及片状六边形的钾霞石。因此,150 ℃为合成羟基钙霞石的适宜条件。
|
图 3 不同温度下合成产品的XRD图 Fig.3 XRD patterns of synthesized products at different temperatures |

|
图 4 不同温度下合成产品的SEM图 Fig.4 SEM images of synthesized products at different temperatures |
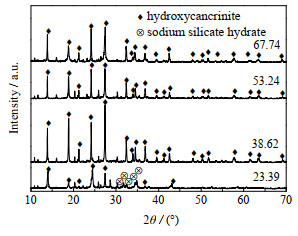
图 5和6分别为反应温度为150 ℃,反应时间为12 h时,不同n(H2O)/n(K2O)合成产物的XRD图和SEM图。当n(H2O)/n(K2O) = 23.39时,羟基钙霞石的特征衍射峰强度较低并且出现了水合硅酸钠的衍射峰,产物形貌为破碎的球状。这是由于合成体系中碱的质量浓度过高,导致体系中的硅铝酸根离子发生溶解且沸石的成核变得困难。当n(H2O)/n(K2O)的比例继续增大至38.62~67.74时,体系碱的质量浓度适当降低,可以得到结晶度和纯度较高的羟基钙霞石,其形貌均为球形(图 6(b)、(c))。随着n(H2O)/n(K2O) 的增大,合成的羟基钙霞石的粒径逐渐减小,由5 μm逐渐缩小至500~800 nm,这可能是由于体系中K+的质量浓度逐渐降低所致。凝胶中K+将导致成核和结晶的时间延长,缓慢的结晶速率有助于减少成核数目,增加晶体颗粒的生长[23-24],因此,当合成体系中K+浓度增加时会导致晶体的粒径增大。n(H2O)/n(K2O)增大将会减小溶液中K+的质量浓度,从而使合成羟基钙霞石的粒径减小。
|
图 5 不同n(H2O)/n(K2O)合成产品的XRD图 Fig.5 XRD patterns of synthesized products at different n(H2O)/n(K2O) ratios |

|
图 6 不同n(H2O)/n(K2O)合成产品的SEM图 Fig.6 SEM images of synthesized products at different n(H2O)/n(K2O) ratios |
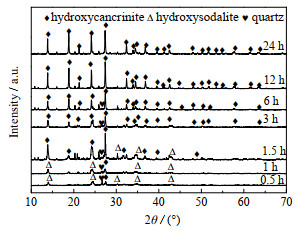
在反应温度为150 ℃,n(H2O)/n(K2O) = 38.62条件下,不同反应时间合成固相产品的XRD结果如图 7所示。图 8为含钾岩石原料、含钾岩石活化分解后的产物和水热反应不同时间合成固体产物的SEM图。含钾岩石原料是粒径约为100 μm的块状物体(图 8(a)),经过亚熔盐活化处理后,含钾岩石原料转化为小尺寸的块状石英和部分无定形物质(图 8(b))。当反应时间为0.5 h时,XRD图表明产物主要为羟基方钠石以及少量石英;其形貌为不规则球形且其表面被少量无定形物质包裹(图 8(c))。当反应时间为1 h时,羟基方钠石在XRD图中的衍射峰强度增加;其晶体形貌逐步生长为规则的球体(图 8(d))。当反应时间延长至1.5 h时,XRD图表明有部分羟基方钠石转变为羟基钙霞石;产物的形貌为胡桃形的羟基方钠石和羟基钙霞石的结合体(图 8(e))。当反应时间大于3 h,XRD图表明所得产物的衍射峰几乎全部属于羟基钙霞石。在高硅铝比的条件下,低稳定性的方钠石倾向于转化为高稳定性的钙霞石[25]。随着时间的延长,羟基钙霞石在XRD图中的衍射峰强度逐渐增加;其晶体形貌由表面有较多缺陷的球体(图 8(f))逐渐生长为完整的球体。当反应时间为12 h时,得到大小均匀的球体;且随时间延长,羟基钙霞石的形貌以及衍射峰强度几乎不变,这表明羟基钙霞石在12 h内已完成晶化。
|
图 7 不同反应时间合成产品的XRD图 Fig.7 XRD patterns of synthesized products at different reaction times |

|
图 8 不同反应时间合成产品的SEM照片 Fig.8 SEM images of synthesized products at different reaction times |
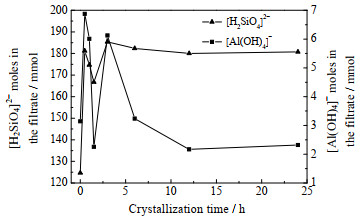
图 9为不同反应时间下滤液中硅铝物质的量的变化规律图。结合不同反应时间下产物的XRD(图 7)和SEM(图 8)结果,对羟基钙霞石的形成机制进行如下推测。在0~0.5 h时,由于OH−的羟基化作用,活化含钾岩石中的无定形硅铝酸盐发生溶解,导致溶液中[H2SiO4]2−和[Al(OH)4]−开始时增多。在0.5~1.5 h时,溶液中硅铝酸根离子反应生成羟基方钠石。随着时间的延长,亚稳态的羟基方钠石不断溶解,使溶液中[H2SiO4]2−和[Al(OH)4]−的物质的量逐渐增大。另外,未活化的石英开始溶解,导致溶液中[H2SiO4]2−的物质的量进一步增加,在溶液中较高[H2SiO4]2−物质的量的作用下,亚稳态的羟基方钠石转化为更加稳定的羟基钙霞石。在3~12 h时,羟基钙霞石处于晶体生长阶段,不断消耗溶液中的[H2SiO4]2−和[Al(OH)4]−,使其物质的量降低;当反应时间为12~24 h,晶体生长基本结束,溶液中的[H2SiO4]2−和[Al(OH)4]−不再向晶体转变,其物质的量趋于稳定。
|
图 9 不同反应时间下滤液中硅铝离子物质的量 Fig.9 Content of silicon and aluminum ions in the filtrate at different reaction times |
上述结果表明,羟基方钠石到羟基钙霞石的转变是一个溶解重结晶的过程,与文献报道的结果一致[26]。然而,钙霞石的形成过程通常由球形的方钠石转变为棱柱状的钙霞石[27-28]。本实验中,转变过程是由球形的羟基方钠石向球形的羟基钙霞石转变,与上述转化途径有所不同。溶液中的K+是形成球形羟基钙霞石的关键。相比于Na+,K+通过更强的盐析作用使液相中可溶的硅酸铝物质脱水形成不溶性的水凝胶,并阻止体系在液相中成核[29]。这种作用将促使球形羟基方钠石在不溶性的水凝胶中发生原位重排生成球形的羟基钙霞石[30-31]。
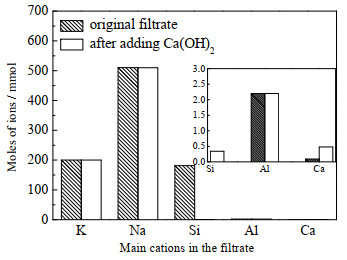
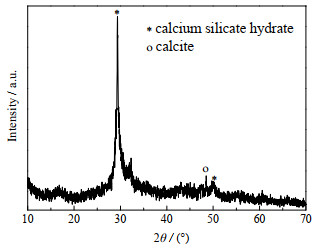
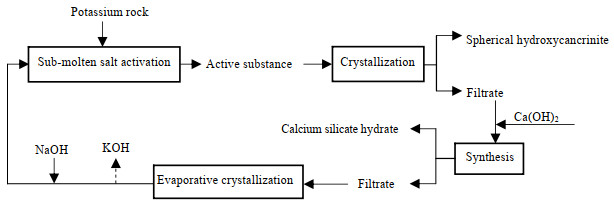
3.2.5 水合硅酸钙的制备以及母液循环合成羟基钙霞石后的滤液中含有大量溶解的硅、钾、钠离子及少量的铝离子,其组成如图 10所示。为充分利用母液中的资源,向其中加入Ca(OH)2,将滤液中的硅转化为具有高附加值的水合硅酸钙沉淀。室温条件下,Si4+与Ca2+按照物质的量比n(Si4+)/n(Ca2+) = 1:1向母液中加入Ca(OH)2。图 11为所得产物的XRD图,其结果表明所得产物为水合硅酸钙,并伴有少量方解石。分离水合硅酸钙后,测得硅离子的去除率高达99.81 %,而其他离子的含量几乎不变(图 10)。此时,滤液含有大量的钾离子(200 mmol)和钠离子(510 mmol),且滤液碱度较高。将滤液蒸发浓缩后,按照2.2节中NaOH和KOH的比例,补加一定量的NaOH并调整滤液中NaOH和KOH的质量分数为80%,按照2.2节的步骤继续用于含钾岩石的活化以及球形羟基钙霞石的合成。但多次循环后会导致滤液中钾离子含量增多,依据文献[32]报道的NaOH和KOH的相图,将一部分KOH从体系中分离出去,调整体系组成继续用于含钾岩石的活化以及球形羟基钙霞石的合成。因此,设计含钾岩石综合利用的母液循环工艺流程图,如图 12所示。按照循环工艺合成的产品XRD图如图 13所示,结果表明所合成的产品为纯度较高的羟基钙霞石。
|
图 10 反应前后滤液中主要阳离子含量 Fig.10 Main cation content in the filtrate before and after reaction |
|
图 11 向滤液添加Ca(OH)2后所得产物的XRD图 Fig.11 XRD pattern of the product obtained by adding Ca(OH)2 to the filtrate |
|
图 12 含钾岩石制备羟基钙霞石和水合硅酸钙的工艺流程 Fig.12 Synthesis flow sheet of hydroxycancrinite and calcium silicate hydrate from the potassic rocks |
|
图 13 母液循环后所得产物的XRD图 Fig.13 XRD pattern of the product obtained after mother liquor recycling |
依据式(1)计算羟基钙霞石在吸附时间为t时对Cu(Ⅱ)的吸附量qt (mg⋅g−1):
| $ {q_t} = \frac{{({\rho _0} - {\rho _t})V}}{m} $ | (1) |
式中:ρ0和ρt分别为初始溶液和吸附时间t时溶液中的Cu(Ⅱ)的质量浓度,mg·L−1;V是溶液的体积,L;m为羟基钙霞石的质量,g。
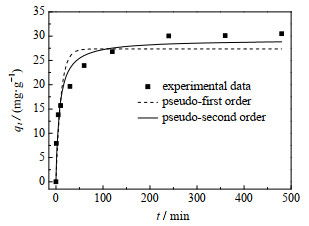
3.3.1 吸附动力学羟基钙霞石对Cu(Ⅱ)的吸附动力学曲线如图 14所示,分别采用伪一阶方程式(2)、伪二阶方程式(3)[33‒34]对吸附动力学进行拟合,拟合曲线见图 14,相应的拟合参数如表 2所示,表中R2为相关系数。
|
图 14 吸附动力学及相应伪一阶和伪二阶模型拟合曲线 Fig.14 Adsorption kinetics and corresponding pseudo-first-order and pseudo-second-order models fitting curves |
|
|
表 2 羟基钙霞石对Cu(Ⅱ)吸附的动力学模型参数 Table 2 Kinetic model parameters of Cu(Ⅱ) adsorption by hydroxycancrinite |
| $ {q_t} = {q_\mathrm{e} }\left( {1 - {\mathrm{e}^{ - {k_1}t}}} \right) $ | (2) |
| $ {q_t} = \frac{{{q_\mathrm{e} }^2{k_2}t}}{{\left( {1 + {k_2}{q_\mathrm{e} }t} \right)}} $ | (3) |
式中:qe为吸附达到平衡时羟基钙霞石对Cu(Ⅱ)的吸附量,mg⋅g−1;k1为伪一级动力学方程的速率常数,min−1;k2为伪二级动力学方程的速率常数,g⋅mg−1⋅min−1。
通过比较2个动力学方程拟合的相关系数可以得出,相比于伪一阶模型,伪二阶模型对羟基钙霞石吸附Cu(Ⅱ)的动力学拟合效果更好。
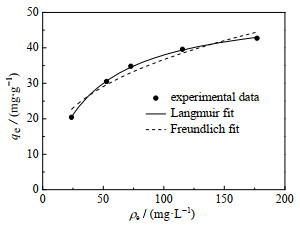
3.3.2 吸附等温线羟基钙霞石对Cu(Ⅱ)的吸附等温数据见图 15,分别采用Langmuir方程(4)和Freundlich方程(5)[35]对吸附等温数据进行拟合,拟合曲线见图 15,相应的拟合参数见表 3。
|
图 15 吸附等温线及相应的Freundlich和Langmuir模型拟合曲线 Fig.15 Adsorption isotherm curve and Freundlich and Langmuir models fitting curves |
|
|
表 3 羟基钙霞石对Cu(Ⅱ)等温吸附模型参数 Table 3 Isothermal adsorption model parameters of Cu(Ⅱ) adsorption on hydroxycancrinite |
| $ {q_\mathrm{e} } = \frac{{{q_\mathrm{m}}{K_\mathrm{L}}{\rho _\mathrm{e} }}}{{1 + {K_\mathrm{L}}{\rho _\mathrm{e} }}} $ | (4) |
| $ {q_\mathrm{e} } = {K_\mathrm{F}}{\rho _\mathrm{e} }^{\frac{1}{{{n_\mathrm{F}}}}} $ | (5) |
式中:ρe为平衡时的溶液质量浓度,mg⋅L−1;qm为最大吸附量,mg⋅g−1;KL是与吸附自由能有关的常数,mg⋅L−1,KF为吸附容量,L⋅mg−1;nF为吸附强度。
与Freundlich模型相比,Langmuir模型具有更高的相关系数(R2=0.999 1),说明Langmuir模型能更好地描述羟基钙霞石对Cu(Ⅱ)的等温吸附过程。Langmuir模型是基于单层覆盖在具有相似亲和力且分布均匀的相同活性位点上的假设,因此羟基钙霞石对Cu(Ⅱ)的吸附属于单分子层的吸附。根据Langmuir模型拟合的结果可知,羟基钙霞石对Cu(Ⅱ)的最大吸附量为51.76 mg⋅g−1。与以矿物和固体废弃物合成的吸附剂相比(表 4),羟基钙霞石表现出较高的Cu(Ⅱ)吸附量,具有大规模应用的潜力。
|
|
表 4 羟基钙霞石与其他吸附剂对Cu(Ⅱ)的吸附性能的比较 Table 4 Comparison of Cu(Ⅱ) adsorption performance between hydroxycancrinite and other adsorbents |
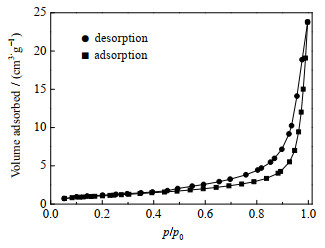
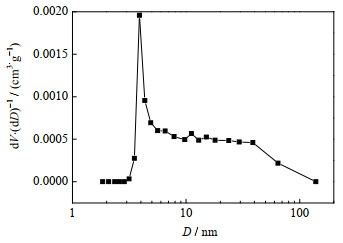
由图 16可知,羟基钙霞石的N2吸附-脱附等温线表现出属于Ⅴ型等温线的特征,并且在相对压力p/p0=0.45处存在一个明显的滞后环,这表明羟基钙霞石存在介孔结构,孔径D分布曲线(图 17)也证明了所合成的羟基钙霞石的孔道主要为介孔和大孔,这可归因于球形羟基钙霞石颗粒中存在的晶间空隙,其比表面积和孔体积分别为6.684 8 cm2⋅g−1和0.034 8 cm3⋅g−1。
|
图 16 羟基钙霞石的N2吸附-脱附等线 Fig.16 N2 adsorption-desorption isotherms of hydroxycancrinite |
|
图 17 羟基钙霞石的孔径分布曲线 Fig.17 Pore size distribution curve of hydroxycancrinite |
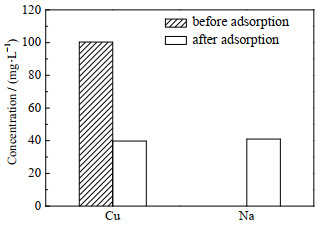
为探究对Cu(Ⅱ)的吸附机理,测定了吸附前后溶液中离子含量的变化。通过图 18可以看出,吸附后溶液中的Cu(Ⅱ)质量浓度降低,而Na(Ⅰ) 质量浓度却大幅度增加。吸附时,Cu(Ⅱ)可进入羟基钙霞石的孔道并与孔道中Na(Ⅰ)发生了离子交换,导致溶液中Na(Ⅰ) 质量浓度的增加。因此,羟基钙霞石主要利用离子交换完成对Cu(Ⅱ)的吸附。
|
图 18 吸附前后溶液中Cu(Ⅱ)和Na(Ι)质量浓度的变化 Fig.18 Changes of Cu(Ⅱ) and Na(Ι) contents in solution before and after adsorption |
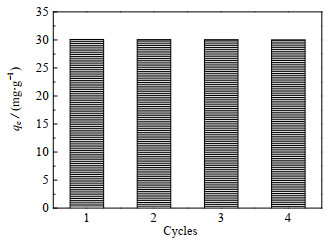
吸附剂的重复使用性能是其实际应用的关键。将吸附后的羟基钙霞石于25 ℃、25 mL、0.1 mol⋅L−1的乙二胺四乙酸二钠溶液进行解吸。吸附剂的循环吸附能力如图 19所示,羟基钙霞石经过4次循环吸附之后,其对Cu(Ⅱ)的吸附能力仍然为29.8 0 mg⋅g−1。相比于初次吸附的30.1 0 mg⋅g−1,吸附能力几乎没有减弱,表现出良好的再生能力。
|
图 19 羟基钙霞石的循环吸附能力 Fig.19 Cyclic adsorption capacity of hydroxycancrinite |
(1) 针对含钾岩石的资源化利用,以亚熔盐活化后的含钾岩石为原料,通过水热反应成功制备了球形羟基钙霞石,确定了水热反应的适宜条件为反应温度为150 ℃,n(H2O)/n(K2O)=38.62,反应时间为12 h,合成的羟基钙霞石呈现出大小均一、粒径为4~5 μm的球形形貌。
(2) 羟基钙霞石的形成经历了无定形硅铝酸盐的溶解,球形羟基方钠石形成,最终在K+的盐析作用下转化为球形的羟基钙霞石。
(3) 合成后的滤液制备水合硅酸钙后,经蒸发浓缩可再次用于钾长石的活化。
(4) 合成的羟基钙霞石表现出优异的Cu(Ⅱ)吸附性能。25 ℃下,羟基钙霞石对Cu(Ⅱ)最大吸附量为51.76 mg⋅g−1,吸附过程符合伪二阶动力学模型和Langmuir等温吸附模型,且具有良好的稳定性。
| [1] |
LIU S K, HAN C, LIU J M, et al. Hydrothermal decomposition of potassium feldspar under alkaline conditions[J]. RSC Advances, 2015, 5(113): 93301-93309. DOI:10.1039/C5RA17212H |
| [2] |
LIU C C, LIU S C, QIN Y H, et al. The intensified leaching behavior of potassium from phosphorus-potassium associated ore in HCl-CaF2 system with surfactant: Part I kinetics and modelling[J]. Separation and Purification Technology, 2019, 212: 89-100. DOI:10.1016/j.seppur.2018.11.025 |
| [3] |
TANNVAR H, DHAWAN N. Recovery of potash values from feldspar[J]. Separation Science and Technology, 2020, 55(7): 1398-1406. DOI:10.1080/01496395.2019.1588317 |
| [4] |
HASELI P, MAJEWAKI P, CHRISTO F C, et al. Thermochemical and experimental kinetic analysis of potassium extraction from ultrapotassic syenite using molten chloride salts[J]. Industrial & Engineering Chemistry Research, 2019, 58(17): 7397-7407. |
| [5] |
BACHANI P, BHATTACHARYA S, JAIN D, et al. Bioprospecting of halotolerant bacterial isolates for potassium recovery from K-feldspar[J]. Chemical Engineering & Technology, 2016, 39(9): 1645-1652. |
| [6] |
LIU C J, MA H W, GAO Y. Hydrothermal processing on potassic syenite powder: Zeolite synthesis and potassium release kinetics[J]. Advanced Powder Technology, 2019, 30(11): 2483-2491. DOI:10.1016/j.apt.2019.07.024 |
| [7] |
SU S Q, MA H W, CHUAN X Y. Hydrothermal decomposition of K-feldspar in KOH-NaOH-H2O medium[J]. Hydrometallurgy, 2015, 156: 47-52. DOI:10.1016/j.hydromet.2015.05.014 |
| [8] |
MIAO Q Y, ZHAO B, LIU S J, et al. Decomposition of the potassic rocks by sub-molten salt method and synthesis of low silica X zeolite[J]. Asia Pacific Journal of Chemical Engineering, 2016, 11(4): 558-566. DOI:10.1002/apj.1980 |
| [9] |
刘洋, 张恕, 李雲, 等. KOH-KF亚熔盐法活化含钾岩石制备W沸石[J]. 高校化学工程学报, 2022, 36(1): 85-91. LIU Y, ZHANG S, LI Y, et al. Synthesis of zeolite W from potassic ores activated by KOH-KF sub-molten salt[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 85-91. |
| [10] |
MENG Y R, ZHAO B, ZHANG H Q, et al. Synthesis of zeolite W from potassic rocks activated by KOH sub-molten salt method[J]. Crystal Research and Technology, 2018, 53(6): 1700216. DOI:10.1002/crat.201700216 |
| [11] |
LI T S, LIU H Y, FAN Y, et al. Synthesis of zeolite Y from natural aluminosilicate minerals for fluid catalytic cracking application[J]. Green Chemistry, 2012, 14(12): 3255-3259. DOI:10.1039/c2gc36101a |
| [12] |
YUE Y Y, KANG Y, BAI Y, et al. Seed-assisted, template-free synthesis of ZSM-5 zeolite from natural aluminosilicate minerals[J]. Applied Clay Science, 2018, 158: 177-185. DOI:10.1016/j.clay.2018.03.025 |
| [13] |
LI S C, KANG C S, KIM S C, et al. The extraction of Ta, Nb and rare earths from fergusonite by using KOH sub-molten salt leaching[J]. Hydrometallurgy, 2021, 201: 105358. DOI:10.1016/j.hydromet.2020.105358 |
| [14] |
王静洁, 赵斌, 李琳, 等. 钾长石水热合成K-ZSM-5分子筛[J]. 硅酸盐学报, 2014, 42(3): 340-348. WANG J J, ZHAO B, LI L, et al. Hydrothermal synthesis of K-ZSM-5 molecular sieve from potassium feldspar[J]. Journal of the Chinese Ceramic Society, 2014, 42(3): 340-348. |
| [15] |
SU S Q, MA H W, CHUAN X Y. Hydrothermal synthesis of zeolite A from K-feldspar and its crystallization mechanism[J]. Advanced Powder Technology, 2016, 27(1): 139-144. DOI:10.1016/j.apt.2015.11.011 |
| [16] |
SEO S M, KIM D, KIM D, et al. A simple synthesis of nitrate cancrinite from natural bentonite[J]. Journal of Porous Materials, 2018, 25(6): 1561-1565. DOI:10.1007/s10934-018-0569-4 |
| [17] |
SELIM A Q, MOHAMED E A, SELIEM M K, et al. Synthesis of sole cancrinite phase from raw muscovite: Characterization and optimization[J]. Journal of Alloys and Compounds, 2018, 762: 653-667. DOI:10.1016/j.jallcom.2018.05.195 |
| [18] |
WERNERT V, SCHAEF O, ALOUI L, et al. Cancrinite synthesis from natural kaolinite by high pressure hydrothermal method: Application to the removal of Cd2+ and Pb2+ from water[J]. Microporous and Mesoporous Materials, 2020, 301: 110209. DOI:10.1016/j.micromeso.2020.110209 |
| [19] |
QIU W, ZHENG Y. Removal of lead, copper, nickel, cobalt, and zinc from water by a cancrinite-type zeolite synthesized from fly ash[J]. Chemical Engineering Journal, 2009, 145(3): 483-488. DOI:10.1016/j.cej.2008.05.001 |
| [20] |
ZHENG R J, FENG X Z, ZOU W S, et al. Converting loess into zeolite for heavy metal polluted soil remediation based on "soil for soil-remediation" strategy[J]. Journal of Hazardous Materials, 2021, 412: 125199. DOI:10.1016/j.jhazmat.2021.125199 |
| [21] |
DANG T H, NGUYEN X H, CHOU C L, et al. Preparation of cancrinite-type zeolite from diatomaceous earth as transesterification catalysts for biodiesel production[J]. Renewable Energy, 2021, 174: 347-358. DOI:10.1016/j.renene.2021.04.068 |
| [22] |
陈华丹, 郭菊花, 戴勇, 等. 混合亚熔盐法分解钾长石制备钙霞石和W分子筛[J]. 人工晶体学报, 2015, 44(11): 3158-3165. CHEN H D, GUO J H, DAI Y, et al. Synthesis of cancrinite and zeolite W from K-feldspar by mixed sub-molten salt method[J]. Journal of Synthetic Crystals, 2015, 44(11): 3158-3165. DOI:10.16553/j.cnki.issn1000-985x.2015.11.041 |
| [23] |
HE S S, WANG Y X, YANG C, et al. Potassium cation induced controllable synthesis of CAN zeolite hollow microspheres[J]. Microporous and Mesoporous Materials, 2016, 225: 365-370. DOI:10.1016/j.micromeso.2016.01.022 |
| [24] |
YILMAZ B, WARZYWODA J, SACCO A. Synthesis of large ETS-4 crystals in the Na and Na/K systems: The effects of alkali metal ion and synthesis mixture alkalinity[J]. Journal of Crystal Growth, 2004, 271(1/2): 325-331. |
| [25] |
GUO R Y, YAO W G, MA H W, et al. Two-step hydrothermal synthesis of nano-kaolinite from fly ash: Thermodynamics and mechanism[J]. Journal of Cleaner Production, 2020, 271: 122567. DOI:10.1016/j.jclepro.2020.122567 |
| [26] |
BARNES M C, ADDAI-MENSAH J, GERSON A R, et al. In the solubility of sodalite and cancrinite in synthetic spent liquor and the mechanism and kinetics of the Sodalite to Cancrinite phase transformation: 128th TMS Annual Meeting [C]. San Diego: Light Metals, 1999.
|
| [27] |
ZHANG P, LI S Q, ZHANG C Q. Solvent-free synthesis of nano-cancrinite from rice husk ash[J]. Biomass Conversion and Biorefinery, 2019, 9(3): 641-649. DOI:10.1007/s13399-019-00375-8 |
| [28] |
LIN D C, XU X W, ZUO F, et al. Crystallization of JBW, CAN, SOD and ABW type zeolite from transformation of meta-kaolin[J]. Microporous and Mesoporous Materials, 2004, 70(1/2/3): 63-70. |
| [29] |
IWAMA M, SUZUKI Y, PLEVERT J, et al. Location of alkali ions and their relevance to crystallization of low silica X zeolite[J]. Crystal Growth & Design, 2010, 10(8): 3471-3479. |
| [30] |
YANG K, LI Y, GUO H F, et al. Rapid synthesis of zeolite P from potassic rocks by gel-like-solid phase method[J]. Asia Pacific Journal of Chemical Engineering, 2021, 16(4): 2641. DOI:10.1002/apj.2641 |
| [31] |
MSAHAL K, HARSH J B, FLURY M, et al. Analysis of precipitates from reactions of hyperalkaline solutions with soluble silica[J]. Applied Geochemistry, 2005, 20(7): 1357-1367. DOI:10.1016/j.apgeochem.2005.01.015 |
| [32] |
CHRISTOV C, MOLLER N. Chemical equilibrium model of solution behavior and solubility in the H-Na-K-OH-Cl-HSO4-SO4-H2O system to high concentration and temperature[J]. Geochimica et Cosmochimica Acta, 2004, 68(6): 1309-1331. DOI:10.1016/j.gca.2003.08.017 |
| [33] |
YAN L G, LI S, YU H Q, et al. Facile solvothermal synthesis of Fe3O4/bentonite for efficient removal of heavy metals from aqueous solution[J]. Powder Technology, 2016, 301: 632-640. DOI:10.1016/j.powtec.2016.06.051 |
| [34] |
LI Y R, BAI P, YAN Y, et al. Removal of Zn2+, Pb2+, Cd2+, and Cu2+ from aqueous solution by synthetic clinoptilolite[J]. Microporous and Mesoporous Materials, 2019, 273: 203-211. DOI:10.1016/j.micromeso.2018.07.010 |
| [35] |
PARK J H, WANG J J, KIM S H, et al. Recycling of rice straw through pyrolysis and its adsorption behaviors for Cu and Zn ions in aqueous solution[J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2017, 533: 330-337. |
| [36] |
JOSEPH I V, TOSHEVA L, DOYLE A M. Simultaneous removal of Cd(Ⅱ), Co(Ⅱ), Cu(Ⅱ), Pb(Ⅱ), and Zn(Ⅱ) ions from aqueous solutions via adsorption on FAU-type zeolites prepared from coal fly ash[J]. Journal of Environmental Chemical Engineering, 2020, 8(4): 103895. DOI:10.1016/j.jece.2020.103895 |




