2. 浙江大学 化学工程与生物工程学院, 浙江 杭州 310058
2. College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310058, China
竹子属禾本科竹亚科,我国竹子资源丰富种类繁多,共有40余属400多种[1];其中毛竹的种植面积约占竹子总面积的三分之一,但其利用率很低[2]。据《本草纲目》记载,竹叶、竹茹、竹根等有着丰富的药食两用价值,为开发中医药、保健品和护肤品提供了重要资源。近年来随着生物技术和现代医学的发展,人们对竹叶的开发利用有了进一步的提高[3]。据研究报道,竹叶中含有丰富的竹叶黄酮、多糖、氨基酸以及多种微量元素[4]。潘进权等[5]研究表明竹叶黄酮作为一种天然的抗氧化剂,对超氧阴离子和羟基自由基有较好的清除能力;王楠等[6]研究表明通过将竹叶黄酮纳米粒子作用于黑色素瘤细胞(B16),能显著抑制细胞内的酪氨酸酶活性,抑制黑色素的生成,且当竹叶黄酮纳米粒子的质量浓度为100 mg·mL−1时,其美白效果优于β-熊果苷。黄赛金等[7]研究表明竹叶多糖能显著降低实验组小白鼠的脂质过氧化,提升超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-px)的活性,表明竹叶多糖具有一定的抗衰老功效。张英等[8]研究表明竹叶中含有丰富的氨基酸资源,如谷氨酸、天冬氨酸等,且其中的特种氨基酸δ-羟基赖氨酸具有比赖氨酸更高的抗氧化活性。综上所述,大量的研究表明竹叶中的活性成分具有抗氧化、抗自由基、抗衰老、美白等生物学功效。在护肤行业中,发酵化妆品已成为天然植物提取化妆品之后的又一大热点,如海蓝之谜、SK-Ⅱ神仙水等,因其具有显著的护肤功效,深受消费者喜爱[9]。植物经过发酵后会产生有显著护肤功效的活性物质,我国拥有丰富的中草药资源,已有不少研究报道通过中草药的微生物发酵得到护肤功效显著的化妆品原料。比如,赵丹等[10]利用葡萄酒酵母发酵灵芝,得到的灵芝发酵液具有抗衰老和美白功效;蔡丙国等[11]研究酵母菌发酵茉莉花得到的发酵液具有显著的美白功效。然而对于竹叶发酵利用的研究较为有限,竹叶发酵产物的护肤功效尚未被充分阐明。
本研究以毛竹竹叶发酵液为研究对象,初步研究了发酵液对角质形成细胞(HaCaT)和黑色素瘤细胞(B16)的影响,为竹叶发酵液在化妆品美白、保湿、抗炎等功效的应用提供一定的实验依据,同时也为提高毛竹的利用率提供参考。
2 实验部分 2.1 实验材料与仪器 2.1.1 实验材料角质形成细胞(HaCaT)、小鼠黑色素瘤细胞(B16),购于上海歌凡生物科技有限公司;酿酒酵母,购于中国工业微生物菌种宝藏管理中心;RPMI-1640培养液(含体积分数为1% 的青-链霉素,体积分数为1% 的胎牛血清)和DMEM高糖培养液(含体积分数为1% 的青-链霉素,体积分数为1% 的胎牛血清),购于浙江森瑞生物科技有限公司;胎牛血清,购于浙江天杭生物科技股份有限公司;细胞计数试剂盒(CCK-8),购于TargetMol;磷酸缓冲盐溶液(PBS),购于北京索莱宝生物科技有限公司;葡萄糖、酵母膏、蛋白胨,购于上海生工;RNA抽提试剂盒(RNAiso Plus Kit)、反转录试剂盒(PrimeScriptTM RT reagent Kit)、荧光定量PCR试剂盒(TB Green qPCR),购于宝日医生物技术有限公司;其他试剂均为分析纯。
2.1.2 实验仪器CO2培养箱HF90,购于力康生物医疗科技控股有限公司;多功能酶标仪Spark,购于瑞士Tecan集团公司;倒置生物显微镜,购于奥林巴斯中国有限公司;离心机L3-5K,购于湖南可成仪器设备有限公司;震荡培养箱,购于上海润度生物科技有限公司;紫外可见分光光度计,购于上海凌析仪器有限公司。
2.2 实验方法 2.2.1 竹叶发酵液的制备方法采摘的毛竹用剪刀剪掉多余部分,保留完整的竹叶。将竹叶用清水清洗2~3遍,晾干后放在烘箱45 ℃下烘干,然后研磨成竹叶粉末。称取1 g竹叶粉末,2 g葡萄糖,加入100 mL蒸馏水,121 ℃高压灭菌15 min,冷却后接种酿酒酵母种子液(菌液浓度为2×108 CFU·mL−1),于28 ℃震荡培养箱,60 r·min−1,发酵72 h,精滤得到竹叶发酵液(FBL)。
2.2.2 竹叶发酵液主要活性物的测量方法 2.2.2.1 竹叶发酵液中黄酮含量的测定取干燥好的芦丁标准样品10.0 mg,用30% 乙醇水溶液(无特殊说明时均为体积分数,下同)稀释至100 mL备用;分别量取上述标准液0、1.0、2.0、4.0、6.0、8.0于25 mL容量瓶中,加入30% 乙醇水溶液适当稀释;向容量瓶中转移1 mL预先配制好的质量分数为5% 的亚硝酸钠水溶液,振荡并放置5 min后,立刻加入1 mL 10% 硝酸铝水溶液,振荡至体系均匀,室温放置5 min;向上述体系中分别滴加10 mL 1.0 mol·L−1氢氧化钠水溶液,摇匀并静置10 min,用30% 的乙醇水溶液定容,放置5 min后测定其在510 nm处的吸光度(OD)值[12],每个样品至少平行测定3次,0 mL溶剂瓶为空白参比。以OD值为横坐标,芦丁浓度为纵坐标,绘制标准曲线。
取适量的FBL,用4 mL的30% 乙醇水溶液稀释溶解并转移至25 mL容量瓶中,加入1 mL的5% 亚硝酸钠水溶液,振荡至体系均匀,室温下静置5 min后滴加质量分数为10% 的硝酸铝溶液至体系变色,摇匀并放置5 min;待体系完全反应后加入1 mol·L−1氢氧化钠水溶液10 mL,振荡至体系完全均一,静置10 min,待络合结束加入30% 的乙醇水溶液定容,静置5 min。取适量的待测液转移至比色皿中,30% 的乙醇水溶液(不含样品)作为空白对照,用紫外可见分光光度计测定其在510 nm处的OD值,每个样品平行测定3次,记录每次OD值,代入标准曲线方程计算样品中总黄酮的浓度。
2.2.2.2 竹叶发酵液中多糖含量的测定精密称取蒽酮试剂100.0 mg,用预先配制好的质量分数为75% 的硫酸水溶液溶解并定容至100 mL,在低温避光条件下保存备用(6 h内用完,配好的溶液呈现黄色,见光会变绿,使试剂变质);配制1 mg·mL−1的葡萄糖标准液,并稀释成0、20、40、60、80、100、120、140、160 μg·mL−1的溶液备用;分别取1 mL上述溶液于10 mL的离心管中,1 mL的蒸馏水作为空白对照,分别于冰浴中加入4 mL现配的蒽酮-硫酸试剂,立刻封口振荡,于100 ℃沸水浴中加热15 min,每个样品重复4次。平行组的4个样品自加入沸水浴到反应结束的间隔时间应控制在15 min,误差控制在8 s以内,反应结束后立即转移至冰水浴中冷却5 min后转移至室温环境,待体系与环境温度一致时用紫外可见分光光度计测定其在620 nm的OD值[13]。以葡萄糖OD值为横坐标,葡萄糖浓度为纵坐标,绘制标准曲线。
取适量的FBL稀释至合适浓度,加入蒽酮-硫酸试剂,待反应结束后按上述标准方法测定并计算多糖含量,最终结果以葡萄糖计。
2.2.2.3 竹叶发酵液中氨基酸含量的测定配制20 mg·mL−1的茚三酮水溶液100 mL,低温避光保存(现配现用);取10 mL的离心管,分别加入0、2、4、6、8、10、12、14、16、18 μg·mL−1不同质量浓度的甘氨酸标准液1 mL,再加入2 mL pH6.0的PBS,摇匀后再加入1 mL的茚三酮标准液,振荡后于100 ℃加热30 min,反应结束先在冰水浴冷却5 min再转移至室温环境,用0 μg·mL−1标准液作为空白对照,用紫外可见分光光度计于568 nm处测定OD值[14]。以甘氨酸OD值为横坐标,其对应的不同质量浓度的甘氨酸标准溶液的值为纵坐标,绘制标准曲线。
取适量的FBL,加入茚三酮水溶液,按上述标准方法测定并计算氨基酸含量,最终结果以甘氨酸计。
2.2.3 细胞培养和分组HaCaT细胞和B16细胞分别用RPMI-1640培养液和DMEM高糖培养液在37 ℃、5% CO2条件下培养,当细胞融合度达到70%~80% 时,采用质量分数为0.25% 的胰酶进行消化,并用血球计数板计数,最后制备一定浓度的细胞悬液接种于细胞培养皿传代。
角质形成细胞实验分为3组:空白对照组、模型组、实验组;其中空白对照组细胞不经过任何处理,模型组细胞采用85 μg·mL−1浓度的十二烷基硫酸钠(SLS)处理4 h,实验组细胞先用一定浓度的FBL处理24 h,吸弃培养基,再用无菌PBS洗2遍,最后用质量浓度为85 μg·mL−1的SLS处理4 h[15]。
2.2.4 HaCaT细胞和B16细胞的活力测定选择适当浓度的FBL,对HaCaT细胞和B16细胞进行CCK-8实验。取对数生长期的HaCaT细胞和B16细胞,密度为3×104~5×104个·mL−1,分别在96孔细胞培养板上铺板,在37 ℃,5% CO2条件下过夜培养。加入10 μL已配好梯度浓度的FBL,作用24 h后,再加入10 μL的CCK-8试剂孵育2~4 h,用酶标仪测定各孔在450 nm下的OD值。细胞活力计算方法如下[16]:
| $ 细胞活力=\frac{实验组{\text{OD}}_{450}-凋零孔{\text{OD}}_{450}}{对照组{\text{OD}}_{450}-凋零孔{\text{OD}}_{450}}\times 100\% $ |
通过氢氧化钠裂解法测定细胞内黑色素的含量[17],取对数生长期的B16细胞,密度为3×104~5×104个·mL−1,在96孔细胞培养板上铺板,在37 ℃,5% CO2条件下过夜培养。加入10 μL已配好梯度浓度的FBL,每组设置5个平行组,作用24 h,吸弃上清液,再用已灭菌的PBS洗涤3次,加入150 μL 1 mol·L−1氢氧化钠溶液(含质量分数为10% 的二甲基亚砜),用移液器吹打混匀,再在80 ℃水浴锅中反应40 min,最后在酶标仪上测定405 nm处OD值。相对黑色素含量计算方法如下:
| $ 相对黑色素含量=\frac{实验组{\text{OD}}_{450}-凋零孔{\text{OD}}_{450}}{对照组{\text{OD}}_{450}-凋零孔{\text{OD}}_{450}}\times 100\% $ |
取对数生长期的细胞,密度为5×104个·mL−1,在6孔细胞培养板上铺板,每孔总体积为2 mL;细胞分为3组,分别是空白对照组、SLS组、FBL组,利用RNAiso提取总RNA,然后采用PrimeScriptTMRT reagent Kit把RNA逆转成互补DNA(cDNA),加入SYBR染料、引物以及cDNA模板后,进行实时荧光定量PCR反应。反应程序为两步法,具体程序如下:预变性95 ℃,30 s;PCR反应95 ℃,5 s,60 ℃,30 s,40次循环。丝聚蛋白(FLG)基因、肿瘤坏死因子-α(TNF-α)基因、白介素-6(IL-6)基因和内参基因甘油醛-3-磷酸脱氢酶(GAPDH)的上游(F)及下游(R)引物序列分别为
FLG-F: TGAAGCCTATGACACCACTGA,
FLG-R: TCCCCTACGCTTTCTTGTCCT;
TNF-α-F: GAGGCCAAGCCCTGGTATG,
TNF-α-R: CGGGCCGATTGATCTCAGC;
IL-6-F: CCTGAACCTTCCAAAGATGGC,
IL-6-R: TTCACCAGGCAAGTCTCCTCA;
GAPDH F: ACCCACTCCTCCACCTTTGA,
GAPDH R: CTGTTGCTGTAGCCAAATTCGT。
2.2.7 竹叶发酵液多次皮肤刺激性试验本实验由浙江方圆检测集团股份有限公司完成并提供报告。实验方法如下:试验前动物在实验动物房环境中至少适应3 d时间。试验前约24 h,将实验动物背部脊柱两侧毛剃除,去毛范围左、右各约3 cm×3 cm,涂抹面积约2.5 cm×2.5 cm。试验时取受试物约0.5 mL涂抹在试验侧皮肤上,另一侧作为对照,每天涂抹1次,连续涂抹14 d。从第2天开始,每次涂抹前剪毛,用水清除残留受试物。1 h后观察结果,对照区和试验区同样处理。按《化妆品安全技术规范(2015年版)》的“第六章4皮肤刺激性/腐蚀性试验”[18],对皮肤刺激反应进行评分,按下列公式计算每只动物平均分,并根据评分皮肤刺激强度分级判定皮肤刺激强度。
| $ 每天每只动物平均积分(刺激指数)=\frac{{{\displaystyle \sum 每只动物{14}_{}\text{ d}的红斑和水肿总积分}}_{450}}{受试动物数\times 14} $ |
实验结果均以标准差
FBL中主要成分是竹叶黄酮 [5]、多糖 [7]和氨基酸[8],测得竹叶黄酮质量浓度为129.77 μg·mL−1、多糖质量浓度为581.74 μg·mL−1、氨基酸质量浓度是32.23 μg·mL−1,并与常规的水-乙醇提取方法相比,如表 1所示:这3种成分的提取率都有明显的提高。
|
|
表 1 发酵对主要成分提取率的影响 Table 1 Effects of fermentation on the extraction rate of essential components |
本研究发现发酵过程有效地提高了多糖、黄酮和氨基酸的提取率,这可能是发酵期间酵母菌对细胞壁的分解,促进细胞内有效成分的溶出,从而提高了竹叶发酵的功能性成分提取率;此外,酵母的增殖可能强化了对发酵底物的转化,如将植物基蛋白质降解为小分子氨基酸。赵丹等[10]的研究中也有提到灵芝发酵液相对灵芝水提液中多糖、多肽、黄酮含量均有提高。使用微生物进行发酵有助于产生更多的活性物质,提高生物活性成分的利用。
3.2 竹叶发酵液的细胞毒性测定HaCaT细胞和B16细胞经过不同质量浓度ρFBL的FBL处理24 h后的增殖率如图 1、2所示。当细胞活力小于80% 时,可说明该样品对细胞存在毒性[19]。从图 1中可以看出FBL对HaCaT细胞具有一定的促进增殖的作用,尤其添加10−1 g·mL−1 FBL时,细胞活力最高,具有统计学意义(p < 0.01)。但是同样的质量浓度下竹叶水提取液对HaCaT细胞的活性具有明显的抑制作用,细胞活力均在80% 以下。原因可能是因为发酵液中的竹叶黄酮在一定浓度下对HaCaT具有良好的生物学作用,对超氧阴离子和羟基自由基有着较好的清除能力[5],从而有促进角质形成细胞的增殖能力;而其他质量浓度的FBL对HaCaT细胞没有显著促进增殖,也没有毒性。因此,FBL对HaCaT细胞有一定的细胞增殖功效,并且在测试的浓度范围内没有细胞毒性,温和性较好,并且温和性高于竹叶水提取液。综上分析初步判断FBL作为一种天然的护肤原料具有一定的安全性。此外,从图 1、2可知在FBL作用下2种细胞的活力均在100% 以上,后续功效实验选择10−3 g·mL−1作为主要的实验浓度。
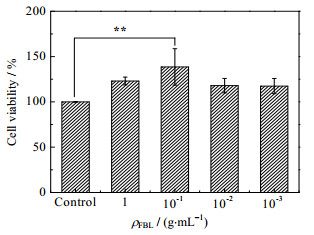
|
图 1 竹叶发酵液对HaCaT细胞增殖的作用 Fig.1 Effects of FBL on cell viability of HaCaT cells |
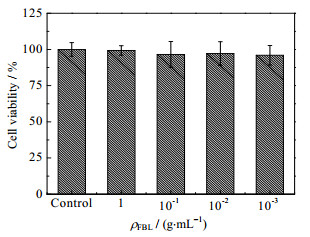
|
图 2 竹叶发酵液对B16细胞增殖的作用 Fig.2 Effects of FBL on cell viability of B16 cells |
小鼠黑色素瘤细胞(B16)与人类黑色素细胞合成黑色素的代谢过程较为相似,因此在体外筛选美白相关的原料时大都会采用此细胞作为模型。熊果苷、抗坏血酸(VC)等是目前化妆品中常用的美白原料,但有研究发现他们在高浓度下对细胞有较大的毒性[20]。当下美白原料的开发不仅要注重美白效果,也要考量对细胞的毒性,即安全性。从图 2可以发现FBL对B16细胞没有细胞毒性,相对温和安全。并且从图 3中可以看出当FBL稀释1 000倍再作用在B16细胞24 h后,细胞中的黑色素含量降低到空白对照组的63.81%,与空白对照组相比差异极显著(p < 0.001)。FBL能显著降低B16细胞中黑色素的含量,原因可能是发酵后的竹叶黄酮含量有明显提升,而竹叶黄酮能显著抑制细胞内的酪氨酸酶活性[6],从而抑制其黑色素的生成。由上可以推测FBL具有一定的美白功能,并且温和安全。
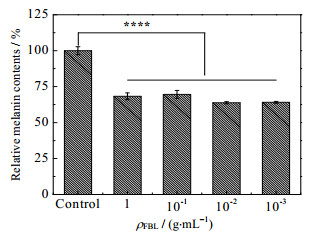
|
图 3 竹叶发酵液对B16黑色素细胞黑色素合成的影响 Fig.3 Effects of FBL on melanin synthesis in B16 melanoma cells |
角质形成细胞位于皮肤的表皮层,在皮肤屏障功能中起着重要作用[21]。SLS是化妆品行业常见的一种表面活性剂,它能破坏皮肤表皮屏障功能,破坏细胞正常生长[22]。因此研究采用SLS作为皮肤表皮屏障破坏的模型对FBL进行了研究。图 4为HaCaT细胞在倒置显微镜下(目镜放大10倍,物镜放大20倍)的形态图;图 4(a)的细胞没有经过任何处理,正常的HaCaT细胞生长方式为贴壁生长,轮廓清晰,形态呈扁平多角形,折光性好[23];图 4(b)的细胞经过85 μg·mL−1浓度的SLS处理4 h,此时贴壁细胞的数量明显比图 4(a)少,且部分细胞的形态变成长条形,轮廓模糊,细胞内外可见较多的颗粒物;图 4(c)的细胞先用一定浓度的FBL处理24 h后,吸弃样品再用无菌PBS洗两遍,最后再用85 μg·mL−1浓度的SLS处理4 h,此时HaCaT细胞不管是数量还是形态上均与图 4(a)差异不大。以上结果表明FBL可以有效增强皮肤屏障功能。
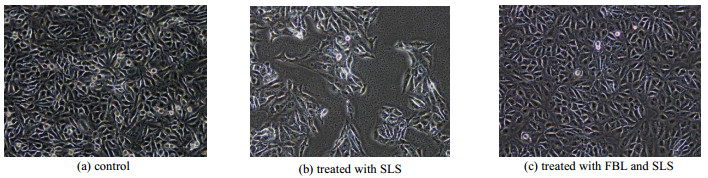
|
图 4 竹叶发酵液对角质形成细胞形态的影响 Fig.4 Effects of FBL on HaCaT cells morphology |
丝聚蛋白(FLG)是角质形成细胞分化蛋白中的一种,主要在颗粒层和透明层中表达。Batista等[24]研究表明特应性皮炎患者中丝聚蛋白的表达明显比正常人低;Park等[25]发现丝聚蛋白表达水平下降,会导致皮肤屏障功能异常。从图 5中可以看出SLS模型组的丝聚蛋白的信使RNA(mRNA)表达水平显著低于空白对照组(p < 0.01),而FBL组的丝聚蛋白的mRNA表达水平显著高于SLS模型组(p < 0.001),这一结果与倒置显微镜下观察到的细胞形态的结果一致,综上分析推测FBL可以通过增加丝聚蛋白的表达,来强化皮肤屏障的功能。
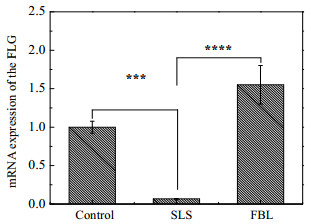
|
图 5 竹叶发酵液对角质形成细胞中丝聚蛋白基因表达的影响 Fig.5 Effects of FBL on filaggrin gene expression of HaCaT cells |
SLS是化妆品中常见的一种表面活性剂,它能破坏皮肤表皮的屏障功能,且能通过TNF-α信号通路引发皮肤炎症,最终使促炎因子白介素-6(IL-6)表达增加[22]。本实验通过一定浓度的SLS制造炎症模型,从图 6中可以看出SLS模型组的TNF-α和IL-6的mRNA表达水平显著高于空白对照组(p < 0.001,p < 0.01),这一结果与Bernhofer等[26]的研究结论一致,而FBL组的TNF-α和IL-6的mRNA表达水平显著低于SLS模型组(p < 0.001,p < 0.01)。以上结果表明,FBL能抑制细胞中TNF-α和IL-6的基因表达,减轻角质形成细胞的炎症反应,保护由SLS造成损伤的细胞。因此,FBL作为一种化妆品原料具有抗炎的功效。
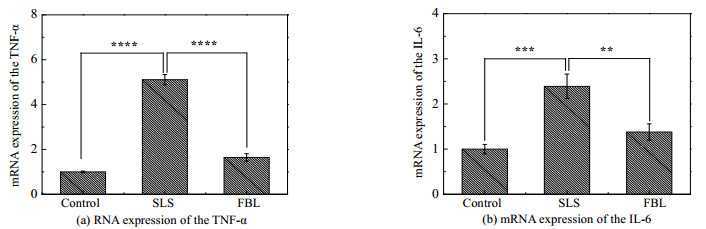
|
图 6 竹叶发酵液对角质形成细胞中炎症因子基因表达的影响 Fig.6 Effects of FBL on inflammatory factor genes expression of HaCaT cells |
根据《化妆品安全技术规范(2015年版)》[18]对FBL样品进行安全性毒理检验,结果见表 2。在本试验条件下,受试物对家兔多次皮肤刺激性试验结果为无刺激性。
|
|
表 2 受试物对家兔多次皮肤刺激性试验结果 Table 2 Results of repeated rabbit skin irritation tests of FBL |
竹叶发酵液作用于HaCaT细胞和B16细胞都没有毒性,2种细胞均表现出较高的活力,并且对家兔多次皮肤刺激试验无刺激性,说明FBL具有良好的生物安全性。通过测定黑色素含量发现,FBL能明显抑制B16细胞中黑色素的生成,说明FBL具有一定的美白功效。通过一定浓度的SLS构建角质形成细胞损伤模型,发现加入FBL的实验组细胞形态明显好于对照组,且丝聚蛋白的基因表达水平也显著高于对照组,炎症因子TNF-α和IL-6的基因表达水平也显著低于对照组,说明FBL有一定的增强皮肤屏障和抗炎的功效。
| [1] |
梁泰然. 中国竹林类型与地理分布特征[J]. 竹子研究汇刊, 1990(4): 1-16. LIANG T R. Types and geographical flora characteristics of bamboo forest in china[J]. Journal of Bamboo Research, 1990(4): 1-16. |
| [2] |
李延军, 许斌, 张齐生, 等. 我国竹材加工产业现状与对策分析[J]. 林业工程学报, 2016, 1(1): 2-7. LI Y J, XU B, ZHANG Q S, et al. Present situation and the countermeasure analysis of bamboo timber processing industry in China[J]. Journal of Forestry Engineering, 2016, 1(1): 2-7. |
| [3] |
YU Y, ZHAN M L, GUANG T C, et al. Bamboo leaf flavonoids extracts alleviate oxidative stress in HepG2 cells via naturally modulating reactive oxygen species production and Nrf2-mediated antioxidant defense responses[J]. Journal of Food Science, 2019, 84(6): 1609-1620. DOI:10.1111/1750-3841.14609 |
| [4] |
DAN Y Z, CAI Y W, YING S Z, et al. Insight into solvent effects on phenolic content and antioxidant activity of bamboo leaves extracts by HPLC analysis[J]. Journal of Food Measurement and Characterization, 2018, 12(3): 2240-2246. DOI:10.1007/s11694-018-9840-2 |
| [5] |
潘进权, 张世英, 何敏婷, 等. 竹叶总黄酮提取工艺及抗氧化特性的研究[J]. 中国食品学报, 2012, 12(3): 39-44. PAN J Q, ZHANG S Y, HE M T, et al. Extracting process and antioxidation character of flavonoids from bamboo leaves[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(3): 39-44. |
| [6] |
王楠, 唐伟敏, 楚秉泉, 等. 基于B16黑素瘤细胞评价体系的竹叶黄酮纳米粒子美白功效[J]. 精细化工, 2016, 33(12): 1375-1380. WANG N, TANG W M, CHU B Q, et al. Whitening efficacy of bamboo leaf flavonoids nanoparticles based on b16 melanoma cell evaluation system[J]. Fine Chemicals, 2016, 33(12): 1375-1380. |
| [7] |
黄赛金, 尹爱武, 龚灯, 等. 淡竹叶多糖的抗衰老作用研究[J]. 现代食品科技, 2015, 31(11): 51-55. HUANG S J, YIN A W, GONG D, et al. Anti-aging effects of polysaccharides from lophatherum gracile brongn[J]. Modern Food Science and Technology, 2015, 31(11): 51-55. |
| [8] |
张英, 丁霄霖, 王树英. 竹叶特种氨基酸的存在及其生物学意义[J]. 无锡轻工大学学报, 1997(1): 31-34. ZHANG Y, DING X L, WANG S Y. Existence of in specific amino acid bamboo leaves and its biological significance[J]. Journal of Wuxi University of Light Industry, 1997(1): 31-34. |
| [9] |
龚述辉. 中国微生态护肤品现状和前景分析[J]. 日用化学品科学, 2020, 43(9): 1-4. GONG S H. Analysis on the current situation and prospects of China's micro ecological skin care products[J]. Science of Daily Chemicals, 2020, 43(9): 1-4. |
| [10] |
赵丹, 许丹妮, 王冬冬, 等. 灵芝发酵液的成分检测及美白与抗衰老功效评价[J]. 日用化学工业, 2016, 46(4): 226-230, 242. ZHAO D, XU D N, WANG D D, et al. Analysis of fermentation liquor of Ganoderma lucidum and evaluation of its whitening and anti - senility efficacy[J]. China Surfactant Detergent & Cosmetics, 2016, 46(4): 226-230, 242. |
| [11] |
蔡丙国, 傅国华, 刘少勇. 酵母菌发酵复方组合物及其在美白保湿护肤品中的应用: CN105434323A [P]. 2016-03-30. CAI B G, FU G H, LIU S Y. Yeast fermented compound composition and its application in whitening and moisturizing skin care products: CN105434323A [P]. 2016-03-30. |
| [12] |
赵振, 刘霞, 黄昭, 等. 苎麻籽总黄酮含量测定方法比较研究[J]. 食品安全质量检测学报, 2019, 10(18): 6195-6200. ZHAO Z, LIU X, HUANG Z, et al. Comparative study on determination method of total flavonoids content in ramie seeds[J]. Journal of Food Safety and Quality, 2019, 10(18): 6195-6200. |
| [13] |
叶建中, 陈文英, 王成章, 等. 高品质竹叶多糖的筛选及含量测定方法的研究[J]. 现代化工, 2008(2): 268-270. YE J Z, CHEN W Y, WANG C Z, et al. Screening of polysaccharide and study on their analysis for high-quality bamboo leaves[J]. Modern Chemical Industry, 2008(2): 268-270. |
| [14] |
黄松, 吴月娜, 刘梅, 等. 茚三酮比色法测定青天葵中总游离氨基酸的含量[J]. 中国中医药信息杂志, 2010, 17(12): 50-52. HUANG S, WU Y N, LIU M, et al. Quantitative determination of total free-amino acid in nervilia fordii (hance) schltr. by ninhydrin colorimetric method[J]. Chinese Journal of Information on TCM, 2010, 17(12): 50-52. |
| [15] |
赵丹, 苏宁, 张佳婵, 等. 十二烷基硫酸钠对角质细胞基因表达的影响及作用通路研究[J]. 日用化学工业, 2016, 46(6): 334-338. ZHAO D, SU N, ZHANG J C, et al. Study with respect to effect of sodium dodecyl sulfate on gene expression of keratinocytes and its signaling pathway[J]. China Surfactant Detergent & Cosmetics, 2016, 46(6): 334-338. |
| [16] |
LI M, LIN X F, LU J, et al. Hesperidin ameliorates UV radiation-induced skin damage by abrogation of oxidative stress and inflammatory in HaCaT cells[J]. Journal of Photochemistry & Photobiology, B: Biology, 2016, 165: 240-245. |
| [17] |
PARK S, SEOK J K, KWAK J Y, et al. Anti-melanogenic effects of resveratryl triglycolate, a novel hybrid compound derived by esterification of resveratrol with glycolic acid[J]. Archives of Dermatological Research, 2016, 308: 325-334. |
| [18] |
国家食品药品监督管理总局. 化妆品安全技术规范[EB/OL]. 2015年版. (2015-12-13) [2021-08-27]. https://www.nmpa.gov.cn/hzhp/hzhpfgwj/hzhpgzwj/20151223120001986.html. State Administration of Food and Drugs. Technical Specifications for Cosmetics Safety [EB/OL]. 2015 ed. (2015-12-13) [2021-08-27]. https://www.nmpa.gov.cn/hzhp/hzhpfgwj/hzhpgzwj/20151223120001986.html. |
| [19] |
王勇恒, 梁彦会, 孙培冬. 川芎提取物美白双靶点活性研究[J]. 日用化学工业, 2020, 50(4): 249-254. WANG Y H, LIANG Y H, SUN P D. Study on the dual-target whitening activities of Ligusticum chuanxiong Hort. extracts[J]. China Surfactant Detergent & Cosmetics, 2020, 50(4): 249-254. |
| [20] |
MAEDA K, FUKUDA M. Invitro effectiveness of several whitening cosmetic components in human melanocytes[J]. Journal of the Society of Cosmetic Chemists, 1991, 42(6): 361-368. |
| [21] |
DIAS M K H M, MADUSANKA D M D, HAN E J. Sargassum horneri (Turner) C. Agardh ethanol extract attenuates fine dust-induced inflammatory responses and impaired skin barrier functions in HaCaT keratinocytes[J]. Journal of Ethnopharmacology, 2021, 273: 101-112. |
| [22] |
YANG Y, CHANG C, HUANG C, et al. Anti-inflammation and anti-apoptosis effects of pearl extract gel on UVB irradiation HaCaT cells[J]. Bio-medical Materials and Engineering, 2015, 26(Suppl.1): S139-45. |
| [23] |
FRUKAWA K, KONO M, KATAOKA T, et al. Effects of egg shell membrane on keratinocyte differentiation and skin aging in vitro and in vivo[J]. Nutrients, 2021, 13(7): 2144-2144. |
| [24] |
BATISTA D, PEREZ L, ORFALI R, et al. Profile of skin barrier proteins (filaggrin, claudins 1 and 4) and Th1/Th2/Th17 cytokines in adults with atopic dermatitis[J]. Journal of the European Academy of Dermatology and Venereology, 2015, 29(6): 1091-1095. |
| [25] |
PARK J, JEKARL D, KIM Y, et al. Novel FLG null mutations in Korean patients with atopic dermatitis and comparison of the mutational spectra in Asian populations[J]. Journal of Dermatology, 2015, 42(9): 867-873. |
| [26] |
BERNHOFER L P, SEIBERG M, MARTIN K M. The influence of the response of skin equivalent systems to topically applied consumer products by epithelial mesenchymal interaction[J]. Toxicology in Vitro, 1999, 13(2): 219-229. |




