糖尿病是21世纪增长最快、卫生支出最多的疾病之一,全球目前有5.366亿人患有糖尿病,患病率9.8%;预计到2045年全球将有7.837亿人患有糖尿病,患病率11.2%[1],其中90% 以上是Ⅱ型糖尿病。Ⅱ型糖尿病发病机制为胰岛β细胞胰岛素分泌不足和外周胰岛素抵抗[2]。因为可以促进胰岛素分泌[3]及抑制胰高血糖素分泌[4]从而起到降血糖的作用[5-10],胰高血糖素样肽-1(GLP-1)自发现以来就成为了Ⅱ型糖尿病研究的热门靶点。但由于体内DPP-4酶的酶切与肾清除作用,内源性GLP-1半衰期不足2 min。因此,对GLP-1进行修饰,避免DPP-4酶作用,维持GLP-1活性,延长体内循环时间是开发临床可用的Ⅱ型糖尿病降糖药的关键。目前已上市多种GLP-1受体激动剂用于治疗Ⅱ型糖尿病,延长血液循环和皮下缓释是2种降低给药频率至每周一次的关键方法[11-12]。前者是基于与大分子长循环片段的连接或融合,如抗体融合的度拉鲁肽[13],白蛋白融合的阿必鲁肽[14],PEG化的洛塞那肽[15],白蛋白结合的利拉鲁肽[16]和索马鲁肽[17]。后者是将药物通过皮下储库缓慢释放,如缓慢释放的艾塞那肽微球[18-19]。但是,前者在皮下快速释放进入血液循环导致在血液中的初始浓度较高,会引起呕吐、胃不适、体重急剧下降等不良反应[20-23],很难通过提高药物浓度或给药量的方法将给药频率进一步降低到两周甚至三周一次。而后者面临在皮下组织中免疫反应的降解和清除作用[24]。因此,只有避免皮下免疫反应,实现更久的皮下缓释,再结合血液长循环,才有可能实现更长效的缓释治疗。
受球蛋白优越的生物相容性的启发,Chen等[25]由球蛋白表面提取谷氨酸-赖氨酸(EK)片段,Yang等[26]通过制备EK二聚体后缩聚合成两性离子多肽P(EK)。这类材料可以通过离子水合作用与水分子紧密结合实现[27-28]抗非特异性蛋白质吸附作用(nonfouling),从而避免引起炎症和免疫清除作用。此外,这类材料具有良好的生物相容性、生物可降解性等特点,可广泛运用于生物医学领域,尤其是在多肽/蛋白质类药物的递送方面具有重要应用。因此,本研究创新性地使用两性离子多肽P(EK)60修饰GLP-1衍生物利拉鲁肽主链(Lira-mainchain)制备胶束,通过皮下缓慢释放和体内长循环实现更长效的降血糖效果,从而减少患者给药次数,减轻给药痛苦,降低成本,提高便利性。
2 实验部分 2.1 仪器与试剂合成原料与试剂:Nε -苄氧羰基-α-叔丁基-L-赖氨酸盐酸盐、δ-苄基-N-叔丁氧羰基L-谷氨酸、N-叔丁氧羰基-S-三苯甲基-L-半胱氨酸、Fmoc保护的利拉鲁肽主链(Fmoc-Lira-mainchain)购自吉尔生化;1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(EDC·HCl)购自上海晶纯试剂;无水N-羟基苯并三氮唑(HOBt)、三乙胺(TEA)、顺丁烯二酸酐、哌啶、牛血清白蛋白组分V(BSA)、β-巯基乙醇等购自阿拉丁试剂;100-200目硅胶购自青岛海洋化工厂;磺化Cy3 NHS酯购自晓柚生物;透析袋购自Spectrum Laboratories;铜网购自新兴百瑞;RPMI-1640培养基、HEPES缓冲液、丙酮酸钠等购自美仑生物;CCK-8购自碧云天;大鼠GLP-1酶联免疫检测试剂盒购自生工生物工程;大鼠insulin酶联免疫检测试剂盒购自AMEKO;度拉鲁肽(度易达)购自Lilly。
细胞与动物:大鼠胰岛细胞瘤细胞(INS-1),小鼠单核巨噬细胞白血病细胞(RAW264.7)购自协和细胞库;6周龄的雄性db/db小鼠购自南京集萃药康并于浙江省医科院实验动物中心饲养。
仪器:LC-20AD凝胶渗透色谱仪(岛津公司,日本)、DMX400核磁共振谱仪(Bruker公司,瑞士)、Zetasizer Nano ZS动态光散射仪(马尔文公司,英国)、Triple TOF 5600+超高效液相-三重四极杆飞行时间质谱联用仪(AB Sciex公司,美国)、JEM-1010EX透射电镜(JEOL公司,日本)、J-1500圆二色谱(Jasco公司,日本)、M200酶标仪(MDS ANALYTICAL公司,美国)、RF-5301pc荧光分光光度计(岛津公司,日本)、FACSCalibur流式细胞仪(BD公司,美国)、ECLIPSE Ti荧光显微镜(尼康公司,日本)、GA-3手持血糖仪和血糖试条(三诺公司,中国)。
2.2 实验方法 2.2.1 合成部分P(EK)60的合成(图 1):称取EK二聚体[29](化合物1)(400.00 mg,0.80 mmol),EDC·HCl(230.04 mg,1.20 mmol),HOBt(162.16 mg,1.20 mmol),Boc-Cys(Trt)-OH(1.85 mg,0.004 mmol),溶于无水DMF室温密闭反应48 h。使用乙醚沉淀产物,得化合物2,加入2 mL三氟乙酸和4 mL质量分数为33% 的HBr/HOAc,冰浴搅拌反应6 h脱除保护基,使用乙醚沉淀产物,用水溶解产物并调节pH至中性,纯水透析,冻干得白色固体P(EK)60(化合物3)(收率51.89%~65.12%)。氢谱核磁结果:化学位移δ:1.26~1.50 2H,1.53~1.68 2H,1.68~1.85 2H,1.85~2.10 2H,2.10~2.38 2H,2.80~2.97 2H,3.95~4.24 2H。
|
图 1 P(EK)60-Lira的合成路线 Fig.1 Synthetic route of P(EK)60-Lira |
P(EK)60-Lira的合成(图 1):称取20.01 mg(5.55 μmol)Fmoc-Lira-mainchain(化合物4)和0.554 mg(5.65 μmol)顺丁烯二酸酐(MA)溶于1 500 μL DMSO中,室温搅拌反应45 min,纯水透析,冻干获得白色固体Fmoc-Lira-MA(化合物5)(18.79 mg,收率91.43%)。称取3.90 mg(1.05 μmol)Fmoc-Lira-MA(化合物5)溶于50 μL DMSO中,称取98.78 mg(6.59 μmol)P(EK)60(化合物3)溶于用三氟乙酸调节pH至6.0的400 μL纯水中,将两者混合,室温搅拌反应24 h,冻干。过量P(EK)60水洗去除,收集水洗沉淀物再冻干,得到Fmoc-P(EK)60-Lira(19.05 mg,收率94.9%)。将其溶于2 mL哌啶、二氯甲烷体积比为1:1的碱性溶液中,搅拌反应1 h,PBS透析,纯水透析,冻干获得P(EK)60-Lira(化合物6)(14.89 mg,收率82.49%)。使用良溶剂(体积分数:DMSO 10%、丙二醇10%、纯水80%)溶解P(EK)60-Lira后微流滴入劣溶剂(纯水)中,搅拌4 h超滤浓缩得到胶束1和胶束2,使用纯水透析法制备得到胶束3。对这3个批次的P(EK)60-Lira胶束分别冻干。
荧光分子标记药物:称取5 mg(0.28 mmol)的P(EK)60-Lira,5 mg(0.075 mmol)BSA和5 mg(1.48 mmol)Lira-mainchain于离心管中,用0.5 mL 0.1 mol⋅L−1的NaHCO3(pH 8.3)的水溶液溶解。向P(EK)60-Lira、BSA溶液中分别滴加2 mg⋅mL−1的Cy3-NHS的DMSO溶液100 μL(0.26 mmol),向Lira-mainchain溶液中滴加2 mg⋅mL−1的Cy3-NHS的DMSO溶液250 μL(0.66 mmol),室温避光反应过夜,透析冻干得到Cy3-P(EK)60-Lira(3.12 mg,收率61.3%)、Cy3-BSA(4.33 mg,收率86.2%)和Cy3-Lira-mainchain(2.11 mg,收率41.8%)。
2.2.2 合成分析表征使用氘代试剂溶解化合物,通过核磁共振氢谱(1H-NMR)测定分子结构。通过凝胶渗透色谱法(GPC)测定P(EK)60、P(EK)60-Lira的分子量,采用PEG/PEO的GPC标准品对分子量进行标定,流动相为0.5 mol⋅L−1的硝酸钠,设定流速为1 mL⋅min−1,柱温为35 ℃。使用凝胶色谱法、差重法、酶联免疫法3种方法计算Fmoc-Lira-MA与P(EK)60的反应效率。制备0.2 mg⋅mL−1的P(EK)60和P(EK)60-Lira水溶液,使用圆二色谱(CD)测定二级结构,扫描波长为260~190 nm。使用芘荧光探针法测定临界胶束浓度,用荧光分光光度计设置发射波长为390 nm,扫描300~360 nm的激发光谱测量荧光强度,并用空白样品进行标定。使用纯水制备0.1 mg⋅mL−1的P(EK)60-Lira的分散液,将样品滴于铜网上,干透后置于透射电子显微镜(TEM)下观察胶束形态和粒径,取200 μL的P(EK)60-Lira分散液通过动态光散射仪(DLS)测量胶束的水力直径。
2.2.3 体外活性研究两性离子多肽P(EK)60的酶降解性能研究:称取两性离子多肽P(EK)60 12 mg,溶于4 mL纯水中,加入质量浓度为2 mg⋅mL−1的胰酶溶液60 μL,于摇床37 ℃,120 r⋅min−1酶解。分别于不同时间点取400 μL样品,过滤并高温煮沸灭活,冷却至室温后加入GPC样品瓶中,进样测分子量。根据分子量的变化判断其酶解程度与酶解性能。
药物的体外释放研究:向截留分子量为20 000、50 000、100 000的透析袋中分别加入2 mL质量浓度为0.1 mg⋅mL−1的Cy3-P(EK)60-Lira、Cy3-BSA的PBS分散液。密封透析袋,将其放置于盛有38 mL、pH=7.4的PBS的离心管中,使透析袋浸没在液面以下,放入37 ℃、120 r⋅min−1摇床中避光恒温振荡。分别在0~24 h的时间点从离心管中取样300 μL于荧光分光光度计中,测量在510 nm激发波长、560 nm发射波长下的荧光强度并放回。绘制标准曲线,计算药物的释放量。
药物促进INS-1细胞增殖研究:使用RPMI-1640培养基(胎牛血清体积分数为10%,青/链霉素双抗体积分数为1%,10 mmol⋅L−1的HEPES,1 mmol⋅L−1的丙酮酸钠,50 μmol⋅L−1的β-巯基乙醇),每两天换液,每周1:3传代。以1×104个/孔的密度将INS-1细胞接种在96孔板中,培养24 h以贴壁。使用培养基配制0、1、2、4、8、16 μmol⋅L−1的Lira-mainchain和P(EK)60-Lira。移去原有培养基,加入上述Lira-mainchain和P(EK)60-Lira,每孔100 μL,每个样品设置5个复孔。在37 ℃、CO2体积分数为5% 的细胞培养箱中培养24 h,移去培养基,加入CCK-8体积分数为10% 的无血清培养基,孵育3 h,显色后置于酶标仪中测量并读取波长为450、620 nm下的吸光度。使用双波长法校准,以药物物质的量浓度为0 μmol⋅L−1的孔为空白对照组,设其吸光度为100%,则样品组的吸光度相对空白对照组换算为百分数计算细胞活力。
药物促进INS-1细胞胰岛素分泌研究:以每孔1×104个的密度将INS-1细胞接种在2块96孔板中,培养24 h以贴壁,移去原有培养基,每孔加入100 μL的含有10 mmol⋅L−1葡萄糖的Krebs Ringer Buffer(KRB)缓冲液孵育1 h。使用KRB缓冲液配制0、1、2、4、8、16 μmol⋅L−1的Lira-mainchain和P(EK)60-Lira备用。移去KRB缓冲液,每孔100 μL分别加入上述不同浓度的Lira-mainchain、P(EK)60-Lira,孵育1 h,每个样品设置5个复孔。孵育结束后吸取培养液上清,使用大鼠胰岛素ELISA试剂盒测试INS-1细胞胰岛素分泌量。使用CCK-8测定96孔板中细胞数目,对胰岛素分泌量进行校正。
药物对巨噬细胞的抗免疫吸附作用:将RAW264.7细胞以每孔1×106个的密度接种于六孔板中,在细胞培养箱中培养24 h以贴壁。将Cy3-P(EK)60-Lira和Cy3-Lira-mainchain分别用RPMI-1640培养基(体积分数为10%胎牛血清,体积分数为1% 青/链霉素双抗)配制成浓度为3 μmol⋅L−1 (> CMC)的药物分散液,于荧光分光光度计中测量在激发波长510 nm,发射波长560 nm下测荧光强度。去除六孔板中的原有培养基,向接种有细胞的孔中加入2 mL的上述药物分散液,空白孔仅加入2 mL的培养基,孵育2 h。孵育结束后消化、洗涤并离心收集细胞,上流式细胞仪测试。
2.2.4 体内活性研究db/db小鼠饲养及筛选:db/db小鼠(C57BL/KsJ)是瘦素受体基因敲除小鼠,属于Ⅱ型糖尿病模型[30-31]。从南京集萃药康订购6周龄db/db雄性小鼠23只,于浙江省医科院实验动物中心饲养。选取3只在血糖升高形成Ⅱ型糖尿病模型前处死,摘取胰腺组织,作为糖尿病早期的样本。剩余20只使用普通饲料适应性喂养一周,随后隔天监测小鼠空腹6 h血糖和体重,当空腹6 h血糖稳定在16.7 mmol⋅L−1以上时确定为Ⅱ型糖尿病模型[32-33]。所有动物研究都是根据IACUC批准的协议,按照NIH实验室动物护理和使用指南进行的。
db/db小鼠体内不同粒径药物药效学研究:将成模的20只db/db小鼠分成5组,400(胶束1)、600(胶束2)、800 nm(胶束3)的P(EK)60-Lira组,PBS阴性对照组,度拉鲁肽阳性对照组每组各4只。使用无菌PBS配制浓度为120 μmol⋅L−1的400、600、800 nm的P(EK)60-Lira胶束分散液。P(EK)60-Lira给药剂量为600 nmol⋅kg−1,根据每只小鼠体重计算给药剂量。PBS组给予相同体积的PBS。度拉鲁肽组(度易达,1.5 mg: 0.5 mL)给予db/db小鼠的剂量为10 nmol⋅kg−1,约0.6 mg⋅kg−1[34],使用PBS稀释到与P(EK)60-Lira组相同体积。记录给药前随机血糖及空腹6 h血糖,随后根据分组皮下注射相应药物,观察注射部位正常且无漏液后给予进食。随后监测随机血糖及空腹6 h血糖,待小鼠血糖有明显回升,并且多饮多食多尿特征严重时,停止血糖监测。
不同粒径P(EK)60-Lira胶束的注射部位免疫原性研究和对胰岛β细胞的影响:在药效学实验结束后注射过量麻醉处死小鼠,分组解剖并取小鼠的注射部位组织和胰腺,置于福尔马林中固定24 h,制作组织蜡块和切片。分组为:(1) 糖尿病早期还尚未自发形成Ⅱ型糖尿病的db/db小鼠;(2) 注射PBS的Ⅱ型糖尿病db/db小鼠;(3)、(4)、(5)分别为注射400、600、800 nm P(EK)60-Lira胶束分散液后的Ⅱ型糖尿病db/db小鼠。对注射部位切片进行苏木精-伊红(HE)染色,对胰腺组织切片进行苏木精-伊红(HE)染色和胰岛素抗体免疫组织化学染色,在正置显微镜下观察并采集图像。
3 结果与讨论 3.1 合成表征结果Fmoc-Lira-mainchain和顺丁烯二酸酐(MA)进行酰化反应生成Fmoc-Lira-MA,核磁共振氢谱图1H-NMR (600 MHz,DMSO-d6)(图 2(a))。通过GPC测试聚合物P(EK)60和P(EK)60-Lira的相对分子质量如表 1和图 2(b)所示。聚合物P(EK)60与Fmoc-Lira-MA反应后变为P(EK)60-Lira,相对分子质量变大,可以判断Fmoc-Lira-MA已接上聚合物载体。P(EK)60、P(EK)60-Lira的圆二色谱图如图 2(c)所示,通过Dichroweb网站对样品的数据进行具体分析,分析结果如表 2所示,P(EK)60和P(EK)60-Lira具有较多的α螺旋的结构。
|
图 2 结构表征结果 Fig.2 Structural characterization results |
|
|
表 1 反应前后的相对分子质量及其分布 Table 1 Molecular weight and distribution before and after reaction |
|
|
表 2 多肽二级结构分析 Table 2 Analysis for secondary structure of polypeptide |
计算338和333 nm处的芘荧光强度比值(I338/I333),绘制I338/I333与质量浓度对数值图(图 3(a)),对两段散点进行拟合,2条直线的交点处即胶束在水中的临界胶束浓度,为0.02 mg⋅mL−1。配制0.1 mg⋅mL−1的不同批次的P(EK)60-Lira胶束分散液,使用DLS测试胶束的水力直径,测试结果如表 3所示,胶束1、2、3分别对应400、600、800 nm的胶束。对上述P(EK)60-Lira胶束进行TEM表征,如图 3(b)、(c)、(d)所示,400 nm胶束干态粒径为50~100 nm,600 nm胶束干态粒径在100 nm左右,800 nm胶束干态粒径为100~200 nm。提高P(EK)60-Lira浓度测得的DLS胶束水力直径基本不变,且胶束在制备后冻干保存,注射前使用PBS溶解分散,可以避免胶束结构发生变化和团聚。

|
图 3 P(EK)60-Lira胶束表征结果 Fig.3 Characterization results of P(EK)60-Lira micelles |
|
|
表 3 不同批次P(EK)60-Lira胶束DLS结果 Table 3 DLS results of P(EK)60-Lira micelles in different batches |
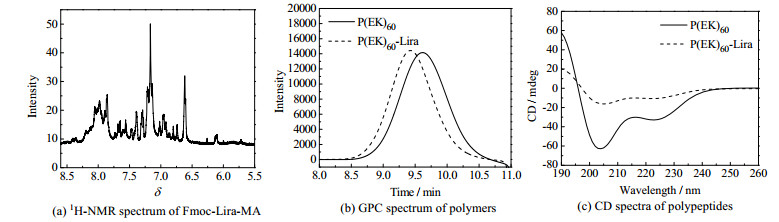
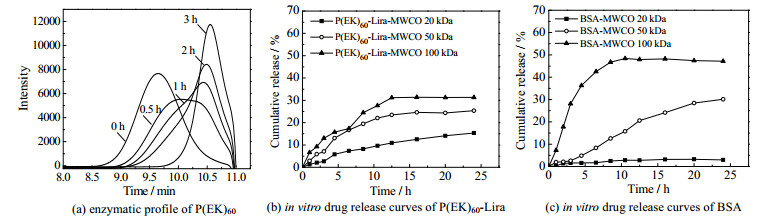
载体P(EK)60的酶解后凝胶色谱图如图 4(a)所示,P(EK)60在第10 min已经发生了部分酶解,随着时间的推移峰不断右移,直至酶解了3 h后,峰变窄,分子量相对均一,随后峰不再右移,标志着P(EK)60已酶解完全。这说明两性离子多肽载体P(EK)60可酶解,安全性高。
|
图 4 载体酶降解和胶束体外释放行为研究 Fig.4 Profiles of carrier enzyme degradation and micelles release in vitro |
在截留分子量为20 000的透析袋中P(EK)60-Lira(图 4(b))的释放量(15%)大于BSA(图 4(c))(3%),说明胶束解离后以游离分子形态存在的药物分子可以透过透析袋,胶束可在注射至皮下后从皮下储库渗透进入毛细血管实现体内循环。在截留分子量为50 000、100 000的透析袋中P(EK)60-Lira(图 4(b))(25%、30%)的释放量均小于BSA(图 4(c))(30%、50%),说明P(EK)60-Lira的肾清除率小于BSA,药物在体内循环时多数药物可以被肾小球的毛细血管截留,不易被肾清除,从而可以提高药物半衰期。
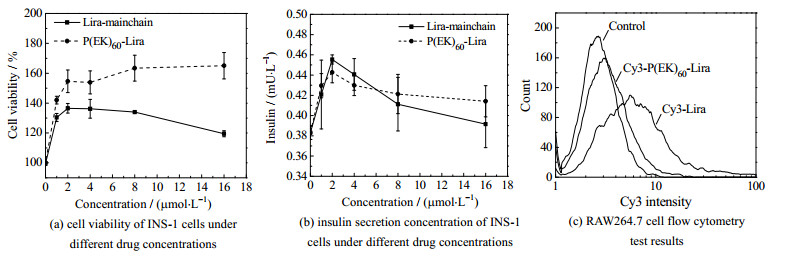
3.2.2 药物的体外GLP-1活性和抗免疫吸附作用药物促进INS-1细胞增殖(图 5(a))的结果表明,Lira-mainchain、P(EK)60-Lira均保留了GLP-1的促进INS-1细胞增殖[35-38]的作用。Lira-mainchain随着浓度的增加,促进增殖作用先增强后减弱,最大细胞活力为136%。P(EK)60-Lira随着浓度的增加,促进增殖作用先增强后达到平衡,最大细胞活力在165%。P(EK)60-Lira更好地维持了GLP-1的促进INS-1细胞增殖作用。药物刺激INS-1细胞的胰岛素分泌(图 5(b)) 的结果表明,Lira-mainchain、P(EK)60-Lira均保留了GLP-1促进胰岛素分泌[39-40]的活性,随着浓度的增加,促进胰岛素分泌的功能呈先增强后减弱的趋势。通过载体修饰后的P(EK)60-Lira保留了GLP-1的生物活性。
|
图 5 药物的体外活性研究 Fig.5 Study on drug activity in vitro |
荧光分光光度计测得3 μmol⋅L−1的Cy3-P(EK)60-Lira和Cy3-Lira-mainchain的荧光强度分别为123.4和95.7。流式细胞仪测试结果如图 5(c)所示,空白对照、Cy3-P(EK)60-Lira和Cy3-Lira-mainchain组的RAW264.7细胞平均荧光强度分别为2.98、4.24和9.84。通过空白对照和荧光分光光度计测得的荧光强度校正,将Cy3-Lira-mainchain的吞噬量设为100%,则Cy3-P(EK)60-Lira的吞噬量抑制了85.8%。两性离子多肽P(EK)60可以有效地避免巨噬细胞的识别和吞噬,进而避免药物注射后引起皮下炎症反应和清除,实现胶束在皮下长期驻留并缓慢释放降低血糖的效果。
3.3 体内活性研究 3.3.1 db/db小鼠体内不同粒径药物的药效学研究记录分组给药后三周的小鼠随机血糖(图 6(a))和空腹6 h血糖数据(图 6(b))。P(EK)60-Lira胶束粒径对降血糖效果有很大的影响,粒径越小,长效降血糖效果越好,降血糖效果越稳定,个体差异越小。粒径为800、600、400 nm的P(EK)60-Lira胶束分别有5~6、9~10、17~18 d的降血糖效果。PBS阴性对照组维持在20~25 mmol⋅L−1的高血糖。3种粒径的药物胶束都在第4天出现了血糖谷值,可能是前4 d胶束以解离为主释放单分子进入血液循环,这一过程持续累积到第4天达到了GLP-1血药浓度峰值,因此血糖出现谷值。度拉鲁肽阳性对照组有4 d的降血糖效果。度拉鲁肽降血糖幅度更大,但长效性不足。相比空腹血糖,P(EK)60-Lira胶束对随机血糖调控效果更为明显,且胶束粒径越小,长效降血糖效果越好越稳定。从降血糖幅度看,P(EK)60-Lira还有可提升空间,后续可以进一步控制胶束粒径使同一时间内解离释放的药物分子增加,从而提高GLP-1血药浓度,得到更明显的降血糖效果。400 nm P(EK)60-Lira胶束的长效降血糖效果是上市的长效降糖药周制剂型度拉鲁肽的4倍以上,有望在人体实现皮下注射一次达到一个月的降血糖效果。
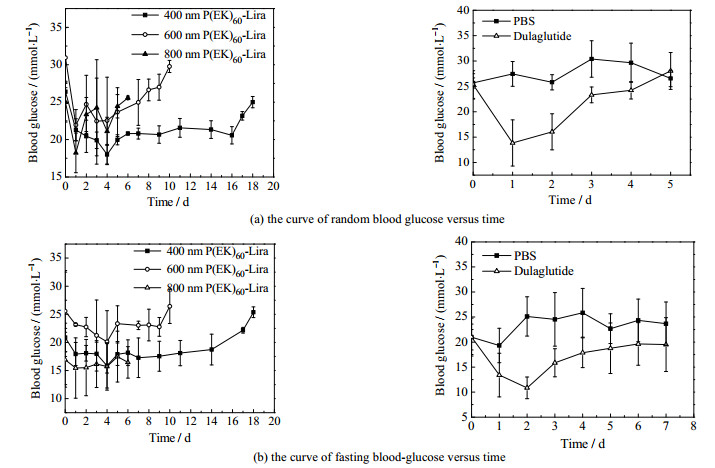
|
图 6 db/db小鼠血糖数据 Fig.6 Blood glucose data of db/db mice |
注射部位的HE染色切片结果如图 7所示,注射部位如果产生炎症则会募集大量炎症细胞,细胞核会被染成蓝色。注射PBS的db/db小鼠注射部位无明显炎症细胞出现。注射P(EK)60-Lira组,400、600、800 nm的注射部位出现的炎症细胞依次增多。这说明P(EK)60-Lira粒径越大越容易引起皮下炎症反应,可能是由于胶束组装不稳定,使部分P(EK)60-Lira的Lira疏水链在外侧,以及药物分散不良出现明显药物颗粒,从而引起免疫吸附和巨噬细胞吞噬,引发较明显的炎症反应,从而清除皮下储库中的药物,导致较短的降血糖效果。
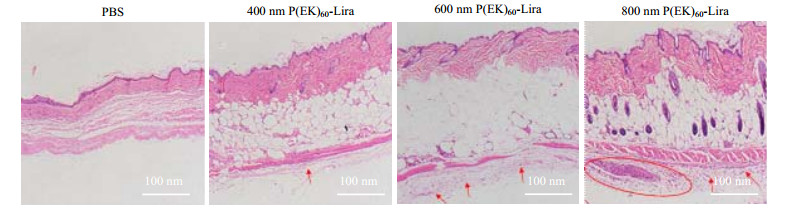
|
图 7 注射部位石蜡切片HE染色图像 Fig.7 HE staining images of paraffin section at injection site |
胰腺组织的HE染色结果(图 8(a))表明,糖尿病早期的db/db小鼠的胰岛较大,结构完整,内部细胞相对紧密,胰岛较为完好。PBS组为Ⅱ型糖尿病小鼠,胰岛形状较小且不规整,内部细胞疏散,结构不完整(红色箭头部位),出现多处空泡,胰岛损伤严重。同理观察P(EK)60-Lira给药组的胰岛损伤情况,800 nm的最严重,600 nm次之,400 nm的最轻。胰岛素抗体免疫组化染色(图 8(b))的棕色部位为胰岛素抗体阳性即胰岛β细胞部位。结果表明,糖尿病早期组胰岛素抗体染色颗粒颜色浓密且分布相对均匀。注射PBS的Ⅱ型糖尿病组胰岛素抗体染色颗粒少,颜色浅且分布不均匀,可以判断胰岛β细胞损伤严重,代表了Ⅱ型糖尿病模型的胰岛特征。同理观察P(EK)60-Lira给药组的胰岛β细胞损伤,800 nm的最严重,600 nm次之,400 nm的最轻。综合细胞增殖实验和胰腺切片结果,可以发现P(EK)60-Lira具有对胰岛β细胞的保护和修复作用,并且胶束粒径越小,作用越明显。
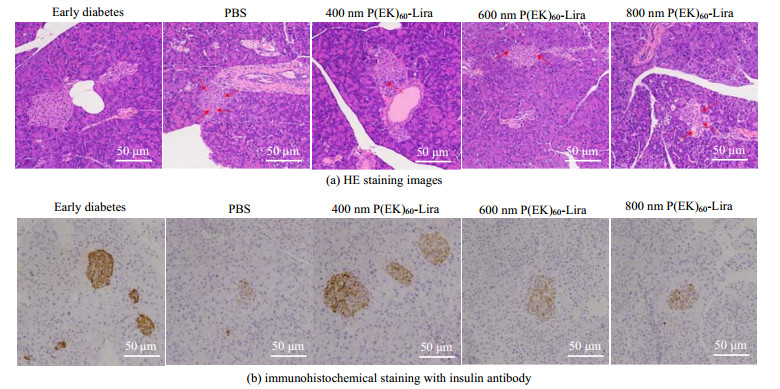
|
图 8 胰腺石蜡切片染色结果 Fig.8 Staining images of pancreas paraffin section |
本研究制备了两性离子多肽修饰的GLP-1衍生物P(EK)60-Lira胶束,通过体外活性研究验证了P(EK)60的酶降解性和安全性,P(EK)60-Lira胶束的缓慢释放与减少肾清除的潜力,促胰岛细胞增殖、提高胰岛素分泌能力,抗免疫吸附和吞噬的性能。通过体内活性研究验证了P(EK)60的长效降血糖效果与粒径大小呈负相关,粒径最小的400 nm胶束具有17~18 d的长效降血糖效果,是市售周制剂型度拉鲁肽的4倍以上,并且可以避免注射部位炎症和修复胰岛β细胞。
P(EK)60-Lira通过皮下缓释和体内长循环实现了超长效的降血糖效果,具有临床开发的应用前景,可以作为潜在的超长效GLP-1类似物用于Ⅱ型糖尿病的治疗以减少患者给药次数,提高便利性。其长效的关键在于胶束组装及质量控制,尤其需要在控制胶束粒径和释放行为方面进一步研究。通过改进制备工艺制得粒径更小、更均一的药物胶束,以期获得更好的药物缓释和长效降血糖效果,但后续需要进行更系统的动物实验的探究。以P(EK)60为代表的两性离子多肽作为一种平台技术有望成为多种多肽的载体,实现多肽/蛋白质类药物长效递送。
| [1] |
International Diabetes Federation. IDF Diabetes Atlas[EB/OL]. (2012-05-03) [2021-12-01]. http://diabetesatlas.org
|
| [2] |
STUMVOLL M, GOLDSTEIN B J, VAN H T W. Type 2 diabetes: Principles of pathogenesis and therapy[J]. Lancet, 2005, 365(9467): 1333-1346. DOI:10.1016/S0140-6736(05)61032-X |
| [3] |
FEHMANN H C, GOKE R, GOKE B. Cell and molecular biology of the incretin hormones glucagon-like peptide-1 and glucose dependent insulin releasing polypeptide[J]. Endocrine Reviews, 1995, 16(3): 390-410. DOI:10.1210/edrv-16-3-390 |
| [4] |
GREENBAUM C J, PRIGEON R L, D'ALESSIO D A. Impaired beta-cell function, incretin effect, and glucagon suppression in patients with type 1 diabetes who have normal fasting glucose[J]. Diabetes, 2002, 51(4): 951-957. DOI:10.2337/diabetes.51.4.951 |
| [5] |
BUSH M A, MATTHEWS J E, DE B E H, et al. Safety, tolerability, pharmacodynamics and pharmacokinetics of albiglutide, a long-acting glucagon-like peptide-1 mimetic, in healthy subjects[J]. Diabetes Obesity & Metabolism, 2009, 11(5): 498-505. |
| [6] |
BUSH M, SCOTT R, WATANALUMLERD P, et al. Effects of multiple doses of Albiglutide on the pharmacokinetics, pharmacodynamics, and safety of digoxin, warfarin, or a low-dose oral contraceptive[J]. Postgraduate Medicine, 2012, 124(6): 55-72. DOI:10.3810/pgm.2012.11.2613 |
| [7] |
GEISER J S, HEATHMAN M A, CUI X, et al. Clinical pharmacokinetics of dulaglutide in patients with type 2 diabetes: Analyses of data from clinical trials[J]. Clinical Pharmacokinetics, 2016, 55(5): 625-634. DOI:10.1007/s40262-015-0338-3 |
| [8] |
GRUNBERGER G, FORST T, LANDO L F, et al. Early fasting glucose measurements can predict later glycaemic response toonce weekly dulaglutide[J]. Diabetic Medicine, 2016, 33(3): 391-394. DOI:10.1111/dme.12833 |
| [9] |
GUTNIAK M, ORSKOV C, HOLST J J, et al. Antidiabetogenic effect of glucagon-like peptide-1 (7-36)amide in normal subjects and patients with diabetes mellitus[J]. The New England Journal of Medicine, 1992, 326(20): 1316-1322. DOI:10.1056/NEJM199205143262003 |
| [10] |
RITZEL R, ORSKOV C, HOLST J J, et al. Pharmacokinetic, insulinotropic, and glucagonostatic properties of GLP-1 [7-36 amide] after subcutaneous injection in healthy volunteers. Dose-response-relationships[J]. Diabetologia, 1995, 38(6): 720-725. DOI:10.1007/BF00401846 |
| [11] |
蒋镜清, 符玲, 谈梦璐, 等. 胰高血糖素样肽-1(GLP-1)类似物研究进展[J]. 高校化学工程学报, 2020, 34(6): 1327-1338. JIANG J Q, FU L, TAN M L, et al. Studies on glucagon like peptide-1 (GLP-1) analogues: A review[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(6): 1327-1338. DOI:10.3969/j.issn.1003-9015.2020.06.001 |
| [12] |
NAUCK M A, MEIER J J. Are all GLP-1 agonists equal in the treatment of type 2 diabetes?[J]. European Journal of Endocrinology, 2019, 181(6): R211-R234. DOI:10.1530/EJE-19-0566 |
| [13] |
LAU J, BLOCH P, SCHäFFER L, et al. Discovery of the once-weekly glucagon-like peptide-1 (GLP-1) analogue semaglutide[J]. Journal of Medicinal Chemistry, 2015, 58(18): 7370-7380. DOI:10.1021/acs.jmedchem.5b00726 |
| [14] |
ZACHARY T B. Gut-derived incretin hormones and new therapeutic approaches[J]. Diabetes Care, 2004, 27(10): 2554-2559. DOI:10.2337/diacare.27.10.2554 |
| [15] |
LEE S H, LEE S, YOUN Y S, et al. Synthesis, characterization, and pharmacokinetic studies of PEGylated glucagon-like peptide-1[J]. Bioconjugate Chemistry, 2005, 16(2): 377-382. DOI:10.1021/bc049735+ |
| [16] |
CORREIA L C L, LATADO A, PORZSOLT F. Liraglutide and cardiovascular outcomes in type 2 diabetes[J]. New England Journal of Medicine, 2016, 375(18): 1798-1798. |
| [17] |
JENSEN L, HELLEBERG H, ROFFEL A, et al. Absorption, metabolism and excretion of the GLP-1 analogue semaglutide in humans and nonclinical species[J]. European Journal of Pharmaceutical Sciences, 2017, 104: 31-41. DOI:10.1016/j.ejps.2017.03.020 |
| [18] |
DEYOUNG M B, MACCONELL L, SARIN V, et al. Encapsulation of Exenatide in poly-(D, L-lactide-co-glycolide) microspheres produced an investigational long-acting once-weekly formulation for type 2 diabetes[J]. Diabetes Technology & Therapeutics, 2011, 13(11): 1145-1154. |
| [19] |
LI K, YU L, LIU X J, et al. A long-acting formulation of a polypeptide drug exenatide in treatment of diabetes using an injectable block copolymer hydrogel[J]. Biomaterials, 2013, 34(11): 2834-2842. DOI:10.1016/j.biomaterials.2013.01.013 |
| [20] |
PRATLEY R E, NAUCK M A, BARNETT A H, et al. Once-weekly albiglutide versus once-daily liraglutide in patients with type 2 diabetes inadequately controlled on oral drugs (HARMONY 7): A randomised, open-label, multicentre, non-inferiority phase 3 study[J]. Lancet Diabetes & Endocrinology, 2014, 2(4): 289-297. |
| [21] |
DUNGAN K M, POVEDANO S T, FORST T, et al. Once-weekly dulaglutide versus once-daily liraglutide in metformin-treated patients with type 2 diabetes (AWARD-6): A randomised, open-label, phase 3, non-inferiority trial[J]. Lancet, 2014, 384(9951): 1349-1357. DOI:10.1016/S0140-6736(14)60976-4 |
| [22] |
THOMPSON A M, TRUJILLO J M. Dulaglutide the newest GLP-1 receptor agonist for the management of type 2 diabetes[J]. Annals of Pharmacotherapy, 2015, 49(3): 351-359. DOI:10.1177/1060028014564180 |
| [23] |
LIUTKUS J, ARODA V R, BAIN S C, et al. Efficacy and safety of once-weekly semaglutide vs. once-daily insulin glargine in insulin-naïve subjects with type 2 diabetes (SUSTAIN 4)[J]. Canadian Journal of Diabetes, 2016, 40(5): S41. |
| [24] |
DRUCKER D J, BUSE J B, TAYLOR K, et al. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: A randomised, open-label, non-inferiority study[J]. Lancet, 2008, 372(9645): 1240-1250. DOI:10.1016/S0140-6736(08)61206-4 |
| [25] |
CHEN S, CAO Z, JIANG S. Ultra-low fouling peptide surfaces derived from natural amino acids[J]. Biomaterials, 2009, 30(29): 5892-5896. DOI:10.1016/j.biomaterials.2009.07.001 |
| [26] |
YANG Q, WANG L, LIN W, et al. Development of nonfouling polypeptides with uniform alternating charges by polycondensation of the covalently bonded dimer of glutamic acid and lysine[J]. Journal of Materials Chemistry B, 2014, 2(5): 577-584. DOI:10.1039/C3TB21333A |
| [27] |
CHEN S, LI L, ZHAO C, et al. Surface hydration: Principles and applications toward low-fouling/nonfouling biomaterials[J]. Polymer, 2010, 51(23): 5283-5293. DOI:10.1016/j.polymer.2010.08.022 |
| [28] |
WU J, LIN W, WANG Z, et al. Investigation of the hydration of nonfouling material poly(sulfobetaine methacrylate) by low-field nuclear magnetic resonance[J]. Langmuir, 2012, 28(19): 7436-7441. DOI:10.1021/la300394c |
| [29] |
杨庆华. 抗非特异性蛋白质吸附多肽的合成、表征及体外酶降解性能研究[D]. 杭州: 浙江大学, 2014. YANG Q H. Investigation of antifouling polypeptides: synthesis, characterization and in vitro enzymatic degradation [D]. Hangzhou: Zhejiang University, 2014. |
| [30] |
BATES S H, KULKARNI R N, SEIFERT M, et al. Roles for leptin receptor/STAT3-dependent and -independent signals in the regulation of glucose homeostasis[J]. Cell Metabolism, 2005, 1(3): 169-178. DOI:10.1016/j.cmet.2005.02.001 |
| [31] |
KUMAR R, RAMACHANDRAN U, SRINIVASAN K, et al. Design, synthesis and evaluation of carbazole derivatives as PPARa/gamma dual agonists and antioxidants[J]. Bioorganic & Medicinal Chemistry, 2005, 13(13): 4279-4290. |
| [32] |
SRINIVASAN K, VISWANAD B, ASRAT L, et al. Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: A model for type 2 diabetes and pharmacological screening[J]. Pharmacological Research, 2005, 52(4): 313-320. DOI:10.1016/j.phrs.2005.05.004 |
| [33] |
ZHANG M, LV X, LI J, et al. The characterization of high-fat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model[J]. Experimental Diabetes Research, 2008, 704045. |
| [34] |
GLAESNER W, VICK A M, MILLICAN R, et al. Engineering and characterization of the long-acting glucagon-like peptide-1 analogue LY2189265, an Fc fusion protein[J]. Diabetes Metabolism Research and Reviews, 2010, 26(4): 287-296. DOI:10.1002/dmrr.1080 |
| [35] |
CHON S, GAUTIER J F. An update on the effect of incretin-based therapies on β-cell function and mass[J]. Diabetes Metab, 2016, 40(2): 99-114. DOI:10.4093/dmj.2016.40.2.99 |
| [36] |
EGAN J M, BULOTTA A, HUI H X, et al. GLP-1 receptor agonists are growth and differentiation factors for pancreatic istet beta cells[J]. Diabetes Metabolism Research and Reviews, 2003, 19(2): 115-23. DOI:10.1002/dmrr.357 |
| [37] |
ARAKAWA M, EBATO C, MITA T, et al. Effects of exendin-4 on glucose tolerance, insulin secretion, and beta-cell proliferation depend on treatment dose, treatment duration and meal contents[J]. Biochemical and Biophysical Research Communications, 2009, 390(3): 809-814. DOI:10.1016/j.bbrc.2009.10.054 |
| [38] |
JHALA U S, CANETTIERI G, SCREATON R A, et al. CAMP promotes pancreatic beta-cell survival via CREB-mediated induction of IRS2[J]. Genes & Development, 2003, 17(13): 1575-1580. |
| [39] |
MAYO K E, MILLER L J, BATAILLE D, et al. International union of pharmacology. XXXV. The glucagon receptor family[J]. Pharmacological Reviews, 2003, 55(1): 167-194. DOI:10.1124/pr.55.1.6 |
| [40] |
MUELLER T D, FINAN B, BLOOM S R, et al. Glucagon-like peptide 1 (GLP-1)[J]. Molecular Metabolism, 2019, 30: 72-130. DOI:10.1016/j.molmet.2019.09.010 |




