2. 郑州中科新兴产业技术研究院,河南 郑州 450000
2. Zhengzhou Zhongke Institute of Emerging Industries Technology, Zhengzhou 450000, China
组织工程关键是制造出与特定组织类型机械性能和生物学特性等性质相似的活体组织构建物[1~3]。随着研究者对天然组织细胞外基质的组成和作用的更好理解,可控合成组织特异性仿生材料的研发进展愈加快捷。天然微环境为多功能细胞的表型表达提供了关键的刺激因素,因此,开发具有分层/分级/梯度/多相结构的可植入支架材料成为当前的研究热点[4-10]。
近年来,许多研究者对骨软骨界面组织工程支架材料的分层/分级/梯度/多相等结构,产生浓厚兴趣并开展了系列研究。刘学清等[11]以壳聚糖(chitosan, Cs)、聚乙烯醇为原料,采用微波技术制备组分含量沿厚度方向渐变的梯度材料;结果发现,组分含量、材料的物理性能等均沿梯度方向渐变。程文则等[12]通过叠层冷冻干燥法制得三层聚己内酯/Cs多孔梯度支架材料,从底层、中层到表层,支架的孔隙率逐渐增大,但抗压性能逐渐减小;且聚己内酯含量越高,降解性能越差。许多研究者不仅成功制备了梯度支架,并把细胞复合到梯度支架检测其生物相容性和增殖分化等性能。BI等[13]以胶原/Cs为软骨相、生物活性玻璃-胶原为成骨相制备双层支架材料,两相衔接良好,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)在上面充分铺展。ZHU等[14]制备了Cs/聚己内酯/Ⅱ型胶原材料,发现支架孔径、孔隙率、机械性能均呈现出梯度渐进性,适宜软骨细胞生长。HAN等[15]以复合浓度梯度转化生长因子的Cs/明胶(gelatin, Gel)支架为软骨相,复合浓度梯度骨形态发生蛋白的左旋聚乳酸支架为成骨相,发现成骨相和软骨相支架可分别促进BMSCs向成骨细胞和软骨细胞分化,体内实验两相支架分别促进新生骨和软骨形成,且二者整合良好。GUO等[16]以梯度丝蛋白/生物矿化硅作为支架,同样促进BMSCs体外成骨分化,而且细胞分化程度沿支架梯度方向排布。ROWLAND等[17]以天然软骨基质作为支架,通过温度梯度渐进性产生支架孔径的梯度渐进性,28天后发现该支架能有效支持MSCs在其上的软骨形成。除体外检测梯度支架性能外,部分学者将其移植到生物体内进行相关研究。LIU等[18]以静电纺丝方法制备以左旋聚乳酸复合聚己内酯/Ⅰ型胶原/透明质酸纤维材料为软骨相,以β-磷酸三钙/透明质酸纤维为成骨相的双层支架材料,植入兔骨软骨损伤区域后,修复效果良好。LEVINGSTONE等[19]以Ⅰ型胶原/Ⅱ型胶原/透明质酸为软骨相,Ⅰ型胶原/Ⅱ型胶原/羟基磷灰石为中间层,Ⅰ型胶原/羟基磷灰石为成骨相,制备梯度支架。植入损伤区域后12个月完全形成再生软骨下骨,比对照组支架早3个月,软骨下骨和透明软骨在支架植入区整合良好。DU等[20]采用激光烧技术制备聚己内酯微球和羟基磷灰石/聚己内酯微球的多层梯度支架。将该支架植入兔的损伤区域,发现支架可通过早期的骨再生诱导新生软骨形成,且新生软骨与周围组织整合良好。虽然目前已经能模拟出天然软骨复杂的层次结构,但其存在层与层之间的无缝结合难以实现,高连通的孔隙结构难以控制,以及部分原材料在体内难以降解等问题,是研究者们亟待解决的难题。
Cs和Gel是具有良好生物相容性和体内降解性的天然材料,而β-甘油磷酸钠(β-sodium glycerophosphate,GP)则具有成凝胶特性。本研究以上述3种材料为原料,基于多元耦合仿生理念,协同发挥各原料的功能优势,调控各材料间配比,制备在结构上具有梯度渐进性的复合功能性支架材料。同时,为验证支架的生物相容性,将具有多向分化潜能的SD大鼠BMSCs接种于支架以形成细胞-复合支架构建物,对细胞在复合梯度支架上的分布、黏附、铺展和细胞外基质分泌情况分别进行检测,以期为体外构建天然软骨梯度支架材料奠定基础。
2 实验材料和方法 2.1 实验材料壳聚糖(脱乙酰度 > 85%,美国Amresco公司);β-甘油磷酸钠,明胶,溶菌酶(美国Sigma公司);1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐,N-羟基琥珀酰亚胺,2-(吗啉基)乙磺酸(上海麦克林生化科技有限公司);冰乙酸(天津大茂化学试剂厂);磷酸氢二钠(天津科密欧化学试剂有限公司);冷冻干燥机(上海豫明仪器有限公司,FD-1A-50);钨灯丝扫描电镜(美国FEI公司,QUANTA 450);集热式恒温加热磁力搅拌器(巩义予华仪器有限责任公司,DF-101S)。
2.2 梯度支架的制备将Cs溶于
取冷冻干燥后的配比为3:1:2、6:1:3.5、9:1:5、12:1:6.5、15:1:8 Cs/GP/Gel仿生梯度支架,沿纵向维度制成1 mm的薄片样品。将样品喷金处理后,置于钨灯丝扫描电子显微镜下观察支架的微观形貌、孔道结构。加速电压为30 kV,钨灯丝扫描电镜的极限分辨率为3 nm。
2.4 支架材料的吸水率测定用分析天平称量样品干燥状态下质量(m1),样品置于37 ℃的去离子水中24 h后湿态重量(m2)。支架的吸水率Wa由式(1)计算得
| $ W_{\mathrm{a}}=\frac{m_{2}-m_{1}}{m_{1}} \times 100 \% $ | (1) |
将各比重瓶装满无水乙醇(为避免支架自身吸水溶胀产生的误差,用无水乙醇代替水),称重,记为(W1),将质量为(WS)的支架样品浸置于乙醇中,真空脱除支架中由于自身孔道吸收乙醇而产生的气泡。各隔一定时间,取出比重瓶称重,直至支架完全被无水乙醇所饱和,然后再加满无水乙醇,称重,记为(W2)。取出充盈乙醇的样品,称量剩余的乙醇与比重瓶质量,记为(W3)。测试温度下无水乙醇密度为ρ。因此,支架样品本身体积(支架孔壁的固体部分的体积)为VS = (W1–W2 + WS) / ρ,支架样品中孔的体积为VP = (W2–W3–WS) / ρ,支架材料孔隙率P由式(2)计算得
| $ P=\frac{V_{P}}{V_{P}+V_{S}}=\frac{W_{2}-W_{3}-W_{\mathrm{S}}}{W_{1}-W_{3}} \times 100 \% $ | (2) |
称量干燥样品质量(m0),然后将其置于含有2 mg·mL-1溶菌酶的PBS缓冲溶液中,并置于37 ℃恒温恒湿环境中孵育3 d、6 d后取出样品,随后使用去离子水反复清洗后烘干称得t时刻干燥样品质量(mt)。支架材料降解率Dt由式(3)计算得
| $ D_{\mathrm{t}}=\frac{m_{t}-m_{0}}{m_{0}} \times 100 \% $ | (3) |
取70~120 g重SD大鼠,提取股骨来源的BMSCs作为种子细胞,采用全骨髓培养法贴壁培养获取原代BMSCs。本文所用SD大鼠取自大连医科大学SPK动物实验中心,本实验已通过大连理工大学生物与医学伦理审查委员会的审查。将SD大鼠拉颈处死,浸泡到无水乙醇中30 min对其进行消毒;首先,剪开后腿外侧皮肤,取出完整的胫骨和股骨,依次浸置于75%的乙醇和PBS缓冲溶液中15 min,之后用PBS洗涤两遍;再次,剪断胫骨和股骨两端的髌骨,露出骨髓腔,迅速收集骨髓悬液。最后,将获取的含有杂细胞的骨髓悬液接种到细胞培养瓶中,置于37 ℃、5% CO2培养箱中。3 ~ 4 d后,当倒置相差显微镜下观察到大量贴壁铺展的细胞时,进行半量换液以去除培养基中未贴壁的杂细胞;当细胞生长达到基本完全融合后,根据收获的细胞量及实验需要进行传代培养。通过更换培养基来分离和纯化BMSCs,当细胞生长至80%~90%融合后进行传代培养。
2.8 BMSCs与梯度支架复合培养将不同配比的各组Cs/GP/Gel仿生软骨梯度支架材料、对照组Cs/GP/Gel溶液共混支架置于75%乙醇中浸泡消毒,并紫外灭菌12 h。再将其浸泡于PBS缓冲溶液中2 h,然后将其浸润在完全培养基中1 h。调整P3代BMSCs的细胞密度至3.0×105 cells·mL-1,在支架正反两面各接种5 μL细胞悬液。随后将该细胞培养板置于37 ℃、5% CO2培养箱中培养,待细胞黏附到支架上后,补加1 mL完全培养基。根据细胞生长状态以及培养基颜色等决定是否更换培养基,以备进行后续相关检测。
2.9 BMSCs在支架材料上的分布及活性情况检测取接种72 h后细胞梯度支架复合物,使用Calcein/Hoechst/PI染色液对其进行Dead/Live荧光染色。将其置于37 ℃、5% CO2培养箱中孵育30 min后,于倒置荧光显微镜下观察。
同样取接种72 h后细胞梯度支架复合物,2.5%的戊二醛固定,梯度酒精脱水干燥后,进行扫描电镜观察。
2.10 BMSCs在支架材料上的增殖情况检测将P3代BMSCs细胞浓度调整为3.0×107 cells·mL-1,吸取100 μL细胞悬液接种到Cs/GP/Gel梯度支架和共混支架中。然后,将该细胞培养板置于37 ℃、5% CO2培养箱中培养,第1、3、5、7 d同一时间加入CCK-8检测液,置于37 ℃、5% CO2培养箱中孵育3 h,用酶标仪检测各观测孔内溶液的OD值,设置测量波长为450 nm,以不加细胞的空白孔的OD值作为调零值。根据标准曲线计算对应OD值的细胞数目,以培养时间为横坐标、细胞数目为纵坐标将测量结果绘制成BMSCs的生长曲线。
2.11 统计学分析为减少人为因素等带来的偶然误差,所有制备及表征实验都至少平行进行3次。实验结果用X±s表示,数据用OriginPro 9.0软件进行统计学分析,采用t检验法对数据进行统计学显著性差异比较,*P < 0.05认为有显著性差异,**P < 0.01认为有较大显著性差异,***P < 0.001认为有极大显著性差异。
3 结果与讨论 3.1 支架材料的扫描电镜观察图 1为Cs/GP/Gel仿生软骨梯度支架材料的扫描电镜图。从图 1(a)~(c)中可以看出,在纵向维度上,梯度支架材料的孔径呈现出明显的梯度渐进性,且梯度渐进性a(3:1:2) < b(6:1:3.5) < c(9:1:5),孔道立体性a < b < c;从图 1(a3)~(c3)中可以看出支架表层孔径较小,孔壁较厚,提供的细胞附着位点数较少;从图 1(a3)~(c3)中可以看出支架中间层出现纤维状结构,孔径加大,提供的细胞附着位点数较充足;从图 1(a4)~(c4)中可以看出支架深层孔径进一步加大,孔壁较薄,孔道相互贯通,该孔道结构有利于软骨细胞向成骨细胞的转变,从而在软骨钙化层的隔离下向软骨真实生理分层结构中的软骨下骨层过渡。从图 1(d1)中可以看出该梯度支架材料开始出现纤维状结构,其孔径明显大于上述支架材料的孔径,但是生理分层现象已经不太明显。随着Cs含量的增加,梯度支架材料的孔径逐渐增大。图 1(e1)无明显生理分层现象和孔径的梯度渐进性,孔径较均匀。图f为骨软骨组织的横截面示意图,可以看出软骨组织分为表层,中间层和深层[22]。由于Cs所占比例过大,导致有细小颗粒析出。Cs:GP:Gel = 18:1:9.5配比的梯度支架材料孔径较大,无法截留大多数细胞,所以未对其进行后续的扫描电镜观察。
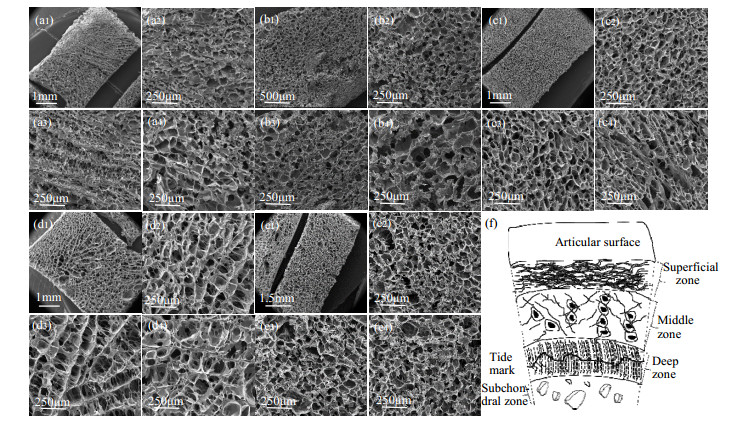
|
图 1 Cs/GP/Gel仿生软骨梯度支架材料的SEM图片 Fig.1 SEM images of the Cs/GP/Gel biomimetic cartilage gradient scaffolds ((a1)~(a4): 3:1:2; (b1)~(b4): 6:1:3.5 (c1)-(c4): 9:1:5; (d1)~(d4): 12:1:6.5; (e1)~(e4): 15:1:8, (a1)~(d1): overall morphology, ×50; (a2)~(d2): surface morphology, ×200; (a3)~(d3): morphology in the middle layer, ×200; (a4)~(d4): morphology in the deep layer, ×200) |
扫描电镜结果说明采用调控单层溶液浓度制备的比例为3:1:2、6:1:3.5、9:1:5的Cs:GP:Gel梯度支架有着与天然骨软骨组织相似的分层结构[21],且制备的梯度支架材料各个层之间的界面难以区分,实现了层与层之间的无缝衔接。已有研究者[22-23]证明无缝集成的梯度支架强度优于单独层支架材料。因此本研究制备的该3种比例的梯度支架材料结构方面适宜作为软骨修复材料。
3.2 支架材料吸水率和孔隙率检测支架材料的吸水率和孔隙率对于细胞的粘附生长等具有一定影响[3]。较高的吸水率可以为支架上的细胞提供充足的营养物质,梯度孔隙率可促进特定的细胞迁移[24]。Cs/GP/Gel仿生软骨梯度支架材料和对照组Cs/GP/Gel支架材料的吸水率结果如图 2(a)所示,随着Cs含量的增多,支架的吸水率均呈现先增后减的趋向。梯度支架的吸水率均介于(584.24±3.79)% ~ (677.47±1.70)%,明显高于对照组支架的吸水率(325.12±2.73)% ~ (558.35±11.09)%。这是由于梯度支架材料更为疏松多孔,自身的孔道结构更为复杂,够吸收更多的水分。Cs:GP:Gel配比为9:1:5的梯度支架吸水率高达677.47%,说明该梯度支架可以更充分地吸收培养基,为支架上的细胞提供充足的营养物质供应。
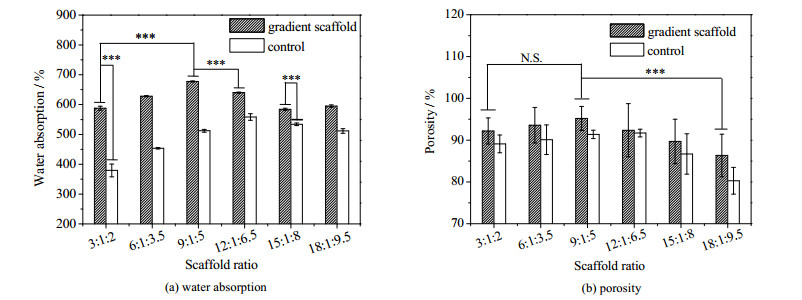
|
图 2 Cs/GP/Gel仿生软骨梯度支架材料的吸水率和孔隙率 Fig.2 Water absorption and porosity of the Cs/GP/Gel biomimetic cartilage gradient scaffold materials ***: most significant difference, P < 0.001; **: most significant difference, P < 0.01; N.S.: no significant difference, P≥ 0.05. |
Cs/GP/Gel仿生软骨梯度支架材料和对照组Cs/GP/Gel支架材料的孔隙率测定结果如图 2(b)所示。由于制备梯度支架时初始材料Cs、GP和Gel含量不同,制备的混合液浓度也不相同,所以各混合液的含水量不同。因此当混合液预冻结晶时,由于含水量不同,含水量多的混合液结的冰晶相对较大,反之,结的冰晶相对较小,所以制备出的支架孔隙大小有差异。结果表明,随着Cs含量的增多,支架的孔隙率变化与吸水率相同。梯度孔径支架的孔隙率都介于(86.34±5.10)% ~ (95.20±2.86)%,高于对照组支架的孔隙率(76.20±3.12)% ~ (91.71±0.91)%。这是由于梯度支架材料在纵向维度上呈现梯度渐进性,整体的孔密度在加权平均之后较均匀。Cs:GP:Gel配比为9:1:5的梯度支架孔隙率高达95.2%,说明该梯度支架可以为细胞的黏附增殖等提供更大的比表面积,从而诱导形成新的再生软骨组织。
3.3 支架材料的降解率检测图 3为Cs/GP/Gel仿生软骨梯度支架材料和对照组的降解率曲线图。从图 3(a)、(b)中均可看出,随着时间的延长,各支架材料的降解率均增高。Cs/GP/Gel梯度支架降解速率共分为两个阶段:第1周降解迅速,这是由于支架在第1阶段易于与周围的软骨组织和周围营养液整合,或在此基础上形成新生软骨组织。第2周明显减慢,支架第1周在酶的作用下被分散成水凝胶状的较小链段和低聚物,随即该物质被进一步降解,直至被完全吸收或代谢。对比图 3(a)和3(b)发现,梯度支架材料的降解速率和降解率均高于对照组支架的降解速率和降解率。这是由于梯度支架材料的孔道结构较疏松,更有利于降解。综上,结合这些材料的物理特性,包括其孔结构、吸水率和孔隙率等,配比为Cs:GP:Gel =9:1:5的支架材料更适宜作为软骨缺损的修复材料。
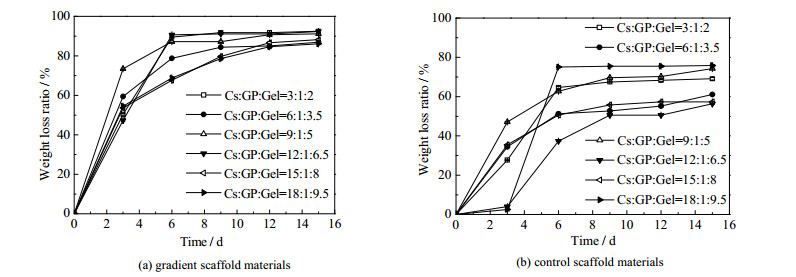
|
图 3 Cs/GP/Gel仿生软骨支架材料的降解率 Fig.3 Profiles of weight loss ratio of the Cs/GP/Gel biomimetic cartilage scaffold materials |
本研究以Cs和Gel作为梯度支架的基础材料,优势在于其能够为细胞提供天然结合位点且降解后无有害降解产物生成[26-27]。通过将P3代BMSCs接种于该梯度支架(Cs:GP:Gel=9:1:5)上观测其培养72 h的死活和伸展情况以考察其生物相容性。图 4为P3代BMSCs在梯度支架材料上72 h的分布及活性。对比图 4(a1)和4(b1)可看出,细胞数目在孔径的纵向维度方向呈现出梯度排列(图 4(a1)中箭头所示方向)。且不同细胞之间形成类似天然软骨中胶原纤维的趋势,这有利于新生软骨组织的生成。还发现梯度支架上细胞的铺展状态等生长情况优于对照组的细胞,该结果与前人研究一致[13]。从图 4(a5)、4(a6)和4(b5)、4(b6)中可以看出,72 h时BMSCs已基本完全黏附并铺展在支架表面上,证实了该支架具有良好的生物相容性[28]。梯度支架和对照胶原支架之间观察到细胞数目差异很小,梯度支架结构不影响其生物相容性。图 4(c)为细胞在支架上生长的定量分析,可发现梯度支架材料上的活细胞数目略多于对照组支架上的细胞数目。由图 4(c)可以看出,第3天的细胞生长速率最低,是由于BMSCs进入一个全新的生长环境,需要一个潜伏期来适应这种生长环境的改变,以便再一次进行粘附、贴壁和铺展过程。第3天之后便进入BMSCs的对数生长期,BMSCs开始快速增殖,Cs/GP/Gel梯度支架和共混支架为细胞的生长增殖提供了充足的空间。说明制备的梯度支架材料接近于天然软骨的真实构造,适宜用作软骨仿生梯度支架材料。
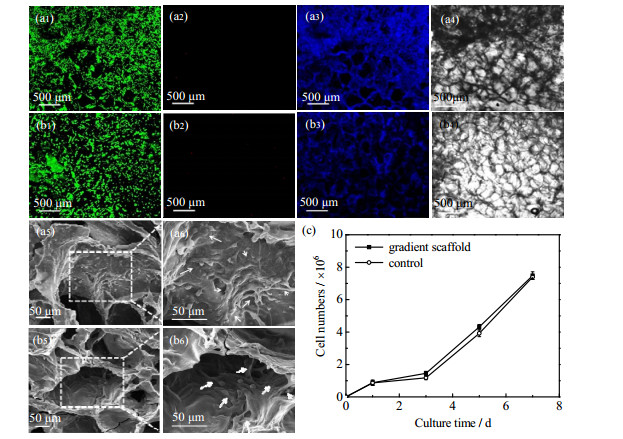
|
图 4 BMSCs在仿生软骨梯度支架材料上的分布、活性及增值情况 Fig.4 Distribution, activity and proliferation of BMSCs in biomimetic cartilage gradient scaffold materials (a1)~(a6): Cs/GP/Gel biomimetic cartilage gradient scaffold materials (Cs:GP:Gel = 9:1:5); (b1)~(b6): Cs/GP/Gel solution blending scaffold materials (Cs:GP:Gel = 9:1:5); (a1)~(b1) Calcein-AM, (a2-b2) PI, (a3)~(b3) Hoechst, (a4)~(b4) Bright field; Scale: (a1)~(a4), (b1)~(b4) 500 μm; (a5)~(a6), (b5)~(b6) 50 μm |
本研究通过调控单层溶液浓度成功制备了Cs/GP/Gel梯度支架材料,模拟了类似天然软骨的真实生理结构。该支架具有适宜的吸水率[(584.24±3.79)%~(677.47±1.70)%]、孔隙率[(86.34±5.10)% ~ (95.20±2.86)%]和降解率[(86.09±2.46)%~(92.48±3.86)%]。通过进一步优化材料发现,当Cs/GP/Gel配比为9:1:5时,该梯度支架吸水率、孔隙率尤佳。因此,此配比适于作为骨软骨体外制备与构建的基础支撑材料。且BMSCs在此支架上粘附和伸展状况良好,进一步证实其具有良好的生物相容性。本研究制备的具有仿生生理分层结构的梯度支架,为软骨特定分级结构的设计和研究提供了新的思路。
| [1] |
KIM M, FARRELL M J, STEINBERG D R, et al. Enhanced nutrient transport improves the depth-dependent properties of tri-layered engineered cartilage constructs with zonal co-culture of chondrocytes and MSCs[J]. Acta Biomaterialia, 2017, 58: 1-11. DOI:10.1016/j.actbio.2017.06.025 |
| [2] |
SCAFFARO R, LOPRESTI F, BOTTA L, et al. Integration of PCL and PLA in a monolithic porous scaffold for interface tissue engineering[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2016, 63: 303-313. DOI:10.1016/j.jmbbm.2016.06.021 |
| [3] |
LIAO J, TIAN T, SHI S, et al. The fabrication of biomimetic biphasic CAN-PAC hydrogel with a seamless interfacial layer applied in osteochondral defect repair[J]. Bone Research, 2017, 5: 17018. DOI:10.1038/boneres.2017.18 |
| [4] |
ZHANG S, CHEN L, JIANG Y, et al. Bi-layer collagen/microporous electrospun nanofiber scaffold improves the osteochondral regeneration[J]. Acta Biomaterialia, 2013, 9(7): 7236-7247. DOI:10.1016/j.actbio.2013.04.003 |
| [5] |
YIN D, WU H, LIU C, et al. Fabrication of composition-graded collagen/chitosan-polylactide scaffolds with gradient architecture and properties[J]. Reactive & Functional Polymers, 2014, 83: 98-106. |
| [6] |
MIMURA T, IMAI S, KUBO M, et al. A novel exogenous concentration-gradient collagen scaffold augments full-thickness articular cartilage repair[J]. Osteoarthritis and Cartilage, 2008, 16(9): 1083-1091. DOI:10.1016/j.joca.2008.02.003 |
| [7] |
ZHOU J, XU C, WU G, et al. In vitro generation of osteochondral differentiation of human marrow mesenchymal stem cells in novel collagen-hydroxyapatite layered scaffolds[J]. Acta Biomaterialia, 2011, 7(11): 3999-4006. DOI:10.1016/j.actbio.2011.06.040 |
| [8] |
DI L A, SZLAZAK K, LORENZO M I, et al. Influencing chondrogenic differentiation of human mesenchymal stromal cells in scaffolds displaying a structural gradient in pore size[J]. Acta Biomaterialia, 2016, 36: 210-219. DOI:10.1016/j.actbio.2016.03.014 |
| [9] |
SCAFFARO R, LOPRESTI F, BOTTA L, et al. Preparation of three-layered porous PLA/PEG scaffold: Relationship between morphology, mechanical behavior and cell permeability[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2016, 54: 8-20. DOI:10.1016/j.jmbbm.2015.08.033 |
| [10] |
YUCEKUL A, OZDIL D, KUTLU N H, et al. Tri-layered composite plug for the repair of osteochondral defects: In vivo study in sheep[J]. Journal of Tissue Engineering, 2017, 8: 1-10. |
| [11] |
刘学清, 刘继延. 壳聚糖/聚乙烯醇梯度材料的制备及表征[J]. 塑料工业, 2008(10): 20-23. LIU X Q, LIU J Y. Preparation and characterization of chitosan/polyvinyl alcohol gradient material[J]. China Plastics Industry, 2008(10): 20-23. DOI:10.3321/j.issn:1005-5770.2008.10.006 |
| [12] |
程文则.聚己内酯/壳聚糖梯度支架的制备及其性能研究[D].武汉: 华中科技大学, 2013. CHENG W Z. Study on the structure and property of polycaprolactone/chitosan gradient scaffold[J]. Wuhan: Huazhong University of Science and Technology, 2013. |
| [13] |
BI L, LI D, LIU J, et al. Fabrication and characterization of a biphasic scaffold for osteochondral tissue engineering[J]. Materials Letters, 2011, 65(13): 2079-2082. DOI:10.1016/j.matlet.2011.04.013 |
| [14] |
ZHU Y, WAN Y, ZHANG J, et al. Manufacture of layered collagen/chitosan-polycaprolactone scaffolds with biomimetic microarchitecture[J]. Colloids and Surfaces B-Biointerfaces, 2014, 113: 352-360. DOI:10.1016/j.colsurfb.2013.09.028 |
| [15] |
HAN F, ZHOU F, YANG X, et al. A pilot study of conically graded chitosan-gelatin hydrogel/PLGA scaffold with dual-delivery of TGF-beta 1 and BMP-2 for regeneration of cartilage-bone interface[J]. Journal of Biomedical Materials Research Part B-Applied Biomaterials, 2015, 103(7): 1344-1353. DOI:10.1002/jbm.b.33314 |
| [16] |
GUO J, LI C, LING S, et al. Multiscale design and synthesis of biomimetic gradient protein/biosilica composites for interfacial tissue engineering[J]. Biomaterials, 2017, 145: 44-55. DOI:10.1016/j.biomaterials.2017.08.025 |
| [17] |
ROWLAND C R, COLUCCI L A, GUILAK F. Fabrication of anatomically-shaped cartilage constructs using decellularized cartilage-derived matrix scaffolds[J]. Biomaterials, 2016, 91: 57-72. DOI:10.1016/j.biomaterials.2016.03.012 |
| [18] |
LIU S, WU J, LIU X, et al. Osteochondral regeneration using an oriented nanofiber yarn-collagen type Ⅰ/hyaluronate hybrid/TCP biphasic scaffold[J]. Journal of Biomedical Materials Research Part A, 2015, 103(2): 581-592. DOI:10.1002/jbm.a.35206 |
| [19] |
LEVINGSTONE T J, RAMESH A, BRADY R T, et al. Cell-free multi-layered collagen-based scaffolds demonstrate layer specific regeneration of functional osteochondral tissue in caprine joints[J]. Biomaterials, 2016, 87: 69-81. DOI:10.1016/j.biomaterials.2016.02.006 |
| [20] |
DU Y, LIU H, YANG Q, et al. Selective laser sintering scaffold with hierarchical architecture and gradient composition for osteochondral repair in rabbits[J]. Biomaterials, 2017, 137: 37-48. DOI:10.1016/j.biomaterials.2017.05.021 |
| [21] |
SEO S J, MAHAPATRA C, SINGH R K, et al. Strategies for osteochondral repair: Focus on scaffolds[J]. Journal of Tissue Engineering, 2014, 5: 1-14. |
| [22] |
LEVINGSTONE T J, MATSIKO A, DICKSON G R, et al. A biomimetic multi-layered collagen-based scaffold for osteochondral repair[J]. Acta Biomaterialia, 2014, 10(5): 1996-2004. DOI:10.1016/j.actbio.2014.01.005 |
| [23] |
ARMIENTO A R, STODDART M J, ALINI M, et al. Biomaterials for articular cartilage tissue engineering: Learning from biology[J]. Acta Biomaterialia, 2017, 65: 1-20. |
| [24] |
SULTAN S, MATHEW A P. 3D printed scaffolds with gradient porosity based on a cellulose nanocrystal hydrogel[J]. Nanoscale, 2018, 10(9): 4421-4431. DOI:10.1039/C7NR08966J |
| [25] |
GALPERIN A, OLDINSKI R A, FLORCZYK S J, et al. Integrated bi‐layered scaffold for osteochondral tissue engineering[J]. Advanced Healthcare Materials, 2013, 2(6): 872-883. DOI:10.1002/adhm.201200345 |
| [26] |
MELLATI A, FAN C M, TAMAYOL A, et al. Microengineered 3D cell-laden thermoresponsive hydrogels for mimicking cell morphology and orientation in cartilage tissue engineering[J]. Biotechnology and Bioengineering, 2017, 114(1): 217-231. DOI:10.1002/bit.26061 |
| [27] |
KUTTAPPAN S, MATHEW D, NAIR M B. Biomimetic composite scaffolds containing bioceramics and collagen/gelatin for bone tissue engineering-A mini review[J]. International Journal of Biological Macromolecules, 2016, 93: 1390-1401. DOI:10.1016/j.ijbiomac.2016.06.043 |
| [28] |
CHENG N C, LIN W J, LING T Y, et al. Sustained release of adipose-derived stem cells by thermosensitive chitosan/gelatin hydrogel for therapeutic angiogenesis[J]. Acta Biomaterialia, 2017, 51: 258-267. DOI:10.1016/j.actbio.2017.01.060 |




