近年来,氮杂芳环含能化合物的设计、合成及性能研究备受单质含能化合物研究领域的关注[1-3]。氮杂芳环化合物包括含吡唑、咪唑、呋咱、三唑、四唑、五唑、三嗪和四嗪等杂环的化合物,此类化合物的分子中存在多个反应位点,可引入不同的含能基团(如硝基、硝胺基、硝酸酯基、偕二硝基、硝仿乙基等)对分子结构进行修饰,从而可设计、合成出结构多样性能较好的含能衍生物[4-11]。氮杂芳环化合物结构中含有大量的C=N、N-N和N=N键,具有较高的正生成热,同时对摩擦、静电火花钝感和对热稳定,高氮、低碳氢含量使其更容易达到氧平衡,分解产物主要为氮气,且产气量较大,清洁无污染,未来在混合炸药、固体推进剂和气体发生剂等领域具有广阔的应用前景。
研究表明,氮杂芳环化合物随着氮原子数目的增加(从吡唑到五唑),含能化合物能量水平提升的同时,感度也随之升高、稳定性变差。因此,研究者希望通过向分子中引入不同取代基团来调节能量和感度的平衡。近年来的实验发现,在氮杂芳环化合物分子NH位点上引入“N-NH2(N-NHR)”结构单元及进一步衍生化,能够显著改善化合物的能量水平、热稳定性或感度性能[12-15]。主要体现在:(1)向氮杂芳环化合物中引入氨基,可增加氮含量,分子中形成更多的N-N键,使化合物具有更高的正生成热;同时,分子内或分子间形成大量氢键,提高化合物晶体密度,进一步提高爆轰性能;氨基可进一步衍生成硝基、硝胺基、叠氮基、三硝基乙氨基等含能基团,设计出结构多样的含能化合物;(2)氮杂芳环化合物结构中大多含有亚氨基(-NH-),受杂环本身和吸电子取代基的影响,具有一定的酸性,导致长储过程中的不稳定性,氨基的引入可以显著降低酸性,提高长储稳定性;(3)氮杂芳环化合物中引入N-氨基,氨基中的氢原子与分子中硝基、硝酸酯基等基团中的N、O原子形成更多分子内或分子间氢键,可进一步降低化合物的感度,同时提高化合物的热稳定性[16-19]。
国外氮杂芳环化合物的N-氨化物研究较早,国内只是跟踪、仿研了少数性能较优的典型化合物。本文系统总结了国内外关于氮杂芳环化合物的N-氨化物及其含能衍生物的研究现状。
2 氮杂芳环N-氨化物向氮杂芳环化合物分子中引入N-NH2结构单元,目前国内外涉及氮杂芳环底物的种类相对单一、数量较少。根据逆合成分析,可以归结为两种合成策略:一是先引入N-NH2结构单元然后环化,即“氨化环化法”;二是先构建氮杂芳环,然后选择不同N-氨化体系在分子中引入N-NH2结构单元,即“直接氨化法”。
2.1 氨化环化法采用“氨化环化法”的合成策略,向氮杂芳环分子中引入N-NH2结构单元,首先在分子中引入肼、腙、双腙等含N-NH2的结构单元,然后通过分子内或分子间的环加成、缩合等反应实现环化过程。目前,尚未见关于吡唑、咪唑、吡嗪类化合物的相关文献报道,只有少数关于三唑(1, 2, 4-三唑、1, 2, 3-三唑)和四唑化合物的研究。
(1) 三唑-N-氨化物的合成
以有机羧酸(甲酸、乙酸等)和水合肼为原料,经高温缩合反应、高温常压蒸馏、减压蒸馏等系列苛刻操作,最后制备出一系列带不同取代基的3, 5-二取代-4-氨基-1, 2, 4-三唑化合物[20-22] (Scheme 1)。
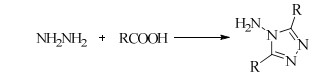
|
Scheme 1 |
以乙二醛、水合肼为起始原料,首先反应得到乙二醛双腙衍生物,经活性MnO2催化氧化、成环反应制备出1-氨基-1, 2, 3-三唑[23-26](Scheme 2)。
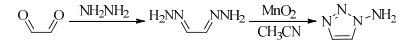
|
Scheme 2 |
(2) 四唑-N-氨化物的合成
以苯甲醛、水合肼为原料,经缩合反应合成中间体苯甲腙,然后在原甲酸三乙酯存在下,与叠氮化钠发生成环反应生成苯甲胺基四唑,最后在盐酸中水解获得1-氨基四唑[27-29] (Scheme 3)。
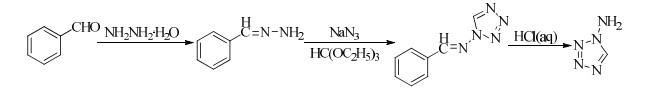
|
Scheme 3 |
以氨基硫脲为原料,首先在氧化铅、叠氮化钠作用下生成碳二亚胺,在与反应过程中生成的HN3反应,生成1, 5-二氨基四唑(DA15T)[30]。后来,研究者对DA15T的合成工艺进行了改进,以二氨基胍盐酸盐为原料,与亚硝酸钠、浓盐酸在低温条件下重氮化制备DA15T[31-32] (Scheme 4)。
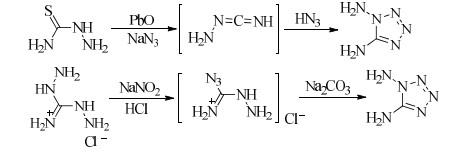
|
Scheme 4 |
(3) 连-1, 2, 4-三唑-N-氨化物的合成
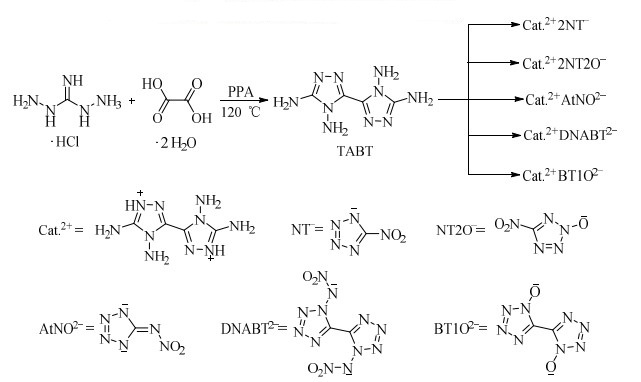
以二氨基胍盐酸盐和草酸二水合物为原料,在五氧化二磷的磷酸体系中,升温至120 ℃反应4 h,然后经冰水稀释、碱性中和、盐酸或草酸重结晶、高温真空干燥过夜、碱液高温煮洗等一系列操作过程,生成4, 4′, 5, 5′-四氨基-3, 3′-双-1, 2, 4-三唑(TABT) (Scheme 5),收率仅为19.6%[33-34]。
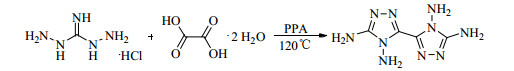
|
Scheme 5 |
采用“氨化环化法”向氮杂芳环分子中引入N-NH2结构单元,国内外文献报道的较少,且利用此合成策略设计、合成N-NH2化合物难度较大,可设计、合成的氮杂芳环化合物种类和数量受限制条件较多,通常需高温、高压、催化等苛刻条件。因此,向氮杂芳环分子中引入N-NH2结构单元,首选是“直接氨化法”,即首先构建含不同取代基的氮杂芳环母体,然后采用N-氨化反应引入N-NH2单元。目前常用的N-氨化剂有:羟胺-O-磺酸(HOSA)、对甲基苯磺酰羟胺(THA)、三甲基苯磺酰羟胺(MSH)等。
(1) 羟胺-O-磺酸(HOSA)
HOSA是一种白色或类白色固体,易溶于水,极易吸潮,室温下在水溶液中缓慢分解,温度升高则加速分解,干燥状态下可长期保存。作为N-氨化试剂,可在碳、氮、硫、磷原子上引入氨基,氨化能力较弱,主要用于富电子氮杂芳环的N-氨化反应。研究者利用HOSA与氮杂芳环底物或其含能盐,通过N-氨化反应制备了多种氮杂芳环N-氨化物,但是普遍收率较低。如LI YA-NAN等[35]用取代的硝基吡唑、硝基三唑与HOSA反应合成出相应的N-氨化物,收率仅在10%~40%;RAYMOND等[36]以四唑钠盐为起始物,与HOSA反应生成了1-氨基四唑,收率不足20%;KUZ′MENKO等[37]用HOSA对1, 2, 3-三唑进行N-氨化反应制备1-氨基-1, 2, 3-三唑,得到1-氨基-1, 2, 3-三唑和2-氨基-1, 2, 3-三唑的混合物,且产率极低;RAAP等[38]以5-氨基四唑的钠盐为原料,与HOSA反应得到了1, 5-氨基四唑(DAT),但反应同时产生难以分离的副产物2, 5-二氨基四唑,DAT收率仅有8.5%。(Scheme 6)
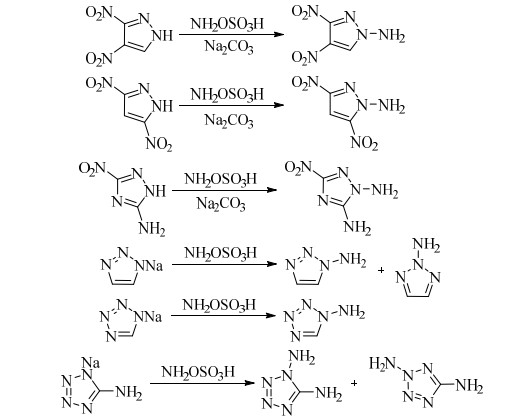
|
Scheme 6 |
(2) 对甲基苯磺酰羟胺(THA)
THA是一种白色固体,室温下不稳定,容易分解,使用时通常需现制现用,为了防止发生分解现象,多数情况下都是将其制成溶液存放,具有较强的氨化能力。国内外研究者目前使用的较多,例如ZHAO等[39-40]用THA与3, 5-二硝基吡唑的铵盐反应制备了1-氨基-3, 5-二硝基吡唑,收率为50%;ZHANG等[41]用THA与4-叠氮基(硝基)-5-硝基-1, 2, 3-三唑的铵盐反应分别制备了2-氨基-4-叠氮基-5-硝基-1, 2, 3-三唑和2-氨基-4, 5-二硝基-1, 2, 3-三唑,收率分别为75%和55%;KLAPÖTKE等[42]采用THA与5-硝基四唑的铵盐反应合成了2-氨基-5-硝基四唑,收率为50%,采用THA与5, 5′-双四唑的钠盐反应得到了两种产物1, 1′-二氨基-5, 5′-双四唑和1, 2-二氨基-5, 5′-双四唑,收率分别为10%和6%。(Scheme 7)
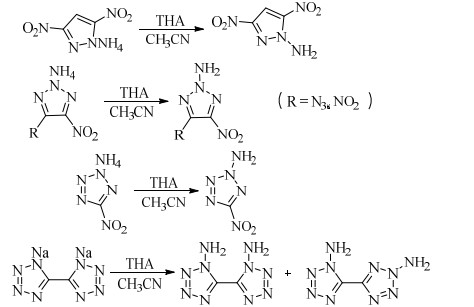
|
Scheme 7 |
(3) 三甲基苯磺酰羟胺(MSH)
MSH是一种白色针状晶体,其熔点为59.9 ℃,热分解峰温为70.5 ℃,干燥状态下较THA稳定性好。作为一种具有较强氨化能力的N-氨化试剂,主要用于缺电子氮杂芳环底物的N-氨化反应。MENDIOLA等[43]利用MSH与3-取代吡啶反应制备了N-氨基取代吡啶的三甲基苯磺酸盐;贺云等[44]采用3, 5-二硝基-1, 2, 4-三唑钠盐与MSH反应合成出1-氨基-3, 5-二硝基-1, 2, 4-三唑,收率为66.0%;蒋涛等[45]以3, 5-二硝基吡唑钠盐与MSH制备出1-氨基-3, 5-二硝基吡唑,收率为60.7%;景梅等[46]以2, 4-二硝基咪唑钾盐与MSH反应得到1-氨基-2, 4-二硝基咪唑,收率为57.8%。(Scheme 8)
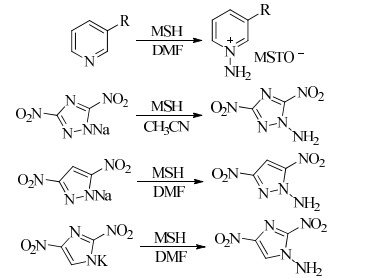
|
Scheme 8 |
氮杂芳环N-氨化物大多具有氮含量高、正生成热大、对热稳定等特点,分子中含有N-氨基,利用氨基的反应活性,可进一步衍生成硝胺基、三硝基乙氨基、氧化偶氮基等含能基团,从而获得结构多样、性能各异的含能衍生物[47-54]。
3.1 N-三硝基乙氨基含能衍生物的合成及性能利用N-氨基的反应活性,通过与三硝基乙醇的缩合反应,生成含三硝基乙氨基官能团的含能衍生物,文献报道了多种化合物的合成及性能。
PING等[55]以硝基咪唑为原料,经N-氨化反应制备了N-氨基硝基咪唑含能化合物,然后N-氨基与三硝基乙醇的缩合反应,进一步合成了N-三硝基乙氨基硝基咪唑含能衍生物(Scheme 9),对合成的化合物进行了完整的结构表征、热性能、感度和爆轰性能研究。结果表明,N-氨基硝基咪唑化合物的撞击感度均大于40 J,热分解温度在140~308 ℃;而N-三硝基乙氨基咪唑化合物具有较高的密度和爆轰性能,晶体密度在1.75~1.84 g·cm-3,爆压在27.6 ~35.9 GPa,爆速在7 815~8 659 m·s-1,分解温度在136~172 ℃,相比与TNT和TATB具有较好的爆轰性能。
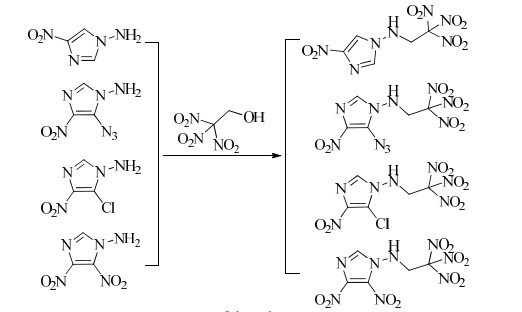
|
Scheme 9 |
PING等[56]以硝基取代吡唑或三唑的N-氨化物为原料,与三硝基乙醇反应制备了一系列N-三硝基乙氨基硝基吡唑或三唑含能化合物(Scheme 10),对化合物的结构、感度、热性能和爆轰性能做了全面的研究。结果显示,该系列化合物密度在1.74~1.83 g·cm-3,生成热184.6~565.6 kJ·mol-1,爆压27.4 ~35.6 GPa,爆速8 174~9 053 m·s-1,撞击感度7 J ~40 J,摩擦感度80 N~360 N,部分化合物综合性能优于黑索金(RDX),可作为潜在高能量密度材料使用。
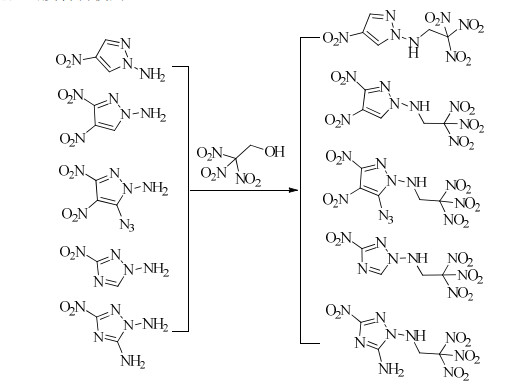
|
Scheme 10 |
GÖBEL等[57]以1, 5-二氨基四唑为原料,与三硝基乙醇发生缩合反应合成了两种N-NH2含能衍生物:N-三硝基乙基-1, 5-二氨基四唑(TTD)和N, N′-双(三硝基乙基)-1, 5-二氨基四唑(BTTD)(Scheme 11),对2种化合物的晶体结构、热性能和爆轰性能进行了详细的研究,TTD的晶体密度为1.831 g·cm-3,生成热为430.5 kJ·mol-1,理论爆速和爆压分别为9 194 m·s-1和37.0 GPa;BTTD的晶体密度为1.897 g·cm-3,生成热为435.7 kJ·mol-1,理论爆速和爆压分别为9 323 m·s-1和38.8 GPa。
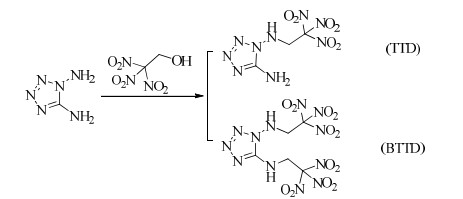
|
Scheme 11 |
FISCHER等[58]以甲酸二甲酯为原料,经肼解、缩合、氯化、叠氮化、环化、硝解、碱解等反应,制备了高氮含量的四唑钾盐化合物— 1, 1′-二硝氨基-5, 5′-双四唑二钾盐(K2DNABT) (Scheme 12),对其物化及爆轰性能进行了详细的研究,并与典型起爆药叠氮化铅的性能进行了对比研究。结果表明,K2DNABT具有更好的综合性能,其氮含量50.3%,密度2.11 g·cm-3,热分解温度200 ℃,爆压31.7 GPa,爆速8 330 m·s-1,爆炸气体体积489 L·kg-1。
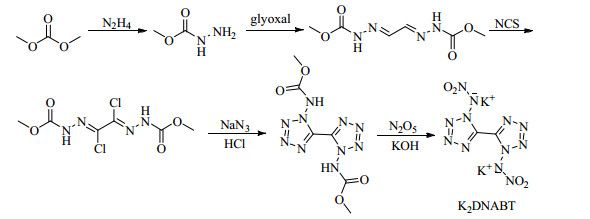
|
Scheme 12 |
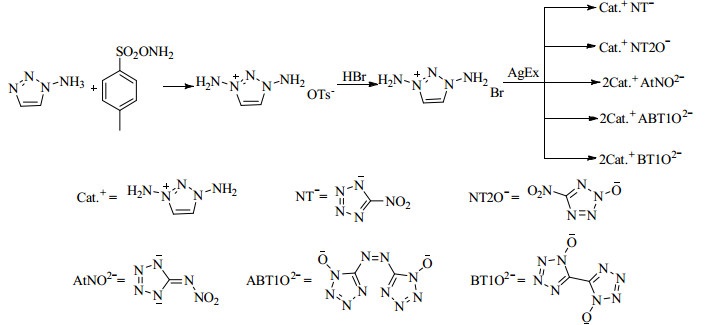
KLAPÖTKE等[59]以1-氨基-1, 2, 3-三唑为原料,与对甲苯磺酰羟胺发生氨化反应合成了1, 3-二氨基-1, 2, 3-三唑对甲苯磺酸盐,并进一步与2-羟基-5-硝基四唑、TKX-50、1, 1′-二羟基-5, 5′-偶氮双四唑、5-硝氨基四唑等的银盐发生复分解反应制备了相应的含能离子化合物(Scheme 13)。性能系统研究表明,该系列化合物具有非常高正的生成热,综合性能优良,特别是其中1, 3-二氨基-1, 2, 3-三唑1, 1′-二羟基-5, 5′-偶氮双四唑盐,其密度1.739 g·cm-3,氮含量70.69%,热分解温度185 ℃,生成热1 755.8 kJ·mol-1,爆压33.6 GPa,爆速9013 m·s-1。因此,可考虑未来作为新型含能材料中的燃料组分使用。
|
Scheme 13 |
KLAPÖTKE等[30]以二氨基胍盐酸盐和草酸二水合物为原料,经缩合反应合成了4, 4′, 5, 5′-四氨基-3, 3′-双-1, 2, 4-三唑(TABT),以其为阳离子,与2-羟基-5-硝基四唑、5-硝基四唑、5-硝氨基四唑、1, 1′-二硝氨基-5, 5′-双四唑、TKX-50等制备了多种含能离子化合物(Scheme 14)。系统研究了该类化合物的结构、热性能、感度及爆轰性能,结果表明,该类化合物的密度1.746~1.870 g·cm-3,氮含量为52.2%~71.4%,热分解温度介于200~342 ℃,生成热为301.5~1 107.7 kJ·mol-1,爆速为8 237 ~9 053 m·s-1,撞击感度大多在6 ~40 J,摩擦感度大多为360 N。研究结果表明,此类化合物具有较高的密度、较好的热稳定性、较高的生成热和较低的机械感度,有望作为一类新型的高能低感含能材料使用。
|
Scheme 14 |
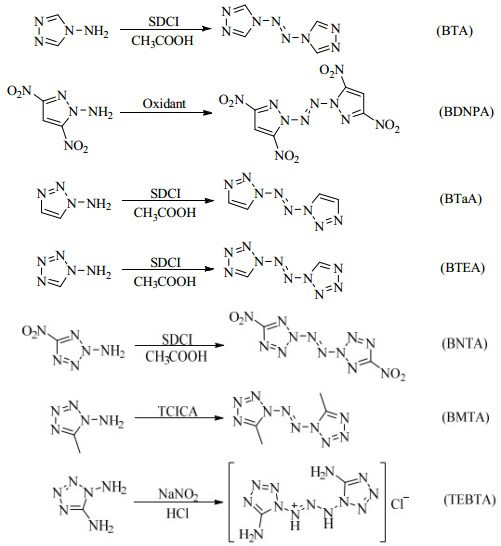
氮杂芳环N-氨化物除可形成N-硝氨基、N-三硝基乙氨基及含能盐衍生物外,含能材料研究者利用N-氨基的氧化偶联反应,设计、制备了一系列分子中含N-N=N-N结构、性能独特的氮杂芳环化合物[60]。LI等[61-63]在二氯异氰尿酸钠和醋酸(SDCI/CH3COOH)体系中,氧化4-氨基-1, 2, 4-三唑制备了4个氮原子相连(N4)的4, 4′-偶氮基双(1, 2, 4-三唑)(BTA)。LI等[64]采用不同的氧化剂,氧化1-氨基-3, 5-二硝基吡唑制备了6个氮原子相连(N6)的1, 1′-偶氮基双(3, 5-二硝基吡唑)(BDNPA)。LI等[65]用SDCI/CH3COOH体系氧化1-氨基-1, 2, 3-三唑制备了8个氮原子相连(N8)的1, 1′-偶氮基双(1, 2, 3-三唑)(BTaA)。KLAPÖTKE等[42, 66]采用SDCI/CH3COOH体系分别氧化1-氨基四唑和2-氨基-5-硝基四唑,分别制备了1, 1′-偶氮基双四唑(BTEA)和1, 1′-偶氮基双(5-硝基四唑)(BNTA);TANG等[67]首次采用三氯异氰酸体系作为N-NH2的氧化剂,通过氧化1-氨基-5-甲基四唑制备了1, 1′-偶氮基双(5-甲基四唑)(BMTA)等含有10个氮原子相连(N10)的含能化合物;随后,TANG等[68]对1, 5-二氨基四唑进行重氮化反应时,意外获得了目前含最长氮原子相连(N11)的N-NH2衍生物—1, 1′-(三氮-1-烯-1, 3-二基)双(5-氨基四唑)(TEBTA)(见Scheme 15)。研究者对目标产物进行了结构表征和性能研究(见表 1)。晶体结构表明,目标化合物的芳香性并不局限于氮杂环内,而是两个氮杂环和偶氮键一起构成一个大的离域共轭体系。此外,研究发现偶氮键的引入不仅能够增加化合物的密度和生成热,而且偶氮键连接于杂环氮原子比连接于杂环碳原子,更有利于提高多氮化合物的密度和生成热。
|
Scheme 15 |
|
|
表 1 含N-N=N-N结构化合物的性能 Table 1 Properties of energetic compounds with N-N=N-N structure |
从表 1的数据可以看出,在不考虑取代基影响的情况下,从直接相连4个氮原子的BTA到8个氮原子的BTaA,再到10个氮原子相连的BTEA,化合物的密度、生成热、爆压和爆速都逐渐增大,热分解温度则逐渐降低。由此可见,在含有N-N=N-N结构的氮杂芳环化合物中,分子中直接相连的氮原子数目越多,化合物的含能性质就越突出,但化合物的热稳定性则逐渐降低。目前,直接相连11个氮原子是最长氮链,随着含能材料的发展,合成具有更多氮原子相连的多氮甚至是全氮化合物将更加困难,也更具有挑战性。
4 结论综上可见,目前在氮杂芳环N-氨化物方面,国内外研究主要涉及单环氮杂芳环底物,种类相对单一、数量较少;N-氨化试剂的选择大多集中在羟胺-O-磺酸和对甲基苯磺酰羟胺,前者氨化能力较弱,后者室温下不能稳定存放、需现用现制。氮杂芳环N-氨化物及其N-氨基含能衍生物的性能研究结果可知,较氨化前的母体化合物,氮杂芳环N-氨化物及其各类含能衍生物表现出氮含量高、正生成热大、高能低感等特性,是一类具有潜在应用前景的新型含能化合物。
然而,目前氮杂芳环N-氨化物及其含能衍生物的研究,大多针对单环氮杂芳环底物,研究对象不够系统,缺乏体系性,涉及多环甚至稠环氮杂芳环底物的报道较少。含能材料研究者未来应系统开展不同类型氮杂芳环底物(单环、多环、稠环) N-氨化物及其含能衍生物的设计、合成及性能研究,以期筛选出综合性能优异的氮杂芳环N-氨基含能衍生物,为此类化合物的设计合成及应用探索研究提供更多选择。
| [1] |
GAO H, SHREEVE J M. Azole-based energetic salts[J]. Chemical Reviews, 2011, 111(11): 7377-7436. DOI:10.1021/cr200039c |
| [2] |
ZHANG Q, SHREEVE J M. Energetic ionic liquids as explosives and propellant fuels: a new journey of ionic liquid chemistry[J]. Chemical Reviews, 2014, 114(20): 10527-10574. DOI:10.1021/cr500364t |
| [3] |
肖啸, 葛忠学, 刘庆, 等. 氮杂环化合物氧化偶联反应的研究进展[J]. 含能材料, 2013, 21(2): 173-179. XIAO X, GE Z X, LIU Q, et al. Progress in oxidation-coupling reaction of nitrogen-containing heterocyclic compounds[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2013, 21(2): 173-179. DOI:10.3969/j.issn.1006-9941.2013.02.005 |
| [4] |
IZSÁK D, KLAPÖTKE T M. Preparation and crystal structure of 5-azido-3-nitro-1H-1, 2, 4-triazole, its methyl derivative and potassium salt[J]. Crystals, 2012, 2(2): 294-305. DOI:10.3390/cryst2020294 |
| [5] |
LI Y, LIU W, PANG S. Synthesis and characterization of 5-nitro-2-nitratomethyl-1, 2, 3, 4-tetrazole: A high nitrogen energetic compound with good oxygen balance[J]. Molecules, 2012, 17(5): 5040-5049. DOI:10.3390/molecules17055040 |
| [6] |
ZHANG C, SUN C, HU B, et al. Synthesis and characterization of the pentazolate anion cyclo-N5-in (N5)6(H3O)3(NH4)4Cl[J]. Science, 2017, 355(6381): 374-376. |
| [7] |
EK S, REHN S, WAHLSTÖM L Y, et al. Synthesis and characterization of eight arylpentazoles[J]. Journal of Heterocyclic Chemistry, 2013, 50(2): 261-267. DOI:10.1002/jhet.v50.2 |
| [8] |
FISCHER N, IZSÁK D, KLAPÖTKE T M, et al. The chemistry of 5-(tetrazol-1-yl)-2H-tetrazole: an extensive study of structural and energetic properties[J]. Chemistry - A European Journal, 2013, 19(27): 8948-8957. DOI:10.1002/chem.v19.27 |
| [9] |
DIOPPOLD A A, KLAPÖTKE T M, OSWALD M. Asymmetrically substituted 5, 5'-bistriazoles-nitrogen rich materials with various energetic functionalities[J]. Dalton Transactions, 2013, 42(31): 11136-11145. DOI:10.1039/c3dt51205c |
| [10] |
黄晓川, 郭涛, 刘敏, 等. 联唑类含能化合物及其含能离子盐研究进展[J]. 含能材料, 2015, 23(3): 291-301. HUANG X C, GUO T, LIU M, et al. Review on bis azoles and its energetic ion derivatives[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2015, 23(3): 291-301. |
| [11] |
YU Q, WANG Z, WU B, et al. A study of N-trinitroethyl-substituted aminofurazans: high detonation performance energetic compounds with good oxygen balance[J]. Journal of Materials Chemistry A, 2015, 3(15): 8156-8164. DOI:10.1039/C4TA06974A |
| [12] |
李小童, 庞思平, 于永忠, 等. 杂环化合物氮氧化反应研究的新进展[J]. 有机化学, 2007, 27(9): 1050-1059. LI X T, PANG S P, YU Y Z, et al. New progress in the study of nitrogenous oxidation of heterocyclic compounds[J]. Chinese Journal of Organic Chemistry, 2007, 27(9): 1050-1059. |
| [13] |
KATRITZKY A R. Advances in heterocyclic chemistry[M]. Amsterdam: Elsevie, 2012: 1-106.
|
| [14] |
HAO W, GAO H, SHREEVE J M. N-oxide 1, 2, 4, 5-tetrazine-based high-performance energetic materials[J]. Chemistry - A European Journal, 2014, 20(51): 16943-16952. DOI:10.1002/chem.201405122 |
| [15] |
梁丽轩, 周智明. 钝感高能含能离子盐的研究进展[J]. 火炸药学报, 2014, 37(1): 1-11. LIANG L X, ZHOU Z M. Progress of study on insensitive high energetic ionic salts[J]. Chinese Journal of Explosives & Propellants, 2014, 37(1): 1-11. DOI:10.3969/j.issn.1007-7812.2014.01.001 |
| [16] |
WANG R, XU H, GUO Y, et al. Bis[3-(5-nitroimino-1, 2, 4-triazolate)]-based energetic salts: Synthesis and promising properties of a new family of high-density insensitive materials[J]. Journal of American Chemical Society, 2010, 132(34): 11904-11905. DOI:10.1021/ja1055033 |
| [17] |
THOTTEMPUDI V, GAO H, SHREEVE J M. Trinitromethyl-substituted 5-nitro- or 3-azo-1, 2, 4-triazoles: Synthesis, characterization, and energetic properties[J]. Journal of American Chemical Society, 2011, 133(16): 6464-6471. DOI:10.1021/ja2013455 |
| [18] |
YIN P, PARRISH D A, SHREEVE J M. Bis(nitroamino-1, 2, 4-triazolates): N-bridging strategy toward insensitive energetic materials[J]. Angewandte Chemie, 2014, 126(47): 13103-13106. DOI:10.1002/ange.201408127 |
| [19] |
ZHANG Q, HE C, YIN P, et al. Insensitive nitrogen-rich materials incorporating the nitroguanidyl functionality[J]. Chemistry - An Asian Journal, 2014, 9(1): 212-217. DOI:10.1002/asia.201301242 |
| [20] |
GOE G L, SCRIVEN E F V, KEAY J G, et al. Process for the synthesis of 4-amino-1, 2, 4-triazole derivatives: USP 5 099 028[P], 1992-03-24.
|
| [21] |
HASEGAWA Y, HYODA S, FUJITA H, et al. Process for producing cyclic hydrazine derivatives, tetrahydropyridazine and hexahydropyridazine: USP 5 977 360[P], 1999-11-02.
|
| [22] |
BOURDAUDUCQ P. Process for the preparation of 4-amino-1, 2, 4-triazole: USP 6 040 456[P], 2000-03-21.
|
| [23] |
SHIGENO K, ONO T, TANAKA M, et al. Process for producing 1-amino-1, 2, 3-triazole as pharmaceutical intermediate: JP 95-33 028[P], 1995-08-30.
|
| [24] |
HARADE K, ODA M, NISHIMURA M, et al. Preperation of 1-amino-1, 2, 3-triazole from acetaldedyde hydrazones and hydrazine: JP 09 286 780[P], 1997-01-27.
|
| [25] |
KAPLAN G, DRAKE G, TOLLISON K, et al. Synthesis, characterization and structural investigation of 1-amino-3- ubstituted- 1, 2, 3- triazolium salts and a new route to 1-substituted-1, 2, 3-triazoles[J]. Journal of Heterocyclic Chemistry, 2005, 42(1): 19-27. DOI:10.1002/jhet.v42:1 |
| [26] |
施宏刚, 李生华, 李玉川, 等. 1-氨基-1, 2, 3-三唑的合成[J]. 含能材料, 2008, 16(6): 676-678. SHI H G, LI S H, LI Y C, et al. Synthesis of 1-amino-1, 2, 3-triazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2008, 16(6): 676-678. DOI:10.3969/j.issn.1006-9941.2008.06.007 |
| [27] |
GAPONIK P N, KARAVAI V P. Synthesis of 1-aminotetrazole[J]. Khimiya Geterotsiklicheskikh Soedinenii, 1983, 6(3): 841-842. |
| [28] |
FISCHER N, KARAGHIOSOFF K, KLAPÖTKE T M, et al. New energetic materials featuring tetrazoles and nitramines-synthesis, characterization and properties[J]. Zeitschrift fǔr Anorganische und Allgemeine Chemie, 2010, 636(5): 735-749. DOI:10.1002/zaac.v636:5 |
| [29] |
肖啸, 葛忠学, 刘庆, 等. 1-氨基四唑的三步法合成与表征[J]. 化学推进剂与高分子材料, 2013, 11(3): 48-51. XIAO X, GE Z X, LIU Q, et al. Three-step synthesis method and characterization of 1-aminotetrazole[J]. Chemical Propellants & Polymeric Materials, 2013, 11(3): 48-51. |
| [30] |
GAPONIK P N, KARAVAI V P. Synthesis and properties of 1, 5-diaminotetrazole[J]. Khim Geterotsikl Soedin, 1984, 12(9): 1683-1686. |
| [31] |
GAPONIK P N, VOITEKHOVICH S V, LYAKHOV A S. Crystal structure and physical properties of the new 2D polymeric compound bis(1, 5-diaminotetrazole) dichlorocopper (Ⅱ)[J]. Inorganica Chimica Acta, 2005, 358(8): 2549-2557. DOI:10.1016/j.ica.2005.03.005 |
| [32] |
JUAN C G, GERHARD H, KONSTANTIN K, et al. Derivatives of 1, 5-diamino-1H-tetrazole: A new family of energetic heterocyclic-based salts[J]. Inorganic Chemistry, 2005, 44(12): 4237-7253. DOI:10.1021/ic050104g |
| [33] |
CENTORE R, CARELLA A, FUSCO S. Supramolecular synthons in fluorinated and nitrogen-rich ortho-diaminotriazoles[J]. Structural Chemistry, 2011, 22(5): 1095-1103. DOI:10.1007/s11224-011-9805-0 |
| [34] |
KLAPÖTKE T M, SCHMID P C, SCHNELL S, et al. Thermal stabilization of energetic materials by the aromatic nitrogen-rich 4, 4', 5, 5'-tetraamino-3, 3'-bi-1, 2, 4-triazolium cation[J]. Journal of Materials Chemistry A, 2015, 3(6): 2658-2668. DOI:10.1039/C4TA05964F |
| [35] |
LI Y, LIU N, SU P, et al. Synthesis and structural characterization of N-amino compounds[J]. Asian Journal of Chemistry, 2014, 26(21): 7151-7156. DOI:10.14233/ajchem |
| [36] |
WALLACE R. Hydroxylamine-o-sulfonic acid: Its use in organic synthesis[J]. Organic Preparations and Procedures International, 1982, 14(4): 265-307. DOI:10.1080/00304948209354920 |
| [37] |
KUŹMENKO V V, POZHARSKⅡ A F. Electrophilic N-amination of v-triazole[J]. Journal of Organic Chemistry USSR EN, 1992, 28(6): 1320-1321. |
| [38] |
RAAP R. Amination of tetrazoles with hydroxylamine-o-sulfonic acid: 1- and 2-aminotetrazoles[J]. Canadian Journal of Chemistry, 1969, 47(19): 3677-3681. DOI:10.1139/v69-606 |
| [39] |
ZHAO X, QI C, ZHANG L, et al. Amination of nitroazoles-A comparative study of structural and energetic properties[J]. Molecules, 2014, 19(1): 896-910. DOI:10.3390/molecules19010896 |
| [40] |
YIN P, ZHANG Q, ZHANG J, et al. N-trinitroethylamino functionalization of nitroimidazoles: A new strategy for high performance energetic materials[J]. Journal of Materials Chemistry A, 2013, 1(25): 7500-7510. DOI:10.1039/c3ta11356f |
| [41] |
ZHANG Y, PARRISHB D A, SHREEVE J M, et al. Derivatives of 5-nitro-1, 2, 3-2H-triazole-high performance energetic materials[J]. Journal of Materials Chemistry A, 2013, 1(3): 585-593. DOI:10.1039/C2TA00136E |
| [42] |
KLAPÖTKE T M, PIERCEY D G, STIERSTORFER J. Amination of energetic anions: High-performing energetic materials[J]. Dalton Transactions, 2012, 41(31): 9451-9459. DOI:10.1039/c2dt30684k |
| [43] |
MENDIOLA J, RINCÓN J A, MATEOS C, et al. Preparation, use, and safety of O-mesitylenesulfonylhydroxylamine[J]. Organic Process Research & Development, 2009, 13(2): 263-267. |
| [44] |
贺云, 范桂娟, 张光全, 等. 1-氨基-3, 5-二硝基-1, 2, 4-三唑的合成工艺改进及性能[J]. 含能材料, 2014, 22(2): 182-185. HE Y, FAN G J, ZHANG G Q, et al. Synthesis improvement and properties of 1-amino-3, 5-dinitro-1, 2, 4-triazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(2): 182-185. DOI:10.3969/j.issn.1006-9941.2014.02.011 |
| [45] |
蒋涛, 张晓玉, 景梅, 等. 1-氨基-3, 5-二硝基吡唑的合成、晶体结构及热性能[J]. 含能材料, 2014, 22(5): 654-657. JIANG T, ZHANG X Y, JING M, et al. Synthesis, crystal structure and thermal property of 1-amino-3, 5-dinitropyrazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(5): 654-657. |
| [46] |
景梅, 舒远杰, 王军, 等. 1-氨基-2, 4-二硝基咪唑的合成、晶体结构及热性能[J]. 含能材料, 2014, 22(4): 454-457. JING M, SHU Y J, WANG J, et al. Synthesis, crystal structure and thermal property of 1-amino-2, 4-dinitroimidazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(4): 454-457. DOI:10.3969/j.issn.1006-9941.2014.04.005 |
| [47] |
金兴辉, 胡炳成, 刘祖亮, 等. 1-氨基-2-硝基胍4-硝胺基-1, 2, 4-三唑盐的合成及性能[J]. 含能材料, 2015, 23(3): 213-217. JING X H, HU B C, LIU Z L, et al. Synthesis and properties of 1-amino-2-nitroguanidinium 4-nitroamino-1, 2, 4-triazole salt[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2015, 23(3): 213-217. |
| [48] |
OVCHINNIKOV I V, KULIKOV A S, EPISHINA M A, et al. Synthesis of N-trinitroethyl derivatives of linear and heterocyclic nitrogen-containing compounds[J]. Russian Chemical Bulletin, International Edition, 2005, 54(5): 1346-1349. DOI:10.1007/s11172-005-0408-z |
| [49] |
GÖBEL M, KLAPÖTKE T M. Synthesis and characterization of N-trinitroethyl derivatives of nitrogen containing compounds[J]. New Trends in Research of Energetic Materials, Czech Republic, 2007, 149. |
| [50] |
ZHANG Q, ZHANG J, PARRISH D A, et al. Energetic N-trinitroethyl-substituted mono-, di-, and triaminotetrazoles[J]. Chemistry-An Asian Journal, 2013, 19(33): 11000-11006. |
| [51] |
LI S, ZHANG W, WANG Y, et al. 2, 4, 6-Tris(2, 2, 2-trinitroethylamino)-1, 3, 5-triazine: synthesis, characterization, and energetic properties[J]. Journal of Energetic Materials, 2014, 32(1): 33-40. |
| [52] |
管鸣宇, 杨红伟, 吕春绪, 等. 三硝基乙基四嗪化合物的合成与表征[J]. 含能材料, 2014, 22(6): 736-740. GUAN M Y, YANG H W, LV C X, et al. Synthesis and characterization of trinitroethyl compounds derived from tetrazine[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2014, 22(6): 736-740. |
| [53] |
GAO H, SHREEVE J M. Trinitroethyl - A functionality leading to energetic compounds with high nitro content[J]. RSC Advances, 2014, 4(47): 24874-24880. DOI:10.1039/c4ra03885a |
| [54] |
ZHANG Q, SHREEVE J M. Growing catenated nitrogen atom chains[J]. Angewandte Chemie International Edition, 2013, 52(34): 8792-8794. DOI:10.1002/anie.201303297 |
| [55] |
YIN P, ZHANG Q, ZHANG J, et al. N-trinitroethylamino functionalization of nitroimidazoles: A new strategy for high performance energetic materials[J]. Journal of Materials Chemistry A, 2013, 1(25): 7500-7510. DOI:10.1039/c3ta11356f |
| [56] |
YIN P, ZHANG J, HE C, et al. Polynitro-substituted pyrazoles and triazoles as potential energetic materials and oxidizers[J]. Journal of Materials Chemistry A, 2014, 2(9): 3200-3208. DOI:10.1039/c3ta15057g |
| [57] |
GÖBEL M, KLAPÖTKE T M. Development and testing of energetic materials: The concept of high densities based on the trinitroethyl functionality[J]. Advanced Functional Materials, 2009, 19(3): 347-365. DOI:10.1002/adfm.v19:3 |
| [58] |
FISCHER D, KLAPÖTKE T M, STIERSTORFER J. Dikalium-1, 1'-dinitramino-5, 5'-bistetrazolat-ein primǎsprengstoff mit schneller detonation und hoher initiierungsleistung[J]. Angewandte Chemie, 2014, 126(31): 8311-8314. DOI:10.1002/ange.201404790 |
| [59] |
KLAPÖTKE T M, PIERCEY D G, STIERSTORFER J. The 1, 3-diamino-1, 2, 3-triazolium cation: a highly energetic moiety[J]. European Journal of Inorganic Chemistry, 2013, 1(9): 1509-1517. |
| [60] |
LI Z, ZENG D, ZHANG J, et al. Theoretical study on novel nitrogen-rich energetic compounds of bis(amino)-azobis(azoles) with tetrazene unit[J]. Journal of Molecular Modeling, 2012, 18(10): 4687-4698. DOI:10.1007/s00894-012-1458-4 |
| [61] |
LI S, PANG S, LI X, et al. Synthesis of new tetrazene(N-N=N-N)-linked bi(1, 2, 4-triazole)[J]. Chinese Chemical Letters, 2007, 18(10): 1176-1178. DOI:10.1016/j.cclet.2007.08.018 |
| [62] |
QI C, LI S, LI Y, et al. A novel stable high-nitrogen energetic material: 4, 4'-azobis(1, 2, 4-triazole)[J]. Journal of Materials Chemistry, 2011, 21(9): 3221-3225. DOI:10.1039/c0jm02970j |
| [63] |
LIU W, LI S, LI Y, et al. Nitrogen-rich salts based on polyamino substituted N, N'-azo-1, 2, 4-triazole: a new family of high performance energetic materials[J]. Journal of Materials Chemistry A, 2014, 2(38): 15978-15986. DOI:10.1039/C4TA03016H |
| [64] |
LI Y, YU T, LIAN P, et al. Synthesis of 1, 1'-azobis(3, 5-dinitropyrazole)[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2015, 23(6): 610-612. |
| [65] |
LI Y, QI C, LI S, et al. 1, 1'-Azobis-1, 2, 3-triazole: A high-nitrogen compound with stable N8 structure and photochromism[J]. Journal of American Chemical Society, 2010, 132(35): 12172-12173. DOI:10.1021/ja103525v |
| [66] |
KLAPÖTKE T M, PIERCEY D G. 1, 1'-Azobis(tetrazole): A highly energetic nitrogen-rich compound with a N10 chain[J]. Inorganic Chemistry, 2011, 50(7): 2732-2734. DOI:10.1021/ic200071q |
| [67] |
TANG Y, YANG H, SHEN J, et al. Synthesis and characterization of 1, 1'-azobis(5-methyltetrazole)[J]. New Journal of Chemistry, 2012, 36(12): 2447-2450. DOI:10.1039/c2nj40731k |
| [68] |
TANG Y, YANG H, WU B, et al. Synthesis and characterization of a stable, catenated N11 energetic salt[J]. Angewandte Chemie International Edition, 2013, 52(18): 4875-4877. DOI:10.1002/anie.v52.18 |




