正丁醛自缩合合成2-乙基-2-己烯醛(辛烯醛)是2-乙基己醇(辛醇)工业生产中实现碳链增长的关键步骤。目前,工业上正丁醛自缩合反应采用强碱水溶液作催化剂,虽可以获得较高的辛烯醛收率,但存在催化剂难以重复使用、含碱废水处理费用高等缺点。随着绿色化学的发展,研究基于环境友好催化剂的新工艺过程越来越受到重视。固体碱具有高活性、高选择性、反应条件温和、易于回收、可循环使用等诸多优点[1]。目前,在羟醛缩合反应中应用的固体碱催化剂主要分为无机固体碱(主要为金属氧化物CaO、MgO和SrO等)[2, 3]和有机固体碱(主要为赖氨酸、负载有机胺等)[4, 5]。以碱土金属氧化物为代表的无机固体碱存在对空气、水敏感,催化性能不稳定等缺点,而有机固体碱热稳定性差,阻碍了固体碱催化剂的工业应用。正丁醛自缩合过程属于典型的羟醛缩合反应,既可被碱催化又可被酸催化。固体酸因其稳定性好和催化活性高而备受关注,但固体酸催化羟醛缩合反应研究远不及固体碱。赵月昌等[6]制备了固体超强酸SO42-/TiO2、SO42--/SnO2、SO42-/Fe2O3,并研究了其对C3-C8醛自缩合反应的催化性能,发现SO42-/TiO2的催化效果最好。然而在适宜反应条件下正丁醛的转化率只有59.2%,辛烯醛的选择性为95.4%。Musko等[7]采用浸渍法将硅钨酸(TSA)负载在MCM-41上制备了TSA/MCM-41催化剂,在超临界CO2的条件下研究了其对线性醛自缩合反应的催化性能。在适宜反应条件下,正丁醛的转化率为46.0%,辛烯醛的选择性为95.2%。上述催化剂虽具有较好的辛烯醛选择性,但正丁醛的转化率较低。本课题组也开展了固体酸催化正丁醛自缩合反应的研究。陈翠娜等[8]以浸渍法制备的H4SiW12O40/SiO2为催化剂进行正丁醛自缩合反应,在120℃下反应6 h,正丁醛的转化率为90.4%,辛烯醛的选择性为89.2%。但该催化剂稳定性较差。刘肖红等[9]采用La-Al2O3催化剂对正丁醛自缩合反应进行研究,适宜条件下,正丁醛的转化率最高达到90.6%,辛烯醛的选择性为91.7%,该催化剂回收经焙烧处理后重复使用性能良好。熊超[10]采用Ce-Al2O3催化剂,在固定床上对正丁醛自缩合反应进行研究,适宜反应条件下得到正丁醛的转化率为74.0%,辛烯醛的收率为60.2%。但运行14 h后,因Al2O3与副产物水发生水合反应导致催化活性大大降低。
TiO2是一种常见的光催化剂,也是一种广泛应用的廉价、低毒载体[11, 12],同时在有机合成特别是羟醛缩合反应中也有应用报道[13, 14]。Idriss等[13]研究发现TiO2可以较好地催化乙醛气相羟醛缩合反应,以金红石相TiO2为催化剂时,羟醛缩合产物巴豆醛的选择性为19%,而以锐钛矿相TiO2为催化剂时,巴豆醛的选择性为68%。可见TiO2晶型对产物选择性有较大影响。Morris等[14]申请了关于非均相催化剂催化脂肪醛缩合生成α,β-不饱和醛的专利,其中一实施例描述了在固定床上TiO2催化正丁醛自缩合反应,正丁醛的转化率为80%,辛烯醛的选择性可达到94%。但该专利未开展TiO2催化性能影响因素及反应条件优化等相关的研究。赵洺等[15]采用纳米TiO2对涂料进行改性,发现加入纳米TiO2的试样在水中浸泡240 h后无变化,表现出优异的水稳定性。这对于抑制羟醛缩合反应副产水引起的催化剂水合作用,进而提高催化稳定性具有重要参考价值。
鉴于TiO2在羟醛缩合反应中表现出良好的催化性能以及其本身优异的水稳定性能,本文采用TiO2催化正丁醛自缩合反应,重点研究TiO2晶型对催化正丁醛自缩合反应性能的影响。采用溶胶-凝胶法制备TiO2,通过催化剂表征阐明不同晶型TiO2催化性能存在差异的原因,研究反应条件对锐钛矿型TiO2催化正丁醛自缩合反应性能的影响,最后,构建锐钛矿型TiO2催化正丁醛自缩合反应的反应网络。
2 实验部分 2.1 催化剂制备以钛酸正丁酯为钛源、无水乙醇为溶剂、冰醋酸为螯合剂制备TiO2凝胶。具体过程如下:室温下按一定比例将钛酸丁酯与无水乙醇混合形成黄色澄清溶液A;按一定比例配置冰醋酸、蒸馏水和无水乙醇溶液B,调节pH值≤ 3;将溶液B缓慢滴入溶液A中,水浴加热形成白色凝胶,干燥得黄色晶体,研磨后于不同温度下焙烧,即为不同晶型的TiO2粉末。
2.2 催化剂表征 2.2.1 比表面积、孔容和孔径分析催化剂的比表面积及孔结构测定在美国Micromeritics公司生产的ASAP 2020 M+C型比表面积及孔隙度分析仪上进行。称取0.20 g左右的样品,首先在200℃下真空脱气4 h以除去样品表面所吸附的杂质,然后将样品管置于分析站,在液氮条件下进行N2吸附-脱附测定。催化剂的比表面积采用BET法计算,孔容和孔径采用BJH脱附法计算。
2.2.2 X射线衍射测定(XRD)在日本理学株式会社生产的Rigaku D/max-2500型X射线衍射仪上对催化剂样品进行物相分析。操作条件为:Cu靶,狭缝SS/DS = 1°,RS0.15 mm,石墨单色滤光片,工作电流为100 mA,工作电压为40 kV,扫描范围10~80°,扫描速率8°·min-1。
2.2.3 催化剂表面酸碱性测定(CO2-TPD和NH3-TPD)采用美国Micromeritics公司生产的AutoChem Ⅱ-2920型化学吸附仪对催化剂进行NH3-TPD和CO2-TPD测试以测定其表面酸碱性。以CO2-TPD测试为例,具体步骤如下:将0.10 g左右待测样装入U型样品管中,在流量为25 mL·min-1氦气下吹扫,以10℃·min-1的升温速率由室温升至样品制备过程中的焙烧温度并恒温60 min,除去催化剂表面吸附的杂质;然后降温至110℃吸附CO2(流量为25 mL·min-1、时间30 min),而后以50 mL·min-1的氦气吹扫60 min以除去物理吸附的CO2。待基线平稳后,以10℃·min-1的速率升温脱附。使用TCD检测器记录CO2脱附信号。NH3-TPD测试过程与CO2-TPD类似。
2.3 正丁醛自缩合反应过程在100 mL高压反应釜中进行正丁醛自缩合反应。典型操作过程为:将40 mL正丁醛和占正丁醛质量15%的催化剂加入高压反应釜中,通入N2以置换空气;然后开启搅拌并升温至180℃,保持反应8 h;反应结束后停止加热和搅拌,将反应釜冷却至室温,离心过滤除去催化剂,将滤液计量后进行定量分析。
2.4 产物分析 2.4.1 定性分析采用安捷伦7890B-5977A型气相色谱-质谱(GC-MS)联用仪进行产物的定性分析。气化室温度180℃;HP-5色谱柱,柱温采用程序升温:60℃保持40 min,以10 ℃·min-1升温至200℃保持10 min;载气:氦气,流量1.0 mL·min-1;质谱分析条件:EI源温度230℃,四级杆检测器温度150℃;质量数范围:20~550 m/z。
2.4.2 定量分析采用北京北分瑞利分析仪器有限责任公司生产的SP 2100型气相色谱仪测定反应液组成。气化室温度180℃;KB-1毛细管色谱柱,采用程序升温控制柱温:初温80℃,保持3 min,以10℃·min-1升温至160℃,保持10 min;氢火焰检测器,温度180℃。采用内标法进行定量计算,内标物为邻二甲苯。
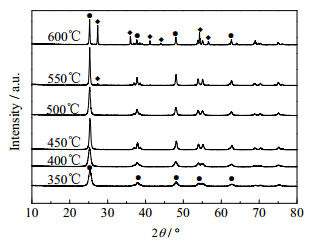
3 结果与讨论 3.1 制备条件对TiO2晶型及催化性能的影响 3.1.1 焙烧温度的影响在自然界中TiO2有立方晶系的金红石、锐钛矿和正交晶系的板钛矿3种晶型结构。不同晶型的TiO2表现出不同的催化活性,而焙烧温度是决定晶型的关键因素。因此,首先考察了焙烧温度对TiO2晶型及催化活性的影响。图 1为TiO2凝胶经过不同温度焙烧所得TiO2样品的XRD谱图。
|
图 1 不同焙烧温度制得TiO2样品的XRD谱图 Fig.1 XRD patterns of TiO2 samples calcined at different temperatures ●A: anatase ◆R: rutile |
由图 1可知,焙烧温度为350℃时,在2θ= 25.3°处出现锐钛矿型TiO2的(101晶面)特征峰,40°、50°、55°及65°左右出现了锐钛矿晶型其他晶面的衍射峰(见标准卡JCPDS-21-1272),没有出现其他晶型TiO2的衍射峰,说明此时只有锐钛矿一种晶型存在。衍射峰比较宽化,是由小的粒子尺寸和非晶态结构引起的[16]。焙烧温度低于550℃时,TiO2的XRD谱图均只表现出锐钛矿衍射峰,且随着焙烧温度的升高,衍射峰逐渐变得尖锐说明TiO2晶粒在长大,逐渐由无定形或微晶向锐钛矿晶相转变,结晶程度不断提高。在焙烧温度达到550℃时,所制备的TiO2粉体在2θ = 27.3°出现新的衍射峰,表明已有部分锐钛矿相转变为金红石相(110晶面),此时锐钛矿与金红石晶型共存。根据文献[17~19]中得出下列公式可计算两种晶型的比例。
| $ \begin{array}{l} w({\rm{A}}) = \frac{1}{{(1 + 1.265{I_{\rm{R}}}/{I_{\rm{A}}})}}\\ w({\rm{R}}) = \frac{1}{{(1 + 0.884{I_{\rm{A}}}/{I_{\rm{R}}})}} \end{array} $ |
式中w(A)和w(R)分别代表锐钛矿晶型和金红石晶型的质量分数。IA为锐钛矿型TiO2的最强衍射线(出现在2θ = 25.3°)的强度;IR为金红石型TiO2的最强衍射线(出现在2θ = 27.5°)的强度。
不同焙烧温度制得TiO2的催化效果及其中不同晶型所占比例计算结果如表 1所示。可以看出,随着焙烧温度的升高,正丁醛的转化率和辛烯醛的收率均先升高后下降,而辛烯醛的选择性一直下降。当焙烧温度为400℃时,正丁醛的转化率和辛烯醛的收率同时达到最大,分别为91.1%和81.6%,此时辛烯醛的选择性为89.6%。锐钛矿是由TiO6八面体组成,四面体配位的钛为醛发生自缩合反应的活性中心[20]。焙烧温度升高,TiO2表面缺陷减少,且钛会由四面体配位向八面体配位转变,这可能是导致不同温度所得催化剂活性差异的原因之一[21]。结合晶型比例可以看出,随着金红石比例的增加,TiO2的活性明显下降。这是由于锐钛矿型TiO2(101晶面)表面上存在大量O空穴,在反应中作为吸电子中心,有效地促进吸附及催化反应的进行;而金红石型TiO2 (110晶面)表面结构十分稳定,在催化反应中的活性较低[22]。
| 表 1 焙烧温度对TiO2催化性能的影响 Table 1 Effects of calcination temperature on TiO2catalytic performance |
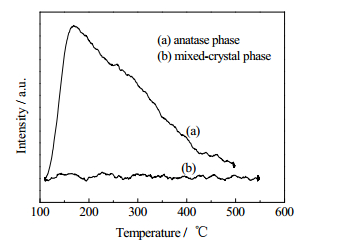
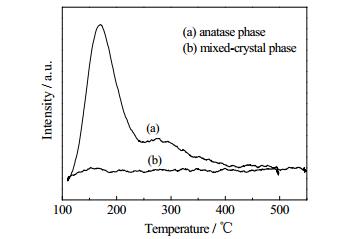
分别对400℃下焙烧的锐钛矿TiO2样品和550℃下焙烧的混晶TiO2样品进行NH3-TPD和CO2-TPD表征,结果如图 2和图 3所示。可以看出,虽然550℃下焙烧的混晶TiO2仍以锐钛矿晶型为主,但金红石型TiO2的出现大大减少了表面酸量和碱量。由于羟醛缩合反应既可以被酸催化也可以被碱催化,而且酸-碱协同催化可明显提高正丁醛自缩合反应效果[23],故推测锐钛矿晶型TiO2表面兼具比较丰富的酸碱中心,是其具有较好催化活性的重要原因,而混晶TiO2表面酸碱中心的急剧减少是造成其催化性能下降的主要原因。
|
图 2 锐钛矿和混晶TiO2的NH3-TPD Fig.2 NH3-TPD curves of TiO2 catalysts with anatase phase and mixed-crystal phase |
|
图 3 锐钛矿和混晶TiO2的CO2-TPD Fig.3 CO2-TPD curves of TiO2 catalysts with anatase phase and mixed-crystal phase |
对不同焙烧温度制备的TiO2进行了比表面积和孔结构表征,并根据XRD表征结果计算了TiO2样品的晶粒大小,结果如表 2所示。可以看出,随着焙烧温度的升高,比表面积和孔容呈下降趋势,而平均孔径逐渐增大。这可能是因为焙烧温度升高使得催化剂出现烧结,造成细小的孔道塌陷或者被堵塞。并且TiO2样品粒径的计算也证实了这一推测。随着焙烧温度的升高,TiO2样品晶粒逐渐增大,特别是在高温条件下,催化剂晶粒烧结现象更为突出。从不同焙烧温度制备TiO2的SEM图(见图 4)同样可以看到,随着焙烧温度的升高,TiO2出现团聚及晶粒增大的现象。催化剂的比表面积主要是由孔道内的孔壁面积决定,当部分孔结构塌陷时,催化剂的比表面积必然会降低[24]。结合表 1中的活性评价结果可知,TiO2的比表面积以及晶粒尺度均影响了反应物与催化剂的有效接触,从而降低了其催化活性。

|
图 4 不同焙烧温度制备TiO2的SEM图 Fig.4 SEM images of TiO2 calcined at different temperatures |
| 表 2 焙烧温度对TiO2织构性质的影响 Table 2 Effects of calcination temperature on TiO2textural properties |
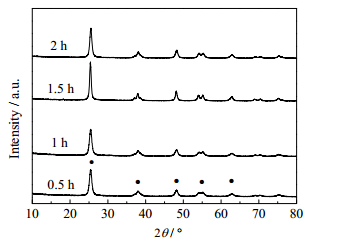
图 5为TiO2凝胶在400℃下经过不同焙烧时间处理所得TiO2样品的XRD谱图。随着焙烧时间的延长,TiO2的晶型并未发生明显改变,仍以锐钛矿晶型存在。不同焙烧时间对TiO2催化性能影响评价结果如表 3所示。随着焙烧时间的延长,正丁醛的转化率、辛烯醛的收率和选择性均逐渐升高。当焙烧时间为1 h时,正丁醛的转化率、辛烯醛的收率和选择性同时达到最大,分别为91.1%、81.6%和89.6%。继续延长焙烧时间,正丁醛的转化率、辛烯醛的收率和选择性只是略有降低。分别测定了不同焙烧时间所得TiO2的比表面积和孔结构,结果列于表 3。焙烧0.5 h时,TiO2的比表面积比较大。可能是由于焙烧时间较短使得前驱体分解不完全或TiO2还有部分以无定型存在,导致其活性低。当焙烧时间超过1 h后,TiO2的物理结构变化不大,比表面积只是略有降低,与其催化活性变化趋势一致。因此,选择1 h为催化剂适宜的焙烧时间。
|
图 5 不同焙烧时间制得TiO2的XRD谱图 Fig.5 XRD patterns of TiO2 calcined at different times ● A: anatase |
| 表 3 焙烧时间对TiO2催化性能及其织构性质的影响 Table 3 Effects of calcination time on catalytic performance and textural properties of TiO2 |
以适宜条件下制备的TiO2为催化剂,考察了催化剂用量对正丁醛自缩合反应的影响,结果如图 6所示。随着催化剂用量的增加,正丁醛的转化率逐渐升高,辛烯醛的收率先升高后降低。催化剂用量较少时,可能存在活性位不足的问题;而随着催化剂用量增大,活性位点增多,正丁醛的转化率和辛烯醛的收率逐渐升高。在催化剂用量为15%(wt)时,辛烯醛取得最大收率为81.6%。催化剂用量再增大,正丁醛的转化率增势缓慢,辛烯醛的收率和选择性开始下降。这可能是由于活性位点过多,生成的目标产物与正丁醛再进一步发生缩合反应所致[25]。因此,适宜催化剂用量为15%(wt)。
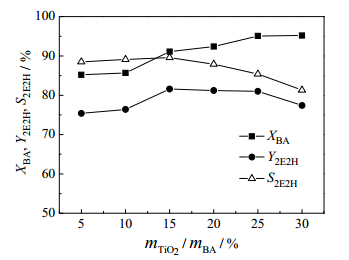
|
图 6 催化剂用量对正丁醛自缩合反应的影响 Fig.6 Effects of catalyst amount on n-butanal self-condensation Reaction conditions: T = 180℃, t = 8 h |
考察了反应温度对正丁醛自缩合反应的影响,结果如图 7所示。随着反应温度的升高,正丁醛的转化率先升高再趋于平缓,而辛烯醛的收率先上升后下降。根据陈翠娜[26]对正丁醛自缩合反应的热力学计算结果可知,该反应是放热反应,升高温度并不利于反应的进行。在较低温度范围内反应受动力学控制。随着温度升高反应速率加快,正丁醛的转化率逐渐升高;在较高温度时,反应在比较短的时间内达到平衡,反应受热力学控制。过高的温度不但会抑制正丁醛自缩合反应,反而会促进中间产物2-乙基-3-羟基己醛与正丁醛进行季先科反应[27]。推测在上述两方面共同作用下,导致辛烯醛的收率和选择性下降。比较180和200℃的反应结果,发现200℃时辛烯醛的收率略高,但在200℃时辛烯醛的选择性偏低。因此,选择180℃为适宜的反应温度,此时辛烯醛的选择性为89.6%,收率为81.6%。
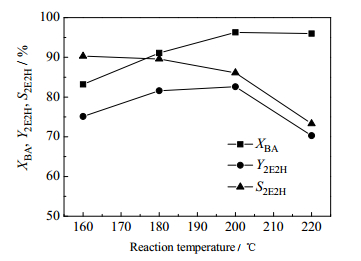
|
图 7 反应温度对正丁醛自缩合反应的影响 Fig.7 Effects of reaction temperature on n-butanal self-condensation Reaction conditions: the weight percentage of catalyst = 15.0%, t = 8 h |
考察了反应时间对正丁醛自缩合反应的影响,结果如图 8所示。随反应时间的延长,正丁醛的转化率逐渐提高,反应8 h后正丁醛的转化率变化趋势平缓;而辛烯醛的收率和选择性均表现出先升后降的变化趋势,且二者在反应时间为8 h时同时达到最大值,分别为81.6%和89.6%。因此,选择8 h为正丁醛自缩合反应适宜的反应时间。
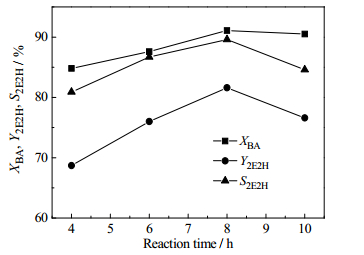
|
图 8 反应时间对正丁醛自缩合反应的影响 Fig.8 Effects of reaction time on n-butanal self-condensation Reaction conditions: the weight percentage of catalyst = 15.0%, T = 180℃ |
对锐钛矿型TiO2催化剂的重复使用性进行了研究,结果如表 4所示。使用后的TiO2催化剂经过无水乙醇洗涤、常温干燥、及400℃焙烧1 h后,重新用于催化正丁醛自缩合合成辛烯醛反应。催化剂重复使用7次,其催化活性无明显变化。说明TiO2催化剂不仅具有较高的活性而且具有较好的重复使用性能。
| 表 4 催化剂重复使用性 Table 4 Reusability of anatase TiO2 catalysts |
为了清晰了解TiO2催化正丁醛自缩合反应体系的组成,以及不同晶型TiO2对正丁醛自缩合反应体系的影响,对不同晶型TiO2催化作用下的正丁醛自缩合反应体系进行了气相色谱-质谱联用(GC-MS)分析。首先,对以400℃下焙烧1 h的锐钛矿型TiO2催化正丁醛自缩合反应后的产液进行GC-MS分析,发现产液中除了含有原料正丁醛和产物辛烯醛以外,还有正丁醇、正丁酸、正丁酸-2-乙基-3-羟基己酯、3-壬烯、2, 4-二乙基-2, 4-辛二烯醛。
对于反应体系中的副产物正丁酸,Shen等[24]研究了碱土金属氧化物催化正丁醛气相自缩合反应,发现正丁醛可以发生自酯化反应生成丁酸丁酯,而丁酸丁酯还可能进一步水解生成正丁酸和正丁醇。本课题组Xiong等[28]研究Ce-Al2O3催化正丁醛自缩合反应的反应体系,也得到类似结果。故推测本反应体系中正丁酸也是由正丁醛自身季先科反应生成丁酸丁酯,丁酸丁酯再分解产生,同时生成正丁醇。Luo等[29]考察了Degussa P25(75%锐钛矿与25%金红石的混合物)对乙醛自缩合反应的影响,推断在Degussa P25表面会发生一级产物丁烯醛与乙醛二次缩合生成2, 4-二己烯醛。由此推断本研究中的辛烯醛可与正丁醛发生二次缩合反应生成2, 4-二乙基-2, 4-辛二烯醛。产液中存在的正丁酸-2-乙基-3-羟基己酯推测是部分2-乙基-3-羟基已醛与一分子的正丁醛进行季先科反应生成。朱雪华等[25]及Tsuji等[27]分别利用稀土化合物和氧化铝为催化剂对正丁醛自缩合反应进行研究时也发现了相同的副反应。Idrisis[13]曾提出一小部分的乙醛可以发生分解生成C、H、O。因此,在本反应中,认为少量的正丁醛自身分解产生H2,进而可以将正丁醛还原为正丁醇。Kim等[30]研究不同金属氧化物负载Pd催化线性醛自缩合反应,认为2-乙基-2-己烯醛可以发生C-C键断裂生成乙烷和正己醛,正己醛与正丁酸发生偶联反应生成4-壬酮,然后加氢生成4-壬醇,再脱水生成3-壬烯。故推测本反应体系中的壬烯的出现也是发生了类似的化学反应。
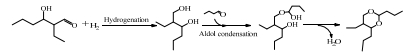
根据以上副反应,推断出锐钛矿型TiO2催化正丁醛羟醛缩合反应网络,如图 9所示。大部分的正丁醛(A)发生羟醛缩合反应生成2-乙基-3-羟基己醛(E),2-乙基-3-羟基己醛脱水生成2-乙基-2-己烯醛(G)。2-乙基-2-己烯醛还可以与正丁醛二次缩合生成2, 4-二乙基-2, 4-辛二烯醛(H)。一部分中间产物2-乙基-3-羟基己醛与正丁醛进行季先科反应生成正丁酸-2-乙基-3-羟基己酯(F)。小部分的正丁醛可以通过季先科反应生成丁酸丁酯(B),丁酸丁酯水解生成正丁酸(D)和正丁醇(C)。同时正丁醛在少量H2的存在下可以还原为正丁醇(C)。2-乙基-2-己烯醛的C-C键断裂生成乙烷和正己醛(I)。正己醛与正丁酸发生偶联反应生成4-壬酮(J)。然后加氢生成4-壬醇(K),再脱水生成3-壬烯(L)。
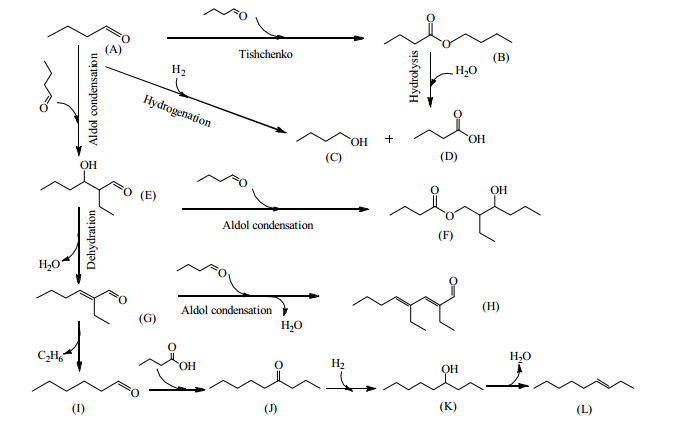
|
图 9 锐钛矿型TiO2催化正丁醛自缩合反应网络 Fig.9 Reaction network of n-butanal self-condensation catalyzed by anatase TiO2 |
对900℃下焙烧1 h得到的纯金红石型TiO2催化正丁醛自缩合的产液进行了GC-MS分析。与锐钛矿型TiO2催化正丁醛自缩合反应产生的副产物相比,尽管仍存在正丁醇、正丁酸和壬烯,但含量大大减少,而2, 4-二乙基-2, 4-辛二烯醛为主要副产物。除此之外,产液中还出现了5-乙基-2, 4-二丙基-1, 3-二氧六环和二丁酸-2-乙基-1-丙基-1, 3-丙二酯两种副产物。张帆等[31]以室温离子液体为催化剂和反应介质进行二元醇和醛类反应得到缩醛产物。据此,可以推测反应(1),即中间产物2-乙基-3-羟基己醛在H2存在的条件下被还原生成2-乙基-1, 3-己二醇,2-乙基-1, 3-己二醇与正丁醛进行缩醛反应生成5-乙基-2, 4-二丙基-1, 3-二氧六环。另外,反应体系中含有醇类和羧酸在酸或碱的催化作用下可发生酯化反应,如反应(2),即两分子正丁酸和一分子2-乙基-1, 3-己二醇生成二丁酸-2-乙基-1-丙基-1, 3-丙二酯。由此看来,在正丁醛自缩合反应中,金红石相TiO2催化剂有利于大分子副产物的生成,这与Luo等[29]报道相一致。
|
(1) |

|
(2) |
(1) 锐钛矿型TiO2比金红石型TiO2具有更好的催化正丁醛自缩合反应性能,原因在于锐钛矿表面兼具比较丰富的酸碱中心,TiO2的比表面积以及晶粒尺度也会在一定程度上影响其催化活性。
(2) 以TiO2凝胶在空气气氛中400℃焙烧1 h制备的锐钛矿TiO2为催化剂,利用单因素实验确定了适宜的反应条件:催化剂用量15%(wt)、反应温度180℃、反应时间8 h。在以上条件下,正丁醛转化率为91.1%,辛烯醛收率和选择性分别为81.6%和89.6%。TiO2的重复使用性能也较好,重复使用7次,其催化活性基本没有改变。
(3) 锐钛矿型TiO2催化正丁醛自缩合反应体系中除目的产物辛烯醛外,主要副产物为正丁醇、正丁酸、正丁酸-2-乙基-3-羟基己酯、3-壬烯、2, 4-二乙基-2, 4-辛二烯醛等。金红石型TiO2催化正丁醛自缩合反应体系中,2, 4-二乙基-2, 4-辛二烯醛为主要副产物,还增加了5-乙基-2, 4-二丙基-1, 3-二氧六环和二丁酸-2-乙基-1-丙基-1, 3-丙二酯两种物质,表明金红石相TiO2更利于大分子物质的形成。
| [1] | WEI Tong(魏彤), WANG Mou-hua(王谋华), WEI Wei(魏伟), et al. Solid base catalysts(固体碱催化剂)[J]. Chemistry(化学通报) , 2002, 65(9): 594-600. |
| [2] | King F, Kelly G J. Combined solid base/hydrogenation catalysts for industrial condensation reactions[J]. Catalysis Today , 2002, 73(1-2): 75-81. DOI:10.1016/S0920-5861(01)00520-X. |
| [3] | Kelly G J, King F, Kett M. Waste elimination in condensation reactions of industrial importance[J]. Green Chemistry , 2002, 4(4): 392-399. DOI:10.1039/b201982p. |
| [4] | Watanabe Y, Sawada K, Hayashi M. A green method for the self-aldol condensation of aldehydes using lysine[J]. Green Chemistry , 2010, 41(31): 384-386. |
| [5] | ZHANG Yuan-yuan (张媛媛). The study of new catalytic technology of self-condensation of butanal to 2-ethylhexenal (正丁醛自缩 合生成辛烯醛新型催化工艺研究) [D]. Shanghai (上海): Shanghai Normal University (上海师范大学), 2010. http://d.wanfangdata.com.cn/Thesis/Y1666710 |
| [6] | ZHAO Yue-chang(赵月昌), LIANG Xue-zheng(梁学正), GAO Shan(高珊), et al. Study on the catalytic aldol condensation by super acid and its solvent effection(固体超强酸催化下的醛酮自身缩合及其溶剂效应的研究)[J]. Journal of Molecular Catalysis(分子催化) , 2007, 21(4): 315-318. |
| [7] | Musko N E, Grunwaldt J D. Heterogeneously catalysed aldol reactions in supercritical carbon dioxide as innovative and non-flammable reaction medium[J]. Topics in Catalysis , 2011, 54(16): 1115-1123. |
| [8] | CHEN Cui-na(陈翠娜), LIU Xiao-hong(刘肖红), AN Hua-liang(安华良), et al. n-Butyraldehyde aldol self-condensation catalyzed by H4SiW12O40/SiO2(H4SiW12O40/SiO2催化正丁醛自缩合反应)[J]. CIESC Journal(化工学报) , 2014, 65(6): 2106-2112. |
| [9] | LIU Xiao-Hong(刘肖红), WANG Yi(王毅), AN Hua-liang(安华良), et al. Synthesis of 2-ethyl-2-hexenal via n-butanal self-condensation catalyzed by La-Al2O3(La-Al2O3催化正丁醛自缩合合成辛烯醛反应)[J]. CIESC Journal(化工学报) , 2016, 67(5): 1884-1891. |
| [10] | XIONG Chao (熊超). Reaction kinetics of n-butanal aldol condensation over Ce-Al2O3 catalyst and its catalytic stability (Ce-Al2O3催化正丁醛自缩合反应动力学及催化稳定性研究) [D]. Tianjin (天津): Hebei University of Technology (河北工业大学), 2016 |
| [11] | WANG Chung-xia(王春霞), YE Zhi-ping(叶志平), LÜ Li-xing(吕力行), et al. Influence of TiO2-supports on the catalytic properties of catalyts for de-nox in flue gas(烟气脱硝催化剂中载体TiO2对催化性能的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27(5): 896-902. |
| [12] | ZHANG Ling-ling(张玲玲), YU Jie(俞杰), WANG Xiao-zhong(王晓钟), et al. Gas-phase oxidation of 2-picoline to synthesize 2-pyridylaldehyde using Bi-Mo/TiO2 dual-metal catalysts(双金属催化剂Bi-Mo/TiO2气相催化氧化2-甲基吡啶合成2-吡啶甲醛)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(5): 1082-1087. |
| [13] | Idriss H, Kim K S, Barteau M A. Carbon-carbon bond formation via aldolization of acetaldehyde on single crystal and polycrystalline TiO2 surfaces[J]. Journal of Catalysis , 1993, 139(1): 119-133. DOI:10.1006/jcat.1993.1012. |
| [14] | Morris D L. Preparation of α, β-aldehydes by aldol condensation.US, 4316990[P]. 1982, 2, 23. http://www.freepatentsonline.com/4316990.html |
| [15] | ZHAO Ming(赵洺), JIANG Li(姜利). Experimental research on the loaded nano titanium dioxide photocatalysis materials coating(负载纳米TiO2光催化材料涂料的试验研究)[J]. Forest Engineering(森林工程) , 2012, 28(3): 62-64. |
| [16] | SUN Li-ping(孙丽萍), GAO Shan(高山), ZHAO Hui(赵辉), et al. Preparation, crystal phase transition and photocatalytic properties of nanometer TiO2 powders(纳米二氧化钛的晶型转变及光催化性能研究)[J]. Journal of Functional Materials(功能材料) , 2004, 35(5): 632-634. |
| [17] | PAN Chao(潘超), LI Qi(李琪), QIAO Qing-dong(乔庆东). Investigation on the influence of calcining temperature on TiO2 nanocrystalline structure by XRD(焙烧过程对TiO2纳米晶型参数的影响)[J]. Science & Technology In Chemical Industry(化工科技) , 2004, 12(1): 26-28. |
| [18] | Ding X Z, Liu X H, He Y Z. Grain size dependence of anatase-to-rutile structural transformation in gel-derived nanocrystalline titania powders[J]. Journal of Materials Science Letters , 1996, 15(20): 1789-1791. DOI:10.1007/BF00275343. |
| [19] | Jongsomjit B, Wongsalee T, Praserthdam P. Characteristics and catalytic properties of Co/TiO2 for various rutile:anatase ratios[J]. Catalysis Communications , 2005, 6(11): 705-710. DOI:10.1016/j.catcom.2005.07.002. |
| [20] | Singh M, Zhou N J, Paul D K, et al. IR spectral evidence of aldol condensation:acetaldehyde adsorption over TiO2 surface[J]. Journal of Catalysis , 2008, 260(2): 371-379. DOI:10.1016/j.jcat.2008.07.020. |
| [21] | GE Xin(葛鑫), LI Bi-jing(李碧静), HU Jing(胡静), et al. Effect of calcining temperature on catalytic performance of TiO2(焙烧温度对二氧化钛催化性能的影响)[J]. Chemical Engineering (China)(化学工程) , 2011, 39(11): 61-65. |
| [22] | LI Wei-kun (李玮琨). A DFT study: structures and catalytic performance of TiO2 surfaces (二氧化钛结构和催化性质的密度泛函理论研究) [D]. Shanghai (上海): East China University of Science and Technology (华东理工大学), 2013. http://cdmd.cnki.com.cn/Article/CDMD-10251-1014251199.htm |
| [23] | LIU Xiao-hong(刘肖红), WU Li-li(吴丽丽), AN Hua-liang(安华良), et al. Aldol self-condensation of n-butyraldehyde to 2-hexenal catalyzed by KF-γ-Al2O3(KF-γ-Al2O3催化正丁醛自缩合合成辛烯醛)[J]. Acta Petrolei Sinica (Petroleum Processing Section)(石油学报(石油加工)) , 2015(6): 1332-1337. |
| [24] | Shen W Q, Tompsett G A, Xing R, et al. Vapor phase butanal self-condensation over unsupported and supported alkaline earth metal oxides[J]. Journal of Catalyst , 2012, 286(2): 248-259. |
| [25] | ZHU Xue-hua(朱雪华), YAO Ying-ming(姚英明), LI Hong-ming(李红明), et al. Aldol-Tishchenko reaction of butanal catalyzed by organolanthanoid complexes(稀土化合物催化丁醛Aldol-Tishchenko反应的研究)[J]. Journal of The Chinese Rare Earthsociety(中国稀土学报) , 2002, 20(5): 468-469. |
| [26] | CHEN Cui-na (陈翠娜). Self-condensation of n-butyraldehyde to 2-ethyl-hexenal over H4SiW12O40/SiO2 catalyst (H4SiW12O40/SiO2催化正丁醛自缩合合成辛烯醛反应研究) [D]. Tianjin (天津): Hebei University of Technology (河北工业大学), 2013. |
| [27] | Tsuji H, Yagi F, Hattori H, et al. Self-condensation of n-butyraldehyde over solid base catalysts[J]. Journal of Catalysis , 1994, 148(2): 759-770. DOI:10.1006/jcat.1994.1262. |
| [28] | Xiong C, Liang N, An H L, et al. n-Butyraldehyde self-condensation catalyzed by Ce-modified γ-Al2O3[J]. RSC Adavance , 2015, 5(125): 103523-103533. DOI:10.1039/C5RA21125E. |
| [29] | Luo S, Falconer J L. Aldol condensation of acetaldehyde to form high molecular weight compounds on TiO2[J]. Catalysis Letters , 1999, 57(3): 89-93. DOI:10.1023/A:1019003817314. |
| [30] | Kim S M, Mi E L, Choi J W, et al. Conversion of biomass-derived butanal into gasoline-range branched hydrocarbon over Pd-supported catalysts[J]. Catalysis Communications , 2011, 16(1): 108-113. DOI:10.1016/j.catcom.2011.09.022. |
| [31] | ZHANG Fan(张帆), XU Dan-qian(许丹倩), LUO Shu-ping(罗书平), et al. Acetalization of aldehydes with diols catalyzed by ionic liquids(离子液体催化醛与二元醇的缩醛化反应)[J]. Journal of Chemical Industry and Engineering (China)(化工学报) , 2004, 55(12): 2047-2050. |




