2. 矿产资源化学四川省高校重点实验室,四川 成都 610059
2. Mineral Resources Chemistry Key Laboratory of Sichuan Higher Education Institutions, Chengdu 610059, China
近年来随着人们环保意识的增强,低碳出行已经成为一种新时尚,而我国也在大力发展以新能源汽车为代表的新型交通工具,这就给电池行业特别是能量密度高、使用寿命长的锂离子电池的发展带来契机。但我国锂盐生产供需矛盾突出,固态锂矿资源也在逐渐枯竭,所以富含锂的液态矿产资源就受到人们的重视。在我国青藏高原上分布着众多天然高原湖泊,这些湖泊多以盐湖为主,并且多数富含锂、硼等矿产资源[1]。特别是位于青藏高原北缘的柴达木盆地各类盐储量之丰富,素有聚宝盆之美称[2]。其中仅察尔汗盐湖就蕴藏着以锂、钾、镁和硼为主各类盐类矿产资源达600多亿t,其中锂盐(以LiCl计)的蕴藏量为世界首位[3]。如何合理开发和利用这些宝贵的盐湖资源就成了亟待解决的问题。
盐湖矿产资源的合理开发和利用离不开相平衡的指导,对于盐湖卤水相平衡的研究由来已久。Teeple等[4]在1929年针对Searles盐湖的开发,开展了对含硼五元体系Na+, K+//Cl-, CO32-, borate-H2O的研究。近20年来,国内学者针对青藏高原盐湖群开展了大量盐湖卤水相平衡研究,宋彭生等[5-6]主要针对含锂体系Li+, Na+, K+//Cl-, SO42--H2O和Li+, Sr+, Na+, K+//Cl--H2O进行相平衡研究。邓天龙等[7-8]对在273~308 K下含硼水盐体系进行了介稳相平衡研究,研究发现硼酸盐在介稳状态下存在明显的过饱和现象,不易形成复盐。曾英等[9]对含锂硼的四元体系Li+, Na+//SO42-, B4O72--H2O在273 K的介稳相平衡进行了研究,研究结果发现该体系有复盐3Na2SO4·Li2SO4·12H2O生成。桑世华等[10-11]开展了含锂五元体系Li+, Mg2+//Cl-, SO42-, B4O72--H2O及其4个共饱点,有复盐LiCl·MgCl2·7H2O生成,四元子体系存在2个共饱点,无复盐生成。本文所研究的对象柴达木盆地盐湖位于干旱、寒冷的青藏高原,年平均气温接近0 ℃[12],研究的四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K的相平衡关系未见文献报道,开展低温相平衡的研究对指导当地盐湖生产具有实际意义。
2 实验部分 2.1 实验试剂与仪器实验试剂:去离子水(pH≈6.0,电导率 < 1×10-5 S·m-1),使用前需煮沸除去CO2;无水Li2B4O7(国药集团化学试剂有限公司,分析纯A.R.);MgB4O7·9H2O(实验室合成[15]);MgSO4(成都市科隆化工试剂场,分析纯A.R.);Li2SO4·H2O(成都市科隆化工试剂场,分析纯A.R.),其他辅助试剂也均用A.R.级。
实验仪器:UPT-II-20T型超纯水机(四川优普超纯科技有限公司);HX-HHSA4型水浴锅(深圳市力通世纪科技有限公司,精度0.1℃);SHH-250型恒温箱(重庆英博实验仪器有限公司,温度范围:-15~60 ℃,精度0.1℃);DJ1C-100增力电动搅拌器(江苏麦普龙仪器制造有限公司,功率100 W,转速0~3000 r·min-1);AL104型电子天平(美国Mettler-Toledo公司,精度0.0001 g);HY-5型回旋式振荡器(金坛市科析仪器有限公司);DX-2700型X-ray粉末衍射仪(丹东方圆仪器有限公司)。
2.2 实验方法采用等温溶解平衡法进行相平衡的研究。实验过程:从上一级共饱点入手逐渐引入另外一种盐(如按照三元体系Li+//SO4,2- B4O72--H2O在273 K的共饱点组成配制饱和溶液,然后按梯度加入MgSO4,其他加料方法与顺序与之相似,不再赘述),盛放于硬质塑料瓶中。置于恒温培养箱的振荡器中,保持温度在273 K(±0.1 K)。让其等温溶解,定期取上层清液,取液前保证沉淀完全下沉,上层清液无悬浮固体出现。然后对待测液中不同组分的溶解度进行分析测定,直至各组分溶解度数据恒定不变以作为平衡的标志,实验中各组分达到平衡时间约为33~36 d。然后取固相用X-ray粉末衍射仪进行固相鉴定。
2.3 分析方法Li+:差减法;Mg2+:混合醇存在下乙二胺四乙酸二钠(Ethylenediamine tetraacetic acid disodium salt, EDTA)络合滴定法[13];B4O72-:甘露醇存在下,碱量法滴定。SO42-:EDTA–钡容量法[14]。平衡液相密度的测定:称量瓶法。平衡固相分析方法:采用化学分析并辅以X-ray粉末衍射仪进行鉴定。
3 结果与讨论 3.1 MgB4O7·9H2O的合成实验所制得的章氏硼镁石的XRD图如图 1所示。具体制备过程如下:将纯度为分析纯的MgCO3·Mg(OH)2·6H2O放在873 K的马弗炉中灼烧3 h,使其充分热解生成MgO。然后将制得MgO、分析纯H3BO3和去离子水以1:8:66的比例称重,并放入烧杯中混匀。将烧杯放置在293 K恒温水浴锅中连续搅拌3 h。将溶液静置,待溶液完全澄清后抽滤,去除不溶物。再将澄清液倒入烧杯中在293 K恒温水浴锅再继续搅拌。此时会不断析出白色沉淀,要继续搅拌,直至沉淀完全析出。抽滤出沉淀物,鼓风干燥箱低温烘干至恒重[15]。实验所制得的章氏硼镁石纯度可满足于本实验分析。
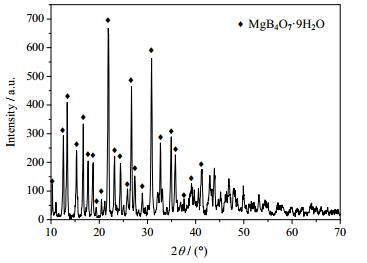
|
图 1 章氏硼镁石(MgB4O7·9H2O)的XRD图 Fig.1 X-ray diffraction pattern of Hungtsaoite (MgB4O7·9H2O) |
实验所测得四元体系Li+, Mg2+//SO42-, B4O72-- H2O 273 K相平衡液相组成(以质量分数w计)以及相应的J necke指数(各种正(负)离子相对于总负离子的摩尔百分数,如J(Mg2+) = n(Mg2+) / (n(SO42-)+n(B4O72-))x100),平衡液相密度数据和各液相点对应的平衡固相盐如表 1所示,其中Ls为Li2SO4·H2O、Eps为MgSO4·7H2O、Lb为Li2B4O7·3H2O、Mb为MgB4O7·9H2O。标准不确定度用u表示,其中u(T) = 0.50 K、u(ρ) = 2.0·10–4 g·cm–3、ur(Li+) = 0.0050、ur(Mg2+) = 0.0050、ur(SO42–) = 0.0050、ur(B4O72–) = 0.0050。
|
|
表 1 四元体系Li+, Mg2+//SO42-, B4O72--H2O 273 K时溶解度和密度数据 Table 1 Solubility and density of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K |
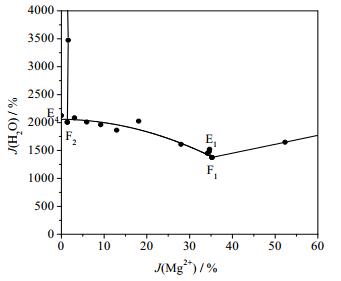
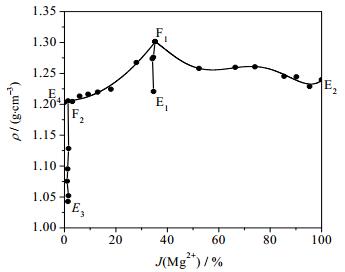
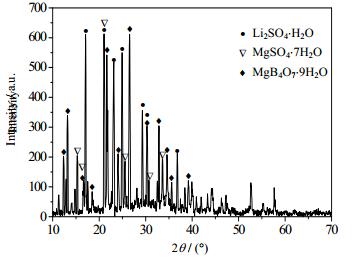
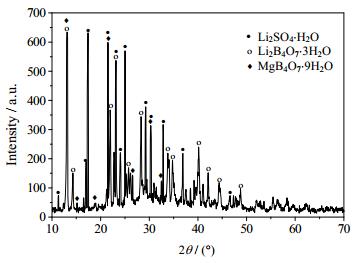
根据相平衡数据所绘制干盐相图及其局部放大图如图 2、3所示,水图及其局部放大图如图 4、5所示,根据平衡液相密度数据绘制的密度图如图 6所示。如图 7、8所示分别为共饱点F1和F2对应的XRD图。由图 2、3可见,该体系既没有复盐也没有固溶体生成,属于简单四元交互体系。干盐相图中有5条单变量曲线分别为E1F1、E2F1、E3F2、E4F2和F1F2;4个结晶相区:Li2B4O7·3H2O、Li2SO4·H2O、MgB4O7·9H2O和MgSO4·7H2O。包含2个共饱点F1、F2,F1对应的平衡固相是Li2SO4·H2O、MgSO4·7H2O和MgB4O7·9H2O,液相组成为w(Li+) = 2.48%、w(Mg2+) = 2.36%、w(SO42-) = 25.96%和w(B4O72-) = 0.91%,F2对应的平衡固相为Li2SO4·H2O、MgB4O7·9H2O和Li2B 4O7·3H2O,液相组成为w(Li+) = 3.40%、w(Mg2+) = 0.08%、w(SO42-) = 22.80%和w(B4O72-) = 1.50%。在该体系中由于Li2SO4和MgSO4的溶解度相对较大,则所对应的相区较小,MgB4O7的溶解度最小所对应的相区最大。由图 4和5可以看出,随着盐溶液浓度增大,溶液中水含量逐渐减小,到共饱点F1处最小质量分数为68.29%。由图 6可以看出,4条单变量曲线由边界点到共饱点密度大体呈现出逐渐增大趋势,到共饱点F1处最大为1.3014 g·cm-3。图 7和8分别为共饱点F1和F2的XRD图,2个共饱点中各平衡固相所对应的特征峰已用特殊符号标出。
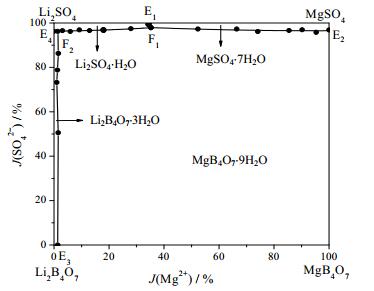
|
图 2 四元体系Li+, Mg2+//SO42-, B4O72--H2O 273 K干盐相图 Fig.2 Dry salt phase diagram of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K |
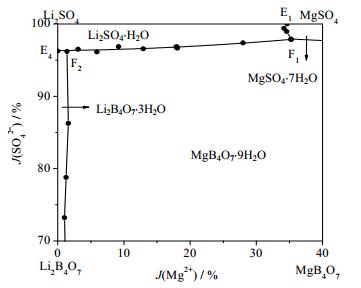
|
图 3 四元体系Li+, Mg2+//SO42-, B4O72--H2O 273 K干盐相图局部放大图 Fig.3 Dry salt phase diagram of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K (enlarged) |
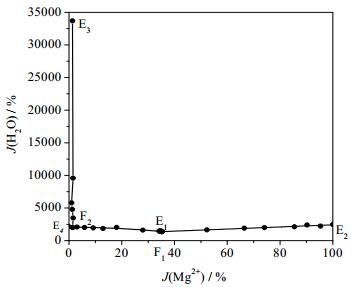
|
图 4 四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K水图 Fig.4 Water phase diagram of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K |
|
图 5 Water phase diagram of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K Fig.5 Water phase diagram of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K (enlarged) |
|
图 6 四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K的平衡液相密度图 Fig.6 Density diagram of equilibrium liquid phase of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K |
|
图 7 四元体系Li+, Mg2+//SO42-, B4O72--H2O在共饱点F1处的XRD图 Fig.7 X-ray diffraction pattern of the invariant point F1 of the quaternary system Li+, Mg2+//SO42--, B4O72--H2O |
|
图 8 四元体系Li+, Mg2+//SO42-, B4O72--H2O在共饱点F2处的XRD图 Fig.8 X-ray diffraction pattern of the invariant point F2 of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O |
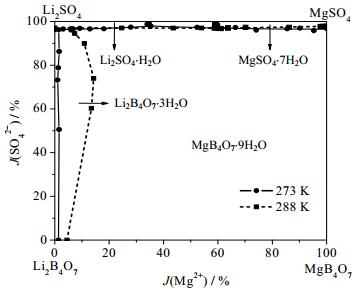
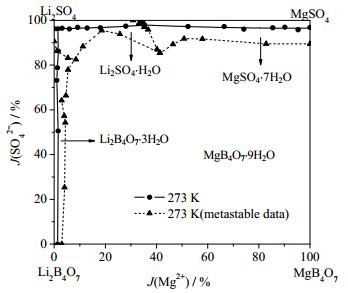
本文不仅对四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K的相平衡进行了研究,还与该体系在288 K时的干盐相图和273 K介稳相图进行了比较,对比图分别如图 9、10所示。
|
图 9 四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K和288 K[11]干盐相图对比图 Fig.9 Comparison of dry-salt-phase diagrams of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K and 288 K[11] |
|
图 10 四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K相图和介稳[8]相图对比图 Fig.10 Comparison of phase diagram and metastable phase diagram[8] of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 273 K |
从图 9中可以看出四元体系Li+, Mg2+//SO42-, B4O72--H2O在273和288 K时均属于简单交互型,无复盐和固溶体生成,各结晶相区及平衡固相组成均未发生变化。随着温度由273 K升高到288 K,Li2B4O7和Li2SO4结晶相区变大,MgSO4和MgB4O7的结晶相区变小。说明MgSO4和MgB4O7的溶解度对温度变化更敏感,所以可以在高温时采用蒸发提取Li2B4O7·3H2O和Li2SO4·H2O,采用冷却法析出MgSO4·7H2O和MgB4O7·9H2O。
由图 10可见,与该体系干盐相图相比其介稳相图中同样存在4个结晶相区,各结晶相区固相组成也未发生变化,但MgB4O7·9H2O结晶相区明显减小,说明MgB4O7在介稳状态溶解度显著增加。这是因为硼酸盐的介稳态较强,在介稳状态溶解度会显著增加,这对溶解度较小的MgB4O7更为显著。由于MgB4O7溶解度的增加使其他3个介稳结晶区相对于对应的相图结晶区也有明显扩大。
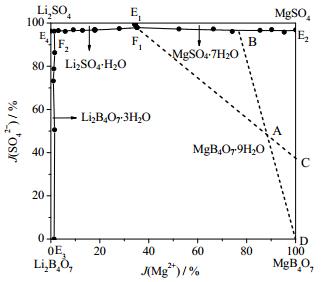
3.4 四元体系Li+, Mg2+//SO42-, B4O72--H2O 273 K相图应用举例假设如图 11所示中的A点为卤水的干基组成,当卤水饱和时MgB4O7·9H2O首先析出;继续蒸发液相点由A点至B点,固相点则为D点;当液相点到达B点时MgSO4·7H2O开始析出;继续蒸发,液相点由B点至F1点时固相点由D点移动至C点;当液相点移动至F1点时Li2SO4·H2O开始析出;F1为三固一液共饱点,是相称共饱点也是绝对干点,根据相律判断此点自由度为零,继续蒸发,液相点不动,直至蒸干。依靠相图预测析盐顺序对盐湖卤水实际生产工艺路线的制定具有指导意义。
|
图 11 卤水盐析路线图 Fig.11 Diagram of salting out route of brine |
(1) 根据实验所得溶解度以及密度数据绘制了四元体系Li+, Mg2+//SO42-, B4O72--H2O在273 K时干盐相图和水图以及他们的局部放大图和密度图。
(2) 研究结果发现该体系属于简单交互四元体系,存在2个共饱点,5条单变量曲线,共有Li2B4O7·3H2O、Li2SO4·H2O、MgB4O7·9H2O和MgSO4·7H2O 4个结晶相区,无复盐和固溶体生成。从所绘制的水图中可以发现,水含量随盐溶液浓度增大而逐渐减小,到共饱点F1处最小。从密度图中可以看出,平衡液相密度在含水量最少的共饱点F1处最大为1.3014 g·cm-3。
(3) 该体系在288 K下依然没有复盐和固溶体生成,通过对比两者干盐图固相结晶区可以发现,温度由273 K升至288 K,MgSO4和MgB4O7的结晶区明显减小,而Li2B4O7和Li2SO4的结晶相区明显增大。说明MgSO4和MgB4O7相较于Li2B4O7和Li2SO4的溶解度对温度更敏感。
(4) 与相同温度下的介稳相图对比,在介稳状态下MgB4O7对应的结晶相区明显变小,说明溶解度增大,这是因为硼酸盐有较强介稳性所致。
| [1] | SANG Shi-hua(桑世华), YIN Hui-an(殷辉安), NI Shi-jun(倪师军), et al. Metastable phase equilibria in the aqueous quaternary system K2B4O7-Na2B4O7-Li2B4O7-H2O at 273.15 K(K2B4O7-Na2B4O7-Li2B4O7-H2O四元体系273.15 K介稳相平衡)[J]. Acta Physico-Chimica Sinica(物理化学学报), 2007, 23(8): 1285-1287. DOI:10.3866/PKU.WHXB20070828. |
| [2] | LIU Zhen-min(刘振敏), YANG Geng-sheng(杨更生). The utilization and sustainable development of salt lake resources in China(我国盐湖资源的开发利用与可持续发展)[J]. Bulletin of Mineralogy, Petrology and Geochemistry(矿物岩石地球化学通报), 1999, 2(18): 59-61. |
| [3] | YAN Jun(严军), HUANG Xiao-liang(黄小良). Studies on utilize of potassium, magnesium and lithium in Saline Lakes of Qinghai province(青海省盐湖钾、镁、锂盐资源开发利用探讨)[J]. Journal of Salt Lake Research(盐湖研究), 2002, 10(4): 63-69. DOI:10.3969/j.issn.1008-858X.2002.04.013. |
| [4] | Teeple J E. The Industrial Development of Searles Lake Brines with Equilibrium Data[M].New York: The Chemical Catalog Company, 1929. |
| [5] | SONG Peng-sheng(宋彭生), DONG Ya-ping(董亚萍), LI Wu(李武). Phase diagram of Li+, Na+, K+//Cl-, SO42--H2O system at 25℃ and its utilization(Li+, Na+, K+//Cl-, SO42--H2O五元体系25℃相图及其应用)[J]. Journal of Salt Lake Research(盐湖研究), 2017, 25(3): 9-17. |
| [6] | SUN Bo(孙柏), SONG Peng-sheng(宋彭生), LI Wu(李武), et al. Thermodynamics and phase equilibria of the oil field brine with Sr system at 25℃ Ⅰ. Sr, Na, K, Li//Cl-H2O system(含锶油田水体系热力学和相平衡研究Ⅰ. Sr, Na, K, Li//Cl-H2O体系)[J]. Journal of Salt Lake Research(盐湖研究), 2015, 23(4): 50-58. |
| [7] | MENG Ling-zong(孟令宗), DENG Tian-long(邓天龙), SUN Bo(孙柏). Metastable equilibria of the ternary system Na+//Cl-, B4O72--H2O at 28℃ and 35℃(Na+//Cl-, B4O72--H2O体系在28℃与35℃时介稳相平衡研究)[J]. Journal of Salt Lake Research(盐湖研究), 2007, 15(1): 34-38. DOI:10.3969/j.issn.1008-858X.2007.01.007. |
| [8] | MENG Ling-zong, GUO Ya-fei, DENG Tian-long, et al. Solid and liquid metastable phase equilibria in the aqueous quaternary system Li+, Mg2+//SO42-, borate-H2O at 273.15 K[J]. Chemical Research in Chinese Universities, 2017, 33(4): 655-659. DOI:10.1007/s40242-017-6404-7. |
| [9] | ZENG Ying, CAO Fu-jia, LI Long-guang, et al. Metastable phase equilibrium in the aqueous quaternary system (Li2SO4 + Na2SO4 + Li2B4O7 + Na2B4O7 + H2O) at 273.15 K[J]. Journal of Chemical and Engineering Data, 2011, 56(5): 2569-2573. DOI:10.1021/je200091k. |
| [10] | LI Ming (李明). Study on equilibria in quinary system Li+, Mg2+//Cl-, SO42-, B4O72--H2O at 288 K (五元体系Li+, Mg2+//Cl-, SO42-, B4O72--H2O 288 K稳定相平衡研究)[D]. Chengdu (成都): Chengdu University of Technology (成都理工大学), 2009. |
| [11] | SANG Shi-hua(桑世华), LI Ming(李明), LI Heng(李恒), et al. A study on phase equilibria of the quaternary system Li+, Mg2+//SO42-, B4O72--H2O at 288 K(交互四元体系Li+, Mg2+//SO42-, B4O72--H2O 288 K相平衡研究)[J]. Acta Geologica Sinica(地质学报), 2010, 11(84): 1704-1707. |
| [12] | REN Xiao-jing(任效京), HUANG Xue-li(黄雪莉). Phase equilibria in the quaternary system of Li+, Mg2+//Cl-, SO42--H2O at 273.15 K(273.15 K下四元体系Li+, Mg2+//Cl-, SO42--H2O相平衡研究)[J]. Inorganic Chemicals Industry(无机盐工业), 2018, 48(7): 13-15. |
| [13] | WANG Shi-qiang(王士强), GAO Jie(高洁), YU Xue(余学), et al. Study on the interference of coexisting lithium ion on the measurement of magnesium ion(大量Li+存在对Mg2+分析测定中的影响研究)[J]. Journal of Salt Lake Research(盐湖研究), 2007, 15(1): 44-48. DOI:10.3969/j.issn.1008-858X.2007.01.009. |
| [14] | Qinghai Institute of Salt Lakes, Chinese Academy of Sciences (中国科学院青海盐湖研究所). Analysis Method of Brine and Salt(卤水和盐的分析方法)[M].Beijng(北京): Science and Technology Press(科学技术出版社), 1984. |
| [15] | JING Yan(景燕). A new method for synthesis of Hungtsaoite(合成章氏硼镁石的新方法)[J]. Sea-Lake Salt and Chemical Industry(海湖盐与化工), 2000, 29(2): 24-25. DOI:10.3969/j.issn.1673-6850.2000.02.009. |




