纤维素作为自然界中储量最为庞大的一种绿色资源,经过化学水解、机械处理得到的纳米纤维素纤维(cellulosenanofibrils, CNF)在保持其基本性能的同时还具有独特的力学性能[1]。CNF作为具有较大长径比的胶体颗粒,在很低的浓度条件下就能通过氢键、范德华力和静电排斥等作用力形成CNF聚集体,进而自组装形成三维网络结构型凝胶[2~5]。因而,CNF形成的凝胶可以应用到生物医学[6]、食品[7]等领域。然而,CNF悬浮液是一个非稳态体系,在熵驱动下纤维容易发生絮凝、聚集,并在重力作用下进一步发生相分离,从而破坏其凝胶结构[7, 8]。
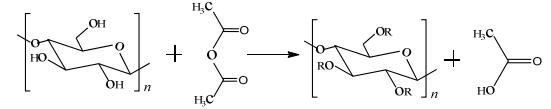
为了调控CNF的聚集性质,改善其凝胶性质,通常采用的方法是在CNF表面引入疏水基团[9~11]。乙酰化作为一种简单化学修饰方法,近年来引起了人们广泛关注[12, 13]。目前,CNF乙酰化采用常规途径是先制备CNF,然后进行乙酰化修饰(图 1)[14]。由于是在纳米尺度进行修饰,修饰所需条件比较苛刻:使用的溶剂大多是有机溶剂,例如:甲苯、丙酮、氯仿等,或者反应时间长、温度高;制备出的乙酰化纳米纤维素纤维(Acetylated cellulose nanofibrils, ACNF)取代度比较低,最高值1.2左右(最大值为3)[10, 13, 14]。上述问题的存在,限制了乙酰化在CNF表面功能化中的应用。此外,CNF凝胶性质还受到盐浓度[15]、温度[4]等因素的影响。Salas等[16]在研究羧酸化CNF悬浮液时发现,添加盐离子后其网络结构强度显著增强。根据DLVO理论,盐离子的存在屏蔽了颗粒表面的电荷强度并降低了双电层的厚度,使得CNF发生聚集从而提高凝胶强度[17, 18]。P kk 等[2]在研究酶水解CNF性质时发现,在较高温度下CNF凝胶强度会轻微增强。
|
图 1 纤维素的乙酰化反应 Fig.1 Acetylation of cellulose. R: H or acetyl |
CNF凝胶宏观性能依赖于加工过程中凝聚态结构的形成和演变,在CNF凝聚相变过程中产生的浓度涨落和非均相结构会使其凝胶表现出特殊的粘弹松弛行为。因此,流变学作为一种有效的表征方法被广泛的用来研究CNF凝胶的宏观性质[2, 4, 5, 7]。目前,对于CNF凝胶流变性质研究多集中在基于线性粘弹理论的小振幅振荡剪切(small amplitude oscillationshear, SAOS)[4, 7],但其所能提供的CNF相互作用信息有限。而大振幅振荡剪切(LAOS)相对于SAOS,可以探测到胶体在非线性区域的特殊结构特征,例如:当胶体颗粒发生物理缠结时,会在线性-非线性过渡区域出现特征指纹峰[19]。
本文以商业化微晶纤维素为原料,采取无溶剂体系先进行乙酰化修饰,然后通过高压均质作用制备一种高取代度的ACNF。利用傅立叶红外光谱仪、X射线衍射仪、透射电子显微镜等表征ACNF分子组成与微观结构;采用流变仪、激光共聚焦显微镜、小角X射线散射仪研究ACNF凝胶在温度和盐离子条件下凝胶变化过程。通过大振幅振荡剪切模式探究微观结构-介观形态-宏观流变性质间的关系来揭示ACNF凝胶化的内机制。
2 实验(材料与方法) 2.1 实验材料和仪器微晶纤维素(Microcrystalline cellulose,MCC)购于上海生工生物工程技术服务有限公司;95%硫酸、乙酸酐、氯化钠、冰醋酸、聚乙二醇20000均购于国药集团化学试剂有限公司;SolarbioMD44透析袋(截留分子量为8000~14000)。
AH-2010高压均质机(美国ABS公司),DHR-3流变仪(美国TA公司),Tecnai 12透射电子显微镜(荷兰Philips公司),D2 PHASER X射线衍射仪(德国Bruker-AXS有限公司),小角X射线散射仪(德国Bruker-AXS有限公司),LSM710激光共聚焦显微镜(德国蔡司公司),CJ-881数显恒温大功率磁力搅拌器(常州智博瑞仪器制造有限公司)。
2.2 ACNF及其凝胶制备微晶纤维素(6 g):冰醋酸:浓硫酸按1:10:0.05的质量比加入到250 mL的圆底烧瓶中,并在反应体系中逐滴加入10.5 mL乙酸酐(根据Avila等[11]采用的方法,测得样品的实际取代度为2.01)。把烧瓶置于带有磁力搅拌的50℃恒温水浴中,1 h后,用大量去离子水终止反应。然后离心洗涤4次(4000 r×min-1),每次10 min。
经上述处理后的样品配置成浓度为0.5%的悬浮液,在1000 bar的均质压力下均质10次,高压均质过程使用15℃的循环冷凝水。经高压均质后的样品,用透析袋透析除去多余的酸,并用聚乙二醇20000浓缩到2%待测。
2.3 ACNF性质表征傅里叶红外光谱仪:经过冷冻干燥的ACNF粉末,利用溴化钾压片方法进行测试,仪器光谱范围400 ~ 4000 cm-1,分辨率2 cm-1,扫描次数16次。
X—射线衍射仪:经过冷冻干燥的ACNF粉末在样品槽中压平后进行X射线衍射分析;X射线源为铜靶,射线波长λ = 1.54 Å,扫描范围为5o < 2θ < 40o,步进为0.02o。
投射电子显微镜:将ACNF悬浮液配置成浓度为0.5%的悬浮液,取一滴在铜网上,磷钼酸负染,室温下自然干燥,然后进行观察。仪器的加速电压为120 kV。
小角X射线散射仪:将ACNF凝胶装入到毛细管样品管中,样品到检测器的距离为1070 mm,射线波长λ = 1.54 Å,q范围为0.007 ~ 0.23 Å−1,用水溶液扣除背景。
2.4 激光共聚焦利用带有凹槽的载玻片,装入ACNF凝胶,用卡尔福克鲁尔荧光白进行染色并密封,分别在25、45、65℃恒温水浴锅中加热20 min。冷却后利用激光共聚焦物镜进行观察,激发波长为408 nm,物镜放大倍数为20倍。
2.5 流变性质测试DHR-3流变仪配备的40 mm不锈钢平板夹具,测试间隙为1000 μm。样品在测试过程中均用石蜡油油封,防止水分蒸发。
动态振荡测试固定频率为1 Hz,应变扫描范围0.01% ~ 1000%。测试温度分别设置为25、45、65℃三个温度,每个样品在测试前通过平板加热10 min。
动态温度扫描控制0.2%的应变(线性粘弹区范围内)和1 Hz的频率,温度扫描范围5 ~ 70℃,升温速度为3℃×min-1,在70℃保持30 s,然后以相同速率降温。
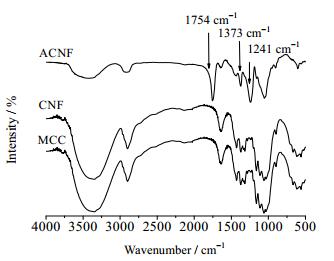
3 实验结果与讨论 3.1 ACNF修饰前后结构和微观形态表征傅里叶红外光谱可以根据吸收峰的位置定性判断化合物中基团的变化。图 2是经过化学修饰前后的ACNF和微晶纤维素的红外光谱图。图谱显示,ACNF在1754 cm-1和1373 cm-1处出现明显的吸收峰,对应的分别是乙酰基中C=O键和C—O键[12];同时在1241 cm-1处出现的吸收峰,对应的是甲基的C—H振动[13]。而对应的CNF在上述位置则没有出现相应的峰,说明冰醋酸不会与CNF发生反应,仅溶胀微晶纤维素,从而使纤维颗粒内部空隙变大,增加了乙酸酐和纤维表面羟基的接触面积[20]。
|
图 2 ACNF修饰前后的红外光谱图 Fig.2 FT-IR spectra of cellulose nanofibrils before (CNF) and after acetylation (ACNF) |
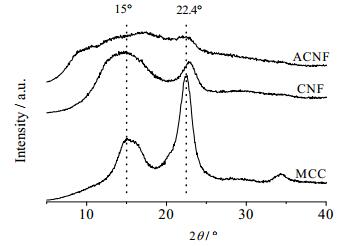
XRD用于考察乙酰化和高压均质的剪切作用对ACNF晶形的影响。处理前后样品的XRD图如图 3所示。通过比较在2θ = 22.4o和2θ = 15o处出现的衍射峰的峰型变化,可以明显看出CNF的衍射强度明显降低,且尖型衍射峰消失,峰型变成“馒头峰”,表明机械剪切作用使得CNF有序性结构降低[21]。而ACNF在上述两个角度处几乎没有衍射峰的存在,说明ACNF颗粒已经不存在有序性结构[13, 22],表明高度的乙酰化修饰会彻底破坏CNF的晶形结构。
|
图 3 CNF和ACNF颗粒的XRD衍射图谱 Fig.3 XRD spectra of CNF and ACNF particles |
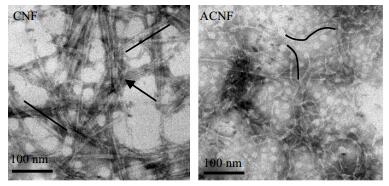
透射电子显微镜可以用于观察ACNF修饰前后微观形态的变化,如图 4所示。电镜图片显示CNF展现出棒状刚性形态(黑色线段),在水溶液中形成典型的纤维丝状网络结构,并通过氢键作用形成了束状聚集体(黑色箭头)[8];通过Image J软件计算CNF直径为(9 ± 0.24) nm。引入疏水基团后,ACNF现出弯曲折叠的棒状柔性形态(黑色线段),且直径降低到(6 ± 0.24) nm。
|
图 4 CNF和ACNF透射电子显微镜图 Fig.4 TEM micrographs of CNF and ACNF |
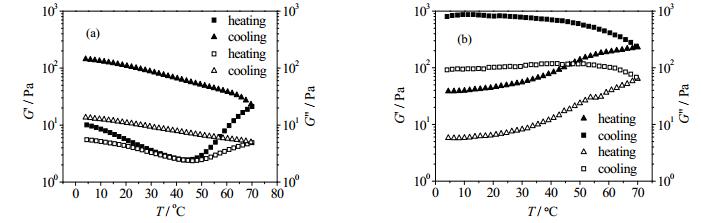
图 5是CNF和ACNF经过25℃和65℃加热后的凝胶形态,可以看到ACNF在65℃下能形成高强度的凝胶,而CNF加热后则不能形成高强度凝胶。为了研究ACNF在温度作用下的凝胶化过程,对添加不同盐浓度的ACNF凝胶进行振荡温度扫描模式下的流变性质测试,如图 6所示。图 6(a)是无盐条件下的ACNF凝胶模量随温度变化曲线,曲线显示ACNF凝胶的弹性模量(G’)和损耗模量(G”)先缓慢下降,当温度超过45℃时急剧升高;其弹性模量经加热后增加了14.31倍(5℃处数据)。凝胶模量降低是由纤维在升温起始阶段热运动加速破坏了原有的凝胶结构造成的[23];当温度超过45℃时,ACNF由于其特殊的弯曲结构(图 4),在布朗运动中纤维重新发生物理缠结,从而增强了纤维的网络结构[24]。添加10 mmol×L-1 NaCl后ACNF凝胶的模量在升温过程中始终处于上升状态(图 6(b)),其弹性模量经过加热后增加了20.78倍(5℃处数据),且凝胶强度高于添加0 mmol×L-1 NaCl凝胶。表明添加盐离子后ACNF凝胶的强度增强,而温度敏感性降低。

|
图 5 CNF和ACNF凝胶在不同温度下的形态 Fig.5 Status of CNF and ACNF gels at different temperatures |
|
图 6 添加不同氯化钠浓度的ACNF凝胶的振荡温度扫描曲线 Fig.6 Oscillation temperature sweep of ACNF gels with different salt concentrations (a) 0 mmol×L-1 (b) 10 mmol×L-1 |
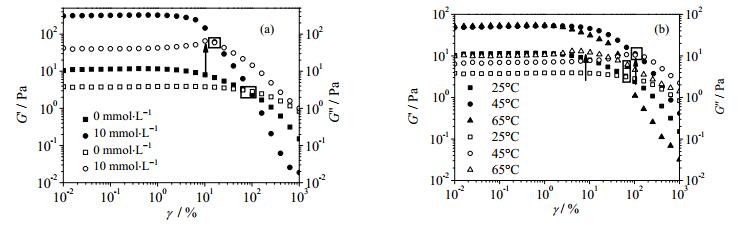
为了研究盐离子、温度对ACNF凝胶结构的影响,对其进行LAOS模式下的流变性质测试,如图 7所示。图 7(a)是添加不同盐浓度的ACNF凝胶的模量随应变(γ)的变化曲线,曲线显示添加盐离子后弹性模量(G’)和损耗模量(G”)增大,屈服应变(弹性模量和损耗模量交点处应变,黑色方框)降低;损耗模量在线性-非线性过渡区域出现特征指纹峰(黑色箭头),该指纹峰是在高应变作用下ACNF颗粒通过物理缠结或连接形成的“笼子”被打破并发生重排而产生的特殊的流变现象[19]。计算得到ACNF凝胶弹性模量在添加盐离子后增加了27.81倍,屈服应变由83.22%降低至16.26%。图 7(b)是ACNF凝胶经过加热后的模量随应变的变化曲线,可以看到经加热后模量变大,屈服应变轻微增加(图 7(b)黑色方框),在线性—非线性过渡区域同样出现特征指纹峰(图 7b黑色箭头)且随温度的升高峰位置后移。虽然添加盐离子和加热都会使ACNF凝胶发生因纤维缠结或连接引起的相同屈服行为,然而通过对比屈服应变数值和剪切重排峰位置的变化,发现盐离子和温度对ACNF凝胶结构的影响是不同的:盐离子的静电屏蔽使纤维发生团聚增,增强了凝胶强度但降低了凝胶的韧性;温度的升高加剧了纤维间的缠绕程度,从而加固凝胶结构,并提高其凝胶韧性。
|
图 7 不同盐浓度的ACNF凝胶的应变扫描曲线(a)和不同温度条件下ACNF凝胶的应变扫描曲线(b) Fig.7 Oscillation rheology results of ACNF gels under different salt concentrations (a) and temperatures (b) |
CNF自组装形成凝胶时,会在介观尺寸受到限制,从而会发生浓度涨落、形成非均相结构,这种结构的变化可以通过激光共聚焦观察[25]。为了考察温度、盐离子对ACNF凝聚相变的影响,对其进行激光共聚焦测试,如图 8所示。图 8(a)~(c)是无盐条件下的ACNF凝胶在不同温度下的激光共聚焦图片,可以观测到纤维聚集体随着温度的升高数量增多、尺寸变大。图 8(d)显示的是添加盐离子后ACNF凝胶的激光共聚焦图,相比于图 8(a),可以看到ACNF凝胶在部分区域发生团聚,在部分区域形成溶剂“空洞”[26]。图 8(d)~(f)是添加盐离子的凝胶在不同温度下的激光共聚焦图,可以看到随着温度的升高,ACNF凝胶中的纤维在整个凝胶空间中通过紧密连接形成网络结构。上述现象表明ACNF在温度作用下发生了物理缠结;而盐离子的加入使得ACNF发生聚集,并通过紧密连接形成凝胶。

|
图 8 不同温度条件下的ACNF凝胶的激光共聚焦图片 Fig.8 CLSM images of ACNF gels under different temperatures (a) 0 mmol×L-1 25℃ (b) 0 mmol×L-1 45℃ (c) 0 mmol×L-1 65℃ (d) 10 mmol×L-1 25℃ (e) 10 mmol×L-1 45℃ (f) 10 mmol×L-1 65℃ |
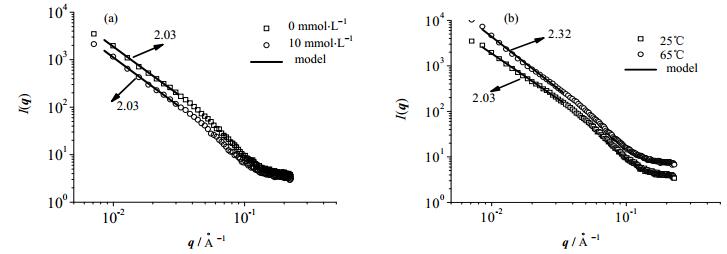
SAXS可以测试凝胶中纤维在微观尺度上的组装结构,其散射强度(I(q))和散射矢量(q)双对数曲线中直线部分的斜率可以用来计算分形维数,即在体系中的堆积方式[27]。为了研究ACNF凝胶在盐离子和温度影响下的微观结构变化,对其进行SAXS测试,结果如图 9所示。添加不同盐浓度的ACNF凝胶的I(q)-q双对数曲线(图 9(a))显示散射曲线在较大的q范围内近似重合,添加10 mmol×L-1 NaCl凝胶的散射强度在小q范围内低于无盐离子凝胶,而计算出的分形维数数值不变,均为2.03。ACNF凝胶经过25℃和65℃加热处理后的I(q)-q双对数曲线(图 9(b))显示ACNF凝胶经65℃加热后的散射强度I(q)值大于25℃,凝胶的分形维数由2.03增加到2.32,表明ACNF的分形维数随着温度的升高而增加[28]。分形维数变化表明,升高温度会改变ACNF凝胶中纤维的堆积方法;盐的加入仅压缩了纤维间的空间距离。
|
图 9 不同盐浓度下ACNF凝胶的SAXS图谱(a)和不同温度下ACNF凝胶的SAXS图谱(b) Fig.9 Coherent SAXS profiles of ACNF gels under different salt concentrations (a) and temperatures (b) |
ACNF凝胶在宏观流变性质和不同尺度上的结构信息,表明添加盐离子和改变温度会产生不同的凝胶机制。在温度作用下,由于纤维的热运动受限而发生物理缠结,导致其在微观尺度上分形维数增加,在宏观流变性质上出现剪切重拍峰,且缠结程度随着温度的升高而增强。添加盐离子后,纤维在静电屏蔽作用下发生聚集形成聚集体,由于相分离过程受限聚集体经相互连接形成凝胶,从而宏观流变上表现出剪切重排现象且其凝胶韧性降低;同时,盐离子的存在不会改变ACNF在微观尺度上的堆积方式,仅压缩了纤维间的空间距离。
4 结论(1) 利用无溶剂体系进行化学修饰,并结合高压均质的方法制备出弯曲和无晶形的ACNF颗粒。ACNF凝胶表现出对温度敏感的性质。添加盐离子之后ACNF的凝胶性增强,温度敏感性降低。
(2) 无盐条件下,ACNF在温度作用下发生凝胶化的实质是纤维在热运动下发生了物理缠结;添加盐离子后,ACNF在静电屏蔽作用下发生聚集,由受限相分离引起聚集体间发生连接导致凝胶化的发生。
| [1] | Fang W, Paanaen A, Vitikainen M, et al. Elastic and pH-responsive hybrid interfaces created with engineered resilin and nanocellulose[J]. Biomacromolecules , 2017, 18(6): 1866-1873. DOI:10.1021/acs.biomac.7b00294. |
| [2] | Pääkkö M, Ankerfors M, Kosonen H, et al. Enzymatic hydrolysis combined with mechanical shearing and high-pressure homogenization for nanoscale cellulose fibrils and strong gels[J]. Biomacromolecules , 2007, 8(6): 1934-1941. DOI:10.1021/bm061215p. |
| [3] | Wang M, Olszewska A, Malho J M, et al. Colloidal ionic assembly between anionic native cellulose nanofibrils and cationic block copolymer micelles into biomimetic nanocomposites[J]. Biomacromolecules , 2011, 12(6): 2074-2081. DOI:10.1021/bm101561m. |
| [4] | Jowkarderis L, Van De Ven T G. Rheology of semi-dilute suspensions of carboxylated cellulose nanofibrils[J]. Carbohydrate Polym , 2015, 123: 416-423. DOI:10.1016/j.carbpol.2015.01.067. |
| [5] | Le G K J, Jouanneau D, Garnier C, et al. Gelling of cellulose nanowhiskers in aqueous suspension[J]. Journal of Applied Polymer Science , 2014, 131(17): 8476-8481. |
| [6] | Zhang Y X, Carbonel R G, Rojas O J. Bioactive cellulose nanofibrils for specific human IgG binding[J]. Biomacromolecules , 2013, 14(12): 4161-4168. DOI:10.1021/bm4007979. |
| [7] | Nechyporchuk O, Belgacem M N, Pignon F. Current progress in rheology of cellulose nanofibril suspensions[J]. Biomacromolecules , 2016, 17(7): 2311-2320. DOI:10.1021/acs.biomac.6b00668. |
| [8] | Li M C, Wu Q, Song K, et al. Cellulose nanoparticles:structure-morphology-theology relationships[J]. Acs Sustainable Chemistry & Engineering , 2015, 3(5): 821-832. |
| [9] | Lee K Y, Quero F, Blaker J J, et al. Surface only modification of bacterial cellulose nanofibres with organic acids[J]. Cellulose , 2011, 18(3): 595-605. DOI:10.1007/s10570-011-9525-z. |
| [10] | Espino P E, Domenek S, Belgacem N, et al. Green process for chemical functionalization of nanocellulose with carboxylic acids[J]. Biomacromolecules , 2014, 15(12): 4551-4560. DOI:10.1021/bm5013458. |
| [11] | Avila R J A, Fortunati E, Kenny J M, et al. Simple citric acid-catalyzed surface esterification of cellulose nanocrystals[J]. Carbohydrate Polym , 2017, 157: 1358-1364. DOI:10.1016/j.carbpol.2016.11.008. |
| [12] | Yuwawech K, Wootthikanokkhan J, Tanpichai S. Enhancement of thermal, mechanical and barrier properties of EVA solar cell encapsulating films by reinforcing with esterified cellulose nanofibres[J]. Polymer Testing , 2015, 48: 12-22. DOI:10.1016/j.polymertesting.2015.09.007. |
| [13] | Jonoobi M, Harun J, Mathew A P, et al. Preparation of cellulose nanofibrilss with hydrophobic surface characteristics[J]. Cellulose , 2010, 17(2): 299-307. DOI:10.1007/s10570-009-9387-9. |
| [14] | Rodionova G, Lenes M, Eriksen O, et al. Surface chemical modification of microfibrillated cellulose:improvement of barrier properties for packaging applications[J]. Cellulose , 2011, 18(1): 127-134. DOI:10.1007/s10570-010-9474-y. |
| [15] | Moon R J, Martini A, Nairn J, et al. Cellulose nanomaterials review:structure, properties and nanocomposites[J]. Chemical Society Reviews , 2011, 40(7): 3941-3994. DOI:10.1039/c0cs00108b. |
| [16] | Salas C, NypelÖ T, Rodriguez A C, et al. Nanocellulose properties and applications in colloids and interfaces[J]. Current Opinion in Colloid & Interface Science , 2014, 19(5): 383-396. |
| [17] | Qi W, Xu H N, Zhang L. The aggregation behavior of cellulose micro/nanoparticles in aqueous media[J]. RSC Advances , 2015, 5(12): 8770-8777. DOI:10.1039/C4RA08844A. |
| [18] | Martola F, Dumont P J, Orgeas L, et al. Micro-mechanics of electrostatically stabilized suspensions of cellulose nanofibrils under steady state shear flow[J]. Soft Matter , 2016, 12(6): 1721-1735. DOI:10.1039/C5SM02310F. |
| [19] | Boromand A, Jamali S, Maia J M. Structural fingerprints of yielding mechanisms in attractive colloidal gels[J]. Soft Matter , 2017, 13(2): 458-473. DOI:10.1039/C6SM00750C. |
| [20] | Bozic M, Vivod V, Kavcic S, et al. New findings about the lipase acetylation of nanofibrillated cellulose using acetic anhydride as acyl donor[J]. Carbohydrate Polym , 2015, 125: 340-351. DOI:10.1016/j.carbpol.2015.02.061. |
| [21] | Davoudpour Y, Hossain S, Khalil H P S A, et al. Optimization of high pressure homogenization parameters for the isolation of cellulosic nanofibrilss using response surface methodology[J]. Industrial Crops and Products , 2015, 74: 381-387. DOI:10.1016/j.indcrop.2015.05.029. |
| [22] | LIN Feng-cai(林凤采), LU Qi-lin(卢麒麟), LIN Yong-mei(林咏梅), et al. Preparation and characterization of acetylated nanocellulose by one-step method(一步法制备乙酰化纳米纤维素及其性能表征)[J]. Chemical Industry and Engineering Progress(化工进展) , 2016, 35(2): 559-564. |
| [23] | Tian Z, Duan L, Wu L, et al. Rheological properties of glutaraldehyde-crosslinked collagen solutions analyzed quantitatively using mechanical models[J]. Materials Science & Engineering C , 2016, 63: 10-17. |
| [24] | Bodvik R, Dedinaite A, Karlson L, et al. Aggregation and network formation of aqueous methylcellulose and hydroxypropylmethyl cellulose solutions[J]. Colloids Surface A , 2010, 354(1): 162-171. |
| [25] | Rashad A, Mustafa K, Heggset E B, et al. Cytocompatibility of wood-derived cellulose nanofibril hydrogels with different surface chemistry[J]. Biomacromolecules , 2017, 18(4): 1238-1248. DOI:10.1021/acs.biomac.6b01911. |
| [26] | ZHUANG Wen-chang(庄文昌), CHEN Xiao(陈晓), ZHAO Ji-kuan(赵继宽), et al. Small angle X-ray scattering studies on colloid dispersive systemsand organized molecular assemblies(胶体分散体系与有序分子组合体的小角X射线散射研究)[J]. Progress in Chemistry(化学进展) , 2005, 17(5): 881-888. |
| [27] | Arvidson S A, Lott J R, Mcallister J W, et al. Interplay of phase separation and thermoreversible gelation in aqueous methylcellulose solutions[J]. Macromolecules , 2013, 46(1): 300-309. DOI:10.1021/ma3019359. |
| [28] | Villetti M A, Soldi V, Rochas C, et al. Phase-separation kinetics and mechanism in a methylcellulose/salt aqueous solution studied by time-resolved small-angle light scattering (SALS)[J]. Macromolecules , 2011, 212(10): 1063-1071. |




