2. 北京低碳清洁能源研究院, 北京 102211;
3. 中国石油大学(北京) 机械与储运工程学院, 北京 102249
2. National Institute of Clean-and-Low-Carbon Energy, Beijing 102211, China;
3. College of Mechanical and Transportation Engineering, China University of Petroleum, Beijing 102249, China
费托蜡(Fischer-Tropsch wax)是费托合成工艺中的一种亚甲基混合物,主要组成是直链的饱和烷烃,碳数分布在20~100[1],其熔点最高可达120 ℃。高质量的费托蜡呈白色,不含硫、氮、芳烃等杂质,具有晶体结构精细、熔点高、稳定性好及坚硬、耐磨等特点[2]。基于以上优点,费托蜡广泛应用于建筑、涂料、塑料、食品及化妆品等领域,具有非常广阔的应用前景[3-4]。
近年来,随着国内费托合成技术的提升以及在应用方面的拓展,高附加值费托蜡产品的需求量逐年增加,因此,对费托蜡精制和提纯的研究越来越受到人们的关注。分级结晶法[5]是提升费托蜡产品质量的重要方法,同时可以有效控制结晶过程晶体的粒度和晶习,以利于固液分离。选择合适的萃取溶剂并获取其准确全面的溶解度数据,是溶液萃取耦合分级结晶工艺开发的必要工作。但目前费托蜡在有机溶剂中的溶解度数据十分有限[6],所以仍需对其溶解热力学进行系统研究。
基于中、高熔点费托蜡生产加工的技术需要,本研究所选温度较高,同时选择5种化学工业中比较常用的有机溶剂进行比较。采用动态法测定常压下费托蜡在正丁醇、乙酸丁酯、正辛烷、石油醚和甲苯溶剂体系中的溶解度数据,并用Apelblat方程、多项式方程以及简化的二参数方程对溶解度数据进行关联,对费托蜡溶解焓、溶解熵和溶解吉布斯自由能进行计算。本工作可为费托蜡结晶过程工艺开发提供理论指导。
2 实验材料和方法 2.1 实验原料及试剂费托蜡(国家能源集团宁夏煤业有限责任公司);正丁醇(分析纯,天津市福晨化学试剂有限公司);乙酸丁酯(分析纯,天津市大茂化学试剂厂);正辛烷(分析纯,天津市科密欧化学试剂有限公司);石油醚(分析纯,沸程90~120 ℃,北京市通广精细化工公司);甲苯(分析纯,北京化工厂)。
2.2 费托蜡组成及性质测定碳、氢、氮元素含量的测定采用Vario EL cube碳氢氮元素分析仪;氧元素含量的测定采用Rapid OXY cube氧元素分析仪;硫元素含量的测定采用HIR-94B型高频红外碳硫分析仪。费托蜡的碳数分布测定采用Aglient 6890N型气相色谱仪,具体条件为:以二硫化碳为溶剂,初始柱温为40 ℃,升温速率为20 ℃·min−1,汽化温度为420 ℃,以C20~C72正构烷烃(色谱纯)为标样。费托蜡的初始结晶温度和熔程测定采用美国TA公司Q20型差示扫描量热仪,具体条件为:氮气气氛,流量为50 mL·min−1,降温速率为10 ℃·min−1,温度范围为20~130 ℃。
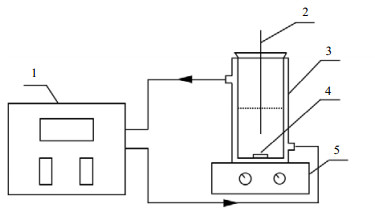
2.3 溶解度测定实验装置和方法采用动态法[7-9]测定费托蜡在正丁醇、乙酸丁酯、正辛烷、石油醚和甲苯中的溶解度,其实验装置如图 1所示。该装置是一带夹套的结晶器,容积为150 mL。结晶器与超级恒温槽相连,实验过程中的升温可由循环水来实现。使用磁力搅拌器使固液两相混合均匀并且加快费托蜡的溶解。采用传统的目测法判定平衡点,通过多次测定消除偶然误差。为避免溶剂在测定过程中的挥发,用橡胶塞密封结晶器瓶口。费托蜡在加入溶剂之前将其充分研磨,以加大费托蜡颗粒与溶剂的接触面积,使固液两相尽可能在短时间内达到平衡。体系温度由插入溶液的热电偶测量,其精度为± 0.1 ℃。
|
图 1 溶解度测定装置图 Fig.1 Schematic diagram of the experimental setup for solubility measurements 1. thermostatic water-circulator bath 2. thermocouple 3. jacketed glass vessel 4. magnetic stirring bar 5. magnetic agitator drive |
实验开始时,溶质和溶剂先后经电子分析天平(精度为± 0.1 mg)准确称量后加入夹套结晶器中。开启磁力搅拌器使固液两相混合均匀,开启超级恒温槽控制体系的温度,实时监测溶液浑浊程度变化,当溶液变澄清时,可以认为费托蜡固体完全溶解,记录此时体系温度即得到此溶解度下的平衡温度。每组实验重复上述操作过程3次,取平均值作为最终的实验结果。
采用摩尔分率表示溶解度,计算公式为
| $ x = \frac{{m/M}}{{m/M + {m_n}/{M_n}}} $ | (1) |
式中:x为溶质的摩尔分率溶解度;m为溶质费托蜡的质量,g;M为溶质费托蜡的摩尔质量,g·mol−1;mn为溶剂(正丁醇、乙酸丁酯、正辛烷、石油醚和甲苯)的质量,g;Mn为溶剂(正丁醇、乙酸丁酯、正辛烷、石油醚和甲苯)的摩尔质量,g·mol−1。
平衡温度的相对平均偏差ARD计算公式为
| $ {\rm{ARD}} = \frac{1}{n}\sum\limits_{i = 1}^n {\frac{{\left| {{T_i} - T} \right|}}{T}} $ | (2) |
式中:Ti和T分别为平衡温度的测量值和平衡温度平均值,K;n为测量次数。
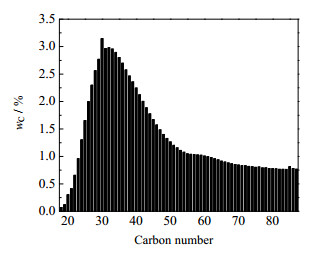
3 实验结果与讨论 3.1 费托蜡组成及性质分析费托蜡的元素分析结果见表 1。表中,Mr为相对分子质量,C、H和O元素质量分数wB分别为84.60%、14.79% 和0.61%,未检出S和N元素,可见该费托蜡纯度较高。同时,费托蜡组成较为复杂,通过高温气相色谱法对含高碳数的费托蜡的碳数分布进行快速准确的测定[10],结果如图 2所示,图中wC为不同碳数烷烃的质量分数。将费托蜡按平均分子进行处理,由碳数分布可计算出其平均相对分子质量Mr为579.85。
|
|
表 1 费托蜡组成及性质 Table 1 Composition and property results of Fischer-Tropsch wax |
|
图 2 费托蜡的碳数分布测定结果 Fig.2 Measurement results of carbon number distribution of Fischer-Tropsch wax |
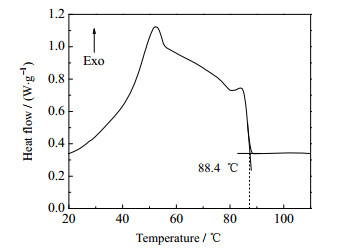
费托蜡作为一种混合物,其熔程主要受烃类组成影响。针对某一种特定的蜡,其组成较为稳定。因此,可由DSC法[11]测得费托蜡的初始结晶温度和熔程等物性参数。图 3费托蜡冷却结晶DSC曲线上放热峰前斜率最大点的切线与曲线上水平线的交点即为该费托蜡的初始结晶温度,熔程为DSC曲线上有明显放热现象的温度区间。取3次测试结果的平均值,计算得到该费托蜡初始结晶温度为88.4 ℃,熔程为20~88.4 ℃。
|
图 3 费托蜡冷却结晶过程DSC曲线 Fig.3 DSC curve of cooling crystallization process of Fischer-Tropsch wax |
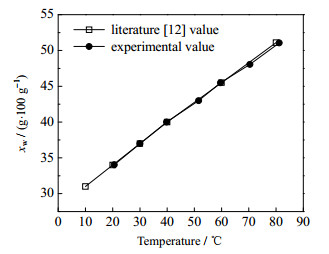
氯化钾在水中的溶解度已有广泛报道,因此,用氯化钾-水作为标准体系,对溶解度测定装置和方法的可靠性进行验证。采用动态法测定氯化钾在水中的溶解度,并与文献[12]值比较,结果如图 4所示。图中xw为质量溶解度,从图 4可以看出,实验测定值与文献值符合良好,说明实验装置和方法可靠,可用于测定费托蜡在5种有机溶剂中的溶解度。
|
图 4 KCl在水中的溶解度 Fig.4 Solubility profiles of potassium chloride in water |
实验测得的费托蜡在正丁醇、乙酸丁酯、正辛烷、石油醚和甲苯5种有机溶剂中溶解度xi, exp见表 2。平衡温度结果的相对平均偏差均在0.04%~0.41%,说明动态法测费托蜡溶解度具有较好的精密度。实验结果表明,费托蜡在5种有机溶剂中的溶解度均随温度的升高而增大;在相同温度下,费托蜡在不同溶剂中的溶解度大小依次为:甲苯 > 石油醚 > 正辛烷 > 乙酸丁酯 > 正丁醇。费托蜡是一种非极性溶质,所以在非极性溶剂甲苯、石油醚和正辛烷中的溶解性能较好,即溶质和溶剂极性越相似,分子间引力越强,越有利于溶质在溶剂中的溶解。
|
|
表 2 费托蜡在5种有机溶剂中的溶解度及拟合偏差 Table 2 Solubilities of Fischer-Tropsch wax in five organic solvents with fitting deviation |
采用Apelblat方程[13-15](式(3))、多项式方程[16-17](式(4))以及简化的二参数方程[18](式(5))对费托蜡溶解度数据进行关联回归。
| $ \ln x=a+\frac{b}{T}+c \ln T $ | (3) |
| $ x=A+B T+C T^{2} $ | (4) |
| $\ln x=A_{1}+\frac{B_{1}}{T}$ | (5) |
式中:a、b、c、A、B、C、A1和B1分别为所对应方程的模型参数,这些参数的回归值列于表 3。采用相关指数R2来描述3种模型的拟合程度。
|
|
表 3 Apelblat方程、多项式方程和简化的二参数方程参数关联结果 Table 3 Parameters of the Apelblat equation, polynomial equation and simplified equation |
利用相对偏差RD、平均相对偏差RAD和均方根偏差RMSD来评估模型计算值与实验值之间的偏差,计算如式(6)~(8)所示。3种模型的计算值(102xi, cal)、实验值与计算值之间的偏差(RD、RAD、RSMD)结果见表 2。
| $ {\mathrm{RD}}=\frac{x_{i, \mathrm{cal}}-x_{i, \exp }}{x_{i, \exp }}$ | (6) |
| ${\mathrm{RAD}}=\frac{1}{N} \sum\limits_{i=1}^{N}\left|\frac{x_{i, \mathrm{cal}}-x_{i, \exp }}{x_{i, \exp }}\right|$ | (7) |
| ${\rm{RMSD}}=\left[\frac{1}{N} \sum\limits_{i=1}^{N}\left(x_{i, \text { cal }}-x_{i, \exp }\right)^{2}\right]^{1 / 2} $ | (8) |
式中:xi, exp和xi, cal分别为溶质摩尔分率溶解度的实验值和溶质摩尔分率溶解度的模型关联计算值。
从表 3可以看出,采用Apelblat方程、多项式方程和简化的二参数方程均能较好地关联费托蜡在5种有机溶剂中的溶解度数据,所得模型方程可预测所测温度范围内费托蜡在不同溶剂中的溶解度。对比3种模型的关联结果,Apelblat方程和多项式方程的拟合效果明显优于简化的二参数方程。其中,Apelblat方程关联曲线如图 5所示。
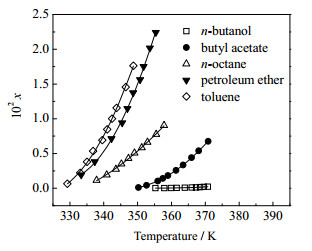
|
图 5 费托蜡溶解度实验数据及Apelblat方程关联曲线 Fig.5 Experimental solubility data of Fischer-Tropsch wax and correlation curve of Apelblat equation |
在实际工程应用中,当温度变化不大时,溶解焓、溶解熵等热力学参数可近似看作常数。目前溶解过程中热力学参数的计算普遍采用修正的Van’t Hoff方程[19-22]进行分析。溶解焓ΔsolH可以用式(9)、(10)进行计算。
| $ \Delta_{\mathrm{sol}} H=-R \times \frac{\partial \ln x}{\partial\left(\frac{1}{T}-\frac{1}{T_{m}}\right)} $ | (9) |
| $T_{m}=\frac{N}{\sum\limits_{i=1}^{N} \frac{1}{T}} $ | (10) |
式中:R为通用气体常数,8.314 J·mol−1·K−1;Tm为温度的调和平均值,K;N为数据样本量。
基于实验的溶解度数据,以1/T-1/Tm为横坐标、ln x为纵坐标线性拟合,斜率为k,截距为d,则溶解焓ΔsolH、溶解吉布斯自由能ΔsolG和溶解熵ΔsolS可分别用式(11)、(12)和(13)来计算。
| $ \Delta_{\mathrm{sol}} G=-R \times T_{m} \times d$ | (11) |
| $\Delta_{\mathrm{sol}} G=-R \times T_{m} \times d$ | (12) |
| $\Delta_{\mathrm{sol}} S=\frac{\Delta_{\mathrm{sol}} H-\Delta_{\mathrm{sol}} G}{T_{m}}$ | (13) |
修正的Van’t Hoff方程拟合结果如图 6和表 4所示,从R2值可以看出,该方程对费托蜡的溶解度数据有较好的拟合效果,可用于热力学参数的计算。
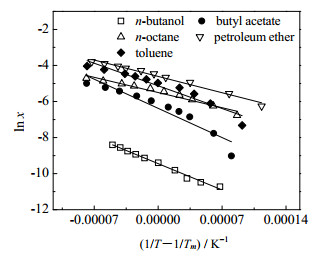
|
图 6 修正的Van’t Hoff方程拟合费托蜡溶解度 Fig.6 Fischer-Tropsch wax solubility fitted by modified Van't Hoff equation |
|
|
表 4 修正的Van’t Hoff方程拟合费托蜡溶解度得到的模型参数 Table 4 Model parameters fitted by modified Van't Hoff equation |
利用式(9)~(13)计算得到的费托蜡在不同溶剂中溶解过程的热力学参数列于表 5。从表中可以发现,ΔsolH和ΔsolG均为正值,说明费托蜡溶解过程是一个非自发的吸热过程,即费托蜡分子与溶剂分子之间的相互作用比溶剂分子之间的相互作用更弱,导致费托蜡与溶剂分子间作用键的能量不足以弥补溶剂分子间原有缔合键的断裂所需要的能量[18],因此需要外界提供能量,这与费托蜡溶解度随温度的升高而增大的结果相一致。费托蜡在乙酸丁酯中的溶解焓最大,说明费托蜡与乙酸丁酯分子作用引力最小,温度对费托蜡在乙酸丁酯中的溶解度影响最大。同时,溶解过程溶质分子与溶剂分子相混合,扰乱了原有溶剂分子的排列,使体系的混乱度增加,故ΔsolS均为正值。
|
|
表 5 费托蜡溶解过程的热力学参数 Table 5 Thermodynamic parameters of Fischer-Tropsch wax during dissolution processes |
(1) 在常压下,费托蜡在所选的5种有机溶剂中的溶解度均随温度升高而增大,且在一定温度下,费托蜡在不同溶剂中的溶解度大小顺序为:甲苯 > 石油醚 > 正辛烷 > 乙酸丁酯 > 正丁醇。
(2) 采用Apelblat方程、多项式方程和简化的二参数方程关联费托蜡在不同溶剂中的溶解度数据,结果表明3种模型均能取得较好的关联结果。对比3种模型的关联结果,Apelblat方程和多项式方程拟合效果明显优于简化的二参数方程。
(3) 采用修正的Van’t Hoff方程计算了费托蜡在不同溶剂中的溶解焓、溶解熵和溶解吉布斯自由能,其值均大于0,说明费托蜡在5种有机溶剂中的溶解过程均为吸热、熵增的非自发过程。
| [1] |
裴曼琳, 张志新, 周敬来, 等. F-T合成蜡的研究进展[J]. 石油化工, 1995, 24(12): 900-903. PEI M L, ZHANG Z X, ZHOU J L, et al. Research progress of F-T synthetic wax[J]. Petrochemical Technology, 1995, 24(12): 900-903. |
| [2] |
孙剑锋, 毕文卓, 王诗语. 费-托合成蜡的性质及应用展望[J]. 当代化工, 2016, 45(12): 2884-2887, 2890. SUN J F, BI W Z, WANG S Y. Properties and application prospects of Fischer-Tropsch synthetic wax[J]. Contemporary Chemical Industry, 2016, 45(12): 2884-2887, 2890. |
| [3] |
张怡, 唐勇, 于鹏浩, 等. F-T合成微晶蜡的市场前景和研究进展[J]. 化工进展, 2010, 29(S1): 353-356. ZHANG Y, TANG Y, YU P H, et al. Market prospect and research progress of F-T synthetic microcrystalline wax[J]. Chemical Industry and Engineering Progress, 2010, 29(S1): 353-356. |
| [4] |
双玥. 高熔点费托合成蜡的应用及发展趋势[J]. 化学工业, 2012, 30(10): 11-15. SHUANG Y. Application and development tendency of Fischer-Tropsch hard wax[J]. Chemical Industry, 2012, 30(10): 11-15. |
| [5] |
丁绪淮, 谈遒. 工业结晶[M]. 北京: 化学工业出版社, 1985. DING X W, TAN Q. Industrial crystallization[M]. Beijing: Chemical Industry Press, 1985. |
| [6] |
孙东旭, 戴咏川, 齐程远, 等. 费-托合成蜡溶剂精制及其结构与性质的研究[J]. 石油炼制与化工, 2016, 47(11): 78-81. SUN D X, DAI Y C, QI C Y, et al. Research on F-T wax solvent deoiling and wax structure and properties[J]. Petroleum Processing and Petrochemicals, 2016, 47(11): 78-81. |
| [7] |
沈乐, 李惠萍, 高江涛, 等. 1-苄基-4-羟甲基-1H-1, 2, 3-三氮唑溶解度的测定及关联[J]. 高校化学工程学报, 2016, 30(1): 1-6. SHEN L, LI H P, GAO J T, et al. Measurement and correlation of 1-benzyl-4-hydroxymethyl-1H-1, 2, 3-triazole solubility[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(1): 1-6. |
| [8] |
宋微微, 马沛生, 相政乐. 丁二酸在五种有机溶剂中溶解度测定及关联[J]. 高校化学工程学报, 2007, 21(2): 341-344. SONG W W, MA P S, XIANG Z L. Determination and correlation of the solubility for succinic acid in five different organic solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(2): 341-344. |
| [9] |
智敏杰, 陈亮. 氯唑西林钠的溶解度和晶习分析研究[J]. 高校化学工程学报, 2020, 34(3): 611-618. ZHI M J, CHEN L. Study on the solubility and crystal habit of cloxacillin sodium[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(3): 611-618. |
| [10] |
池朗珠, 李自运, 蒋莹, 等. 高温气相色谱法测定费-托合成蜡的碳数分布[J]. 石油炼制与化工, 2016, 47(4): 101-104. CHI L Z, LI Z Y, JIANG Y, et al. Determination of carbon number distribution of Fischer-Tropsch wax by high temperature gas chromatography[J]. Petroleum Processing and Petrochemicals, 2016, 47(4): 101-104. |
| [11] |
张喜文, 刘智, 杨春雁, 等. DSC法测定石蜡熔点[J]. 石油化工, 2003, 32(6): 521-524. ZHANG X W, LIU Z, YANG C Y, et al. Determination of wax melting point by DSC[J]. Petrochemical Technology, 2003, 32(6): 521-524. |
| [12] |
袁渭康, 王静康, 费维扬, 等. 化学工程手册[M]. 3版. 北京: 化学工业出版社, 2019. YUAN W K, WANG J K, FEI W Y, et al. Chemical engineering handbook[M]. 3rd ed. Beijing: Chemical Industry Press, 2019. |
| [13] |
ZHANG X, SONG L C, ZHAO D Y, et al. Measurement and correlation of solubility of carbendazim in lower alcohols[J]. Thermochimica Acta, 2018, 659: 172-175. DOI:10.1016/j.tca.2017.12.007 |
| [14] |
谢宏昭, 周龙昌, 王琳琳, 等. 枞酸在四种醇类溶剂中的溶解度测定与关联[J]. 高校化学工程学报, 2011, 25(3): 385-389. XIE H Z, ZHOU L C, WANG L L, et al. Determination and correlation of the solubility for abietic acid in four alcohol solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(3): 385-389. |
| [15] |
张群艳, 吴艳阳, 李赵晋, 等. 均四甲苯在不同溶剂中溶解度的测定及关联[J]. 高校化学工程学报, 2020, 34(5): 1120-1128. ZHANG Q Y, WU Y Y, LI Z J, et al. Determination and correlation of the solubility of mesitylene in different solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(5): 1120-1128. |
| [16] |
贾青竹, 马沛生, 王昶, 等. 2, 4-二氯苯酚在水中溶解度的测定及关联[J]. 化学工程, 2006, 34(8): 44-47. JIA Q Z, MA P S, WANG C, et al. Studies on the solid-liquid equilibrium of 2, 4-dichlorophenol in water[J]. Chemical Engineering (China), 2006, 34(8): 44-47. |
| [17] |
史小帅, 乐清华, 方永明, 等. 溶析结晶法提纯龙脑的热力学研究[J]. 化学工程, 2016, 44(3): 30-35. SHI X S, LE Q H, FANG Y M, et al. Thermodynamic properties of borneol with anti-solvent crystallization[J]. Chemical Engineering (China), 2016, 44(3): 30-35. |
| [18] |
李涛, 沙娇, 赵瑞, 等. 双季戊四醇在3种混合溶剂中的固-液相平衡[J]. 化工学报, 2020, 71(1): 245-253. LI T, SHA J, ZHAO R, et al. Solid-liquid phase equilibrium of dipentaerythritol in three mixed solvents[J]. CIESC Journal, 2020, 71(1): 245-253. |
| [19] |
WANG P, WANG J K, GONG J B, et al. Determination of the solubility, dissolution enthalpy and entropy of Deflazacort in different solvents[J]. Fluid Phase Equilibria, 2011, 306(2): 171-174. DOI:10.1016/j.fluid.2011.03.032 |
| [20] |
HOU H, WANG J L, CHEN L Z, et al. Experimental determination of solubility and metastable zone width of 3, 4-bis (3-nitrofurazan-4-yl)furoxan (DNTF) in (acetic acid + water) systems from (298.15 K-338.15 K)[J]. Fluid Phase Equilibria, 2016, 408: 123-131. DOI:10.1016/j.fluid.2015.08.028 |
| [21] |
ZHOU J Y, FU H L, CAO H, et al. Measurement and correlation of the solubility of florfenicol in binary 1, 2-propanediol+water mixtures from 293.15 K to 316.25 K[J]. Fluid Phase Equilibria, 2013, 360: 118-123. DOI:10.1016/j.fluid.2013.09.020 |
| [22] |
FAN J P, XIE Y L, TIAN Z Y, et al. Solubilities of evodiamine in twelve organic solvents from T=(283.2 to 323.2)K[J]. Journal of Chemical Thermodynamics, 2013, 52(3): 288-291. |




