2. 浙江大学 能源清洁利用国家重点实验室, 浙江 杭州 310027
2. State Key Laboratory of Clean Energy Utilization, Zhejiang University, Hangzhou 310027, China
煤气化技术是一种将煤炭转化为清洁燃料间接实现煤炭清洁高效利用的技术。Guo等[1]提出了“煤炭超临界水气化制氢和H2O/CO2混合工质热力发电多联产系统”,并得到了持续的发展和完善[2~5]。目前国内外针对此系统的研究主要集中于煤炭超临界水气化技术,如Jin等[6-8]开展了超临界水气化制氢中的多尺度化学反应动力学和热质传递强化理论研究,以改善制氢过程中碳不完全转化问题;还构建了5模块并联的超临界水流化床煤气化制氢小型示范样机,并进行72 h测试运行[9]。国外也有多个机构对煤炭超临界水气化过程进行原理性验证及反应机理研究[10~11],但是对于煤炭超临界水气化制氢耦合发电技术部分至今未见公开报道[12]。
超临界水混合工质氢氧化反应器作为连接煤气化环节和发电环节的重要装置,将气化产生的合成气充分氧化,转化为超临界H2O/CO2混合工质通入透平机械中做功发电。此过程避免了含有高浓度H2的混合气体通入透平机械引起多联产系统的安全性风险,同时可以回收氧化放热以兼顾能量利用率。目前公开文献中对氧化反应器的研究集中于氧化反应动力学和反应机理,而针对面向上述多联产系统的氢氧化反应器,还缺乏综合性能的工程尺度研究。
因此,本文在Aspen Plus中建立超临界混合工质氢氧化反应器模型,并以公开报道的超临界水气化制氢示范样机测试产物的相关参数作为反应器入口设定,综合探究反应物初始温度、物料组分对反应器内反应过程的影响,为反应器的结构设计和安全运行以及系统能量利用效率的提高提供理论指导。
2 模型建立Aspen Plus作为经典的化学工程过程模拟平台,已被广泛用于煤气化炉[13]、精馏塔[14]和甲烷化精制合成氨[15]等多种反应流程的模拟。本文参考前人的相关研究,在Aspen Plus中建立了新型超临界H2O/CO2混合工质氢氧化反应器的流程模型。
2.1 反应器流程模型本研究采用O2在反应器中分段通入的形式,对应的氢氧化反应器抽象模型如图 1所示。两股物料经过预混器进入逆流换热反应器中进行反应,模型中设置4个反应器以表示O2分为4段通入。
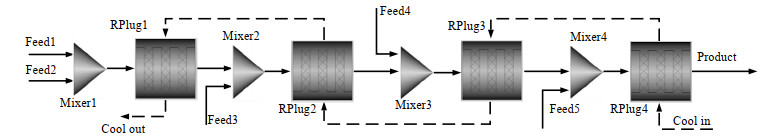
|
图 1 超临界混合工质氢氧化反应器模型流程图 Fig.1 Flow chart of the hydrogen oxidation reactor model with supercritical hybrid working fluid |
超临界H2O/CO2混合工质氢氧化反应器采用适合进行连续反应的管式反应器。反应器管长远大于管径时,管内流动接近理想流动,可以唯一地由化学反应动力学所确定[16]。反应器尺寸是基于混合工质流量以及H2完全反应理论停留时间估算所得。氢氧化反应器常采用不锈钢或合金材料加工而成,通过材料的导热系数、估算管内外对流传热系数和污垢热阻得到综合传热系数。在软件模型设定中反应器类型选用逆流换热的RPlug反应器。管直径为38 mm,管长为2.4 m,管数为1根;冷却水进口温度为室温20 ℃,压强为5×105 Pa,质量流量为800 kg·h-1;总传热系数为0.5 kW·m-2·K-1。
2.1.2 反应及反应动力学参数由于氢氧化反应器的入口工质来源于煤气化炉,并且两者反应条件是连续的。根据超临界水气化制氢过程的反应机制和路径可知[17-18],气化合成气与超临界水之间没有发生特殊反应,因此混合工质超临界水氢氧化反应器内通入O2会发生下列反应:
氧化反应:
| ${{\rm{H}}_2} + \frac{1}{2}{{\rm{O}}_2}\xrightarrow{{}}{{\rm{H}}_2}{\rm{O}}$ | (1) |
| ${\rm{C}}{{\rm{H}}_4} + 2{{\rm{O}}_2}\xrightarrow{{}}{\rm{C}}{{\rm{O}}_2}{\rm{ + }}2{{\rm{H}}_2}{\rm{O}}$ | (2) |
| ${\rm{CO}} + \frac{1}{2}{{\rm{O}}_2}\xrightarrow{{}}{\rm{C}}{{\rm{O}}_2}$ | (3) |
水煤气变换反应:
| $ {\rm{CO}} + {{\rm{H}}_2}{\rm{O}}\overset {} \leftrightarrows {\rm{C}}{{\rm{O}}_2}{\rm{ + }}{{\rm{H}}_2} $ | (4) |
甲烷化反应:
| $ {\rm{CO}} + {\rm{3}}{{\rm{H}}_2}\overset {} \leftrightarrows {\rm{C}}{{\rm{H}}_4}{\rm{ + }}{{\rm{H}}_2}{\rm{O}} $ | (5) |
以上反应中的甲烷化反应是可逆反应,从热力学角度分析在超临界水环境中CH4的生成会受到抑制[19]。有实验结果表明,即使在高温下式(5)的逆反应CH4重整制氢反应速率在没有催化剂条件下也十分缓慢[18]。另外,在超临界水气化制氢过程中碳重整占主导反应,甲烷化反应的影响可以忽略不计[17]。因此本文忽略了甲烷化反应,认为主要反应为氧化反应式(1)、(2)、(3)和水煤气变换反应式(4)。
上述反应的反应速率由下式表示:
| $ r{\rm{ = }}A{\rm{exp }}\left( { - \frac{E}{{RT}}} \right)c_{\rm{1}}^{{\alpha _1}}c_{\rm{2}}^{{\alpha _2}} $ | (6) |
式中:c1和c2分别表示化学反应式中反应物1和反应物2的浓度,mol·m-3;r为反应速率,mol·m-3·s-1;A为指前因子;E为活化能,kJ·mol-1;R为摩尔气体常数,J·mol-1·K-1;T为热力学温度,K;α1、α2为反应级数。
2.1.2节中介绍的反应在超临界水中的反应动力学参数如表 1所示,其中H2、CH4和CO的氧化反应动力学参数分别来自Li等[20]、Webley和Tester[21]以及Helling和Tester[22]的工作,水煤气变换反应的动力学参数则来自Su [17]的工作。
|
|
表 1 反应动力学参数 Table 1 Reaction kinetic parameters |
超临界H2O/CO2混合工质由H2O、H2、CH4、CO和CO2等物质组成。李萌萌等[23]认为在超临界流体的模拟过程中,根据体系极性判断采用Peng-Robinson(PR)或Redlich-Kwong(RK)状态方程作为热力学模型。因此本文中选用通过温度函数修正的Peng-Robinson-Boston- Mathias(PR-BM)状态方程。该模型适用于所有温度、压强下的非极性或弱极性的体系。
2.2 反应器模型验证由于过往对氢氧化反应器的相关研究主要集中在可燃气体反应机理的实验研究方面,故本文选取了H2在超临界H2O/CO2混合工质中的氧化实验[20]进行氢氧化反应器模型的验证。在热力学温度为574 ℃,压强为23.6 MPa,氢氧燃料比为0.92的反应条件下,将不同长度反应器出口的H2和O2浓度的模拟结果和实验数据进行对比。如图 2所示H2和O2浓度在不同长度反应器出口的数值均十分相近。所以本文建立的模型反应动力学参数和物性方法等设置是合理的,具有一定的通用性。
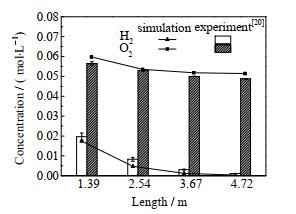
|
图 2 反应器出口组分浓度模拟与实验对比 Fig.2 Simulation and experimental comparison of component concentration at reactor outlet |
本文选取西安交通大学超临界水流化床煤气化制氢小型示范样机[9]的陕西张家峁煤测试产物作为通入氢氧化反应器的初始工质。由于C2组分含量微小,将其统一折算为CH4组分进行计算。高压O2的温度、压强设定与混合工质相同。高压O2流量设定为在工质组分完全氧化的理论所需O2量的基础上过量10%。每段O2入口比例均为25%。
将2.3节中描述的混合工质参数和组分设定作为基准工况G0,参考不同煤种在超临界水中气化产物的各组分比例,适当改变反应温度、组分流量而形成多个模拟工况(如表 2所示),可分析反应器内部反应规律和不同参数变化对反应的影响。其中QB为摩尔流量,kmol·h-1;t为温度,℃;p为压力,MPa。
|
|
表 2 模拟工况设置 Table 2 Simulation condition setting |
基准工况G0的参数设置如表 2所示,其中超临界水占混合工质组分的95% 以上,O2组分均分为4部分通入每段反应器中。基准工况下反应器长度方向上模拟结果如图 3所示,图中,x为摩尔分数,各段反应器的具体参数情况如表 3所示。
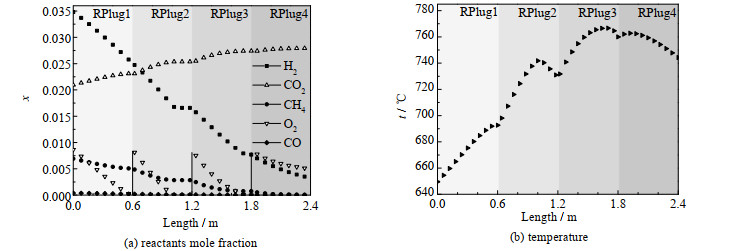
|
图 3 准工况下反应器长度方向上的各参数变化情况 Fig.3 Variation of various parameters along the length of reactor under reference condition |
|
|
表 3 各段反应器热量变化情况 Table 3 Heat change of each reactor |
从图 3(a)中可看出,H2和CH4的摩尔分数x呈不断下降趋势且下降斜率不同,表示在4段反应器中均发生氧化反应,H2的反应速率大于CH4。随着H2的不断消耗,RPlug4中H2反应速率降低,反应器出口有H2残留。但RPlug4中O2也未消耗完全,说明氢氧化反应还有继续反应的空间。CO和CO2的摩尔分数分别呈现总体减少和增加的趋势。
由于O2分段通入每段反应器中,所以图 3(a)中O2的消耗曲线在每段反应器入口有突变,而且其他组分的摩尔分数曲线也有轻微突变。O2消耗速度Rplug2 > Rplug3 > Rplug1 > Rplug4,其反应速率由反应物浓度和温度共同决定。图 3(b)中各段反应器内温度上升情况与O2消耗情况一致。温度下降是由于反应器内部O2消耗完全,氧化反应停止,反应器外部冷却水换热导致的。
在前3段反应器内O2处于不足状态,RPlug1中温度较低,反应速率比较慢,图 3(b)中温度上升速率也比较慢;RPlug2中温度已达700 ℃,氧化反应迅速完成。RPlug3由于浓度的降低,导致反应速率降低。RPlug4中O2足量,限制反应速率的主要因素是反应器内反应物浓度降低。所以,在前两段反应器内反应温度的影响较大,在后两段反应器内,反应物浓度的影响占据主导地位。
由表 3可知,冷却水持续带走反应放出的热量导致冷却水出口温度不断在增加。工质热量变化和反应放出热量都与图 3中曲线变化和分析一致。
3.2 初始温度的变化本节在基准工况的基础上,改变氢氧化反应器初始温度,采用表 2的G1~G4模拟工况与基准工况G0进行对比,氢氧化反应器长度上的模拟结果如图 4、5所示。
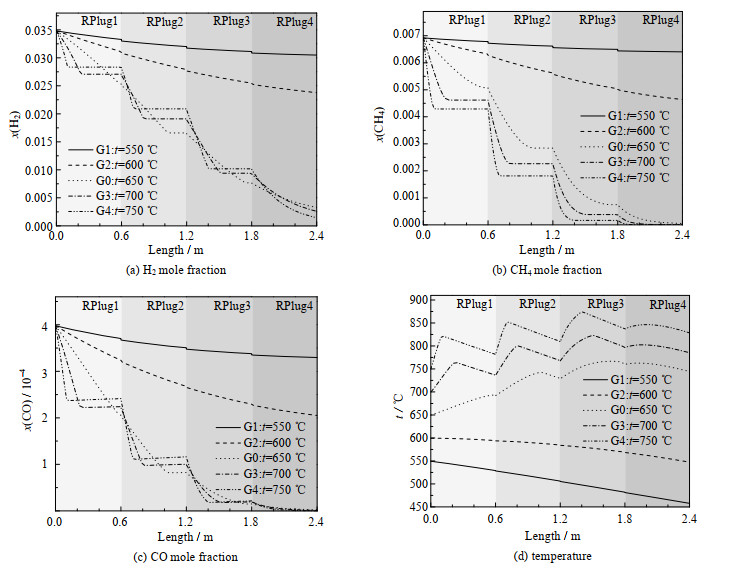
|
图 4 不同温度下反应器长度方向上的各参数变化情况 Fig.4 Variation of various parameters along the length of reactor at different temperatures |
|
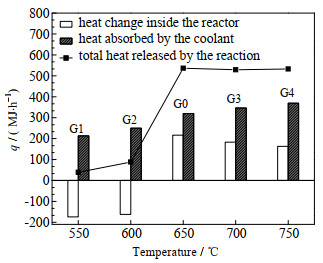
图 5 不同温度下反应器热量变化情况 Fig.5 Heat change of reactor at different temperatures |
图 4(a)、(b)、(c)表示不同温度下H2、CH4、CO的消耗曲线,随着反应温度升高,反应速率都大大升高。当温度大于650 ℃后,由于通入O2量一定,在每段反应器内H2和CH4氧化反应都提前停止,但H2反应量随温度升高逐渐减少,而CH4反应量逐渐增加,所以,CH4对于O2的竞争能力大于H2,O2稀缺时,CH4氧化反应优先于H2氧化。图 4(a)中随着反应温度升高,RPlug4内H2剩余量逐渐减少。所以可以通过增加反应温度来改善基准工况内反应器末端H2剩余问题。
如图 5所示为反应器热量变化情况,图中q为热量,MJ·h-1。总反应放出的热量较大部分是被冷却水带走,且随着温度的上升,冷却水带走的热量比例增加。但冷却水带走热量的能力有限,导致图 4(d)中每段反应器内的温度变化随反应器温度的升高而剧烈。而在G1、G2工况下,温度较低导致反应缓慢,放热很少,冷却水换热使得反应器内温度降低。所以,在基准工况的基础上,较低温度下要减少冷却水换热能力来维持反应器内温度,进而促进反应的进一步进行;较高温度下要适当增加冷却水换热能力保证反应器内温度变化平缓,同时也可以增加热量回收利用。
3.3 H2通入组分流量变化本节在基准工况的基础上,改变混合工质中H2的摩尔流量,采用表 2的G5~G8模拟工况与基准工况G0进行对比,氢氧化反应器长度上的模拟结果如图 6、7所示。
|
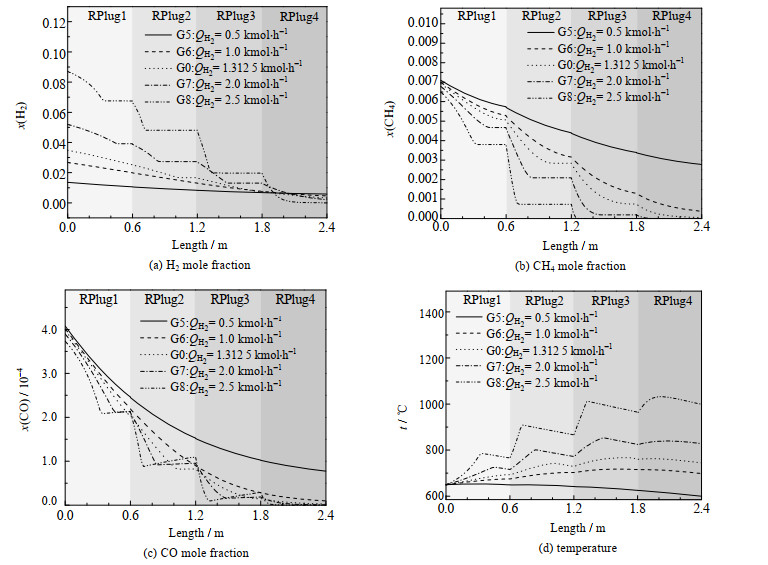
图 6 不同H2组分流量下反应器长度方向上的各参数变化情况 Fig.6 Variation of various parameters along the length of reactor under different H2 flow rates |
|
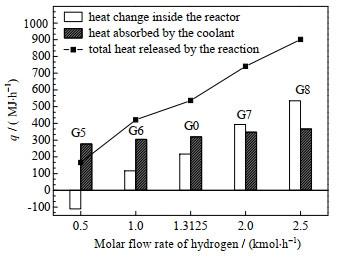
图 7 不同H2组分流量下反应器热量变化情况 Fig.7 Heat change of reactor under different H2 flow rates |
图 6(a)、(b)、(c)表示不同H2组分流量下H2、CH4、CO的消耗情况,随着H2组分流量增加,每段反应器内O2消耗速率提高,使得氧化反应速度增加,转折点提早出现。图 6(a)中RPlug3段H2的消耗量大增是由于CH4完全反应使图 6(d)中由于反应器逆流换热,所以随着氧化反应的提前结束,反应器内部呈现不均匀的温度分布。通过图 6(c)中CO摩尔分数的变化曲线,可以看到反应物氧化反应停止出现转折点后,CO摩尔分数呈现显著的上升趋势,说明水煤气变换反应(4)向逆反应方向的进行。
将文献[17]中的数据通过线性拟合得到平衡常数与温度的表达式,然后通过组分摩尔分数计算浓度商Qc,得到表 4。可知平衡常数K < 浓度商Qc,证明反应(4)是向逆反应方向进行的。但通过图 6(a)、(b)中H2、CH4在氧化反应停止出现转折点后的变化情况,可以发现可逆反应对于总反应进程影响不大。
|
|
表 4 平衡常数与浓度商对比 Table 4 Comparison of equilibrium constant and concentration quotient |
图 7表示不同H2组分流量下反应器热量变化情况,随着H2组分流量的增加,总反应放热增加,由于冷却水流量和换热面积未改变,换热能力有限,使得反应器内部温度提高,存储能量增加。所以对于H2含量多的工质,反应器内温度会大幅上升,需要增加反应器换热能力。
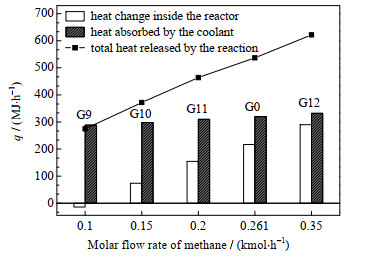
3.4 CH4通入组分流量变化本节在基准工况的基础上,改变混合工质中CH4的摩尔流量,采用表 2的G9~G12模拟工况与基准工况G0进行对比,氢氧化反应器长度上的模拟结果如图 8、9所示。
|
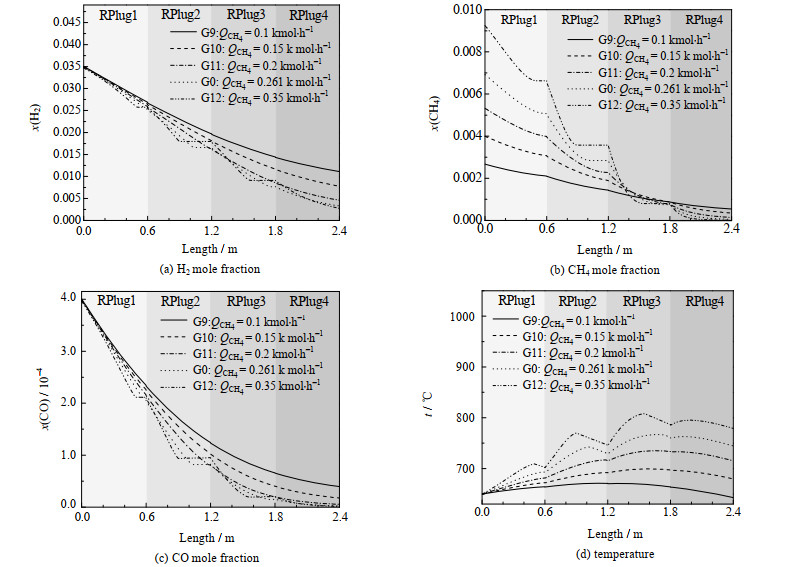
图 8 不同CH4组分流量下反应器长度方向上的各参数变化情况 Fig.8 Variation of various parameters along the length of reactor under different CH4 flow rates |
|
图 9 不同CH4组分流量下反应器热量变化情况 Fig.9 Heat change of reactor under different CH4 flow rates |
图 8(a)、(b)、(c)表示不同CH4组分流量下H2、CH4、CO的消耗情况,随着CH4组分流量的增加,O2消耗速率提高,温度提高,氧化反应提前结束。但CH4流量变化对氧化反应的影响小于H2流量变化的影响主要是因为CH4组分流量低于H2,且变化范围也小于H2。同时图 8(a)中随着CH4组分流量的增加,促进了反应器后段的H2氧化,反应器末端H2剩余量的减少,所以CH4组分流量可以用来改善基准工况反应器尾端H2剩余问题。图 8(d)中由于反应器逆流换热,所以随着氧化反应的提前结束,反应器内部呈现不均匀的温度分布。
与H2组分流量增加相似,图 9中随着CH4组分流量的增加,总反应量增加,放出总热量增加,由于冷却水流量和换热面积未改变,换热能力有限,使得反应器内部温升增加,存储能量增加。需要提高换热能力来降低反应器内部热量吸收,使得反应器内部温度分布保持均匀。
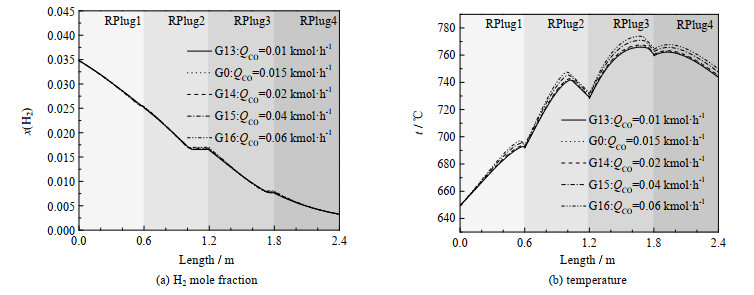
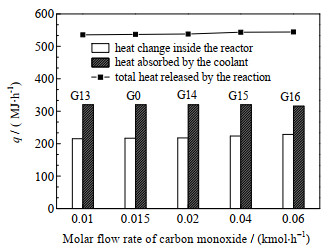
3.5 CO通入组分流量变化本节在基准工况的基础上,改变混合工质中CO的摩尔流量,采用表 2的G13~G16模拟工况与基准工况G0进行对比,氢氧化反应器长度上的模拟结果如图 10、11所示。
|
图 10 不同CO组分流量下反应器长度方向上的各参数变化情况 Fig.10 Variation of parameters along the length of reactor under different CO flow rates |
|
图 11 不同CO组分流量下反应器热量变化情况 Fig.11 Heat change of reactor under different CO flow rates |
从图 10(a)、(b)中可以看出不同CO组分流量下,反应器内总反应进程与温度的均无较大改变。CO作为3大氧化反应物之一,其组分流量的变化对氧化反应的影响应该与3.3、3.4两节中对与H2和CH4的讨论相似。但由于混合工质组分中CO浓度极低,其初始摩尔分数只有0.64% 左右,所以对与模拟工况G16-G19中CO比例在0.4% ~2.8% 变化对整个反应几乎无影响。但CO组分流量增加,总反应物也增加,所以图 10(b)中反应器温度有微量增加。
图 11表示不同CO组分流量下反应器的热量变化情况。从图 11中可以看出,在模拟工况中,CO组分含量的增加对总反应放出热量是增加的,但对于总热量的分布情况无显著影响。不同煤种的超临界水气化产物中,CO的组分含量是比较低的,所以氢氧化反应器中通入不同煤种的超临界水气化产生的混合工质时,CO组分含量变化对反应进程以及热量分布无显著影响。
4 结论本文在Aspen Plus中建立了超临界水混合工质氢氧化反应器模型,通过对多个工况的模拟,得出结论如下:
(1) 在不同煤种超临界水气化产物的输入工况下,氢氧化反应器内部反应主要为H2、CH4和CO组分的氧化反应;水煤气变换反应向逆反应方向进行,但对总反应进程影响不大,可以忽略。在氧化反应过程中,H2对于O2的竞争力小于CH4。
(2) 氢氧化反应器的评价重点在于H2的氧化程度和热量分布2方面。基准工况模拟中存在反应器末端残留H2的问题。H2氧化反应主要受温度和反应物浓度影响,可以采取提高反应温度、适当增加H2和CH4组分流量等措施来促进H2的反应进程。同时,反应器沿程温度分布由内部反应进程和外部冷却水换热能力共同决定,所以需要提高冷却水的换热能力,增加回收的热量,来维持反应器内部温度的均匀分布。
(3) 本文模型只将O2设为均匀分段通入反应器。在模拟过程中,反应器前段氧化反应的主要限制因素为O2浓度,因此改变O2各段通入比例以及高压O2的通入量,有望进一步改善氧化反应进程,使反应器内部温度分布更加均匀,从而优化反应器设计,降低成本。
| [1] |
GUO L J, JIN H. Boiling coal in water: Hydrogen production and power generation system with zero net CO2 emission based on coal and supercritical water gasification[J]. International Journal of Hydrogen Energy, 2013, 38(29): 12953-12967. DOI:10.1016/j.ijhydene.2013.04.089 |
| [2] |
闫秋会, 苗海军, 张莉, 等. 超临界水中煤气化制氢热力发电系统的构建及其能量转化机理分析[J]. 煤炭技术, 2014, 33(8): 221-223. YAN Q H, MIAO H J, ZHANG L, et al. Novel power generation system based on coal gasification in supercritical water and principle of its energy conversion[J]. Coal Technology, 2014, 33(8): 221-223. |
| [3] |
CHEN Z W, ZHANG X S, GAO L, LI S. Thermal analysis of supercritical water gasification of coal for power generation with partial heat recovery[J]. Applied Thermal Engineering, 2017, 111: 1287-1295. DOI:10.1016/j.applthermaleng.2016.10.110 |
| [4] |
郭烈锦, 赵亮, 吕友军, 等. 煤炭超临界水气化制氢发电多联产技术[J]. 工程热物理学报, 2017, 38(3): 678-679. GUO L J, ZHAO L, LU Y J, et al. Coal supercritical water gasification hydrogen generation power generation polygeneration technology[J]. Journal of Engineering Thermophysics, 2017, 38(3): 678-679. |
| [5] |
王巍, 刘晓薇, 毛晨旭, 等. 基于超临界水煤气化工艺的发电系统设计[J]. 工程热物理学报, 2019, 40(5): 1004-1009. WANG W, LIU X W, MAO C X, et al. Design of power generation system based on supercritical water gasification process[J]. Journal of Engineering Thermophysics, 2019, 40(5): 1004-1009. |
| [6] |
JIN H, WU Y, ZHU C, et al. Molecular dynamic investigation on hydrogen production by furfural gasification in supercritical water[J]. International Journal of Hydrogen Energy, 2016, 41(36): 16064-16069. DOI:10.1016/j.ijhydene.2016.04.214 |
| [7] |
JIN H, ZHAO X, GUO L J, et al. Experimental investigation on the gasification kinetic model of a char particle in supercritical water[J]. Energy & Fuels, 2015, 29(12): 8053-8057. |
| [8] |
WEI L P, LU Y J. Fluidization behavior in high-pressure water at temperature from ambient to supercritical[J]. Powder Technology, 2016, 304: 89-100. DOI:10.1016/j.powtec.2016.08.025 |
| [9] |
金辉, 吕友军, 赵亮, 等. 煤炭超临界水气化制氢发电多联产技术进展[J]. 中国基础科学, 2018, 20(4): 4-9, 16, 2. JIN H, LU Y J, ZHAO L, et al. Development of coal-fired power generation technology with coal supercritical water gasification[J]. China Basic Science, 2018, 20(4): 4-9, 16, 2. DOI:10.3969/j.issn.1009-2412.2018.04.002 |
| [10] |
YAMAGUCHI D, SANDERSON P J, LIM S, et al. Supercritical water gasification of victorian brown coal: Experimental characterization[J]. International Journal of Hydrogen Energy, 2009, 34(8): 3342-3350. DOI:10.1016/j.ijhydene.2009.02.026 |
| [11] |
WANG J, TAKARADA T. Role of calcium hydroxide in supercritical water gasification of low-rank coal[J]. Energy & Fuels, 2001, 15(2): 356-362. |
| [12] |
霍朋举. 氢气在超临界H2O/CO2混合工质中氧化特性的数值模拟与实验装置的设计构建[D]. 西安: 西安交通大学, 2018. HUO P J. Numerical simulation on hydrogen oxidation characteristics in supercritical H2O/CO2 mixtures and the design of the experimental device[D]. Xi'an: Xi'an Jiaotong University, 2018. |
| [13] |
朱有健, 王定标, 周俊杰. 固定床煤气化炉的模拟与优化[J]. 化工学报, 2011, 62(6): 1606-1611. ZHU Y J, WANG D B, ZHOU J J. Simulation and optimization of fixed bed gasifier[J]. CIESC Journal, 2011, 62(6): 1606-1611. DOI:10.3969/j.issn.0438-1157.2011.06.020 |
| [14] |
孙玉玉, 汤吉海, 陈献, 等. 带多台侧反应器的间歇反应精馏生产氯化苄非稳态模拟与过程设计[J]. 高校化学工程学报, 2015, 29(2): 387-393. SUN Y Y, TANG J H, CHEN X, et al. Unsteady state simulation and process design of a batch reactive distillation column with multiple side reactors for benzyl chloride production[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(2): 387-393. DOI:10.3969/j.issn.1003-9015.2015.02.022 |
| [15] |
王贤聪, 江健荣, 冯霄, 等. 不同净化工艺下氧气纯度对合成氨流程能耗的影响[J]. 高校化学工程学报, 2019, 33(6): 1465-1472. WANG X C, JIANG J R, FENG X, et al. Effects of oxygen purity on energy consumption in synthetic ammonia processes under different purification processes[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(6): 1465-1472. |
| [16] |
张濂, 许志美, 袁向前. 化学反应工程原理[M]. 上海: 华东理工大学出版社, 2007. ZHANG L, XU Z M, YUAN X Q. Elements of chemical reaction engineering[M]. Shanghai: East China University of Science and Technology Press, 2007. |
| [17] |
SU X H, GUO L J, JIN H. Mathematical modeling for coal gasification kinetics in supercritical water[J]. Energy & Fuels, 2016, 30(11): 9028-9035. |
| [18] |
GE Z W, GUO S M, GUO L J, et al. Hydrogen production by non-catalytic partial oxidation of coal in supercritical water: explore the way to complete gasification of lignite and bituminous coal[J]. International Journal of Hydrogen Energy, 2013, 38(29): 12786-12794. DOI:10.1016/j.ijhydene.2013.06.092 |
| [19] |
LU Y J, GUO L J, ZHANG X M, et al. Thermodynamic modeling and analysis of biomass gasification for hydrogen production in supercritical water[J]. Chemical Engineering Journal, 2007, 131(1/2/3): 233-244. |
| [20] |
LI G X, WANG H X, LU Y J. Kinetic study on hydrogen oxidation in supercritical H2O/CO2 mixtures[J]. Fuel Processing Technology, 2019, 193: 123-130. DOI:10.1016/j.fuproc.2019.05.006 |
| [21] |
WEBLEY P A, TESTER J W. Fundamental kinetics of methane oxidation in supercritical water[J]. Energy & Fuels, 1991, 5(3): 411-419. |
| [22] |
HELLING R K, TESTER J W. Oxidation of simple compounds and mixtures in supercritical water: Carbon monoxide, ammonia and ethanol[J]. Environmental Science & Technology, 1988, 22(11): 1319-1324. |
| [23] |
李萌萌, 姜召, 李璐, 等. Aspen Plus在超临界流体技术中的应用研究进展[J]. 化工进展, 2014, 33(S1): 19-26. LI M M, JIANG Z, LI L, et al. Application of Aspen Plus in supercritical fluid technology[J]. Chemical Industry and Engineering Progress, 2014, 33(S1): 19-26. |




