2. 浙江工业大学 长三角绿色制药协同创新中心,浙江 杭州 310032
2. Collaborative Innovation Center of Green Pharmaceutical Engineering, Zhejiang University of Technology, Hangzhou 310032, China
挥发性有机化合物(Volatile Organic Compounds, VOCs)的排放已经引起了全球性的大气环境问题,如光化学烟雾、城市灰霾、酸雨等,严重威胁到人类健康与安全。工业排放是VOCs的重要来源。据统计,2015年我国VOCs排放量大约为3111.70万吨,仅工业源就占到了近50%。因此,工业源VOCs的有效控制是目前亟需解决的问题。
氯苯类有机物(Chlorobenzenes, CBs)广泛用于染料、塑料、香料、医药、有机合成等生产过程,是含氯VOCs (Chlorinated VOCs, CVOCs)废气的重要组分。CBs化学性质稳定、具有三致效应[1],是一类生态环境风险极高的疏水性、持久性有机污染物,被美国EPA列为优先控制污染物[2]。
目前,处理CVOCs的传统技术主要有燃烧法、冷凝法、吸附法等。其中燃烧法虽然工艺比较简单易操作,但是净化不完全,并且伴有有害的中间产物生成,造成新的污染;冷凝法对于低浓度CVOCs处理效果低且成本高;吸附法对于吸附剂的要求太高,当废气中含有胶粒物质或其他杂质时,吸附剂易中毒;这些技术对CVOCs的处理效果都不显著。近年来兴起的紫外光催化技术以紫外光作为能源,在催化剂作用下将有机物降解为CO2和H2O,具有反应快、反应条件简单、效率高、二次污染少等特点而广泛用于CVOCs的净化领域[3]。其中,有关半导体TiO2及其催化活性改性的研究较多[4]。离子掺杂是提高TiO2光催化活性的重要手段,通过抑制光生电子和空穴的复合,使吸收波长出现红移,提高催化剂对可见光的利用率[5]。Yang等[6]研究表明两种或两种元素以上的共掺杂可进一步抑制光生电子和空穴复合,缩小禁带宽度,改善光催化性能。
目前由于TiO2催化剂对污染物的高催化转化效率使其在废气净化领域的研究越来越多,然而在相对湿度较高时,TiO2净化废气普遍存在催化效果显著下降的情形[7]。本研究利用溶胶凝胶-水热法,以钛酸四丁酯、尿素、磷酸为原料制备了N/P共掺杂TiO2,利用多元素掺杂提高了光催化活性,并发现该催化剂对于湿度较大的CB废气仍具有较好的光催化活性。
2 实验材料与方法 2.1 试剂与仪器钛酸四丁酯、乙酰丙酮、无水乙醇、尿素、磷酸、碳酸铵、氢氧化钠、盐酸、氯苯,均为分析纯,购于杭州华东医药有限公司。实验分析所用的标准气体(如空气、氮气等),由杭州今工特种气体有限公司提供。高压水热反应釜由上海机械设备有限公司生产。
2.2 催化剂制备氮磷共掺杂TiO2光催化剂采用溶胶凝胶-水热法制备。根据响应面中心复合法设计了不同N/P掺杂量的TiO2光催化剂。具体制备流程如下[8]:将50 mL无水乙醇、10 mL钛酸四丁酯、5 mL乙酰丙酮以及一定量的尿素(氮源)充分混合形成淡黄色溶液A,将20 mL无水乙醇、8 mL去离子水以及一定量的磷酸(磷源)混合为溶液B,之后用37.5%浓盐酸调节其pH至2.5,在高速搅拌下,将A溶液以2 drop·s-1的速度缓慢滴加至B溶液,持续搅拌4 h,滴加完毕持续搅拌2 h,室温下陈化6 h后置于80℃干燥箱干燥,研磨获得TiO2前驱体,置于200 mL密闭的聚四氟乙烯内杯的高压水热反应釜内,加入60 mL无水乙醇与60 mL10 mol·L-1NaOH溶液及一定量的碳酸铵固体(作为起泡剂),在130℃下水热反应48 h后,取出经过酸洗(pH = 1的盐酸)、醇洗(无水乙醇)、水洗后在80℃下干燥,研磨得到N/P共掺杂TiO2。
2.3 催化剂表征分别采用X射线衍射仪(X’Pert Pro型,荷兰)、高分辨透射电子显微镜(Tecnai G2 F30 S-Twin型,荷兰)、全自动比表面积和孔径分布仪(ASAP2010型,美国)和紫外可见近红外分光光度仪(UV-3150型,日本)对催化剂进行结构表征(晶型、形貌、比表面积、元素结合态等)、波长响应范围等进行分析。
2.4 催化性能分析光催化反应器为内径2.8 cm、长50 cm的U形石英管(体积550 cm3),将功率20 W、主波长365 nm紫外灯置于反应器正上方作为光源。称取0.08 g改性TiO2催化剂,伴随无水乙醇均匀涂于8片长10 cm的石英舟上,无水乙醇挥发后催化剂附着于石英舟上,将其置于U型管中。采用标准载气吹扫反应气路系统,先去除反应系统内存在的杂质,0.5 h后通入CB,测定进出口CB浓度相等时达到吸附饱和后,打开灯源,进入稳定工作状态,测试催化剂性能。通过调节不同的气流配比和流速,控制进气浓度、反应介质相对湿度及停留时间。
2.5 分析方法CB进出口气浓度采用气相色谱法(Agilent 6890,美国)分析,氢火焰离子(FID)检测器,30 mm×0.32 mm×0.5 μmHP-Innowax毛细管柱,进样口温度250℃,柱温140℃,检测器温度300℃,载气流量1 mL·min-1,进样量800 μL。反应介质的温度、湿度通过温湿度计(Testo 625,德国)测定。
3 结果与讨论 3.1 催化剂制备因素优化 3.1.1 响应面设计及优化根据单因素实验结果,选取N与Ti4+的摩尔比(1/2n尿素:nTi,因素a)、P元素与Ti4+的摩尔比(n磷酸:nTi,因素b)和碳酸铵与Ti4+的摩尔比(n碳酸铵:nTi,因素c)作为制备需考察的因素并设计实验组,通过Box-Behnken design (BBD)设计,获得三因素三水平催化剂制备方案(变化水平见表 1),并考察这些催化剂对CB的转化效果。采用Design-Expert 8.0软件对不同掺杂量的催化剂对于CB转化率进行二次多元回归拟合(等式如下),表 2给出计算值与拟合预测值。催化剂表示为(a)N/(b)P-TiO2(c),其中a、b、c分别是N的掺杂量、P的掺杂量和碳酸铵的添加量,均以Ti4+摩尔数为基础。
| 表 1 BBD实验设计的独立变量和变化水平 Table 1 Independent variables and levels of BBD experimental design |
| 表 2 三因素三水平实验设计及氯苯的转化率及预测值 Table 2 Experimental design of a three-variable and three-level experiment and CB conversion (experimental/predicted) |
| $ \begin{array}{c} {\rm{CB\; conversion }}\left( \% \right){\rm{ }} = {\rm{ }}94.43{\rm{ }} + {\rm{ }}2.3{\rm{ }}\left[ {{{\left( {{\rm{N}}{{\rm{H}}_4}} \right)}_2}{\rm{C}}{{\rm{O}}_3}} \right]{\rm{ }} + {\rm{ }}2.67{\rm{ }}\left[ {\rm{N}} \right]{\rm{ }} + {\rm{ }}1.55{\rm{ }}\left[ {\rm{P}} \right] - 1.6{\rm{ }}\left[ {{{\left( {{\rm{N}}{{\rm{H}}_4}} \right)}_2}{\rm{C}}{{\rm{O}}_3}} \right]\left[ {\rm{N}} \right]{\rm{ }}\\ + {\rm{ }}1.0 {\rm{ }}\left[ {{{\left( {{\rm{N}}{{\rm{H}}_4}} \right)}_2}{\rm{C}}{{\rm{O}}_3}} \right]\left[ {{\rm{La}}} \right] - 0.011{\rm{ }}\left[ {\rm{N}} \right]\left[ {{\rm{La}}} \right] - 7.77{\rm{ }}{\left[ {{{\left( {{\rm{N}}{{\rm{H}}_4}} \right)}_2}{\rm{C}}{{\rm{O}}_3}} \right]^2} - 5.79{\rm{ }}{\left[ {\rm{N}} \right]^2} - 4.68{\rm{ }}{\left[ {{\rm{La}}} \right]^2} \end{array} $ |
对回归模型进行方差分析,P均小于0.0001,失拟项为0.1395。模型失拟项表示模拟模型与实际值不拟合的概率,越小表明拟合得到的模型与实际情形相符程度越高。模型的相关系数R2= 0.9952,说明模型预测较好,可利用该模型分析和预测在不同配比下制备的N/P共掺杂TiO2催化剂对CB的转化率。
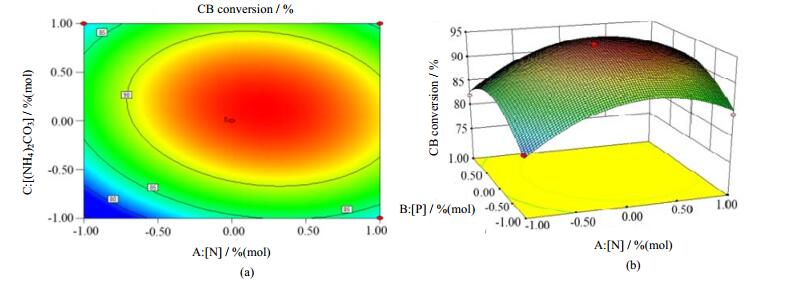
3.1.2 响应面分析Design-Expert8.0软件绘制等高线图可较直观地观察不同N、P变化水平对于CB催化效果的影响。若等高线呈椭圆状,则表明两因素之间的交互作用比较明显。由图 1(a)分析,等高线图成尖锐的椭圆形状,表明碳酸铵和N掺杂量之间存在显著的交互作用[9]。碳酸铵的投加量并不影响催化剂中N的掺杂量,这是因为制备过程中碳酸铵只是作为起泡剂(在3.2.3节得到证明),其添加量并不影响N的掺杂量。当碳酸铵在投加量最优范围内,无论氮掺杂量在高值还是低值,随着碳酸铵的增加,CB的转化率呈增长趋势,然而当碳酸铵的投加量在最优范围之外,随着氮掺杂量的增加,转化率呈降低的趋势。同时,在氮掺杂量最优水平以内,无论碳酸铵投加量在高值还是低值,随着氮掺杂量变大,CB转化率呈升高趋势。由图 1(b)是碳酸铵的投加量与氮掺杂比三维响应面图,可以比较直观地看出最高点表示CB转化率的最高值,最高点所对应的掺杂比则是最优掺杂比。
|
图 1 [(NH4)2CO3]和[N]之间交互作用的等高线图(a)和[N]和[P]3D响应面图(b) Fig.1 (a) Contour plot of interaction between [(NH4)2CO3] and [N] and (b) 3D response surface of interaction between [N] and [P] |
通过响应面分析获得催化剂制备最优条件,n((NH4)2CO3):n(Ti) = 0.49,n(N):n(Ti) = 0.5,n(P):n(Ti) = 0.51,以0.5N/0.5P-TiO2(0.5)表示最优配比的TiO2光催化剂,在此最优条件下,预测CB的转化率为94.43%,随后制备了与该物质的量较为接近的催化剂0.5N/0.5P-TiO2(0.5)并进行了实验,得CB平均转化率为94.56%,基本与理论值吻合,说明本优化模型能较好预测催化剂制备的比例对CB的转化率,证实响应面分析所得到的最佳制备条件具有可行性。
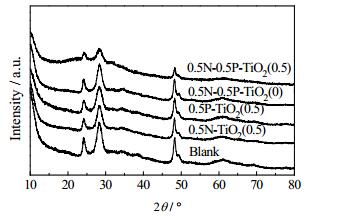
3.2 催化剂的表征 3.2.1 X射线衍射分析通过XRD对制备的催化剂0.5N/0.5P-TiO2(0.5)、0.5N-TiO2(0.5)、0.5P-TiO2(0.5)、0.5N/0.5P-TiO2(0)和未掺杂TiO2进行表征。图 2显示由溶胶凝胶-水热法制备的TiO2光催化剂的晶型为锐钛矿和金红石的混合晶型,对照XRD标准卡片(JCPDS Files NO. 21-1272),在衍射角2θ = 25.4和47.6°出现两个明显的衍射峰,这两个峰分别表示主峰在(101)和(200)晶面的锐钛矿衍射峰,在衍射角2θ = 27.3°也出现较强的衍射峰,为主峰在(110)晶面的金红石衍射峰,表明氮磷共掺杂TiO2催化剂为锐钛矿和金红石二者的混合物相,氮和磷的加入并没有改变TiO2晶型。研究表明,锐钛矿和金红石相的混合相有利于光催化活性的提高[10]。
|
图 2 N-P共掺杂与未掺杂TiO2样品XRD表征 Fig.2 XRD patterns of N-P co-doped and un-doped TiO2 |
元素掺杂导致衍射强度降低、衍射峰变宽,畸变度增大,说明掺杂原子有效进入TiO2晶格,抑制晶粒长大。由图 2分析,掺杂了氮磷元素的样品0.5N/0.5P-TiO2(0.5)在锐钛矿相2θ = 25.42°处衍射峰的宽度大于其它在此处衍射峰的宽度。根据Scherrers公式可以获得晶体粒径的变化趋势[11],计算所得0.5N/0.5P-TiO2(0.5)粒径(4.88 nm)相较于未掺杂的TiO2(6.96 nm)要小,表明晶体颗粒的生长受到了抑制,粒径越小的颗粒其比表面积越大,这将有利于对反应物的吸附和转化[12]。另外,由图中可以看出金红石相2θ = 27.31°处的衍射峰强度明显减弱,这说明掺杂后削弱了金红石衍射峰的强度,而对于锐钛矿衍射峰强度影响不大,因此锐钛矿比例有增大的趋势。根据Spurr-Myers公式计算的XR可表示锐钛矿与金红石的比例,高比例XR的催化剂光催化活性较高[13]。通过公式计算,掺杂氮磷元素的0.5N/0.5P-TiO2(0.5)XR(78%)大于未掺杂TiO2(66%),催化性能更优。
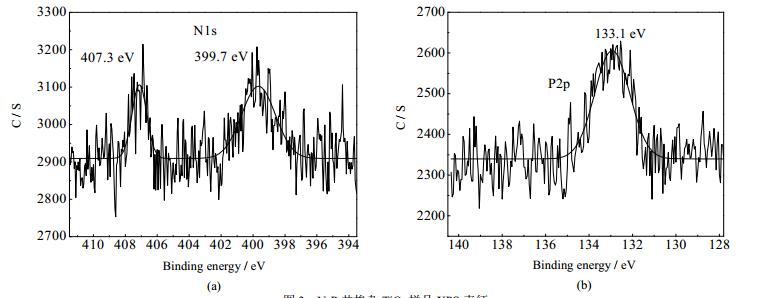
3.2.2 X射线光电子能谱分析通过XPS对0.5N/0.5P-TiO2(0.5)进行表征及分析。由图 3(a),N1s峰值位于399.7和407.3 eV。化学吸附氮或TiN的峰一般出现在小于397.5 eV的位置,因此这两个峰可以排除化学吸氮和TiN。407.3 eV处的峰说明晶格中存在N-O健,推测氮和氧在晶格产生直接作用并以替代掺杂的形式而形成Ti-O-N和/或Ti-N-O。399.7 eV出现的峰应该归属为由于N阴离子直接与TiO2作用形成的取代掺杂N-Ti-O结构[14]。Peng等[15]的研究表明无论是取代N掺杂还是间隙N掺杂都有利于提高TiO2的光催化性能。
|
图 3 N-P共掺杂TiO2样品XPS表征 Fig.3 XPS patterns of N-P co-doped TiO2 |
由图 3(b)分析,在133.1 eV处出现强峰,是P5+的P2p的电子结合能,说明P是以五价的化合态存在的,在129 eV处并未出现Ti-P特征峰,因此推断这可能是由于P5+置换晶格中金属离子Ti4+,产生P5+的掺杂态,导致电荷不平衡,并降低电子和空穴的复合几率。由于P5+取代了部分Ti4+,形成了Ti-O-P,提高了电子空穴对的分离,继而可以提高光催化活性[16]。
3.2.3 透射电镜、比表面积及能谱分析在未煅烧的情况下采用水热-溶胶凝胶法制备的0.5N/0.5P-TiO2(0.5)与未掺杂TiO2纳米管透射电镜(TEM)扫描结果如图 4所示,采用本实验方法制备的TiO2催化剂具有透明中空的纳米管状结构,但部分却出现了团聚现象(图 4(b),排除了电镜制样过程中可能造成的团聚),而图 4 (a)的0.5N/0.5P-TiO2(0.5)催化剂具有更好的分散性,能提供更多的吸附位点,具有更高的吸附能力,这可能归因于碳酸铵作为起泡剂的作用。在130℃反应下,高压反应釜中的碳酸铵完全分解为CO2、H2O和NH3,产生大量混合气泡,在反应釜中爆裂时产生大量能量,能够有效地避免纳米管的团聚,促使其具备更大的比表面积,这种效果等同于超声穴蚀的影响[17]。比较图 4(c)与图 4(d)发现制备的催化剂均为纳米管状结构,但掺杂元素后的TiO2管径更小,未掺杂TiO2的纳米管径约7 nm,掺杂N/P的TiO2纳米管径约5 nm。制备的0.5/0.5P-TiO2(0.5)纳米管具有特殊管状中空结构,可以提供更大的吸附面积,有利于反应物与催化活性组分接触[18]。

|
图 4 N/P共掺杂TiO2(a, c)与未掺杂TiO2(b, d)TEM图 Fig.4 TEM of N/P co-doped TiO2 (a, c) and un-doped TiO2 (b, d) |
此外,对催化剂的比表面积、总孔容及平均孔径进行了测定,本研究制备所制备的0.5N/0.5P-TiO2(0.5) (304.42 m2·g-1)的比表面积明显大于P25(48.42 m2·g-1,为商业化的TiO2),较大的比表面积可以提供更多表面活性位点,有效地提高催化剂与目标污染物的接触概率[19],促使羟基自由基等活性物质生成进而有效地提高光催化活性[12],而且0.5/0.5P-TiO2(0.5)平均孔径(5.04 nm)比未掺杂(6.95 nm)的略小,表明N-P共掺杂能减小纳米管的平均孔径,从而进一步改善TiO2的表面结构,有利于光催化反应的传质过程。一些文献[20]指出,单独N掺杂和单独P掺杂能使样品的平均孔径降低,这可能是由于元素掺杂抑制了纳米管的形成,能减小孔径,这在本研究中也得到了验证。制备的0.5/0.5P-TiO2(0.5)具有介孔结构(介于2~50 nm),有利于光催化形成的中间产物迅速扩散,转化效率提高显著[21]。此外,未掺杂TiO2孔径(5.81 nm)也比P25(6.95 nm)有所减小,表明本研究制备方法能略微缩小孔径。未掺杂TiO2与0.5N/0.5P-TiO2平均孔径大小分别约为7和5nm,结果与TEM表征结果基本一致。
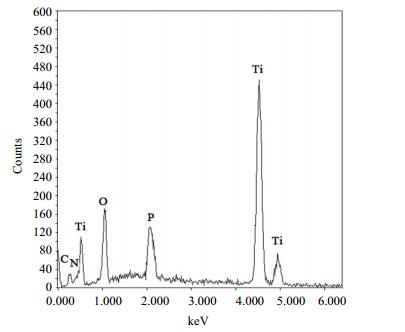
从图 5可以观察到所掺杂的氮、磷元素都出现在能谱扫描图中,说明在氮、磷元素已成功掺入TiO2。比较了0.5N/0.5P-TiO2(0.5)与0.5N/0.5P-TiO2(0)两种催化剂表面各元素的含量(表 3),不仅进一步说明氮、磷元素的成功掺入,而且发现各元素含量几乎没有差别,可以间接证明碳酸铵的加入只是作为起泡剂的作用,并没有增加催化剂中氮元素的含量,不会对掺杂N元素的含量产生影响。
|
图 5 氮磷共掺杂TiO2样品的EDX能谱分析 Fig.5 EDX spectrum of N-P co-doped TiO2 samples |
| 表 3 加入碳酸铵前后催化剂表面元素含量对比 Table 3 Comparison of element contents on catalyst surface before and after ammonium carbonate addition |
非金属离子掺杂能引入晶格氧空位,或部分氧空位在激发时被取代,引起禁带宽度变窄,与金属离子掺杂不同的是电子不需二次跃迁和二次吸收能量,因而催化剂的可见光和紫外光催化活性均未受影响[22]。Xie等[23]利用氟化铵和硫脲制备的F/N和N/S共掺杂TiO2,均在400~620 nm均表现出较好的催化活性,拓展了TiO2光吸收区域。
图 6未掺杂TiO2、0.5P-TiO2(0.5)、0.5N-TiO2(0.5)和0.5N/0.5P-TiO2(0.5)的UV-Vis光谱。利用Kubelka-Munk可以初步计算催化剂禁带宽度[24]。通过数据分析空白TiO2吸收截止波长约412 nm,对应禁带宽度为3.01 eV;0.5N-TiO2(0.5)和0.5P-TiO2(0.5)的吸收截止波长比较接近分别为441和455 nm,对应的禁带宽度分别为2.81和2.73 eV;0.5N/0.5P-TiO2(0.5)吸收截止波长约497 nm,对应禁带宽度为2.5 eV,N/P掺入使催化剂对光吸收阈值有所增加,发生红移现象。结合XPS、XRD和UV-vis分析,N/P的成功掺入,取代了TiO2中的氧元素或进入晶格间隙,缩小了催化剂的带隙能量提高了光量子产率,从而拓展了光吸收区域。
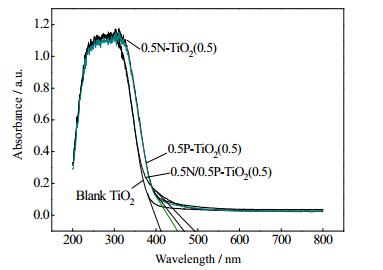
|
图 6 制备的催化剂紫外可见漫反射吸收光谱 Fig.6 UV-vis diffuse reflection absorption spectra of prepared catalysts |
在相对湿度10%、CB进口浓度50~250 mg·m-3、停留时间30和60 s条件下考察进气浓度对0.5N/0.5P-TiO2(0.5)光催化降解CB反应的影响。从图 7中看出,在反应时间为30 s时,去除负荷随着进气浓度的增大逐渐趋于定值。Yu等[25]提出形成·OH等活性基团是光催化反应速率的决定因素,直接与芳香族化合物发生反应,·OH等活性自由基产生的数量决定了CB的转化效果。由于当反应体系中相对湿度和停留时间一定时,·OH产生量为一定值,随着进气浓度的增大,·OH等基团不足于与CB进行反应,从而去除负荷趋于定值。
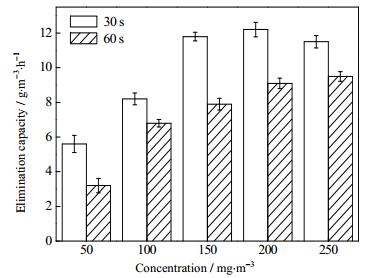
|
图 7 进气浓度对CB转化效果的影响 Fig.7 Effects of initial concentration on CB conversion |
由图 7分析,在进气浓度一定时,反应时间越短,去除负荷越高,停留时间30 s时,当进气浓度为150 mg·m-3(即进气负荷18 g·m-3·h-1),反应体系能承受的进气负荷已趋于饱和,此时进气浓度再增加,反应体系也无法去除。反应时间在60 s时,尽管CB去除负荷在测试浓度范围内还未趋于定值,但增加的幅度已逐渐趋缓。可以预测,在该停留时间下,CB的最大去除负荷最终也将趋于定值。
3.3.2 相对湿度对转化率影响湿度中等或湿度较高都会对光催化活性产生影响[26],而实际废气中都具有一定湿度,因此开发对高湿度承受能力较好的催化剂尤为重要。考察不同湿度条件下0.5N/0.5P-TiO2(0.5)对CB废气的去除效果,图 8显示在相对湿度为10%时,CB的去除效果达到最大值95%,之后随着相对湿度的递增,CB的去除效率呈缓慢下降趋势。
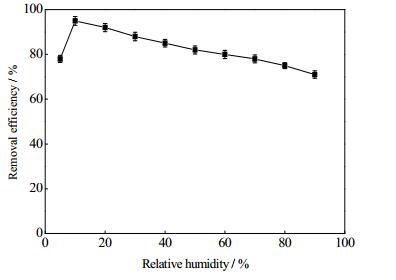
|
图 8 不同湿度对CB去除效果的影响 Fig.8 Effects of relative humidity on CB removal efficiency |
Dong等人的研究[27]指出,TiO2在光催化过程中,在较低湿度下(如10%),气态水分子通过解离形成的·OH能促进污染物的分解,同时水分子与污染物在催化剂表面的竞争吸附表现得不明显;随着体系相对湿度升高,过多的水分子将通过氢键作用形成对分子层,减缓电子的移动速度,水分子占据催化剂表面的吸附位点,对目标污染物的表面吸附将造成影响,同时·OH的产生量也将有所减少。0.5N/0.5P-TiO2(0.5)在高相对湿度下仍能保持较高的催化活性,污染物的吸附在高湿度下的抑制与其他研究相比并没有那么明显,可能由于N/P元素成功掺入并取代部分氧空位形成了新的化学键(Ti-O-N, Ti-N-O, Ti-O-P),氧空位的减少会直接影响水分子的吸附,减缓水分子的竞争吸附[28]。同时结合XPS、UV-vis等表征分析N元素的掺入能够降低TiO2带隙能量,拓展光响应区域,增强可见光吸收能力;P掺杂则会抑制TiO2晶粒生长,增强其表面积和孔容,P5+取代晶格中Ti4+会引起电荷不平衡,将通过表面羟基的增多或氧空位减少得到补偿。表面羟基量的增加能提高TiO2的光催化活性,表面羟基对光催化反应至关重要,表面羟基能捕获光生h+而产生强氧化性·OH。氧空位的减少则会抑制水分子的吸附,从而减弱水分子的竞争吸附。由此可见N/P元素的共掺杂产生协同作用,在提高TiO2光催化活性的同时也在高湿度下保持了较高催化活性[29]。
3.3.3 催化剂稳定性测试催化剂稳定性对于催化剂是一项重要指标,稳定性优劣决定了催化剂的工艺经济效益。测试0.5N/0.5P-TiO2(0.5)的催化性能稳定性实验在相对湿度10%,CB初始进气浓度为150 mg·m-3,停留时间为60 s条件下进行,CB催化反应持续24 h,图 9显示CB总体去除率从94%下降到74%,反应15 h CB去除效率呈缓慢下降趋势,之后下降趋势较之前稍明显。由于随着反应的推进,CB的持续降解与CB降解反应中产生的中间产物会在催化剂表面累积并发生竞争吸附,催化剂表面的有效吸附面积趋于饱和,从而影响催化剂的催化效果[30]。Jeong等[31]在365 nm紫外光源下P25降解甲苯废气研究中,持续降解4 h后效果明显降低;Jeong等[32]在研究相对湿度对其影响时,发现在相对湿度为1%时利用365 nm紫外光下TiO2降解甲苯,20 h后,去除率下降到30%。而本研究中0.5N/0.5P-TiO2(0.5)在持续反应24 h后CB转化率仍可维持在70%以上,表现出较好的催化稳定性。
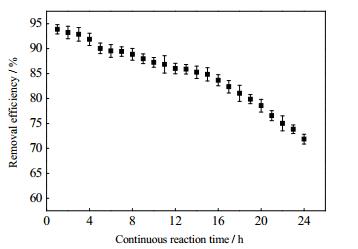
|
图 9 催化剂对CB去除稳定性实验 Fig.9 Stability analysis of the prepared catalyst for CB removal |
在TEM分析中,0.5N/0.5P-TiO2(0.5)为透明中空纳米管状结构,结构良好统一,主要外露热力学稳定的锐钛矿TiO2(101)晶面与XRD分析吻合;BET表明其N/P共掺杂改善表面结织特性,有利于其传质进程,掺杂形成的N-Ti-O和P-O-Ti表面键合结构会阻碍矩阵粒子调整和晶格重排,从而增强了样品表面织构的热稳定性[20],离子的掺杂在一定程度上阻碍降解过程中中间产物的吸附,从而延长催化剂使用寿命,有利于催化稳定性[33]。
在催化剂稳定性测试过程中,对光催化产物进行了初步分析。利用离子色谱对光解产物的吸收液进行了测定,发现其中有少量的Cl-;同时对使用后的催化剂表面进行了处理,发现其浸出液中也含有少量的Cl-,说明了CB降解产物中Cl以Cl-的形态存在(通常形成HCl),这与一些文献的报道[34]也是一致的。CB在降解过程中,·OH和·O2-活性基团率先攻击苯环Cl原子的对位和间位,转化为氯苯酚类,氯苯酚类容易被催化剂表面吸附从而被继续分解,最终Cl以Cl-的形式存在[35]。
4 结论通过Box-Behnken响应面优化法设计催化剂最佳制备条件:当N和Ti的摩尔比为0.5、P和Ti摩尔比为0.5以及(NH4)2CO3和Ti的摩尔比为0.5时,制备得到的催化剂对CB的转化效率达到理论最大为94.43%,以最佳制备条件所制备的0.5N/0.5P-TiO2(0.5),对CB的实际转化率为94.56%,二者基本吻合。采用XRD、TEM、BET、UV-vis和XPS对0.5N/0.5P-TiO2(0.5)进行表征和分析,所制备的催化剂为锐钛矿与金红石混合晶型,具有较大的比表面积和较小的介孔结构,禁带宽度降低显著,在波长为365 nm下对于CB的催化降解性能实验表明该催化剂催化活性较高,最大转化负荷达到11.8~12.1 g·m-3·h-1,在相对湿度为10%时对CB转化效果最佳,在相对湿度高达90%时,催化效果下降却仍可保持较高催化效率,在持续催化反应24 h后,CB的转化效果仍能维持在70%以上。
| [1] | Cheng Z W, Feng L, Chen J M, et al. Photocatalytic conversion of gaseous ethylbenzene on lanthanum-doped titanium dioxide nanotubes[J]. Journal of Hazardous Materials , 2013, 254-255(1): 354-363. |
| [2] | Wang X Y, Kang Q, Li D. Catalytic combustion of chlorobenzene over MnOx-CeO2 mixed oxide catalysts[J]. Applied Catalysis B Environmental , 2009, 86(3-4): 166-175. DOI:10.1016/j.apcatb.2008.08.009. |
| [3] | CHENG Zhuo-wei(成卓韦), ZHOU Ling-jun(周灵俊), YU Jian-ming(於建明), et al. Mechanism study on gaseous α-pinene photocatalyzed by lanthanum-doped titanium dioxide nanotubes(镧掺杂TiO2纳米管对α-蒎烯光催化性能及催化机理研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(2): 320-327. |
| [4] | LAN Yu-wei(兰宇卫), ZHOU Li-ya(周立亚), TONG Zhang-fa(童张法), et al. Fabrication and property investigation of the highly ordered TiO2 nanotube arrays(高度有序TiO2纳米管阵列的制备及其光催化性能研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25(3): 507-512. |
| [5] | Cheng Z W, Sun P F, Jiang Y F, et al. Ozone-assisted UV254nm photodegradation of gaseous ethylbenzene and chlorobenzene:effects of process parameters, degradation pathways, and kinetic analysis[J]. Chemical Engineering Journal , 2013, 228(3): 1003-1010. |
| [6] | Yang J, Bai H Z, Tan X C, et al. IR and XPS investigation of visible-light photocatalysis nitrogen-carbon-doped TiO2 film[J]. Applied Surface Science , 2006, 253(4): 1988-1994. DOI:10.1016/j.apsusc.2006.03.078. |
| [7] | Park E J, Lee J H, Kim K D, et al. Toluene oxidation catalyzed by NiO/SiO2 and NiO/TiO2/SiO2:towards development of humidity-resistant catalysts[J]. Catalysis Today , 2016, 260: 100-106. DOI:10.1016/j.cattod.2015.03.038. |
| [8] | Cheng Z W, Feng L, Chen J M, et al. Photocatalytic conversion of gaseous ethylbenzene on lanthanum-doped titanium dioxide nanotubes[J]. Journal of Hazardous Materials , 2013, 254-255(1): 354-363. |
| [9] | Vaiano V, Sacco O, Iervolino G, et al. Enhanced visible light photocatalytic activity by up-conversion phosphors modified N-doped TiO2[J]. Applied Catalysis B Environmental , 2015, 176-177: 597-600. |
| [10] | Kim S, Kim M, Hwang S H, et al. Enhancement of photocatalytic activity of titania-titanate nanotubes by surface modification[J]. Applied Catalysis B Environmental , 2012, 123-124(30): 391-397. |
| [11] | Kuo C Y, Wu C H, Wu J T, et al. Synthesis and characterization of a phosphorus-doped TiO2 immobilized bed for the photodegradation of bisphenol A under UV and sunlight irradiation[J]. Reaction Kinetics, Mechanisms and Catalysis , 2015, 114(2): 753-766. DOI:10.1007/s11144-014-0783-2. |
| [12] | Li X Y, Zou X J, Qu Z P, et al. Photocatalytic degradation of gaseous toluene over Ag-doping TiO2 nanotube powder prepared by anodization coupled with impregnation method[J]. Chemosphere , 2011, 83(5): 674-679. DOI:10.1016/j.chemosphere.2011.02.043. |
| [13] | Orlikowski J, Tryba B, Ziebro J, et al. A new method for preparation of rutile phasetitania photoactive under visible light[J]. Catalysis Communications , 2012, 24(26): 5-10. |
| [14] | Sathish M, Viswanathan B, Viswanath R P, et al. Synthesis, characterization, electronic structure, and photocatalyticactivity of nitrogen-doped TiO2 nanocatalyst[J]. Chemistry of Materials , 2005, 17(25): 6349-6353. DOI:10.1021/cm052047v. |
| [15] | Peng F, Cai L F, Yu H, et al. Synthesis and characterization of substitutional and interstitial nitrogen-doped titanium dioxides with visible light photocatalytic activity[J]. Journal of Solid State Chemistry , 2008, 181(1): 130-136. DOI:10.1016/j.jssc.2007.11.012. |
| [16] | Shi H, Zhang T, Wang H, et al. Photocatalytic conversion of naphthalene to alpha-naphthol using nanometer-sized TiO2[J]. Chinese Journal of Catalysis , 2011, 32(1-2): 46-50. DOI:10.1016/S1872-2067(10)60158-1. |
| [17] | Chen J Y, Wang H J, Wei X Z. Characterization, properties and catalytic application of TiO2 nanotubes prepared by ultrasonic-assisted sol-hydrothermal method[J]. Materials Research Bulletin , 2012, 47(11): 3747-3752. DOI:10.1016/j.materresbull.2012.06.029. |
| [18] | Jin M, Nagaoka Y, Nishi K, et al. Adsorption properties and photocatalytic activity of TiO2 and La-doped TiO2[J]. Adsorption , 2008, 14(2-3): 257-263. DOI:10.1007/s10450-007-9095-4. |
| [19] | Zhao Z F, Wang Y Z, Xu J. AgCl-loaded mesoporousanatase TiO2 with large specific surface area for enhancing photocatalysis[J]. Applied Surface Science , 2015, 351(1): 416-424. |
| [20] | JIANG Hong-quan(姜洪泉), WANG Qiao-feng(王巧凤), LI Jing-shen(李井申), et al. Sol-hydrothermal preparation of N-P-TiO2 nano particles for photocatalytic degradation of 4-chlorophenol under sunlight irradiation(N-P-TiO2纳米粒子的溶胶-水热制备及太阳光下光催化降解4-氯酚性能)[J]. ActaChimicaSinica(化学学报) , 2012, 70(20): 2173-2178. |
| [21] | Yu J G, Wang W G, Cheng B, et al. Synthesis and enhanced photocatalytic activity of a hierarchical porous flowerlike p-n junction NiO/TiO2 photocatalyst[J]. Chemistry-an Asian Journal , 2010, 5(12): 2499-2506. DOI:10.1002/asia.v5.12. |
| [22] | Zhao Z Z, Xie Y D, Zhang B, et al. Advances on doped TiO2 visible light driven photocatalysts[J]. Bulletin of the Chinese Ceramic Society , 2012, 31(1): 94-95. |
| [23] | Xie Y, Zhao X J. The effects of synthesis temperature on the structure and visible-light-induced catalytic activity of F-N-codoped and S-N-codoped titania[J]. Journal of Molecular Catalysis A:Chemical , 2008, 285(1-2): 142-149. DOI:10.1016/j.molcata.2008.01.028. |
| [24] | Sakthivel S, Kisch H. Daylight photocatalysis by carbon modified titanium dioxide[J]. Angewandte Chemie International Edition , 2003, 42(40): 4908-4911. DOI:10.1002/(ISSN)1521-3773. |
| [25] | Yu K P, Lee G W. Decomposition of gas-phase toluene by the combination of ozone and photocatalytic oxidation process (TiO2/UV, TiO2/UV/O3, and UV/O3)[J]. Applied Catalysis B Environmental , 2007, 75(1-2): 29-38. DOI:10.1016/j.apcatb.2007.03.006. |
| [26] | Korologos C A, Philippopoulos C J, Poulopoulos S G. The effect of water presence on the photocatalytic oxidation of benzene, toluene, ethylbenzene and m-xylene in the gas-phase[J]. Atmospheric Environment , 2011, 45(39): 7089-7095. DOI:10.1016/j.atmosenv.2011.09.038. |
| [27] | Kwon D W, Seo P W, Kim G J, et al. Characteristics of the HCHO oxidation reaction over Pt/TiO2 catalysts at room temperature:the effect of relative humidity on catalytic activity[J]. Applied Catalysis B Environmental , 2015, 163: 436-443. DOI:10.1016/j.apcatb.2014.08.024. |
| [28] | Kontos A G, Katsanaaki A, Maggos T, et al. Photocatalytic degradation of gas pollutants on self-assembled titania nanotubes[J]. Chemical Physics Letters , 2010, 490(1-3): 58-62. DOI:10.1016/j.cplett.2010.03.009. |
| [29] | Lin L, Zheng R Y, Xie J L, et al. Synthesis and characterization of phosphor and nitrogen co-doped titania[J]. Applied Catalysis B Environmental , 2007, 76(1-2): 196-202. DOI:10.1016/j.apcatb.2007.05.023. |
| [30] | Sun S, Ding J J, Bao J, et al. Photocatalytic degradation of gaseous toluene on Fe-TiO2 under visible light irradiation:a study on the structure, activity and deactivation mechanism[J]. Applied Surface Science , 2012, 258(12): 5031-5037. DOI:10.1016/j.apsusc.2012.01.075. |
| [31] | Jeong J, Sekiguchi K, Sakamoto K. Photochemical and photocatalytic degradation of gaseous toluene using short-wavelength UV irradiation with TiO2 catalyst:comparison of three UV sources[J]. Chemosphere , 2004, 57(7): 663-671. DOI:10.1016/j.chemosphere.2004.05.037. |
| [32] | Jeong M G, Park E J, Seo H O, et al. Humidity effect on photocatalytic activity of TiO2, and regeneration of deactivated photocatalysts[J]. Applied Surface Science , 2013, 271(13): 164-170. |
| [33] | Franch M I, Peral J, Domenech X, et al. Aluminium (Ⅲ) adsorption:a soft and simple method to prevent TiO2 deactivation during salicylic acid photodegradation[J]. Chemical Communications , 2005, 14(14): 1851-1853. |
| [34] | Cheng Z W, Gu Z Q, Chen J M, et al. Synthesis, characterization, and photocatalytic activity of porous La-N-co-doped TiO2 nanotubes for gaseous chlorobenzene oxidation[J]. Journal of Environmental Sciences , 2016, 46(8): 203-213. |
| [35] | Zhang L F, Sawell S, Moralejo C. Heterogeneous photocatalytic decomposition of gas-phase chlorbenzene[J]. Applied Catalysis B Environmental , 2007, 71(3-4): 135-142. DOI:10.1016/j.apcatb.2006.08.016. |




