颗粒蛋白(GRN),也称为上皮蛋白,通过颗粒体蛋白前体(pGRN)产生,分子量在6 kD左右,由多种功能富含半胱氨酸的多肽家族组成。GRN家族的成员含有12个半胱氨酸残基,排列在高度保守的位置,半胱氨酸残基形成分子内二硫键,具有特征紧密堆积的结构[1-2]。pGRN是一种分泌性糖蛋白,在胚胎发育、宿主防御、抗炎和创伤修复等生理病理过程中发挥重要作用[3]。大量研究证明pGRN在肿瘤发生和转移中具有重要作用。在许多类型的癌症的临床标本中已经观察到pGRN的过度表达,尤其是在具有高恶性肿瘤的癌症中[4-5]。Bateman等[6]最初从人类炎症细胞分泌物以及大鼠骨髓中分离得到GRNA、GRNB、GRNC和GRND。Sparro等[7]从尿液中分离出GRNF。GRN家族在结构上与表皮生长因子/转化生长因子α(EGF/TGFα)家族具有相似性,GRN在体外显示出对哺乳动物细胞生长的抑制或促进作用,GRN家族的不同成员可以作为细胞增殖的激动剂或拮抗剂,并在胚胎发生、细胞存活、细胞迁移、组织修复、炎症和血管生成中起作用[8-10]。
实验室前期从海鞘中分离出一种新型抗肿瘤多肽CS5931[11],因该多肽的三维结构类似于HGRNA,推测HGRNA可能也具有抗肿瘤活性。为了探究HGRNA的抗癌活性,构建一种能够在毕赤酵母细胞高效表达多肽的方法,优化发酵条件并探究GRNA的抗肿瘤生物活性。
2 实验材料和方法 2.1 实验材料质粒、菌株与癌细胞:表达载体pGAPZαA,生物风公司;大肠杆菌(E.coli)DH-5α由实验室保存;毕赤酵母菌株(P. pastoris)SMD1168H,山东大学生物医药研究院;人结肠癌细胞SW480、人胰腺癌细胞SW1990、人非小细胞肺癌细胞A549、人肾细胞293T,上海奥陆生物技术有限公司。
生化试剂:限制性内切酶、T4DNA连接酶、DNA回收试剂盒、胎牛血清、胰蛋白酶、噻唑蓝(MTT)、透析袋,美国Sigma公司;PCR Mix,南京凯基公司;DNA标记物(marker),深圳华因赛生物技术有限公司;琼脂糖凝胶回收试剂盒,上海信帆生物科技有限公司;培养基RPMI-1640、质粒提取试剂盒,美国Thermo Scientific公司;小鼠抗His-tag单克隆抗体、山羊抗小鼠IgG-HRP,上海爱必信生物技术有限公司,其余试剂为国产分析纯。
培养基配制:LB液体培养基,将5 g酵母提取物、10 g胰蛋白胨及5 g NaCl用1 L双蒸水(ddH2O)溶解,再用5 mol·L-1的NaOH将溶液pH调节至7.0,高压灭菌冷却后待用。LB固体培养基,取配制好的600 mL LB液体培养基,加入9 g琼脂糖搅拌均匀后高压灭菌冷却至45 ℃,在无菌条件下均匀加入15 mg博来霉素(Zeocin),冷却备用。
蛋白缓冲液配制:将17.5 g NaCl、17 g甘恶啉、6 g NaH2PO4,使用ddH2O溶解并用1 mol·L-1的HCl调节pH至8.0后定容至1L。
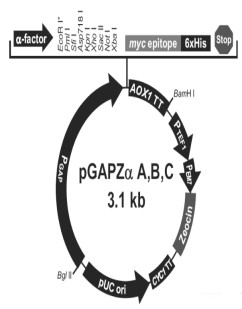
2.2 实验方法 2.2.1 多肽的克隆根据基因序列设计了一对引物,正向引物:5'-CCGGAATTCGATGTGAAATGTGACATGAG-3',反向引物:5'-CTAGTCGATACCCTGTTCACAGGTACCCTTCT-3',下划线部分为EcoRI和Xba I酶切位点。用凝胶提取试剂盒纯化扩增的目的基因,利用EcoRI以及Xba I对PCR产物进行双酶切。将目的基因与载体pGAPZαA(载体图谱见图 1,由质粒公司官网提供)连接后导入感受态的DH-5α,在LB培养基上初步培养。
|
图 1 载体pGAPZαA图谱 Fig.1 Spectrum of Vector pGAPZαA |
将含有目的基因的重组质粒电转入酵母液中,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检查蛋白表达情况。Western印迹分析也用于检查表达的蛋白质,将发酵上清液中的多肽进行电泳,将多肽从琼脂凝胶电转移至硝酸纤维素膜上,小鼠抗His-tag单克隆抗体作为一抗,山羊抗小鼠IgG-HRP作为二抗,做蛋白印迹分析。
2.2.3 酵母发酵的实验方法和设计因酵母菌株为好氧菌,所以实验中增加了通气环节。将过滤后的洁净空气通入摇瓶,以增加供氧量。具体流程为:空气压缩机-稳压阀-稳流阀-流量计-过滤器-摇瓶。将空气压缩后经过稳压阀和稳流阀得到稳定气流,计量后经过滤膜通入摇瓶。
通过预备实验确定部分培养基成分(质量分数):酵母粉1.5%、蛋白胨0.5%、KH2PO40.6%、(NH4)2SO40.2%和MgSO40.05%,通过实验获取了最佳接种量7%、最佳发酵时间80 h。在此基础上,进行进一步的优化实验,对通气量A、豆粉质量分数B、发酵温度C、发酵初始pH值D 4个因素进行了响应面优化设计。其中前个因素采用2水平,发酵初始pH采用3水平的混合设计方法。自变量和水平见表 1,使用Minitab 16软件进行了实验设计,实验设计及结果见表 2。
|
|
表 1 实验因素与水平表 Table 1 Factors and levels of experimental design |
|
|
表 2 实验方案及实验结果 Table 2 Experimental design and results |
在最优发酵条件下,将酵母菌液在4 ℃、1 000 r·min-1条件下离心10 min后收集上清液。加入咪唑洗涤缓冲液,上清液以体积流量6 mL·min-1经金属螯合亲和层析柱(MCAC)纯化,收集各洗脱峰进行SDS-PAGE检测。
将分离提纯后的多肽在4 ℃下透析10 h后进行离心浓缩。离心机在4 ℃环境下,转速为4 000 r·min-1离心5 min。使用BCA法在562 nm处测定蛋白浓度,配制标准如表 3所示。
|
|
表 3 标准蛋白浓度配制 Table 3 Standard protein concentration configuration |
采用MTT法测定。人结肠癌细胞SW480、人胰腺癌细胞SW1990、人非小细胞肺癌细胞A549、人肾细胞293T,在含有10%胎牛血清(FBS)的RPMI-1640培养液中,在37 ℃、5% CO2培养箱中培养,常规传代后取对数生长期细胞,消化细胞并调整浓度。加入不同浓度纯化的HGRNA样品培养48 h。然后按照20 μL每孔加入5 mg·mL-1的MTT,继续培养4~6 h,再按照150 μL每孔加入DMSO,待结晶完全溶解后用酶标仪测定各孔A570值。抑制率的计算式为:抑制率(致死率)=(对照组A值-实验组A值)/对照组A值。
2.2.6 细胞形态观察及DAPI染色将癌细胞在对数生长期消化后使用显微镜实时观察细胞形态,当大部分细胞变圆后终止消化调整浓度培养24 h后,吸出培养液加入不同浓度的HGRNA,对照组加入同体积的PBS。继续培养24 h后使用倒置显微镜观察并拍照。利用DAPI染色方法同上培养细胞24 h后吸取培养液,在4 ℃下用4%多聚甲醛固定细胞1 h,用PBS洗涤并在黑暗中加入5 μg·mL-1的4, 6-联脒-2-苯基吲哚(DAPI)染液1 mL染色10 min,在荧光显微镜下观察并拍照。
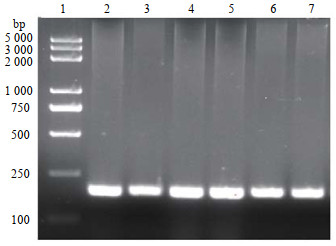
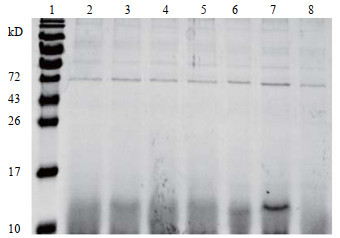
3 实验结果与讨论 3.1 多肽的表达目的基因的琼脂糖凝胶电泳和测序结果如图。从图 2中可以看出,通过PCR扩增到一条约170 bp目标带,通过与HGRNA对比发现分子量大小相符,满足后续实验要求。实验室前期使用大肠杆菌进行表达,发现目标多肽没有活性。猜测可能是因为原核生物没有足够的细胞器进行蛋白加工及修饰,而巴斯德毕赤酵母作为真核生物被认为是生产异源蛋白质最有效、用途最广泛的系统之一[12]。可以在确定的矿物培养基中生长高细胞密度,并且还可以进行许多翻译后修饰,例如蛋白质折叠,蛋白水解加工,二硫键形成和糖基化,也可以使用合适的分泌信号将蛋白质分泌到培养基中[13]。故使用巴斯德毕赤酵母对目标多肽进行表达。通过对多肽进行SDS – PAGE电泳分析检测(图 3),可以看出大约在15 kD处清晰可见诱导表达带。为了进一步确认HGRNA的成功表达,进行了蛋白质印迹分析(图 4)。结果表明与SDS-PAGE分析相对应的位置上出现了一条清晰的条带,证明目标多肽在毕赤酵母菌株中成功表达。
|
图 2 PCR扩增结果 Fig.2 PCR amplification results 1. marker lane 2~7. target lane |
|
图 3 毕赤酵母液中HGRN A多肽SDS-PAGE表达情况 Fig.3 SDS-PAGE results of HGRN A expression in Prichia pastoris 1. marker lane 2~7. target lane 8. empty vector lane |

|
图 4 HGRN A多肽Western blot分析 Fig.4 Western blot analysis of HGRN A 1. marker lane 2~7. target lane 8. empty vector lane |
查阅相关文献,探究A-通气量(mL·min-1)(即每分钟通气体积)、B-豆粉质量分数(%)、C-发酵温度(℃)、D-发酵初始pH 4个因素。以Y-蛋白收率为目标,对表 2结果进行拟合得到回归方程:
| $Y=2.34+1.36 \mathrm{~A}+1.64\mathrm{~B}-0.4037 \mathrm{C}+6.19 \mathrm{D}-1.34 \mathrm{D}^{2}-1.31 \mathrm{AB}+0.35 \mathrm{AC}+0.19 \mathrm{AD}+0.84 \mathrm{BC}-0.13 \mathrm{BD}-0.29 \mathrm{CD} $ | (1) |
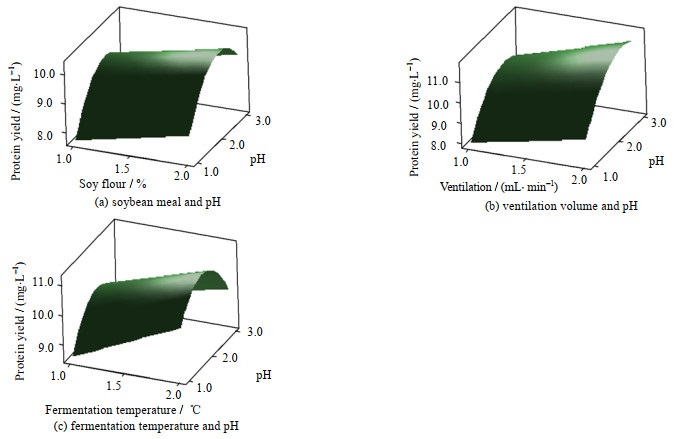
图 5(a)、(b)、(c)分别给出了蛋白多肽收率与豆粉、pH;通气量、pH;发酵温度、pH的关系图。通过图 5(a)可以看出在通气量和发酵温度固定的情况下,蛋白收率在培养液pH不变的情况下随着培养基中豆粉质量分数增加而升高,在培养基豆粉质量分数不变时随着培养液pH的增大先升高后降低。由于固定了通气量和发酵温度,在此水平上没有最大值,同理分析图 5(b)及图 5(c)。酵母在发酵过程中会产生大量乙酸及乳酸,这会改变发酵液的pH从而影响菌株生长及蛋白表达[14]。选择合适的pH不仅能够提高酵母的生长还能提高分泌蛋白的活性,防止其发生降解。培养液pH过高或过低不利于酵母菌株的增殖,豆粉含量的多少同样对酵母生长产生促进或者抑制作用。通过软件进一步分析得出此时豆粉含量在1.6%左右,发酵pH在6.6左右。由图 5(b)可知,当豆粉和发酵温度不变,培养液pH固定时蛋白收率随着通气量的增加而逐渐升高。对于酵母菌液的摇瓶发酵,瓶口的防菌纱布限制了空气交换,而通气量的多少决定酵母接触氧气的多少,酵母能否高密度发酵由氧气来决定。本研究表明通气量在0.1 mL·min-1即可提高蛋白收率。当通气量过少不利于菌株的代谢与高密度增殖,过高则会使得培养液中氧自由基浓度偏大导致酵母发生中毒死亡[15]。考虑以上条件最终将通气量设定在0.13 mL·min-1左右。由5(c)可见,固定通气量与豆粉含量,当培养液pH不变时,发酵温度的持续升高在一定范围内会活跃酵母菌株,有利于提高菌株生长密度,而较低温度有利于多肽的正确折叠、提高蛋白表达,折叠不良的肽抑制性弱或无活性[16]。故而在生长阶段与诱导阶段采用不同的培养温度。考虑到诱导温度在20~28 ℃,设定发酵温度在24.5 ℃左右。
|
图 5 蛋白收率与培养条件的关系 Fig.5 Relationship between protein yields and culturing conditions |
根据响应面优化模型,以最大蛋白收率为优化目标,获得了酵母发酵最优条件:豆粉质量分数1.6%、培养液初始pH 6.6、通气量0.13 mL·min-1、发酵温度24.5 ℃。3次重复实验得到的蛋白收率平均值为13.97 mg·mL-1,与回归模型的预测值(14.49 mg·mL-1)相差3.7%。蛋白收率的预测值与实际值基本吻合,验证了模型的可行性。
3.3 多肽的纯化与浓度测定在最优表达条件下利用MCAC柱分离重组多肽,SDS-PAGE纯化结果如图 6所示。凝胶分析软件Bandscan 5.0对实验结果分析显示纯化率为99.2%,说明纯化效果显著。质粒载体表达蛋白(图 1)由α-factor信号肽(分子量约为8 kD)、HGRNA(分子量约为6 kD)、Myc标签(分子量约为1.1 kD)及6个His标签(分子量约为0.84 kD)依次组成,与SDS-PAGE纯化结果显示的分子量15 kD基本相符,误差在合理范围内。标准蛋白曲线拟合结果如图 7所示,测得目标多肽浓度为19.01 mg·mL-1。

|
图 6 HGRNA多肽纯化结果 Fig.6 Purification results of HGRNA 1. marker lane 2. target lane |
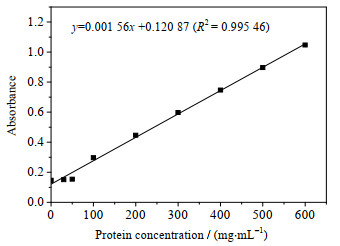
|
图 7 蛋白浓度曲线 Fig.7 Standard curve of protein concentration |
使用MTT法检测HGRNA多肽对SW480、SW1990、A549、239T的细胞毒性作用,结果如图 8所示。结果表明HGRNA对3种癌细胞都比较敏感而对正常细胞无明显作用。HGRNA在低浓度(50 μg·mL-1)时对3种癌细胞抑制作用不明显,提高处理浓度后,具有明显的抑制效果。其中对SW480的抑制效果最好,在浓度为200 μg·mL-1时抑制率达到80%,而SW1990、A549的抑制效果次于SW480。数据结果显示目标多肽对3种癌细胞抑制作用效果呈剂量依赖性关系,IC50值分别为89.7、106.2、100.8 μg·mL-1。
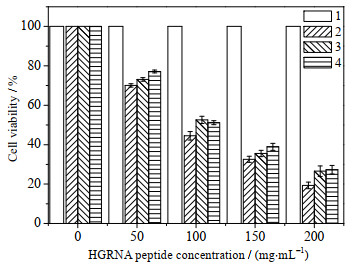
|
图 8 HGRNA多肽对3种癌细胞的抑制结果 Fig.8 Inhibition of HGRNA on three cancer cells 1. 239T 2. SW480 3. SW1990 4. A549 |
GRN家族的不同蛋白具有不同的生物活性,高分辨率核磁共振(NMR)显示,只有GRNA、GRNC和GRNF在溶液中含有相对明确的三维结构,而其他的主要是结构较差的二硫异构体的混合物。GRNA、GRNC和GRNF的三维结构在它们的n-端子域中包含一个稳定的b-发夹堆栈,但在c-端子域中显示出更灵活的结构[5]。Van等[17]将GRNE作为单一培养物放在Wistar大鼠运动神经元和皮层神经元中,在不添加其他生长因子的情况下发现GRNE以剂量依赖的方式支持神经元存活,这说明GRN可作为神经营养因子来调节神经生长并增强神经元存活。Liau等[18]发现在神经胶质瘤细胞系中有大量GRND的存在,胶质瘤在细胞遗传学水平上的17号染色体的过量表达和GRND具有一定相关性。Zhu等[19]发现GRNB可以抑制上皮细胞增殖并诱导上皮细胞分泌嗜中性粒细胞IL-8的主要趋化因子,通过刺激白细胞介素的分泌而发挥抗炎作用。有趣的是GRNC对乳腺癌细胞具有显著抑制作用,而GRNF具有刺激肿瘤细胞生长的作用[4],这意味着有些GRN能够刺激细胞增殖,而其他GRN则具有抑制细胞增殖的作用[20]。尽管对GRN家族的研究取得了重大进展,但对HGRNA的生物学功能仍不清楚。结合本研究的细胞毒性实验(图 8)可初步证明HGRNA具有抗肿瘤生物学活性。
为了进一步确定HGRNA的诱导癌细胞凋亡作用,使用倒置显微镜观察细胞形态(图 9)并借助DAPI染色(图 10)探究了细胞的凋亡情况。在处理细胞24 h之后,从图 9可见没有经过处理的2种肿瘤细胞生长良好,细胞密度较大,排列有规则。实验组肿瘤细胞在经过多肽处理后由规则的形态发生明显的萎缩,细胞密度及黏度降低,细胞之间孔隙变大,贴壁距离变大排列不规律,而随着给药浓度的增加这样现象更加明显。将抑制率作用最好的SW480进行染色,从图 10可以看出未经处理的细胞呈正常状态且分布均匀。低浓度处理下的细胞开始出现凋亡,而高浓度作用下的肿瘤细胞核出现凝聚、半月形现象,且核膜核仁破碎,呈现典型的细胞凋亡现象。

|
图 9 24 h后的肿瘤细胞形态变化 Fig.9 Morphological change of tumor cells after 24 h A: SW480 B:A549 |
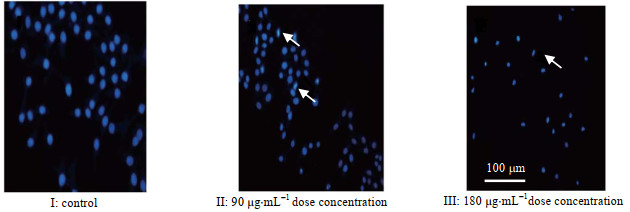
|
图 10 DAPI染色后的细胞形态变化 Fig.10 Cell morphology variation after DAPI staining |
实验室前期证明了一种海鞘多肽对肿瘤细胞产生细胞毒性并以剂量和时间依赖性方式诱导细胞凋亡。由于海鞘多肽的N端序列与本实验中HGRNA相同,且结构相似,这意味着HGRNA可能具有类似作用,而实验结果证明了这种推测。细胞毒性实验(图 8)表明了目标多肽对3种癌细胞的抗增殖作用。显微镜观察结果(图 9)和DAPI染色结果(图 10)表明目标多肽可以诱导细胞大量凋亡。本实验的结果表明HGRNA可以作用于肿瘤细胞发挥抗增殖作用,并以剂量依赖方式诱导癌细胞凋亡。
4 结论本研究通过优化毕赤酵母菌株的发酵分离纯化获得大量HGRNA,使用四种细胞株进行细胞毒性实验,MTT结果表明HGRNA对几种人类癌细胞具有强烈抑制作用而对人正常细胞没有损伤,细胞形态观察表明该多肽能够诱导癌细胞凋亡。实验初步证明HGRNA具有作为开发新型抗肿瘤药物的潜力,为以后的体内研究奠定了基础,对其具体抗肿瘤机制及其他生物活性等问题需要进一步研究。
| [1] |
ANDREW B, HUGH P J. The granulin gene family:from cancer to dementia[J]. My Favorite Molecule, 2009, 31(2): 1245-1254. DOI:10.1002/bies.200900086 |
| [2] |
VIJAY B, ANDREW B. Structure and chromsoal location of the human granulin gene[J]. Biochemical and Biophysical Research Communications, 1992, 18(1): 57-63. DOI:10.1016/0006-291X(92)92349-3 |
| [3] |
WEI T, YI L, QING Y T, et al. The growth factor progranulin binds to TNF receptors and is therapeutic against inflammatory arthritis in mice[J]. Science, 2011, 332(22): 478-484. DOI:10.1126/science.1199214 |
| [4] |
VOSHTANI R, SONG M, WANG H, et al. Progranulin promotes melanoma progression by inhibiting natural killer cell recruitment to the tumor microenvironment[J]. Cancer Letters, 2019, 465(43): 24-35. DOI:10.1016/j.canlet.2019.08.018 |
| [5] |
DMITRI T, SUNEIL M, ANNA V, et al. Structure dissection of human progranulin identifies well-folded granulin/epithelin modules with unique functional activities[J]. Protein Science, 2008, 17: 711-724. DOI:10.1110/ps.073295308 |
| [6] |
BATEMAN A, BELCOURT D, BENNETT H P J, et al. Granulins, a novel class of peptides from leukocytes[J]. Biochemical and Biophysical Research Communications, 1990, 173(3): 1161-1168. DOI:10.1016/S0006-291X(05)80908-8 |
| [7] |
SPARRO G M, GALDENZI G, ELEUTERI A M, et al. Isolation and N-terminal sequence of multiple forms of granulins in human urine[J]. Protein Expression and Purification, 1997, 10(1): 169-174. DOI:10.1006/prep.1997.0726 |
| [8] |
HUANG C H, KUO C J, LIANG S S, et al. Onco-proteogenomics identifies urinary S100A9 and GRN as potential combinatorial biomarkers for early diagnosis of hepatocellular carcinoma[J]. Biochimica et Biophysica Acta Clinical, 2015, 68(7): 205-213. DOI:10.1016/j.bbacli.2015.02.004 |
| [9] |
SWISHER E M. Granulin:Biomarker or interesting window into host/tumor biology?[J]. Gynecologic Oncology, 2011, 3(6): 23-30. DOI:10.1016/j.ygyno.2010.11.001 |
| [10] |
MILANESI E, BONVICINI C, PILOTTO A, et al. Molecular signature of disease onset in Granulin mutation carriers:a gene expression analysis study[J]. Neurobiology of Aging, 2013, 34(2): 1837-1845. DOI:10.1016/j.neurobiolaging.2012.11.016 |
| [11] |
CHENG L, WANG C, LIU H, et al. A novel polypeptide extracted from ciona savignyi induces apoptosis through a mitochondrial- mediated pathway in human colorectal carcinoma cells[J]. Clinical Colorectal Cancer, 2012, 11(3): 207-214. DOI:10.1016/j.clcc.2012.01.002 |
| [12] |
GEOFF P L C, JOAN L C, LLGEN C, et al. Production of recombinant proteins in fermentor cultures of the yeast Pichia pastoris[J]. Current Opinion in Biotechnology, 2002, 13(2): 329-332. DOI:10.1016/S0958-1669(02)00330-0 |
| [13] |
XAVIER G O, ELENAl C, PAU F, et al. Rational development of bioprocess engineering strategies for recombinant protein production in Pichia pastoris (Komagataella phaffii) using the methanol-free GAP promoter. Where do we stand?[J]. New Biotechnology, 2019, 53(3): 24-34. |
| [14] |
GAO M J, SHI Z P. Process control and optimization for heterologous protein production by methylotrophic Pichia pastoris[J]. Chinese Journal of Chemical Engineering, 2013, 21(2): 216-226. DOI:10.1016/S1004-9541(13)60461-9 |
| [15] |
COS O, RAMON R, MONTESINOS J F, et al. Operational strategies, monitoring and control of heterologous protein production in the methylotrophic yeast Pichia pastoris under different promoters:A review[J]. Microbial Cell Factories, 2006, 4(3): 5-17. DOI:10.1186/1475-2859-5-17 |
| [16] |
GHOSALKAR A, SAHAI V, SRIVASTAVA A. Optimization of chemically defined medium for recombinant Pichia pastoris for biomass production[J]. Bioresource Technology, 2008, 99(3): 7906-7910. |
| [17] |
VAN D P, VAN H A, LAMBRECHTS D, et al. Progranulin functions as a neurotrophic factor to regulate neurite outgrowth and enhance neuronal survival[J]. Cell Biology, 2008, 181(1): 37-41. DOI:10.1083/jcb.200712039 |
| [18] |
LIAU L M, LALLONE R L, SEITZ R S, et al. Identification of a human glioma-associated growth factor gene, granulin, using differential immuno-absorption[J]. Cancer Research, 2000, 60(5): 1353-1360. |
| [19] |
ZHU J, NATHAN C J, SIM W D, et al. Conversion of proepithelin to epithelins:Roles of SLPI and elastase in host defense and wound repair[J]. Cell, 2002, 111(6): 867-878. DOI:10.1016/S0092-8674(02)01141-8 |
| [20] |
ANDREW B, BABYKUMARI P C, HUGH P J B. Chromatographic methods for the purification of granulin peptides[M]. New York: Human Press, 2018.
|




