2. 石家庄学院 化工学院,河北 石家庄 050000;
3. 河北工业大学 化工学院,天津 300130
2. School of Chemical Engineering & Technology, Shijiazhuang University, Shijiazhuang 050000, China;
3. School of Chemical Engineering & Technology, Hebei University of Technology, Tianjin 300130, China
四氢噻吩化学性质稳定、气味独特、安全高效等特点,主要作为煤气和天然气的加臭剂;四氢噻吩还是合成多种新型医药、农药及高分子合成材料助剂的中间体等,因此国内需求量较大。目前四氢噻吩的合成方法主要有两条,即噻吩催化加氢法和四氢呋喃合成法。上述两种方法的主要缺陷都是采用了比较昂贵的原料,目前噻吩的市场价格为8~10万元×t-1,四氢吩喃的市场价格也在4~4.5万元×t-1 [1~3]。因此,有必要探索出利用廉价原料,经济、安全、适于工业化的生产四氢噻吩的新方法。而以环丁砜为原料通过加氢脱氧合成四氢噻吩,该方法克服了现有四氢噻吩生产技术的昂贵原料(四氢呋喃或噻吩)问题,而且整个生产过程仅有副产物水,不产生其他污染物。这个工艺是一个环保可行有价值的工艺技术,因此具有很好的发展前景[4]。
根据文献报道[5~7],在加氢脱氧反应过程中还原态催化剂的活性优于硫化态和氧化态催化剂,因此在本论文选用Ni-Mo复合氧化物为催化剂,并经过H2还原得到的还原态催化剂。还原条件对Ni-Mo复合氧化物催化剂的活性有较重要的影响。因此,采用溶胶凝胶法制得Ni-Mo非负载催化剂,以环丁砜为反应原料,考察了还原条件对Ni-Mo复合氧化物催化剂结构及选择性加氢脱氧催化性能的影响。
2 试验部分 2.1 催化剂制备溶胶-凝胶法制备非负载Ni-Mo复合氧化物催化剂。称取一定量的钼酸铵、硝酸镍和柠檬酸(n(Ni):n(Mo)=0.6:1,n(Ni+Mo):n(柠檬酸)=1:1),分别溶解于一定量的50%乙醇(V)溶剂中,将上述溶液混合均匀,再向混合溶液中加入10mL的N, N-二甲基二酰胺;用氨水调节溶液pH值,80℃水浴加热溶液、蒸发水分使络合物聚合生成粘稠状的凝胶,超声波振荡15 min得湿凝胶;湿凝胶在120℃下干燥后,然后在氮气气氛中260℃焙烧3 h (分解柠檬酸),并在空气氛围中500℃焙烧3 h,得Ni-Mo复合氧化物粉体。按质量比7:3的比例将Ni-Mo复合氧化物粉体与粘合剂氢氧化铝干胶混合、成型,500℃焙烧3h,制得非负载Ni-Mo复合氧化物催化剂。
2.2 催化剂表征采用日本理学标准型TG-DTA分析仪考察催化剂前躯体的热分解性质。升温速率:10 K×min-1,温度范围:室温~1073 K,DTA量程:±250 μV,TG量程:7.0 mg;采用美国Micromeritics Auto Chem II-2920化学吸附仪器对催化剂样品进行TPR分析;量取100 mg催化剂样品进行测试,以10℃×min-1的升温速率,还原气氛为H2/Ar (5/95),温度范围室温~900℃,使用TCD检测响应值信号。X射线衍射(XRD)采用日本理学D/Max-2500型X射线衍射仪测定,Cu靶,石墨单色滤光片,狭缝SS/DS=1°,RS 0.15 mm,工作电压40 kV,电流100 mA,计数器SC,扫描范围10°~80°。
2.3 催化剂性能评价催化剂催化环丁砜加氢脱氧性能的评价在连续流动固定床反应装置中进行。反应器长约34 cm,外径1.9 cm,内径1.4 cm;催化剂颗粒长约3 mm,直径1.5 mm,装填量5 mL,催化剂两端填充20~40目石英砂。反应温度230℃,反应压力0.3 MPa,液时空速为1~3 h-1,V氢气/V原料=200。反应前催化剂在常压、H2氛围还原,程序升温10℃×min-1升温至设定温度,恒温一定时间;在一定氢气流量下还原,还原条件见表 1;然后降至反应温度,用计量泵将原料泵入反应器进行反应,反应产物经冷阱冷凝后取样分析(SP-3420A气相色谱仪,毛细管柱OV-1:50 m×0.32 mm,氢火焰检测器)。
| 表 1 催化剂的还原条件 Table 1 Reduction conditions for the catalysts |
环丁砜转化率和加氢脱氧选择性的计算式如下:
| $ \begin{gathered} 转化率\;\;X = \frac{{原料中总环丁砜量-未反应的环丁砜量}}{{原料中总环丁砜量}} \times 100\% \\ 加氢脱氧选择性\;\;S = \frac{{四氢噻吩的量}}{{环丁砜转化的总量}} \times 100\% \\ \end{gathered} $ |
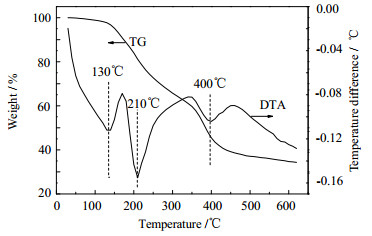
图 1是溶胶-凝胶法制备的Ni-Mo复合氧化物前躯体在N2氛围下的热分析曲线。从图 1的DTA曲线可看出,在500℃之前曲线上有3个明显的吸热峰,分别为130、210、400℃;从TG曲线上可以发现,500℃以前存在3个失重区,分别出现在80~160℃、160~260℃和340~460℃。130℃的吸热峰对应于第一个失重区,为前躯体中所含结晶水的挥发-蒸发过程。210℃吸热峰对应于第二个失重区,为前躯体中所含的柠檬酸在N2氛围下的分解过程。400℃的吸热峰对应于第三个失重区,为金属盐的分解过程。在焙烧温度高于450℃时,催化剂质量基本上保持不变,这表明从催化剂中不再有气体或杂质物质分解出来,这一阶段主要是催化剂进行内部规整、晶化程度提高过程。
|
图 1 Ni-Mo复合氧化物前驱体的热分析曲线 Fig.1 Thermal analysis profiles of Ni-Mo composite oxide precursors |
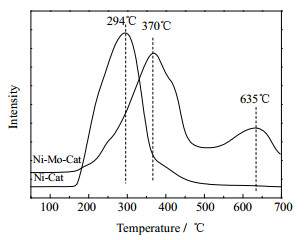
图 2为Ni基催化剂和Ni-Mo复合氧化物催化剂的H2-TPR谱图。纯NiO还原反应的方程式如式(1),由式(1)可得只需一步反应就可以将NiO还原,没有形成其它的中间产物。Rodriguez等[8]认为在还原过程中控制速度的反应是氧空缺的形成,然后吸附催化剂边缘有效H原子发生还原反应,发生还原反应的最低温度在270~400℃。由图 2可知,由溶胶-凝胶法所制备Ni基催化剂在294℃处出现还原峰,这与文献报道相符。MoO3需经过两步才能被完全还原,其方程式如式(2)和(3)所示。MoO3的还原温度在630~930℃,第一步还原生成的中间产物MoO2,如果需要进一步被还原,则还原温度至少不得低于750℃[9]。
|
图 2 催化剂的H2-TPR谱图 Fig.2 H2-TPR profiles of the catalysts |
NiO和MoO3的简单机械混合金属氧化物的还原温度在两个纯氧化物还原温度之间,但是它们的还原温度也不是单调变化的。在复合金属氧化物中以NiO为主时,当MoO3含量超过20%(mol)时,混合催化剂的还原温度则比NiO的还原温度大100℃,约为394℃[10];MoO3含量在20%~50 %(mol)时,其还原温度不再发生变化[9]。
如果NiO与MoO3发生相互作用形成NiMoO4,则NiMoO4的还原也需要经过两步反应,其还原过程见式(4)和(5)。第一步在较低的温度下将NiMoO4还原成镍钼合金,还有部分MoO2,第二步是MoO2的进一步还原,这需要更高的温度,但是这个温度比式(3)中MoO2的还原温度低[10]。由图 2可以看出,Ni-Mo复合氧化物催化剂的在370℃和635℃处有两个主要的还原峰,根据以上分析可知,370℃的还原峰对应于NiMoO4的第一步还原,其温度低于简单混合的NiO和MoO3的还原温度394℃;635℃的还原峰对应于MoO2的还原,其温度远远低于式(3)中MoO2的还原温度750℃。这说明NiMoO4在一定程度上降低了Ni-Mo复合氧化物催化剂的还原温度。
| $ NiO(s) + {H_2}(g) \to Ni(s) + {H_2}O{(g)_{}}(\Delta {G^ \circ } = 2312-49.47T\begin{array}{*{20}{c}} {}&{J \cdot mo{l^{-1}}} \end{array} $ | (1) |
| $ MoO{}_3(s) + {H_2}(g) \to Mo{O_2}(s) + {H_2}O{(g)_{}}(\Delta {G^ \circ } = 85600-26.70T\begin{array}{*{20}{c}} {}&{J \cdot mo{l^{-1}}} \end{array} $ | (2) |
| $ Mo{O_2}(s) + 2{H_2}(g) \to Mo(s) + 2{H_2}O{(g)_{}}(\Delta {G^ \circ } = 105300-98.60T\begin{array}{*{20}{c}} {}&{J \cdot mo{l^{-1}}} \end{array} $ | (3) |
| $ NiMo{O_4}(s) + 2(1 + y){H_2}(g) \to NiM{o_y}(s) + (1-y)Mo{O_2}(s) + 2(1 + y){H_2}O(g) $ | (4) |
| $ NiM{o_y}(s) + (1-y)Mo{O_2}(s) + 2(1-y){H_2}(g) \to NiMo(s) + 2(1-y){H_2}O(g) $ | (5) |
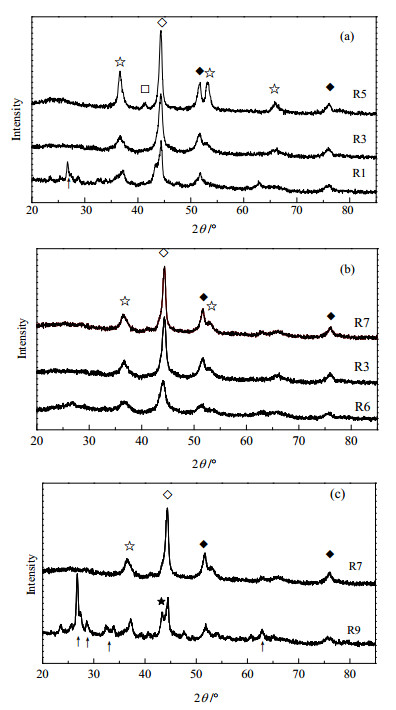
图 3为经过不同还原条件下还原后的催化剂的XRD谱图。由未还原催化剂的XRD谱图可知,溶胶-凝胶法制备的非负载Ni-Mo复合氧化物催化剂主要以NiMoO4的晶相存在[9]。根据文献报道[9, 11],图中26.7°为未还原NiMoO4的特征衍射峰,36.6°、53.2°和66.0°为还原过程中的中间产物MoO2的衍射峰,41.4°为Mo的衍射峰,44.2°为NixMo (镍钼合金)的衍射峰,51.7°和76.0°则为Ni的衍射峰。
|
图 3 不同还原条件Ni-Mo催化剂的XRD谱图 Fig.3 XRD patterns of the Ni-Mo catalysts reduced under different conditions ↑-NiMoO4 ☆-MoO2 ◇-NixMo □-Mo ◆-Ni ★-NiO |
由图 3(a)可知,还原温度对催化剂的晶型和晶化程度有一定的影响。还原温度在350~450℃范围内,Ni-Mo复合氧化物催化剂在常压和氢气氛围下还原后,均出现了MoO2、NixMo、和Ni的特征衍射峰。当还原温度较低(R1)时,催化剂中还存在复合氧化物NiMoO4;当还原温度高于350℃时,催化剂的主体NiMoO4骨架结构瓦解,全部转化为MoO2、Ni和NixMo等物相;当还原温度达到450℃时,催化剂中的还原产物晶化程度明显增强,而且在41.4°处出现了新物相Mo。由催化剂的还原温度分析可知,催化剂发生第一步还原所需要的温度在370℃,在450℃时第一步反应基本完全。因此随着还原温度的升高,催化剂的还原程度加强,进而增强了还原产物的晶化程度。
从图 3(b)可以看出,H2流量对催化剂的晶相结构影响较小。随着H2流量增大,各物相的衍射峰略有增强,当H2流量增加到30 mL×min-1,催化剂的各物相的晶化程度不再随H2流量增加而变化。Arnoldy[12]认为还原形成的H2O在多孔的MoO2中的扩散将比在气相中慢,从而在MoO2颗粒中积聚,水蒸气压力升高,进而抑制催化剂进一步还原。在一定床层截面积和空隙率下,H2流量的增加会提高其表面线速度,有利于将生成的H2O带离反应区,因而促进催化剂的进一步还原。
从图 3(c)可得,当催化剂的还原时间较短(R9)时,催化剂中还存在较多的NiMoO4和少量的NiO。随着还原时间的延长,NiMoO4被还原完全,其衍射峰消失,而且各还原产物的衍射峰增强。这可能由于在非负载催化剂中含有密度较高的活性组分,延长还原时间,增加了活性氧化物与H2接触的几率,因此催化剂的还原将更充分。
3.4 还原条件对催化剂性能的影响在压力0.3 MPa,温度230℃,V氢气/V原料=200,液时空速为1~3 h-1的条件下,考察了还原条件对催化剂催化性能的影响。
3.4.1 还原温度的影响根据产物的色谱分析可知,在Ni-Mo复合氧化物催化剂下,环丁砜首先发生加氢脱氧反应得到四氢噻吩,进一步加氢四氢噻吩转化为为丁烷。图 4为还原温度对环丁砜转化率和四氢噻吩的选择性的影响。图 4表明,在350~450℃,随着还原温度的增加,催化剂的活性呈先增大后减小的趋势,而其选择性由350℃到400℃增加较为明显,再升高还原温度选择性变化不大。这是由于催化剂在较低还原温度下,催化剂中部分复合氧化物还未被完全还原;当还原温度较高时,虽然催化剂的还原较充分,但是可能使部分还原产物发生团聚,增大颗粒度,故导致催化剂的活性反而下降。由XRD分析知,在还原温度为400℃时,催化剂具有较好的MoO2的晶相,Belatal等报道[13]MoO3被H2还原,产物MoO2与H结合形成Mo-OH能起B酸中心作用,而B酸中心是有利于催化加氢脱氧反应,故四氢噻吩的选择性较高。综合考虑二者,催化剂的适宜还原温度为400℃。

|
图 4 还原温度对催化剂催化性能的影响 Fig.4 Effects of reduction temperature on the catalytic performance of the catalysts (a) conversion of sulfolane (b) selectivity of THT |
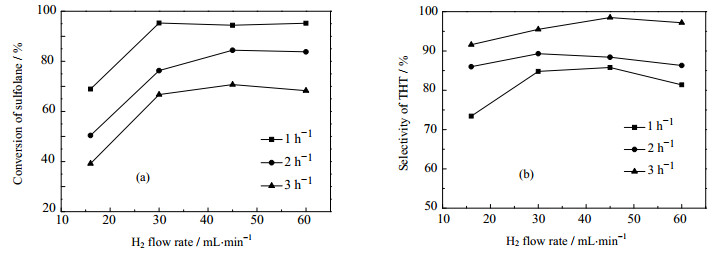
图 5为催化剂被还原时H2流量对催化剂催化性能的影响。从图 5可以看出,随着H2流量的增大,催化剂的活性呈增加的趋势,而对其选择性的影响较小。当H2流量为16 mL×mol-1时,催化剂的活性明显较低,这可能是由于在一定床层截面积和空隙率下,H2流量较小会降低其表面线速度,不利于将还原过程中生成的H2O带离反应区,因而阻碍了催化剂的进一步还原;当H2流量大于45 mL×min-1时,H2流量对催化剂的选择性影响较小,考虑到经济成本,适宜的还原H2流量为45 mL×min-1。
|
图 5 H2流量对催化剂催化性能的影响 Fig.5 Effects of H2 flow ratio on the catalytic performance of the catalysts (a) conversion of sulfolane (b) selectivity of THT |
图 6给出了还原时间对催化剂催化性能的影响。由图 6可得,催化剂的活性和选择性均随着还原温度的增加呈先增大后减小的趋势,还原时间为3 h的活性和选择性达到最优。在催化剂还原过程中,在一定的还原温度和H2流量条件下,延长还原时间,有利于催化剂充分还原;但是还原时间过长,可能导致催化剂还原过度,即MoO2进一步被还原成Mo,MoO2的减小将减小B酸总中心位,这将不利于的选择性加氢脱氧反应。因此适宜的还原时间为3 h,在0.3 MPa,230℃,V氢气/V原料=200,1 h-1的反应条件下,环丁砜的转化率为95.6%,四氢噻吩的选择性为86.2%。

|
图 6 还原时间对催化剂催化性能的影响 Fig.6 Effects of reduction time on the catalytic performance of the catalysts (a) conversion of sulfolane (b) selectivity of THT |
在压力0.3 MPa,V氢气/V原料 200,空速1 h-1,温度230℃,以环丁砜选择性加氢脱氧反应为探针反应,考察了催化剂初活稳定性,实验结果见图 7。由图 7可知,从反应初始至87 h,催化剂的活性基本稳定,环丁砜转化率为87%左右,四氢噻吩的选择性在88%左右,说明非负载Ni-Mo复合氧化物催化剂具有较好的稳定性。

|
图 7 催化剂的稳定性 Fig.7 Stability of the catalysts (a) conversion of sulfolane (b) selectivity of THT |
采用溶胶-凝胶法制备非负载Ni-Mo复合氧化物催化剂具有良好的选择性加氢脱氧性能。在制备过程中NiO和MoO3发生了相互作用而形成了复合氧化物NiMoO4,NiMoO4的形成降低了催化剂中MoO3的还原温度,这有利于催化剂中还原组分Ni、NixMo和MoO2的形成。还原温度和还原时间对催化剂的晶相结构和选择性加氢脱氧性能影响较为明显。催化剂的适宜还原条件为:还原温度400℃,H2流量45 mL×min-1,还原时间3 h。在此条件所还原的催化剂具有良好的稳定性。
| [1] | LI Hong-bin(李鸿滨) . Production technology and market analysis of tetrahydrothiophene(四氢噻吩的生产技术与市场分析)[J]. Chemical Intermediate(化工中间体) , 2006, 5 (6) : 12-19. |
| [2] | WANG Yu-min(王毓敏), CHEN Li-ya(陈丽娅), ZHANG Da-yang(张大洋) , et al. Synthesis of tetrahydrothiophene(四氢噻吩合成的研究)[J]. Liaoning Chemical Industry(辽宁化工) , 1995, 29 (6) : 41-43. |
| [3] | LI Pi-gao(李丕高), LI Gang(李刚) . Improvement on the synthesis of Tetrahydrothiophene(四氢噻吩合成方法的改进)[J]. Chinese Journal of Synthetic Chemistry(合成化学) , 2007, 15 (3) : 374-375. |
| [4] | HOU Kai-hu (侯凯湖), DUAN Yan (段艳), WANG Lan-zhi (王兰芝), et al. Method on the synthesis of tetrahydrothiophene using sulfolane as feed: (以环丁砜为原料生产四氢噻吩的方法), CN: 201110067356.3[P]. 2011-09-07 |
| [5] | Bunch A Y, Wang X, Ozkan U S . Adsorption characteristics of reduced Mo and Ni-Mo catalysts in the hydrodeoxygenation of benzofuran[J]. Applied Catalysis A:General , 2008, 346 (1-2) : 96-103. DOI:10.1016/j.apcata.2008.05.007. |
| [6] | Bunch A Y, Ozkan U S . Investigation of the reaction network of benzofuran hydrodeoxygenation over sulfided and reduced Ni-Mo/Al2O3 catalysts[J]. Journal of Catalysis , 2002, 206 (2) : 177-187. DOI:10.1006/jcat.2001.3490. |
| [7] | Bunch A Y, Wang X, Ozkan U S . Hydrodeoxygenation of benzofuran over sulfided and reduced Ni-Mo/γ-Al2O3 catalysts:effect of H2S[J]. Journal of Molecular Catalysis A:Chemical , 2007, 270 (1-2) : 264-272. DOI:10.1016/j.molcata.2007.02.006. |
| [8] | Rodriguez J A, Hanson J C, Frenkel A I , et al. Experimental and theoretical studies on the reaction of H2 with NiO:role of O vacancies and mechanism for oxide reduction[J]. Journal of the American Chemical Society , 2002, 124 (2) : 346-349. DOI:10.1021/ja0121080. |
| [9] | Slavko M, Biljanan T, Divna M , et al. Gel-combustion synthesis of NiO-MoO3 mixtures and their reduction to Ni-Mo alloys[J]. Materials Chemistry and Physics , 2008, 112 (3) : 254-264. |
| [10] | Wthrer P, Hilaire L, Petit E . Influence of the reduction conditions of MoO3 on its isomerizing properties[J]. Applied Catalysis A:General , 2004, 273 (5) : 249-258. |
| [11] | DUAN Yan(段艳), ZHANG Shun-guang(张舜光), HOU Kai-hu(侯凯湖) . Effects of preparation conditions on the properties of unsupported Ni-Mo composite oxide catalysts for hydrodeoxygenation(制备条件对非负载Ni-Mo复合氧化物催化剂加氢脱氧性能的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26 (3) : 499-454. |
| [12] | Arnoldy P, Jonge J C, Moulijn J A . Temperature programmed reduction of MoO3 and MoO2[J]. Physical Chemistry , 1985, 89 (21) : 4517-4526. DOI:10.1021/j100267a021. |
| [13] | Belatel H, Al-Kandari H, Al-Khorafi F , et al. Catalytic reactions of methylcyclohexane (MCH) on partially reduced MoO3[J]. Applied Catalysis A:General , 2004, 275 (1) : 141-147. |




