2. 湖北三峡实验室, 湖北 宜昌 443007
2. Hubei Three Gorges Laboratory, Yichang 443007, China
胆酸(cholic acid,CA)是存在于人和脊椎动物胆汁中的一种甾类物质[1],分子式为C24H40O5,结构式如图 1所示。CA属于初级胆汁酸,是众多胆汁酸中最容易提取的一种胆汁酸,现代中药制剂中多将其提取入药如复方牛黄散、消痔灵胶囊中,用于治疗热病神昏、中风痰迷、咽喉肿痛、口舌生疮等症状[2-3]。同时胆酸也是熊去氧胆酸、石胆酸、去氧胆酸、鹅去氧胆酸、牛磺胆酸等名贵药物的底物[4-8],为解决药物学上对牛黄、熊胆、蛇胆等药物的需求和来源紧缺的矛盾[9-10],因此,研究开发胆酸具有重要意义。

|
图 1 胆酸结构式 Fig.1 Chemical structure of CA |
目前高纯的胆酸在国内外产量总体不足,但需求旺盛。结晶是物质提纯的主要方法之一,广泛应用于工业生产具有明确的理化性质的各种制品中[11-12]。尤其在制药行业,结晶是最为重要的纯化步骤。溶解度和热力学性质则是决定结晶方法和工艺不可或缺的基础数据[13-16],此外,溶解度和热力学性质还可为晶体形貌的优化、新晶型的研发提供参考[17-18]。根据文献调研,本研究选取工业提取纯化胆酸最常用的乙醇、乙酸乙酯、醋酸等溶剂,研究胆酸在不同溶剂中的溶解度,并计算其各自的表观热力学性质,可为胆酸提纯的生产工艺开发提供一定的理论基础。
2 实验材料和方法 2.1 实验原料及试剂胆酸(98%,上海阿位丁生化科技股份有限公司);甲醇(分析纯,天津市富宇精细化工有限公司);无水乙醇(分析纯,天津市富宇精细化工有限公司);乙酸乙酯(分析纯,天津市大茂化学试剂厂);冰醋酸(分析纯,天津市富宇精细化工有限公司);正丙醇(分析纯,天津市富宇精细化工有限公司)。以上原料试剂均已通过高效液相色谱(LP-20A,日本岛津公司)验证。
2.2 胆酸的结构表征及熔点测定胆酸的晶型及结构特征由X射线衍射仪(D/max-2550X,日本理学株式会社)测定。测试条件:扫描范围为2°~50°,扫描度数0.02°,扫描速度为8(°)⋅min−1。胆酸的熔点和融化焓由差示扫描量热仪(Q20,美国TA Instruments公司)测定,温度测试范围为20~300 ℃,控制升温速率为10 ℃⋅min−1,N2保护。
2.3 溶解度测量实验装置和方法采用重量法[19]测定胆酸在甲醇、乙醇、乙酸乙酯、冰醋酸和正丙醇中的溶解度,其实验装置如图 2所示。该装置由超级恒温槽(THCD-2010,宁波天恒仪器厂)、磁力搅拌器(DF-101S,巩义市予华仪器有限公司)和一个带夹套的结晶器组成。环境温度由超级恒温槽循环水控制,恒温精度为±0.01 K。实验温度以水银温度计为准,测温精度为±0.1 K。用磁力搅拌器使固液两相均匀混合,加快胆酸在溶剂中的溶解。
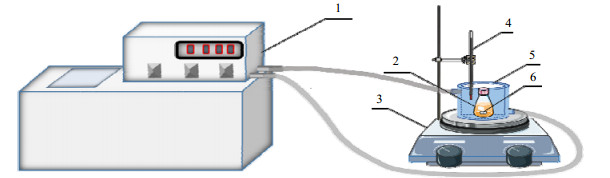
|
图 2 溶解度测定装置图 Fig.2 Schematic diagram of the experimental setup for solubility measurements 1. constant temperature water tank 2. glass bottle 3. magnetic stirrer 4. mercury thermometer 5. jacket crystallizer 6. rotor |
首先将过量的胆酸和溶剂混合加入玻璃瓶中,在设定的温度下搅拌5 h以上。达到溶解平衡后,停止搅拌使颗粒沉淀。待沉降完全后,取上层清液,使用注射器搭配孔径为0.22 μm的有机系针头过滤器过滤到预先称重的小瓶(质量为m1)中称重,称其质量为m2,然后将其放于烘箱中蒸发溶剂,溶剂完全蒸发后质量为m3,称量精度均为±0.000 1 g。则m3−m1为溶质质量,m2−m3为溶剂质量。每组实验重复上述操作3次,取算术平均值作为最终的实验结果。
胆酸的摩尔溶解度计算公式为
| $ x = \frac{{{m_{\rm{s}}}/{M_{\rm{s}}}}}{{{m_{\rm{s}}}/{M_{\rm{s}}} + {m_i}/{M_i}}} $ | (1) |
图 3为胆酸的X射线粉末衍射(PXRD)结果,其衍射角2θ为7.47°、10.37°、11.87°、12.92°、14.86°、18.33°、19.65°、21.81°的特征峰明显,与Material studio模拟出来的曲线的特征峰一一相对应。图 4为胆酸的DSC曲线,吸热峰前斜率最大点的切线与前基线的延长线的交点为CA的熔点[20],其熔点Tm为473.76 K,对其吸热峰积分得熔化焓ΔfusH为97.73 J⋅g−1。

|
图 3 CA的PXRD和其模拟曲线 Fig.3 PXRD pattern and corresponding simulation data of CA |

|
图 4 CA的DSC曲线 Fig.4 DSC curve of CA |
氯化钠在水中的溶解度已有报道,因此,以氯化钠在水中的溶解度为标准,对溶解度测定装置和方法的可靠性进行验证。采用重量法测定氯化钠在水中的溶解度,并与文献值[21]比较,结果如表 1所示。从表 1可以看出,氯化钠溶解度实验值wexp与文献参考值wref符合良好,说明实验装置和方法可靠,可用于测定胆酸在溶剂中的溶解度。
|
|
表 1 氯化钠在水中的溶解度实验数据wexp和文献数据wref对比 Table 1 Comparison of experimental wexp and reference solubility data wexp of sodium chloride in water |
由于冰醋酸冰点为16.2 ℃,所以测定了其在20~55 ℃的溶解度,其余4种溶剂均为0~55 ℃下测定的溶解度,具体测定数据如图 5所示。实验结果表明,胆酸在5种溶剂中的溶解度均随温度升高而增大,且对温度变化敏感;在相同温度下,胆酸在不同溶剂中的溶解度大小依次为:冰醋酸 > 甲醇 > 乙醇 > 正丙醇 > 乙酸乙酯,其规律与溶剂极性规律相同,符合“相似相溶”原理。
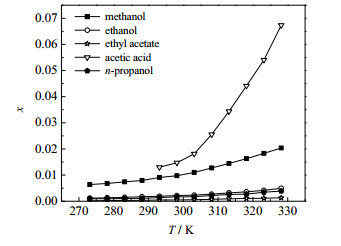
|
图 5 胆酸在各个溶剂中的溶解度数据曲线 Fig.5 Solubility profiles of cholic acid in different solvents |
采用Modified Apelblat模型[22](2)、λh模型[23-24](3)、二次多项式模型[25](4)及三参数van′t Hoff模型[26](5)对CA在不同溶剂中的溶解度进行关联拟合。
| $ \ln x = a + \frac{b}{T} + c\ln T $ | (2) |
| $ {\ln _{}}\left( {1 + \lambda \frac{{1 - x}}{x}} \right) = \lambda h\left( {\frac{1}{T} - \frac{1}{{{T_{\rm{m}}}}}} \right) $ | (3) |
| $ x = {A_1} + {B_1}T + {C_1}{T^2} $ | (4) |
| $ \ln x = {A_2} + \frac{{{B_2}}}{T} + \frac{{{C_2}}}{{{T^2}}} $ | (5) |
采用RD、ARD和RMSD对热力学模型拟合结果进行分析[27],考察所选模型的适用性和准确性,计算如式(6)~(8)所示。
| $ {\rm{RD}} = \frac{{{x_{i, {\rm{exp}}}} - {x_{i, {\rm{cal}}}}}}{{{x_{i, {\rm{exp}}}}}} $ | (6) |
| $ {\rm{ARD}} = \frac{1}{N}\sum\limits_{i = 1}^N {\left| {\frac{{{x_{i, {\rm{exp}}}} - {x_{i, {\rm{cal}}}}}}{{{x_{i, {\rm{exp}}}}}}} \right|} $ | (7) |
| $ {\rm{RMSD}} = {\left[ {\frac{1}{N}\sum\limits_{i = 1}^N {{{\left( {{x_{i, {\rm{exp}}}} - {x_{i, {\rm{cal}}}}} \right)}^2}} } \right]^{\frac{1}{2}}} $ | (8) |
RD、ARD和RMSD值越小,说明拟合值与实验值的偏差越小,拟合效果越好;反之,RD、ARD和RMSD值越大,拟合效果越差[28]。实验值与拟合值之间的偏差(RD、ARD和RMSD)见表 2。
|
|
表 2 胆酸在5种溶剂中的溶解度及其拟合偏差 Table 2 Solubility of cholic acid in five solvents and their fitting deviations |
从表 2可以看出,采用Modified Apelblat模型、λh模型、二次多项式模型及三参数van′t Hoff模型均能很好地关联胆酸在5种有机溶剂中的溶解度数据,其模型方程均可预测胆酸在所测温度范围内不同溶剂中的溶解度,模型拟合参数见表 3。对比3种模型的关联结果,二次多项式模型的拟合效果略优于Modified Apelblat模型、λh模型和三参数van′t Hoff模型。
|
|
表 3 胆酸在5种溶剂中的溶解度模型参数 Table 3 Model parameters of CA solubility in five solvents |
在目前的研究中,与van't Hoff方程相比,修正的van't Hoff方程[29]更适合计算溶质溶解过程中的热力学参数,而且当温度改变不大时,溶解焓ΔsolH和溶解熵ΔsolS等热力学参数可以看作常数,其表达式如下:
| $ {\Delta _{{\rm{sol}}}}H = - R \times \frac{{\partial \ln x}}{{\partial \left( {\frac{1}{T} - \frac{1}{{{T_{\rm{m}}}}}} \right)}} $ | (9) |
| $ {T_{{\rm{hm}}}} = \frac{N}{{\sum\limits_{i = 1}^N {\frac{1}{T}} }} $ | (10) |
根据实验的溶解度数据,以T−1−Thm−1为横坐标,ln x为纵坐标作图,进行线性拟合,结果见图 6。其斜率为k,截距为d,其拟合参数见表 4。其ΔsolH、ΔsolS和ΔsolG可分别用下式计算。
| $ {\Delta _{{\rm{sol}}}}H = - R \times k $ | (11) |
| $ {\Delta _{{\rm{sol}}}}G = - R \times {T_{{\rm{hm}}}} \times d $ | (12) |
| $ {\Delta _{{\rm{sol}}}}S = \frac{{{\Delta _{{\rm{sol}}}}H - {\Delta _{{\rm{sol}}}}G}}{{{T_{{\rm{hm}}}}}} $ | (13) |
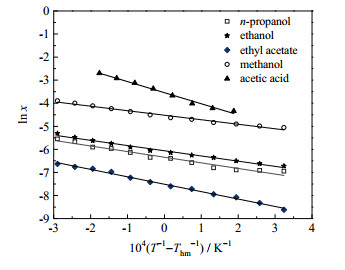
|
图 6 CA溶解度的修正的van't Hoff方程拟合曲线 Fig.6 Fitting curves of the modified van't Hoff equation for CA solubility |
|
|
表 4 修正的van't Hoff拟合CA溶解度的模型参数 Table 4 Model parameters of the modified van't Hoff fitting for CA solubility |
为了比较ΔsolH和ΔsolS对溶解过程相对贡献的大小,这里引入2个热力学参数焓相对贡献ζH和熵相对贡献ζTS[30],计算式如下:
| $ {\zeta _{\rm{H}}} = \frac{{\left| {{\Delta _{{\rm{sol}}}}H} \right|}}{{\left| {{\Delta _{{\rm{sol}}}}H} \right| + \left| {T{}_{{\rm{hm}}}\Delta {}_{{\rm{sol}}}S} \right|}} $ | (14) |
| $ {\zeta _{{\rm{TS}}}} = \frac{{\left| {{T_{{\text{hm}}}}{\Delta _{{\rm{sol}}}}S} \right|}}{{\left| {{\Delta _{{\rm{sol}}}}H} \right| + \left| {{T_{{\rm{hm}}}}{\Delta _{{\rm{sol}}}}S} \right|}} $ | (15) |
计算的表观热力学性质ΔsolH、ΔsolS、ΔsolG、ζH和ζTS见表 5。
|
|
表 5 CA溶解过程的表观热力学参数 Table 5 The apparent thermodynamic parameters of CA dissolution processes |
由表 5可知,胆酸在甲醇、乙醇、乙酸乙酯、冰醋酸和正丙醇中的ΔsolH、ΔsolS和ΔsolG均为正值,说明胆酸在所选的溶剂中的溶解均为非自发、不可逆的吸热过程。其中,冰醋酸的溶解焓变最大,可能是由于冰醋酸的溶解度最大,需要吸收更多的能量来完成溶解过程,而在甲醇、乙醇、乙酸乙酯和正丙醇中,其ΔsolH从大到小分别为乙酸乙酯 > 正丙醇 > 乙醇 > 甲醇,与其溶解度的规律相反;ΔsolG从大到小分别为乙酸乙酯 > 正丙醇 > 乙醇 > 甲醇 > 冰醋酸,也与其溶解度规律相反;ΔsolS均为正值,说明胆酸与溶剂分子混合打乱了溶剂分子之间的混合,所以体系混乱度增加,符合“熵增定律”。另外,ζH和ζTS分别在0.573 1~0.836 1和0.163 9~0.426 9,即ζH最小值为0.573 1,ζTS最大值为0.426 9,说明胆酸在所选溶剂溶解过程中,ΔsolH对ΔsolG的贡献大于ΔsolS。
4 结论(1) 常压下,胆酸在所选择的5种有机溶剂中的溶解度均随温度升高而升高,在相同的温度下,胆酸在各个溶剂中的溶解度大小顺序为:冰醋酸 > 甲醇 > 乙醇 > 正丙醇 > 乙酸乙酯。
(2) 采用Modified Apelblat模型、λh模型、二次多项式模型及三参数van′t Hoff模型拟合胆酸在不同溶剂中的溶解度数据,结果表明4种模型均能取得较好的关联结果。对比4种模型的关联结果,二次多项式模型的拟合效果略优于Modified Apelblat模型、λh模型、三参数van′t Hoff模型。
(3) 采用修正的van′t Hoff方程计算了胆酸在5种有机溶剂中的溶解焓变ΔsolH、溶解熵变ΔsolS和溶解吉布斯自由能变ΔsolG,其值均大于0,表明胆酸在5种有机溶剂中的溶解过程均为吸热、熵增的非自发过程。计算了胆酸在各个溶剂中的焓相对贡献ζH和熵相对贡献ζTS,结果表明胆酸在所选的溶剂的溶解过程中,溶解焓变ΔsolH对溶解吉布斯能变ΔsolG的贡献大于溶解熵变ΔsolS。
符号说明:
A1, B1, C1 —二次多项式模型参数 N —样本数量
A2, B2, C2 —三参数van′t Hoff模型 R —气体常数,R=8.314 J⋅mol−1⋅K−1
a, b, c — Modified Apelblat模型参数 R2 —拟合优度
ARD —平均相对偏差 RD —相对偏差
d —截距 RMSD —均方根偏差
ΔsolG —溶解吉布斯自由能变,kJ⋅mol−1 ΔsolS —溶解熵变,J⋅mol−1⋅K−1
h, λ — λh模型参数 T —实验温度, K
ΔfusH —熔化焓,kJ⋅mol−1 Thm —调和平均温度,K
ΔsolH —溶解焓变,kJ⋅mol−1 Tm —熔点,K
k —斜率 wexp —氯化钠溶解度实验值
Mi —溶剂的摩尔质量,g⋅mol−1 wref —氯化钠溶解度文献值
Ms —溶质的摩尔质量,g⋅mol−1 x —摩尔溶解度
m1 —空瓶的质量,g xi, cal —溶解度拟合值
m2 —空瓶加溶液的质量,g xi, exp —溶解度实验值
m3 —空瓶加溶质的质量,g 2θ —衍射角,(°)
mi —溶剂的质量,g ζH —焓相对贡献
ms —溶质的质量,g ζTS —熵相对贡献
| [1] |
姚子琦, 刘旭春, 周晓溪. 我国人工牛黄的应用研究进展[J]. 科技创新与生产力, 2018(1): 32-34. YAO Z Q, LIU X C, ZHOU X X. Research progress of artificial bezoar in China[J]. Technology Innovation and Productivity, 2018(1): 32-34. |
| [2] |
曹金山. 胆酸的抗炎作用及对呼吸系统的药理作用和组织学影响[D]. 呼和浩特: 内蒙古农业大学, 2001. CAO J S. Anti-inflammatory actions of cholic acid and its effect on pharmacology and histology of respiratory system [D]. Hohhot: Inner Mongolia Agricultural University, 2001. |
| [3] |
孙苗. 胆酸对代谢性炎症模型大鼠糖脂代谢及炎症的影响[D]. 呼和浩特: 内蒙古农业大学, 2021. SUN M. The effects of cholic acid on glycolipid metabolism and inflammation in rats with metaflammation [D]. Hohhot: Inner Mongolia Agricultural University, 2021. |
| [4] |
张佳玮, 朱晓夏. 胆酸低聚物作为主体分子的研究进展[J]. 高分子通报, 2015(9): 163-170. ZHANG J W, ZHU X X. Cholic acid derived oligomers as supramolecular hosts[J]. Polymer Bulletin, 2015(9): 163-170. |
| [5] |
张明霞, 欧阳贵平. 胆酸衍生物的合成及其应用[J]. 合成化学, 2009, 17(2): 140-145. ZHANG M X, OU YANG G P. Synthesis and application of bile acid derivatives[J]. Chinese Journal of Synthetic Chemistry, 2009, 17(2): 140-145. |
| [6] |
汤胜华, 孟艳秋, 蔡伶俐. 熊去氧胆酸化学合成进展[J]. 亚太传统医药, 2008(5): 48-50. TANG S H, MENG Y Q, CAI L L. Progress in the chemical synthesis of ursodeoxycholic acid[J]. Asia-Pacific Traditional Medicine, 2008(5): 48-50. |
| [7] |
袁雪南. 牛胆膏中胆酸的提取并合成鹅去氧胆酸[D]. 天津: 天津科技大学, 2019. YUAN X N. The extraction of cholic acid from Ox-gall Cream and synthesis of chenodeoxycholic acid [D]. Tianjin: University of Science and Technology of Tianjin, 2019. |
| [8] |
HE X L, WANG L T, GU X Z, et al. A facile synthesis of ursodeoxycholic acid and obeticholic acid from cholic acid[J]. Steroids, 2018, 140: 173-178. DOI:10.1016/j.steroids.2018.10.009 |
| [9] |
李新月, 苏芳芳, 蒋超, 等. 中药熊胆资源发展历程与展望[J]. 中国中药杂志, 2022, 47(16): 4284-4291. LI X Y, SU F F, JIANG C, et al. Development history and prospect of Fel Ursi[J]. China Journal of Chinese Materia Medica, 2022, 47(16): 4284-4291. |
| [10] |
柳温曦, 程显隆, 郭晓晗, 等. 牛黄及代用品化学成分、质量控制方法的研究进展[J]. 中国药学杂志, 2019, 54(8): 597-602. LIU W X, CHENG X L, GUO X H, et al. Progress in research on chemical composition and quality control methods of calculus bovis and its substitutes[J]. China Journal of Chinese Materia Medica, 2019, 54(8): 597-602. |
| [11] |
GAO Z G, ROHANI S, GONG J B, et al. Recent developments in the crystallization process: Toward the pharmaceutical industry[J]. Engineering, 2017, 3(3): 343-353. |
| [12] |
KASKIEWICZ P L, ROSBOTTOM I, HAMMOND R B, et al. Understanding and designing tailor-made additives for controlling nucleation: Case study of p-aminobenzoic acid crystallizing from ethanolic solutions[J]. Crystal Growth & Design, 2021, 21(4): 1946-1958. |
| [13] |
XU S J, WANG J K, ZHANG K K, et al. Nucleation behavior of eszopiclone-butyl acetate solutions from metastable zone widths[J]. Chemical Engineering Science, 2016, 155: 248-257. |
| [14] |
LEE S Y, YANG D R, CHANG J W. Design of isosorbide crystallization process as recovery system for poly (ethylene-co-isosorbide) terephthalate production via solubility measurements and crystallization kinetic parameter estimation[J]. Journal of Industrial and Engineering Chemistry, 2020, 92: 191-199. |
| [15] |
ZHANG C T, WANG H R, WANG Y L. Determination of induction period and crystal growth mechanism of ceftriaxone sodium in acetone-water system[J]. Chinese Journal of Antibiotics, 2011, 36(2): 125-128. |
| [16] |
HUANG Z B, SHA J, CHANG Y G, et al. Solubility measurement, model evaluation and Hansen solubility parameter of ipriflavone in three binary solvents[J]. The Journal of Chemical Thermodynamics, 2021, 152: 106285. |
| [17] |
LI M, YANG Z, ZHANG Y, et al. Synthesis, crystal structure, and solubility study of a supramolecular assembly cocrystal formed by levofloxacin and nicotinic acid[J]. Journal of Molecular Structure, 2022, 1249: 131549. |
| [18] |
赵绍磊, 王耀国, 张腾, 等. 制药结晶中的先进过程控制[J]. 化工学报, 2020, 71(2): 459-474. ZHAO S L, WANG Y G, ZHANG T, et al. Advanced process control of pharmaceutical crystallization[J]. CIESC Journal, 2020, 71(2): 459-474. |
| [19] |
WANG Y C, LIN K, JIA W Y, et al. Measurement and correlation of solubility of L-valine, L-isoleucine, L-methionine, and L-threonine in water plus tert-butanol from 283.15 to 328.15 K[J]. Journal of Chemical and Engineering Data, 2021, 66(1): 677-683. |
| [20] |
WANG M F, CAO W Y W. Phase transition and melt-recrystallization behavior of poly (butylene adipate) investigated by simultaneous measurements of wide-angle X-ray diffraction (WAXD) and differential scanning calorimetry (DSC)[J]. Polymers, 2020, 12(1): 75. |
| [21] |
WANG L, SUN J P, HUA Y W, et al. Solubility behaviour and thermodynamic analysis of methyleneaminoacetonitrile in binary (ethanol+ water, ethanol+2-propanol, ethanol+n-butanol) solvents[J]. The Journal of Chemical Thermodynamics, 2019, 138: 272-281. |
| [22] |
ZHANG X, SONG L C, ZHAO D Y, et al. Measurement and correlation of solubility of carbendazim in lower alcohols[J]. Thermochimica Acta, 2018, 659: 172-175. |
| [23] |
HU X R, TIAN Y N, CAO Z D, et al. Solubility measurement, Hansen solubility parameter and thermodynamic modeling of etodolac in four binary solvents from 278.15K to 323.15 K[J]. Journal of Molecular Liquids, 2020, 318: 114155. |
| [24] |
WAN Y M, HE H X, ZHANG P S, et al. Solid-liquid equilibrium solubility and thermodynamic properties of cis-5-norbornene- endo-2, 3-dicarboxylic anhydride in fourteen pure solvents and three binary solvents at various temperatures[J]. Journal of Molecular Liquids, 2019, 297(C): 111396. |
| [25] |
史小帅, 乐清华, 方永明, 等. 溶析结晶法提纯龙脑的热力学研究[J]. 化学工程, 2016, 44(3): 30-35. SHI X S, LE Q H, FANG Y M, et al. Thermodynamic properties of borneol with anti-solvent crystallization[J]. Chemical Engineering (China), 2016, 44(3): 30-35. |
| [26] |
樊冰洁. 三种萘甲酸类物质的二元及三元体系固液相平衡研究[D]. 北京: 北京化工大学, 2019. FAN B J. Research on solid-liquid phase equilibrium of naphthoic acid derivatives in binary and ternary systems [D]. Beijing: Beijing University of Chemical Technology, 2019. |
| [27] |
时燕. 盐酸阿米替林结晶过程研究[D]. 北京: 北京化工大学, 2021. SHI Y. Study on the crystallization process of amitriptyline hydrochloride [D]. Beijing: Beijing University of Chemical Technology, 2021. |
| [28] |
周亚男. L-肌肽结晶过程及晶体形态调控研究[D]. 天津: 天津大学, 2019. ZHOU Y N. A study on crystallization process and crystal morphology control of L-carnosine [D]. Tianjin: Tianjin University, 2019. |
| [29] |
谢浩东, 徐可凡, 于亚楠, 等. 费托蜡在五种有机溶剂中的溶解度测定及关联[J]. 高校化学工程学报, 2022, 36(1): 28-35. XIE H D, XU K F, YU Y N, et al. Determination and correlation of the solubility of Fischer-Tropsch wax in five different organic solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 28-35. DOI:10.3969/j.issn.1003-9015.2022.01.004 |
| [30] |
张鹏帅. 盐酸左旋咪唑溶析结晶基础研究[D]. 郑州: 郑州大学, 2020. ZHANG P S. Basic research on dilution crystallization of levamisole hydrochloride [D]. Zhengzhou: Zhengzhou University, 2020. |




