甘草是豆科植物甘草(Glycyrrhiza uralensis)的干燥根及根茎,常做佐使药入多种中药复方。其味甘性平,归肺、心、胃、脾经并具有补脾益气、祛痰止咳、清热解毒、缓急止痛、调和诸方等功能,在临床中的应用极为广泛。其主要成分甘草酸(glycyrrhizic acid)在甘草根茎中含量达 3.63%~13.06%,具有镇咳,抗炎,抗癌,抗病毒,提高免疫功能等药理作用[1~5]。甘草酸的传统提取分离方法包括水提、醇提或超声提取[6, 7],进而利用树脂吸附[8, 9]进行纯化,此工艺分离效果好,但缺点是分离成本高。泡沫分离技术因其效率高、成本低和无污染等优点[10],在降低中药有效成分分离成本方面具有极大的潜力。由于甘草酸属于皂苷类成分,是一种天然的表面活性物质,目前已有研究通过泡沫分离技术对甘草酸进行富集,但其富集比多在 3 左右[11~13],富集效果仍有待提高。麻黄(Ephedra sinica Stapf)为麻黄科植物的茎,主要含有麻黄碱、伪麻黄碱、甲基麻黄碱等多种成分。麻黄碱具有松弛支气管平滑肌、平喘等药理作用[14],常在临床中与甘草一同入药使用,即配伍使用[15]。在中药的临床使用中,经常通过药物配伍达到增强疗效、扩大治疗范围以及减少不良反应等用药目的。目前,关于配伍药物的研究主要集中在调整剂量、改善药效等方面,对于利用药物配伍提高有效成分泡沫分离效果的研究尚未见报道。因此,通过药物配伍提高有效成分的富集效果将有效地简化后续纯化过程进而提高纯化效果,所以利用药物配伍提高有效成分泡沫分离效果将对拓展泡沫分离技术在中药有效成分分离中的应用有重要的意义。
为了提高泡沫分离甘草酸的分离效果,本文开发了将甘草麻黄配伍合煎所得提取液作为泡沫分离初始原料液进行泡沫分离甘草酸的工艺。在研究麻黄对甘草酸和甘草苷浓度随时间变化影响的基础上,以甘草酸的富集比和回收率为评价指标,研究温度、气体体积流量、甘草酸初始浓度和甘草麻黄质量配比对甘草酸分离效果的影响。
2 实 验 2.1 实验试剂甘草和麻黄均购于北京同仁堂天津药店。甘草酸标准品和甘草苷标准品均购于上海晶纯生化科技有限公司。其他实验试剂均购于天津康科德科技有限公司。
2.2 实验仪器752紫外光栅分光光度计,上海精密科学仪器有限公司;AC0-318型电磁式空气压缩机,广东海利集团有限公司;LZB-3WB型玻璃转子流量计,天津河东五环仪表厂;CS501型超级恒温器,上海实验仪器厂有限公司;GB11A型高效液相色谱仪,安捷伦科技有限公司; JYW-200B型自动界面张力仪,承德试验机责任有限公司;DFA100型泡沫分析仪,德国克吕士公司。
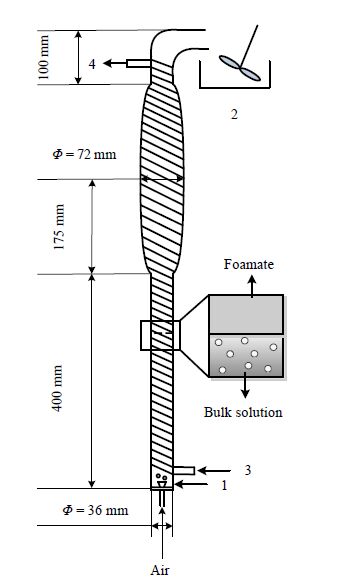
2.3 实验装置实验装置如图 1 所示。全塔高 850 mm,入口处内径 36 mm,椭球部分出现在 400 ~ 750 mm 处,中心处内径 72 mm,由玻璃制成。塔底部安装有多孔聚乙烯膜气体分布器,孔径0.425 mm。压缩空气由鼓泡口引入,通过气体分布器分散成气泡。随着泡沫的上升,泡沫间隙的液体会由于泡沫排液重新回流至主体液中,泡沫自塔顶流出,收集于消泡器中。分离塔外部紧紧缠绕硅胶管,硅胶管与超级恒温器相连接以控制塔内温度。温度监测的温度计附在柱上。所有的泡沫分离实验是在批处理模式下进行。
|
图 1 实验装置示意图 Fig.1 Schematic diagram of the experimental process 1. gas distributor 2. container 3. inlet of circulating water 4. outlet of circulating water |
采用DiamonsilTM C18 (250 mm×4.6 mm,5 μm) 色谱柱,以0.1%(V)磷酸水溶液/乙腈 (63:37) 为流动相,在检测波长为250 nm、柱温为35℃、流量为1.0 mL⋅min-1条件下进行甘草酸的浓度测定,并制作标准曲线,经线性拟合后得:A1 = 15500C1+113.2,R2 = 0.9995,线性范围为:0.24~1.23 g⋅L-1,A1为吸光值,C1 (g⋅L-1)为甘草酸溶液的浓度。将甘草酸标准品、甘草单煎液和麻黄单煎液在上述检测条件下进行对比,发现麻黄的加入不影响甘草酸浓度的测定。
2.5 甘草苷浓度的测量采用上述色谱柱,以0.5%(V)磷酸水溶液/乙腈 (83:17) 为流动相,在检测波长为276 nm、柱温为35℃、流量为1.0 mL⋅min-1条件下进行甘草苷的浓度测定,并制作标准曲线,经线性拟合后得:A2 = 38561C2+90.6,R2 = 0.9995,线性范围为:0.076~0.38 g⋅L-1,A2为吸光值,C2 (g⋅L-1)为甘草苷溶液的浓度。将甘草苷标准品、甘草单煎液和麻黄单煎液在上述检测 条件下进行对比,发现麻黄的加入不影响甘草苷浓度的测定。
2.6 甘草酸水溶液表面张力、起泡高度和泡沫半衰期的测量移取50 mL 甘草酸和甘草苷标准品混合水溶液于样品槽中,在甘草酸浓度0.3 g⋅L-1和温度40℃的条件下,通过自动界面张力仪分别测定不同甘草苷浓度的混合水溶液的表面张力。在上述实验条件和气体体积流量100 mL⋅min-1条件下,移取50 mL甘草酸和甘草苷标准品混合水溶液于样品槽中,调节鼓气时间为 15 s,通过泡沫分析仪分别测定其泡沫高度和泡 沫半衰期。
本实验以泡沫高度来表征甘草麻黄合煎液的起泡性,以泡沫半衰期表征其泡沫的稳定性。取一定量甘草酸和甘草苷混合水溶液于样品槽中,通过泡沫分析仪分别测定混合水溶液的泡沫高度和泡沫半衰期。
2.7 泡沫分离效果的评价指标在甘草酸泡沫分离效率由富集比Eg和回收率Rg(%)两个参数进行评价,其定义如下:
| ${{E}_{g}}=\frac{{{C}_{gf}}}{{{C}_{g0}}}$ | (1) |
| ${R_g} = \frac{{{V_{gf}}{C_{gf}}}}{{{V_{g0}}{C_{g0}}}} \times 100\% $ | (2) |
其中,Cg0和Cgf分别为原料液和消泡液中甘草酸的浓度,g⋅L-1;Vg0和Vgf分别为原料液和消泡液的体积,L。
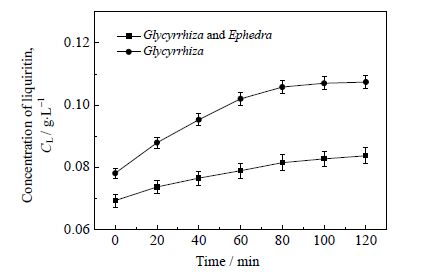
3 结果和讨论 3.1 麻黄对甘草中甘草苷浓度随时间变化的影响实验条件为甘草酸初始浓度0.2 g⋅L-1、提取温度80℃、甘草麻黄合煎质量配比5:3、提取溶剂体积200 mL,取此条件下同等质量的甘草,在甘草一次单煎与甘草麻黄一次合煎过程中,每20 min取一次样,检测甘草苷的浓度,绘制甘草苷浓度随时间变化曲线。麻黄对甘草中甘草苷浓度随时间变化的影响如图 2 所示。
|
图 2 甘草一次单煎与甘草麻黄一次合煎甘草苷 浓度随时间的变化 Fig.2 Liquiritin concentration as a function of time in the leaching solutions of Glycyrrhiza and Glycyrrhiza-Ephedra mixture |
图 2 结果表明,甘草单煎液中甘草苷的浓度在 80 min时基本达到平衡,而甘草麻黄合煎液中甘草苷的浓度较甘草单煎明显下降,降低了22.1%。这是由于甘草中的甘草苷与麻黄中生物碱类成分在合煎过程中发生了化学反应生成沉淀,从而导致甘草麻黄合煎液中甘草苷浓度较甘草单煎液低,此实验结果与孟翔宇等[15]所得结论相一致。
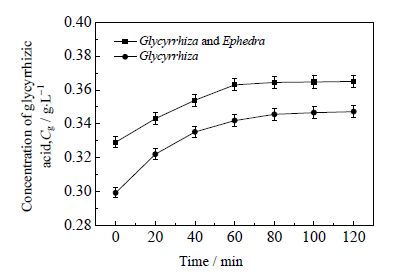
3.2 麻黄对甘草中甘草酸释放的影响按上述相同实验条件检测甘草酸的浓度,绘制甘草酸随时间变化曲线。麻黄对甘草中甘草酸浓度随时间变化的影响如图 3 所示。
|
图 3 甘草一次单煎与甘草麻黄一次合煎 甘草酸浓度随时间的变化 Fig.3 Glycyrrhizic acid concentration as a function of time in the leaching solutions of Glycyrrhiza and Glycyrrhiza-Ephedra mixture |
图 3 结果表明,甘草单煎液与甘草麻黄合煎液在提取过程中甘草酸浓度变化的趋势基本相同,甘草单煎过程中甘草酸的浓度在80 min时基本达到平衡,而甘草麻黄合煎过程中甘草酸的浓度在60 min时基本达到平衡,且其浓度较甘草单煎有所提高。甘草中甘草酸与麻黄中生物碱类成分发生酸碱反应,促进了甘草酸的释放,从而导致甘草麻黄合煎液中甘草酸的浓度与甘草单煎相比有所提高[16]。
3.3 甘草苷对甘草酸水溶液表面张力、起泡高度和泡沫半衰期的影响研究不同甘草苷浓度对甘草酸水溶液表面张力的影响,在甘草酸浓度0.3 g⋅L-1和温度40℃条件下进行,甘草苷浓度分别为0.1、0.2、0.3、0.4、0.5 g⋅L-1。研究不同甘草苷浓度对甘草酸水溶液起泡高度和泡沫半衰期的影响,在甘草酸浓度0.3 g⋅L-1、温度40℃和气体体积流量100 mL⋅min-1条件下进行,甘草苷浓度0.1~0.5 g⋅L-1。结果如表 1 所示。
| 表 1 甘草苷对甘草酸水溶液泡沫性能的影响 Table 1 Effects of liquiritin on foam properties of glycyrrhizic acid solutions |
由表 1可知,随着甘草苷浓度的升高,甘草酸水溶液的表面张力逐渐降低,其起泡高度和泡沫半衰期逐渐升高。这是由于随着甘草苷浓度的增加,溶液的粘度也随之增加,从而降低了泡沫的排液速率,提高了泡沫的稳定性,因此,在泡沫分离甘草酸过程中甘草苷可起到稳泡的作用。由此可知,由于甘草麻黄配伍使得提取液中甘草苷的浓度降低,泡沫的稳定性降低,从而强化了泡沫的排液效果。
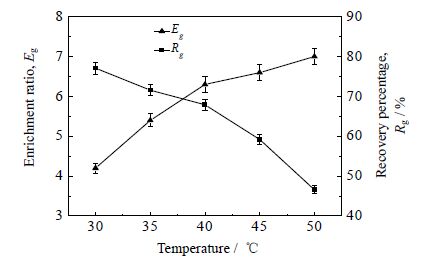
3.4 温度对泡沫分离效果的影响提高温度是促进泡沫排液的有效方法[17]。在气体体积流量200 mL⋅min-1、甘草麻黄质量配比5:3、甘草酸的初始浓度0.3 g⋅L-1条件下,研究不同温度对泡沫分离效果的影响。温度为30~50℃。结果如图 4 所示。
|
图 4 温度对泡沫分离效果的影响 Fig.4 Effects of temperature on foam fractionation |
图 4 结果表明,随着温度的升高,泡沫分离甘草酸的富集比由4.2 升高至7,而其回收率由77.1%降低至46.6%。温度较低时,提取液的黏度较大,泡沫间隙夜由上向下排液遇到的阻力较大,不易返回至液相主体,此时泡沫持液量高,泡沫稳定不易破碎,导致泡沫由塔顶流出时携带大量液体,消泡液中甘草酸的浓度降低,因此获得的富集比较低,但回收率较高。随着温度的升高,提取液黏度随之降低,气泡在上升过程中的阻力减小,泡沫排液得到了强化,泡沫液膜变薄,泡沫变干,其稳定性降低,容易发生聚并和破裂,从而使间隙液返回至液相主体,最终导致甘草酸的回收率下降,但富集比升高。综合考虑,40℃为最适操作温度。
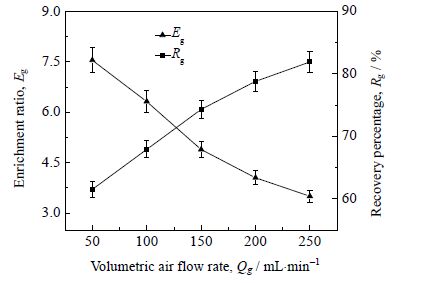
3.5 气体体积流量对泡沫分离效果的影响气体体积流量会显著影响泡沫分离过程中的界面吸附和泡沫排液[18]。研究不同气体体积流量对泡沫分离效果的影响,在温度40℃、甘草麻黄质量配比5:3、甘草酸的初始浓度0.3 g⋅L-1条件下进行。气体体积流量50~250 mL⋅min-1。结果如图 5 所示。
|
图 5 气体体积流量对泡沫分离效果的影响 Fig.5 Effects of volumetric air flow rate on foam fractionation |
图 5 结果表明,随着气体体积流量由 50 mL⋅min-1升高到 250 mL⋅min-1,泡沫分离甘草酸的回收率由 61.5% 升高至 81.9%,而其富集比由 7.55 降低至3.50。在泡沫相中,泡沫沿着分离塔的轴向自下而上运动,而泡沫间的夹带液由上向下流动,当气体体积流量较低时,泡沫在分离设备中的停留时间较长,泡沫排液比较充分,随泡沫一起收集到的夹带液较少,因此获得的甘草酸的富集比较高。气体体积流量增加,形成较大的推动力促进泡沫向上运动,同时产生的泡沫量也随之增加,泡沫在分离塔中的停留时间减少,泡沫排液减弱,大量的间隙液随泡沫一起流出塔顶,因此获得的消泡液的体积增加,甘草酸的回收率升高,但富集比降低。综合考虑,100 mL⋅min-1为最适气体体积流量。
3.6 甘草麻黄质量配比对泡沫分离效果的影响在温度40℃、气体体积流量100 mL⋅min-1、甘草酸的初始浓度0.3 g⋅L-1条件下,研究不同甘草麻黄质量配比对泡沫分离效果的影响。甘草麻黄质量配比范围为5:1至5:5。结果如图 6 所示。
图 6 结果表明,随着麻黄加入量的增加,泡沫分离甘草酸的富集比由 4.63 升高至 7.06,而其回收率由 78.3% 降低至 41.6%。麻黄的加入量逐渐增多,提取液中甘草苷的含量逐渐降低,泡沫的稳定性逐渐减弱;同时提取液中甘草酸的含量随麻黄加入量的增加而增加,致使提取液的起泡性增强。在两方面因素同时作用下,甘草苷稳泡作用的减弱对甘草酸泡沫分离效果的影响更加明显,因此,甘草酸的富集比随甘草麻黄质量配比的降低而升高,而甘草酸的回收率随之下降。综上所述,5:3为最适甘草麻黄质量配比,并且这一配比在临床药物应用配伍范围内[19],可以为后续的工艺优化提供依据。
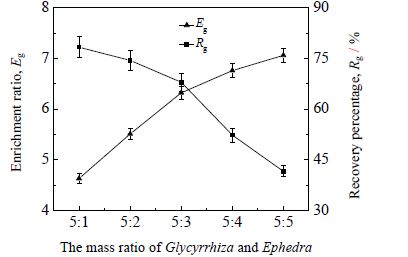
|
图 6 甘草麻黄质量配比对泡沫分离效果的影响 Fig.6 Effects of mass ratio of |
原料液浓度是影响泡沫分离性能的重要参数[20]。在温度40℃、气体体积流量100 mL⋅min-1、甘草麻黄质量配比5:3条件下,研究不同甘草酸初始浓度对泡沫分离效果的影响。甘草酸初始浓度0.1 ~0.5 g⋅L-1。结果如图 7 所示。
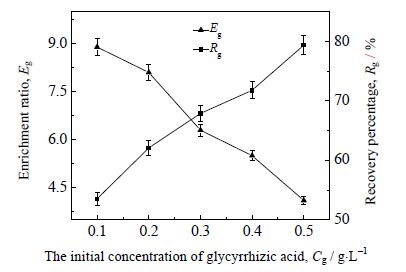
|
图 7 甘草酸初始浓度对泡沫分离效果的影响 Fig.7 Effects of initial concentration of glycyrrhizic acid on foam fractionation |
图 7 结果表明,随着甘草酸初始浓度的增加,泡沫分离甘草酸的富集比由 8.9 降低至 4.1,而其回收率由 53.5% 升高至 79.4%。表面活性物质的初始浓度过低所形成的泡沫不稳定,容易聚集并破碎,致使泡沫夹带液回到主体液相中,从而导致甘草酸的回收率减少;但是泡沫间隙液的减少导致泡沫液膜变薄,收集到的泡沫变干,因此获得的甘草酸的富集比升高。随着溶液初始浓度的增加,溶液的表面张力下降,表面活性物质在气-液界面上的吸附增强,泡沫的稳定性增强,泡沫排液困难,因此,获得的甘草酸回收率升高,但由于泡沫夹带液增多,泡沫液膜变厚,泡沫变湿,最终获得的甘草酸的富集比降低。综合考虑,本研究选择0.2 g⋅L-1为最适甘草酸初始浓度。
4 结 论本文开发了甘草麻黄配伍泡沫分离工艺,甘草麻黄配伍提高了甘草酸在浸提液中的浓度,降低浸提液的表面张力,进而提高了浸提液的起泡性能。同时,甘草麻黄配伍降低了甘草酸泡沫的稳定性,能有效降低泡沫的含水量,因而甘草麻黄配伍能有效提高甘草酸的泡沫分离效果。在甘草酸初始浓度 0.2 g⋅L-1,甘草麻黄质量配比5:3,温度40℃,气体体积流量100 mL×mim-1条件下,甘草酸的富集比和回收率分别为 8.34和 62.5%。而在相同实验条件下,单独泡沫分离甘草中甘草酸的富集比和回收率分别为3.73和59.6%,由此可见,麻黄的引入有效地提高了泡沫分离甘草酸的分离效果。此外,将甘草酸标准品和甘草麻黄配伍泡沫分离甘草酸所得消泡液进行红外光谱分析,结果表明,甘草麻黄配伍泡沫分离得到的甘草酸的纯化程度较高。
符号说明:
| 表 Table |
| [1] | Pompei R, Flore O, Marccialis M A . Glycyrrhizic acid inhibits virus growth and inactivates virus particles[J]. Nature , 1979, 281 (5733) : 689-690 DOI:10.1038/281689a0 |
| [2] | Hoever G, Baltina L, Michaelis M . Antiviral activity of glycyrrhizic acid derivatives against SARS-coronavirus[J]. Journal of Medicinal Chemistry , 2005, 48 (4) : 1256-1259 DOI:10.1021/jm0493008 |
| [3] | Lin J C . Mechanism of action of glycyrrhizic acid in inhibition of Epstein-Barr virus replication in vitro[J]. Antiviral Research , 2003, 59 (1) : 41-47 DOI:10.1016/S0166-3542(03)00030-5 |
| [4] | Lampis G, Deidda D, Pinza M . Enhancement of anti-herpetic activity of glycyrrhizic acid by physiological proteins[J]. Antiviral Chemistry and Chemotherapy , 2001, 12 (2) : 125-131 DOI:10.1177/095632020101200206 |
| [5] | Crance J M, Scaramozzino N, Jouan A . Interferon, ribavirin, 6-azauridine and glycyrrhizin:antiviral compounds active against pathogenic flaviviruses[J]. Antiviral Research , 2003, 58 (1) : 73-79 DOI:10.1016/S0166-3542(02)00185-7 |
| [6] | Shen S, Chang Z, Liu J . Separation of glycyrrhizic acid and liquiritin from Glycyrrhiza uralensis Fisch extract by three-liquid-phase extraction systems[J]. Separation and Purification Technology , 2007, 53 (3) : 216-223 DOI:10.1016/j.seppur.2006.07.003 |
| [7] | Tian M, Yan H, Row K H . Extraction of glycyrrhizic acid and glabridin from licorice[J]. International Journal of Molecular Sciences , 2008, 9 (4) : 571-577 DOI:10.3390/ijms9040571 |
| [8] | Fu B, Liu J, Li H . The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid[J]. Journal of Chromatography A , 2005, 1089 (1) : 18-24 |
| [9] | Charpe T W, Rathod V K . Separation of glycyrrhizic acid from licorice root extract using macroporous resin[J]. Food and Bioproducts Processing , 2015, 93 : 51-57 DOI:10.1016/j.fbp.2013.11.002 |
| [10] | ZHANG Zhe(张哲), WU Zhao-liang(吴兆亮), LONG Yan(龙延) . Enhancement of interfacial adsorption of SDS in foam separation columns with vertical sieve tray internal(垂直筛板构件强化SDS在泡沫分离液相吸附的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29 (3) : 538-543 |
| [11] | Ma J G, Xiu Z L, Zhang D J . Concentration and separation of glycyrrhizic acid by foam separation[J]. Journal of Chemical Technology and Biotechnology , 2002, 77 (6) : 720-724 DOI:10.1002/(ISSN)1097-4660 |
| [12] | LAN Jie(兰洁), YANG Ming(杨明), HAN Li(韩丽) . Comparison between foam fractionation and conventional processing crafts for glycyrrhizic acid inclusion compound(泡沫分离法与常规方法制备甘草酸粗品的比较)[J]. West China Journal of Pharmaceutical Sciences(华西药学杂志) , 2002, 22 (1) : 025-027 |
| [13] | SU Yan-tao(苏艳桃), HAN Li(韩丽), MA Hong-yan(马鸿雁) . Separation of glycyrrhizic acid by intermittence foam fractionation(间歇式泡沫分离提取甘草中甘草酸的工艺研究)[J]. Chinese Traditional and Herbal Drugs(中草药) , 2007, 38 (3) : 365-368 |
| [14] | Blanc P D, Kuschner W G, Katz P P . Use of herbal products, coffee or black tea, and over-the-counter medications as self-treatments among adults with asthma[J]. Journal of Allergy and Clinical Immunology , 1997, 100 (6) : 789-791 DOI:10.1016/S0091-6749(97)70275-6 |
| [15] | ZHAO Jie (赵杰). Basic reseach on the composition rules of Ephedra sinica herbal pairs—Ephedra sinica-Glycyrrhiza uralensis herbal pair (I) (麻黄类药对组成规律的基础研究——麻黄-甘草药对(I)) [D]. Guangzhou(广州): Southern Medical University (南方医科大学), 2012. |
| [16] | MENG Xiang-yu(孟翔宇), PI Zi-feng(皮子凤), SONG Feng-rui(宋凤瑞) . Changes in the effective compounds and the anti-inflammatory activity before and after the decoction of ephedra and liquorite(麻黄-甘草药对配伍前后主要药效成分及抗炎活性的变化)[J]. Chinese Journal of Applied Chemistry(应用化学) , 2009, 26 (7) : 801-806 |
| [17] | ZHANG Yan-xia(张艳霞), WU Zhao-liang(吴兆亮), WU Zeng-jiang(武增江) . Effects of temperature on foam stability and separation efficiencies of foam formed by high concentration SDS aqueous solution during foam separation(温度对高浓度SDS水溶液泡沫稳定性及分离的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26 (3) : 536-540 |
| [18] | Boonyasuwat S, Chavadej S, Malakul P . Surfactant recovery from water using a multistage foam fractionator:Part I. Effects of air flow rate, foam height, feed flow rate and number of stages[J]. Separation Science and Technology , 2005, 40 (9) : 1835-1853 DOI:10.1081/SS-200064595 |
| [19] | HUANG Ying-jie (黄英杰). Reseach on the dosage of prescriptions and ralated issues of <Shang Han Lun> (《伤寒论》用药剂量及其相关问题的研究) [D]. Beijing(北京): Beijing University of Chinese Medicine (北京中医药大学), 2007. |
| [20] | Chen Y C, Parlar H . Enrichment behavior of immunoglobulin by foam fractionation using response surface methodology[J]. Separation and Purification Technology , 2013, 107 : 102-108 DOI:10.1016/j.seppur.2013.01.026 |




