2. 江苏苏美达集团有限公司,江苏 南京 210018
2. Jiangsu Sumec Group Corporation, Nanjing 210018, China
新一代锂离子二次电池,具有比能量密度大、开路电压高、自放电小、无污染等突出优势,被广泛应用于新能源汽车、储能设备、能源、电子设备、军事等领域[1, 2]。然而传统的锂离子电池正极材料,如LiCoO2,LiFePO4,LiMn2O4和LiNi1/3Co1/3Mn1/3O2等,由于其自身放电比容量较低,且与负极材料的比容量差距大,无法满足高容量、高能量密度电子产品的需求[3~6]。因此,寻找一种价格低廉、且具有高比容量的新型正极材料已成为当前的一大研究热点。近年来,研究人员发现富锂锰基正极材料xLi2MnO3·(1-x)LiMO2(M=Mn、Ni、Co),即Li[LixM1-x]O2的实际可利用比容量超过250 mAh·g-1,是未来电动汽车,混合动力汽车的电池正极的重要候选材料[7]。但是,随着对该材料的进一步深入研究,检测到该材料存在首次不可逆容量损失大,高倍率性能差,放电比容量衰减快等问题,这些都严重阻碍了其广泛应用[8, 9]。
为了解决上述问题,科研人员经过大量实验研究发现,对该材料进行表面包覆其他有效材料能切实改性富锂锰基正极材料的电化学综合性能。这类包覆材料就像保护层,不仅可以抑制正极活性材料与电解液之间的副反应,还能缓解在高工作电压下正极材料的结构转变,从而达到电化学性能改进的目的。根据现有文献报道,应用最广泛的包覆材料包括单质碳,金属氧化物(Al2O3,CeO2),金属氟化物(MgF2,CeF3)和磷酸盐系列(AlPO4,Li3PO4)等[10~16]。然而,这些包覆材料都是呈非电化学活性,会直接降低正极材料的重量能量密度。
近来,一种新型的包覆方案被提出,就是在正极材料表面包覆另外一种也具有电化学活性的材料。目前已有MoO3 [17], FePO4[18]作为该类包覆材料,在作为富锂锰基正极材料保护层的同时,还能与Li+反应,释放出额外的放电容量。FeF3作为锂离子电池正极材料,在1.5~4.5 V,其理论比容量高达712 mAh·g-1。Fe3+与Li+在充放电过程中,发生的化学反应如下[19]:
| ${\rm{Fe}}{{\rm{F}}_3} + 3{\rm{L}}{{\rm{i}}^ + } + 3{\rm{e}} \to {\rm{Fe}} + 3{\rm{LiF}}$ |
另外,其反应产物纳米Fe原子和LiF粘附在正极材料表面形成一层保护膜,以此来抑制电解液对正极材料的侵蚀,提高循环稳定性[20]。
目前关于FeF3包覆富锂锰基正极材料的报道很少。鉴于此,本文采取上述新型的包覆方案,选取Li[Li0.2Mn0.54Ni0.13Co0.13]O2(简写:LMNCO)作为富锂锰基正极材料代表,以FeF3作为包覆材料,系统地研究了FeF3表面包覆LMNCO后,对其形貌,结构及电化学性能的影响。
2 实验 2.1 样品制备采用工业上典型的共沉淀法合成[Mn0.54Ni0.13Co0.13](CO3)0.8前驱体,然后将其与LiOH·H2O经过两步烧结后,获得LMNCO正极材料。首先将一定计量比的MnSO4·H2O、NiSO4·6H2O和CoSO4·7H2O配制成金属离子总浓度为1 mol·L-1的混合溶液,然后与含有适当浓度NH3·H2O的Na2CO3溶液一起缓慢滴入不断搅拌的反应釜中。在整个反应过程中,控制溶液的pH为8.0,温度为60℃,搅拌速度为800 r·min-1。待金属离子共沉淀反应完成后,持续搅拌12 h。得到的[Mn0.54Ni0.13Co0.13](CO3)0.8前驱体经过滤、洗涤、烘干后,再与过量5%(wt)的LiOH·H2O混合、研磨。最后在空气气氛中500℃的管式炉中预烧5 h、950℃焙烧12 h,冷却至室温即可得到LMNCO材料。
采用典型的湿化学法来制备FeF3包覆Li[Li0.2Mn0.54Ni0.13Co0.13]O2样品,FeF3包覆量为2%(wt)。首先将上述适量的Li[Li0.2Mn0.54Ni0.13Co0.13]O2材料搅拌分散在去离子水中,然后将一定计量比的NH4F和Fe(NO3)3·9H2O搅拌溶解到上述悬浮液中。通过滴加NH3·H2O来控制整个反应液体系的pH值在9.0。整个反应体系置于80℃的水浴锅内,持续搅拌直到溶液蒸干。将得到的混合物研磨均匀后置于管式炉中, 在空气气氛下400℃烧结4 h,冷却至室温即可得到2%(wt) FeF3包覆的Li[Li0.2Mn0.54Ni0.13Co0.13]O2材料(简写为FeF3@ LMNCO)。
2.2 形貌测试采用Rigaku UltimaIV-185型X射线衍射仪对样品进行XRD分析。使用Cu靶,Kα射线,电压设为40 kV,电流为40 mA,扫描速度2°·min-1,步长0.02,扫描范围(2θ)为10°~80°。采用JEOL JSM-7001F型场发射扫描电镜(FESEM)对合成的样品的表面形貌、颗粒大小和分布进行观察。并采用配套能谱(EDS)定量分析2%(wt) FeF3@LMNCO材料的元素组成部分。采用透射电镜(JEOL JEM 2010) 对FeF3包覆前后的LMNCO颗粒进行观察分析。
2.3 电化学性能测试以N-甲基吡咯烷酮(NMP)为溶剂,将正极活性材料、导电剂乙炔黑、粘结剂(PVDF)以80:10:10的质量比制成混合浆料,均匀涂在铝箔上,形成厚度约为20 μm的涂层。将铝箔涂层在100℃真空烘箱中干燥10 h后,用切片机切割成直径12 mm的圆片,即得到实验所需的正极片。然后以金属锂片为对电极,以1 mol·L-1的LiPF6/EC-EMC (体积比1:1) 为电解液,以Celgard2300聚丙烯多孔膜为隔膜,在手套箱内组装成CR2025型扣式半电池。采用LAND CT2001A电池测试系统对电池进行充放电测试,电流密度以1C=250 mA·g-1计算,温度为25℃。其中首次充放电测试电压区间为2.0~4.8 V,而在循环性能和倍率性能测试中为了减缓电解液的分解,将截止电压降到2.0~4.6 V。采用CHI660D型电化学工作站进行电化学交流阻抗测试,加载交流信号的振幅为5 mV,扫描频率0.01 Hz~100 kHz。
2.4 数据分析处理为了保证实验结果的科学性和准确性,原始LMNCO和LaF3-LMNCO两个试样分别组装成10个电池来进行电化学性能检测。并且采用平均容量和系统误差来综合评价容量数据的准确性,采用Grubbs标准剔除容量异常值。系统误差由以下公式计算:
| $G = \frac{{\left| {{X_i} - \bar X} \right|}}{S}$ | (1) |
| $\sigma = \sqrt {\frac{{n\sum\limits_{i = 1}^n {x_i^2} - {{\left( {\sum\nolimits_{i = 1}^n {{x_i}} } \right)}^2}}}{{n\left( {n - 1} \right)}}} $ | (2) |
其中,σ,Xi,X和n分别代表标准偏差,第i个数据点,所有Xi的平均值和数据点个数总和。由公式(1) 和(2),可以计算出一系列G值。特别的,当G值比tn(α)值(α是置信度,此处α = 1-0.95,并且tn(α)值在参考书中查阅)大时,该数据点必须剔除。然后,其分析结果可以由公式(3) 计算得到:
| $\bar X \pm \frac{\sigma }{{\sqrt n }}$ | (3) |
为了尊重数据的真实性,10组实验测试结果中与上述公式(3) 分析计算最为接近的一组数据,被选为最终电化学性能测试结果,并在下述工作中列出。
3 结果与讨论图 1是FeF3包覆前后的Li[Li0.2Mn0.54Ni0.13Co0.13]O2试样的XRD图谱。图中衍射强度明显的衍射峰,表明两个试样均具有典型层状α-NaFeO2结构,属于六方晶系,R-3m空间群。出现在20°~25°区间内的较低峰值的衍射峰是Li2MnO3的特征峰,是由过渡金属层Li、Mn的超晶格有序排列引起,归属于空间群为C2/m的单斜晶胞结构[10]。XRD图谱中相邻(006)/(012) 和(018)/(110) 两对衍射峰分裂明显,表明合成的样品都具有很好的有序二维层状结构,且结晶性良好[21]。另外,FeF3包覆前后,两个试样的所有特征衍射峰基本一致,而且没有检测到FeF3衍射峰的存在,这可能是所合成的FeF3呈非晶态,或是FeF3包覆量少[20]。表 1为列出了FeF3包覆前后的Li[Li0.2Mn0.54Ni0.13Co0.13]O2试样的晶格结构参数和(003) 与(104) 衍射峰的强度比。表中,c/a比值表示试样的层状结构稳定性,Ⅰ(003)/Ⅰ(104)峰强比值象征着金属阳离子混排情况[14]。两个样品的c/a值均大于4.9(理想的二维层状结构),Ⅰ(003)/Ⅰ(104)大于1.2(理想的金属离子混排度),说明所合成的试样的结构完好,阳离子混排度低。
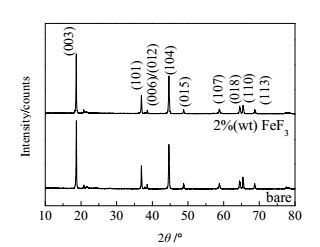
|
图 1 FeF3包覆前后的Li[Li0.2Mn0.54Ni0.13Co0.13]O2试样的XRD图谱 Fig.1 XRD patterns of Li[Li0.2Mn0.54Ni0.13Co0.13]O2 samples before and after FeF3 surface modification |
| 表 1 包覆前后的Li[Li0.2Mn0.54Ni0.13Co0.13]O2试样的晶格结构参数和(003) 与(104) 衍射峰的强度比 Table 1 Ⅰ(003)/Ⅰ(104) values and lattice parameters of raw and FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 |
正极材料Li[Li0.2Mn0.54Ni0.13Co0.13]O2以及FeF3包覆后颗粒的扫描电镜(SEM)如图 2所示。两个样品都表现为类球形状二次颗粒,大小在2~5 μm,是由紧密团聚的一次颗粒组成。同时,SEM图中也检测到一些独立,未团聚的一次颗粒。相比于原始LMNCO颗粒,经过FeF3包覆后的颗粒表面显得粗糙,不光滑,同时有很多细小颗粒附着,这可能是FeF3包覆材料。图 2(c)是2%(wt) FeF3@ LMNCO样品的EDS图谱,图中明显可以观察到Fe和F峰的存在,说明经过FeF3包覆后的材料,的确存在Fe和F元素。为了进一步分析FeF3包覆后对材料Li[Li0.2Mn0.54Ni0.13Co0.13]O2的形貌影响,如图 3所示为两个样品的透射电镜(TEM)。在图 3(a)中,原始LMNCO颗粒表面光滑,而图 3(b)中颗粒表面粗糙,被5~20 nm的FeF3涂层包覆。另外2%(wt) FeF3@ LMNCO样品的高倍率透射电镜如图 3(c)所示,在活性正极材料里面,可以清晰地观察到许多方向一致的晶格条纹排列在一起,而在FeF3包覆层并没有任何晶格条纹。说明所合成的FeF3呈非晶态。

|
图 2 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的SEM图 Fig.2 SEM micrographs of (a) raw and (b) FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2; (c) EDS spectra of FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 |

|
图 3 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的TEM图 Fig.3 TEM micrographs of (a) Li[Li0.2Mn0.54Ni0.13Co0.13]O2 and (b) FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2; (c) HRTEM image of FeF3-coated Li [Li0.2Mn0.54Ni0.13Co0.13]O2 |
图 4为Li[Li0.2Mn0.54Ni0.13Co0.13]O2材料包覆前后的首次充放电曲线。在首次充电过程中,所有样品的曲线都表现出两个特征部分:低于4.5 V的电压上升区域和4.5 V的平台区域,对应于锂离子分别从LiMO2和Li2MnO2组分中脱出。在充电电压上升区域,LiMO2主相中的Ni2+氧化成Ni4+,Co3+氧化成Co4+,这与传统的三元层状正极材料的脱嵌锂机理一致[22]。当充电电压处于4.5 V平台区域时,Li2MnO3组分脱出Li+,同时锂层两侧的O也同时脱出,最后以Li2O的形式从Li2MnO3相中不可逆脱离,对应着的Li2MnO3形成MnO2。在随后的放电过程中,从Li2MnO3脱出的Li2O无法嵌回到正极材料中,因而与充电容量存在一个损失值,即不可逆容量损失[12]。表 2列出的是两个样品在0.1C倍率下的初次充放电比容量及库伦效率数值比较情况。与原始LMNCO相比,FeF3包覆改性后样品的放电比容量(282.9 mAh·g-1)比未包覆的(263.1 mAh·g-1)要高,而且比较小的不可逆容量损失(67.0 mAh·g-1)使得其库伦效率达到80.9%,而原始LMNCO只有73.6%。这主要是因为在电池的充放电反应过程中,FeF3也参加了反应,为正极材料释放出额外的放电比容量。同时,FeF3包覆层在电池首次充电过程中,抑制了氧的逸出,提高了Li+的可逆嵌入/脱出量,减少了不可逆容量损失[23]。
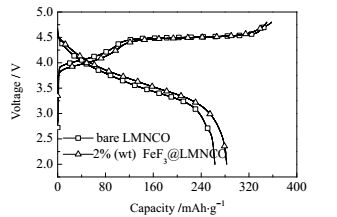
|
图 4 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料在0.1C倍率下的首次充放电曲线 Fig.4 Initial charge–discharge curves of raw and FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 electrodes at 2.0~4.8 V, 25℃ |
| 表 2 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料在0.1C倍率下的首次充放电性能比较,2.0~4.8 V Table 2 Initial charge-discharge data of raw and FeF3-coated Li [Li0.2Mn0.54Ni0.13Co0.13] O2 electrodes at 0.1C rate, 2.0~4.8 V |
图 5是FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料在0.5C倍率下充放电100次过程中的循环性能和放电中值电压变化曲线。由图 5(a)所示,随着充放电循环次数的增加,两个样品的放电容量都呈下降的趋势。但是,原始正极材料的放电容量下降幅度要比FeF3包覆后的正极材料要快。正极材料2%(wt) FeF3@LMNCO的首次放电容量达到202.3 mAh·g-1,经过100次循环后其放电比容量仍有190.6 mAh·g-1,对应的容量保持率达到94.2%。而原始LMNCO正极材料的首次放电比容量只有189.8 mAh·g-1,100次后的容量保持率下降到88.9%。这说明FeF3不仅能提高Li[Li0.2Mn0.54Ni0.13Co0.13]O2的放电比容量,还能促进其放电循环稳定。在Li[Li0.2Mn0.54Ni0.13Co0.13]O2循环过程中,材料会发生由层状向尖晶石结构的转变,同时伴随着极化现象的加剧,使得其放电中值电压会下降[24]。图 5(b)为100次循环过程中,FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的放电中值电压变化曲线。从图中可以明显看出,2%(wt) FeF3@LMNCO样品的放电中值电压下降幅度要比原始正极材料的缓慢。原始正极材料经过100次循环后,其放电中值电压差值(∆U)为0.273 V,远远大于2%(wt) FeF3@LMNCO样品(0.161 V)。而更小的∆U,有利于保证电池的高功率输出。FeF3包覆后的正极材料表现出良好的循环容量和电压稳定性,这是因为FeF3既作为活性材料参与充放电反应,同时也作为保护层,抑制了正极材料与电解液之间的副反应。

|
图 5 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料在0.5C倍率下的变化曲线 Fig.5 Cyclic performance of (a) raw and (b) FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 electrodes at 0.5C, 2.0~4.6 V |
锂离子电池在放电过程中的高倍率性能也是评估正极材料的一个重要指标。在高倍率下仍具有良好的放电性能,才能满足目前新能源汽车的需求。图 6为FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的在不同倍率下的放电比容量。从图中可以看到,2%(wt) FeF3@LMNCO样品的放电比容量比原始LMNCO样品的都要高。特别是,在电流密度提高到5C时,原始LMNCO的放电比容量只有80.0 mAh·g-1,而2%(wt) FeF3@LMNCO样品要高出29.5 mAh·g-1。周知,当电流密度逐渐提高时,锂电池充放电过程中电解液分解会加剧[25]。同时,越来越多的副反应产物会沉积到正极表面,引起电荷转移阻抗的增加和放电比容量的快速下降。而在包覆有FeF3的正极材料表面,电极与电解液之间的副反应得到抑制,促进了正极表面SEI膜的最优结构形成。
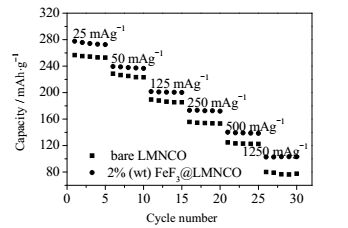
|
图 6 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的倍率性能,2.0~4.6 V Fig.6 Rate cycle performance of the bare and FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 electrodes at various C-rates |
为了研究正极材料在循环过程中的氧化还原反应和相变情况,分别对FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料进行了前三次的循环伏安测试,如图 7所示。在首次循环伏安曲线的上半部分,两个样品都存在着两个氧化峰,即4.2 V和4.55 V处。其中4.2 V处的氧化峰对应着Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料中主相LiMO2的Ni2+,Co3+分别氧化到Ni4+,Co4+ [21]。而在4.55 V处的氧化峰对应着Li2MnO3相的充电活化反应[15]。随后在循环伏安曲线的下半部分中,出现在3.8 V处的还原峰对应着Ni4+,Co4+分别还原到Ni2+,Co3+的过程。而在随后的2nd,3rd还原曲线中,额外出现了在3.3 V处的还原峰,是由于Mn4+还原到Mn3+,此处的还原峰的出现表示材料发生尖晶石结构变化[26]。经过比较,FeF3包覆后的正极材料的3.3 V还原峰的峰位更低,说明材料的尖晶石结构转变得到了抑制。
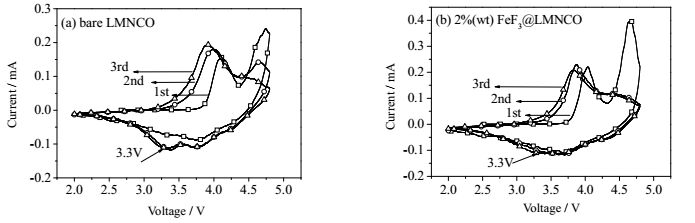
|
图 7 FeF3包覆前(a)、后(b) Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的前三次循环伏安曲线 Fig.7 Cyclic voltammeter profiles of the bare (a) and FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 electrodes (b) at the first three cycles between 2.0 and 4.8 V |
为了分析FeF3包覆后对电池的阻抗影响,图 8给出了FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料所组装的半电池的交流阻抗谱。每一个阻抗图谱按图 8(c)所示的等效电路图进行拟合,其中Rs为电池的体电阻,Rsf为固液界面膜(SEI)的离子/电子迁移阻抗,Rct为电荷转移阻抗,ZW为Li[Li0.2Mn0.54Ni0.13Co0.13]O2内部的Li+扩散阻抗[27],具体拟合数值如表 3所示。从图中可以看到在第5次循环过程中,两个样品的Rs,Rsf和Rct值并没有较大区别。但是循环到第30次时,原始LMNCO样品的阻抗值增加很快,像Rsf由162.6 Ω增加到474.5 Ω。而2%(wt) FeF3@LMNCO样品的△Rsf值只有153.2 Ω,远小于未包覆样品。这是因为FeF3包覆层成功地抑制了电解液的分解,缓解了副产物在正极表面的沉积,使得SEI界面阻抗在很大程度上得到削弱,从而最终得到高性能的2%(wt) FeF3@LMNCO样品。
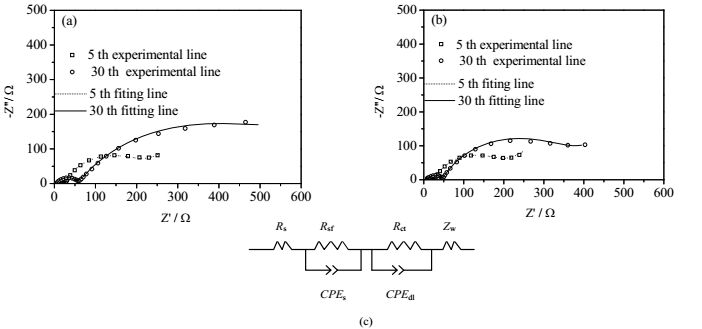
|
图 8 FeF3包覆前(a)、后(b)Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料所组装的半电池交流阻抗谱及其等效电路(c) Fig.8 Electrochemical impedance spectra of bare (a) and FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 electrodes (b) and its equivalent circuit diagram (c) |
| 表 3 FeF3包覆前后Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料所组装的半电池的交流阻抗值 Table 3 Rs, Rf and Rct values of raw and FeF3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 electrodes after different cycles |
采用碳酸盐共沉淀结合高温固相焙烧法合成了富锂锰基正极材料Li[Li0.2Mn0.54Ni0.13Co0.13]O2,并成功在其表面包覆了5~20 nm厚度的FeF3。XRD和SEM分析可得,FeF3包覆前后的样品结构,形貌并没有较大改变。电化学测试结果表明,2%(wt) FeF3@LMNCO样品的首次库伦效率,高倍率放电容量,循环性能更佳。在5C倍率下,2%(wt) FeF3@LMNCO样品的放电比容量达到109.5 mAh·g-1,远高于未包覆样品的80.0 mAh·g-1。除此之外,0.5C倍率下循环100次后,2%(wt) FeF3@LMNCO样品的放电比容量仍有190.6 mAh·g-1,容量保持率高达94.2%。因而FeF3包覆富锂层状正极材料Li[Li0.2Mn0.54Ni0.13Co0.13]O2,是一种有效的改性方法。
| [1] | Goodenough J B, Kim Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587-603.DOI:10.1021/cm901452z. |
| [2] | Etacheri V, Marom R, Elazari R, et al. Challenges in the development of advanced Li-ion batteries: a review[J]. Energy & Environmental Science, 2011, 4(9): 3243-3262. |
| [3] | Takeuchi T, Kyuna T, Morimoto H, et al. Influence of surface modification of LiCoO2 by organic compounds on electrochemical and thermal properties of Li/LiCoO2 rechargeable cells[J]. Journal of Power Sources, 2011, 196(5): 2790-2801.DOI:10.1016/j.jpowsour.2010.11.064. |
| [4] | GUO Xiao-dong(郭孝东), ZHAO Hao-chuan(赵浩川), WEN Jia-jie(文嘉杰), et al. Preparation of high tap-density LiFePO4/C by new iron source(新铁源制备高振实密度LiFePO4/C正极材料)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2011, 25(2): 314-318. |
| [5] | Wu H M, Tu J P, Yuan Y F, et al. Structural, morphological and electrochemical characteristics of spinel LiMn2O4 prepared by spray-drying method[J]. Scripta Materialia, 2005, 52(6): 513-517.DOI:10.1016/j.scriptamat.2004.10.037. |
| [6] | Gao P, Li Y H, Liu H D, et al. Improved high rate capacity and lithium diffusion ability of LiNi1∕3Co1∕3Mn1∕3O2 with ordered crystal structure[J]. Journal of the Electrochemical Society, 2012, 159(4): A506-A513.DOI:10.1149/2.010205jes. |
| [7] | Du C Q, Zhang F, Ma C X, et al. Synthesis and electrochemical properties of Li1.2Mn0.54Ni0.13Co0.13O2 cathode material for lithium-ion battery[J]. Ionics, 2016, 22(2): 209-218.DOI:10.1007/s11581-015-1541-9. |
| [8] | Croy J R, Kim D, Balasubramanian M, et al. Countering the voltage decay in high capacity xLi2MnO3 center·(1-x)LiMO2 electrodes (M = Mn, Ni, Co) for Li-ion batteries[J]. Journal of the Electrochemical Society, 2012, 159(6): A781-A790.DOI:10.1149/2.080206jes. |
| [9] | Li G R, Feng X, Ding Y, et al. AlF3-coated Li(Li0.17Ni0.25Mn0.58)O2 as cathode material for Li-ion batteries[J]. Electrochimica Acta, 2012, 78(9): 308-315. |
| [10] | Ju J H, Cho S W, Hwang S G, et al. Electrochemical performance of Li[Co0.1Ni0.15Li0.2Mn0.55]O2 modified by carbons as cathode materials[J]. Electrochimica Acta, 2011, 56(24): 8791-8796.DOI:10.1016/j.electacta.2011.07.093. |
| [11] | Ulihin A S, Slobodyuk A B, Uvarov N F, et al. Conductivity and NMR study of composite solid electrolytes based on lithium perchlorate[J]. Solid State Ionics, 2008, 179(27-32): 1740-1744.DOI:10.1016/j.ssi.2008.02.027. |
| [12] | Yuan W, Zhang H Z, Liu Q, et al. Surface modification of Li(Li0.17Ni0.2Co0.05Mn0.58)O2 with CeO2 as cathode material for Li-ion batteries[J]. Electrochimca Acta, 2014, 135(22): 199-207. |
| [13] | Sun S W, Wan N, Wu Q, et al. Surface-modified Li[Li0.2Ni0.17Co0.07Mn0.56]O2 nanoparticles with MgF2 as cathode for Li-ion battery[J]. Solid State Ionics, 2015, 278: 85-90.DOI:10.1016/j.ssi.2015.05.021. |
| [14] | Lu C, Wu H, Zhang Y, et al. Cerium fluoride coated layered oxide Li1.2Mn0.54Ni0.13Co0.13O2 as cathode materials with improved electrochemical performance for lithium ion batteries[J]. Journal of Power Sources, 2014, 267(4): 682-691. |
| [15] | Wu Y, Murugan AV, Manthiram A. Surface modification of high capacity layered Li[Li0.2Mn0.54Ni0.13Co0.13]O2 cathodes by AlPO4[J]. Journal of the Electrochemical Society, 2008, 155(9): A635-A641.DOI:10.1149/1.2948350. |
| [16] | Bian X F, Fu Q, Bie X F, et al. Improved electrochemical performance and thermal stability of Li-excess Li1.18Co0.15Ni0.15Mn0.52O2 cathode material by Li3PO4 surface coating[J]. Electrochimica Acta, 2015, 174: 875-884.DOI:10.1016/j.electacta.2015.06.085. |
| [17] | Wang C L, Zhou F, Chen K M, et al. Electrochemical properties of α-MoO3-coated Li[Li0.2Mn0.54Ni0.13Co0.13]O2 cathode material for Li-ion batteries[J]. Electrochimica Acta, 2015, 176: 1171-1181.DOI:10.1016/j.electacta.2015.07.167. |
| [18] | Wang Z Y, Liu E Z, He C N, et al. Effect of amorphous FePO4 coating on structure and electrochemical performance of Li1.2Ni0.13Co0.13Mn0.54O2 as cathode material for Li-ion batteries[J]. Journal of Power Sources, 2013, 236: 25-32.DOI:10.1016/j.jpowsour.2013.02.022. |
| [19] | Hyeyoon Junga, Heejin Songa, Taegyeong Kima, et al. FeF3 microspheres anchored on reduced graphene oxide as a high performance cathode material for lithium ion batteries[J]. Journal of Alloys and Compounds, 2015, 647: 750-755.DOI:10.1016/j.jallcom.2015.06.191. |
| [20] | Zhao T L, Li L, Chen R J, et al. Design of surface protective layer of LiF/FeF3 nanoparticles in Li-rich cathode for high-capacity Li-ion batteries[J]. Nano Energy, 2015, 15: 164-176.DOI:10.1016/j.nanoen.2015.04.013. |
| [21] | Deng H, Belharouak I, Wu H, et al. High temperature performance of surface-treated Li1.1(Ni0.15Co0.1Mn0.55)O1.95 Layered Oxide[J]. Journal of the Electrochemical Society, 2010, 157(7): A776-A781.DOI:10.1149/1.3418608. |
| [22] | XIA Shu-biao(夏书标), ZHANG Ying-jie(张英杰), DONG Peng(董鹏), et al. Solid synthesis of LiNi0.80Co0.15Al0.05O2 cathode with fine-sized materials and its structure and electrochemical properties(细化颗粒固相法合成锂离子电池正极材料LiNi0.80Co0.15Al0.05O2及其结构和电化学性能研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2015, 29(2): 425-431. |
| [23] | Xu G F, Li J L, Xue Q R, et al. Elevated electrochemical performance of (NH4)3AlF6-coated 0.5Li2MnO3·0.5LiNi1/3Co1/3Mn1/3O2 cathode material via a novel wet coating method[J]. Electrochimica Acta, 2014, 117: 41-47.DOI:10.1016/j.electacta.2013.11.064. |
| [24] | Li Y, Bettge M, Polzin B, et al. Understanding long-Term cycling performance of Li1.2Ni0.15Mn0.55Co0.1O2-Graphite lithium-Ion cells[J]. Journal of the Electrochemical Society, 2013, 160(5): A3006-A3019.DOI:10.1149/2.002305jes. |
| [25] | Li J G, Wang L, Zhang Q, et al. Electrochemical performance of SrF2-coated LiNi1/3Co1/3Mn1/3O2 cathode materials for Li-ion batteries[J]. Journal of Power Sources, 2009, 190(1): 149-153.DOI:10.1016/j.jpowsour.2008.08.011. |
| [26] | Park S H, Kang S H, Johnson C S, et al. Lithium-manganese-nickel-oxide electrodes with integrated layered-spinel structures for lithium batteries[J]. Electrochemistry Communications, 2007, 9(2): 262-268.DOI:10.1016/j.elecom.2006.09.014. |
| [27] | Liu J, Manthiram A. Bifunctional effects of carbon coating on high-capacity Li1.2Ni0.13Co0.13Mn0.54O2 cathode for lithium-ion batteries[J]. Journal of Materials Chemistry, 2010, 19(20): 3961-3967. |




