氨基甲酸苯酯(phenyl carbamate,PC)是氨基甲酸酯类化合物,该类化合物广泛用于农药、医药和有机合成等多种领域[1]。尤其PC是尿素法合成碳酸二苯酯(diphenyl carbonate,DPC)的中间体,而DPC是重要的环保化工产品,因其低毒、无污染的性质,在工业、农业等多方面得到广泛应用[2]。DPC可用于合成许多重要的有机化合物和高分子材料,其最重要的用途是作为合成3大通用工程塑料之一的聚碳酸酯的主要原料,代替剧毒光气与双酚A反应合成性能优良的聚碳酸酯[3-4]。
传统上,DPC的生产方法为光气法。但光气剧毒,且副产物HCl腐蚀性强、污染环境。因此,开发非光气法合成DPC成为众多学者研究的重点[5-6]。合成DPC的非光气法主要有酯交换法[7-9]、苯酚氧化羰基化法[3, 10-11]、尿素法[5, 12-13]等。其中,对酯交换法与苯酚氧化羰基化法研究的较多。但酯交换法收率较低,需要开发高效催化剂;苯酚氧化羰基化法工艺简单、原料便宜易得、无污染,但是此方法所用催化剂主要为贵金属化合物[3, 14-15],价格昂贵,且催化剂的制备较繁琐[5, 11]。而关于尿素法合成DPC,虽然热力学计算表明转化率较低[16],文献报道的DPC收率也很低[12-13],但如果仅从反应原料来看,尿素法是一个极具吸引力的方法;尿素和苯酚都是便宜易得的大众化学品,反应副产物仅为氨气,氨气又可用于与CO2反应合成尿素。因此,尿素法实际上是苯酚与CO2反应生成DPC。所以,以尿素和苯酚为原料合成DPC,不仅可得到重要的绿色化工产品DPC,而且可以减少产生温室效应的气体CO2,是非常有研究价值的方法,值得深入研究[17]。
尿素法合成DPC是尿素与苯酚反应首先生成PC,然后PC进一步与苯酚反应生成DPC。文献涉及该反应的研究报道较少,而且也仅是关于尿素与苯酚合成DPC总反应的热力学计算[16]、催化剂选择等[12-13],还未见到关于其各分步反应的研究报道。本文将对尿素法合成DPC过程的第一步反应(尿素与苯酚合成PC)的性能及机理进行研究,以便为尿素法合成DPC方面的研究提供参考。
2 实验部分 2.1 试剂与仪器试剂:尿素,天津市登峰化学品有限公司;苯酚,天津威晨化学试剂科贸有限公司;ZnCl2,天津市风船化学试剂科技有限公司;Al2O3,天津市光复精细化工研究所;Fe2O3、Zn(OAc)2,天津大学科威公司;Cr2O3,天津市化学试剂三厂。以上试剂均为分析纯。
仪器:傅里叶红外光谱仪(VECYOR22型,德国Bruker公司);双泵高效液相色谱仪(515型,美国Waters公司);数显磁力搅拌器(DF-101S型,巩义市予华仪器有限责任公司)。
2.2 实验方法尿素与苯酚合成氨基甲酸苯酯的反应如式(1)所示。
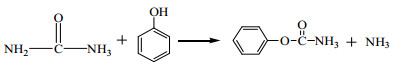
|
(1) |
尿素与苯酚合成PC反应在三口瓶中进行,实验步骤为:称取一定量的苯酚放入三口瓶中,并将三口瓶置于磁力搅拌控温油浴锅中加热。待苯酚呈熔融状态后加入一定质量的催化剂,达到反应温度后,每隔5 min向其中加入少量尿素,尿素完全加入时开始计时。整个过程在氮气保护下进行,反应结束后,进行计量分析。
2.3 分析方法采用515型双泵高效液相色谱仪对产物进行定量分析,紫外光检测波长为254 nm,色谱柱Turner C18(φ4.6 mm×150 mm),流动相为甲醇-水(体积比为65:35)的混合溶液,流量为0.4 mL·min-1。
采用VECYOR22型傅里叶红外光谱仪对催化剂、尿素和苯酚及其混合物进行表征。分辨率为4 cm-1,扫描速度为0.2 cm·s-1,波数范围为400~4 000 cm-1,试样制备方法采用溴化钾压片法。
3 结果与讨论 3.1 催化剂的筛选实验结果表明,在无催化剂参与时,尿素与苯酚几乎不反应。据文献[18]报道,对尿素醇解反应较好的催化剂大多为金属氧化物和金属盐类。因此,在反应温度130 ℃、反应时间5 h、n(尿素):n(苯酚)=1:4的条件下,考察应用于尿素醇解反应效果较好的几种金属氧化物和金属盐类对合成PC反应的催化性能,结果见表 1(YPC表示PC的收率)。
|
|
表 1 不同催化剂的催化性能 Table 1 Performance of various catalysts |
由表 1可知,对合成PC反应,催化效果较好的催化剂是:Al2O3、ZnCl2、Fe2O3、Zn(OAc)2及Cr2O3。
3.2 正交实验除了催化剂种类会影响PC合成反应效果外,反应温度、反应时间、物料配比、催化剂用量等也会有很大影响。因此,利用正交实验来确定各影响因素的较好范围。对上述5种因素,每种因素选取5个水平,并增加一列空白列。因此,选取正交表L25(5 6),正交实验结果见表 2。
|
|
表 2 正交实验结果 Table 2 Results of the orthogonal experiments |
由表 2可知,5种因素对合成PC反应的影响大小为:物料比 > 催化剂种类 > 催化剂用量 > 反应时间 > 反应温度;最佳水平组合为:催化剂ZnCl2、温度150 ℃、反应时间7 h、物料配比为1:6、催化剂用量为反应物总质量的1%(mcat/mtotal=1%)。
另外,由表 2可见,在以ZnCl2为催化剂、反应温度150 ℃、n(尿素):n(苯酚)=1:6、mcat/mtotal=1%、反应时间9 h的条件下,产物PC的收率最高,可达39.04%。而由正交实验数据计算得到的时间因素不同水平的Mi3数值(见表 2),可知最佳反应时间为7 h。因此,进行了反应时间为7 h的补充实验,此条件下收率为34.62%,比反应9 h的收率低,这可能是由于反应时间的延长有助于反应进行得更充分。因此,较好反应条件为:ZnCl2为催化剂、反应温度150 ℃、反应时间9 h、n(尿素):n(苯酚)= 1:6、mcat/mtotal=1%。
表 2中的Rj数值,仅反映了5种因素对合成PC反应收率影响的大小,为了进一步分析各因素对实验影响是否显著,对正交实验数据进行了方差分析,结果如表 3所示。
|
|
表 3 正交实验方差分析 Table 3 Variance analysis of the orthogonal experiments |
表 3中,B、C、G的均方均小于E的均方,因此将B、C、G的平方和作为误差平方和并入E的平方和,相应因素的自由度也并入E的自由度[19],计算得到A及D因素的F值见表 3;若取检验水平α = 0.05,查表[19]得F0.05(4, 16)=3.01。可见在水平α = 0.05下,只有因素D(物料配比)对反应收率影响显著。
3.3 物料配比的单因素优化由表 2知,n(尿素):n(苯酚)=1:6为由正交实验得到的最好配比,但此为物料配比因素中水平的边界值,而且方差分析(表 3)表明物料配比是显著性因素,因此需要进行增大物料配比的单因素实验,以确定最好物料配比。
在ZnCl2为催化剂,mcat/mtotal=1.0%、150 ℃、反应9 h条件下,考察尿素与苯酚的物料比对PC收率的影响,结果如图 1所示。图 1表明,随着苯酚与尿素摩尔比的增大,PC收率增大,当比例达到1:36后再继续加大配比,PC的收率几乎不再变化,故该反应较好物料配比为尿素:苯酚=1:36。
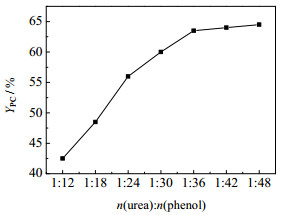
|
图 1 物料比对PC收率的影响 Fig.1 Effects of material ratios on PC yields |
虽然方差分析表明催化剂用量不是显著性因素,但考虑到由正交实验得到的催化剂用量最好值1%为正交实验表中的边界值(最小值),因此,进行了以ZnCl2为催化剂、n(尿素):n(苯酚)=1:36、温度150 ℃、反应时间9 h等条件不变,而催化剂用量为mcat/mtotal=0.5%的实验,此时YPC为58.64%,低于mcat/mtotal=1%时的收率。因此,催化剂最好用量仍是mcat/mtotal=1%。
综上,对ZnCl2催化合成PC反应,较好反应条件为:n(尿素):n(苯酚)=1:36、mcat/mtotal=1.0%、温度150 ℃、反应时间9 h,此时PC的收率达到64.25%。
3.4 反应机理分析为确定ZnCl2催化尿素与苯酚合成PC的反应机理,分别对ZnCl2与苯酚、尿素进行不同方式的处理,并对处理过的样品进行FTIR表征,分析反应物与催化剂作用前、后红外谱图的变化。
3.4.1 ZnCl2与苯酚的相互作用分析分别对如下(a)~(d)所示不同方式处理的ZnCl2、苯酚及其混合物进行FTIR表征,结果见图 2。
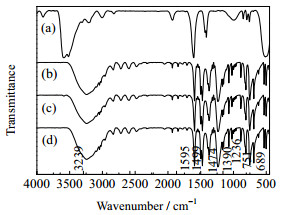
|
图 2 ZnCl2、苯酚及其混合物的FTIR谱图 Fig.2 FTIR spectra of ZnCl2, phenol and their mixtures (a) ZnCl2 (b) phenol (c) n(ZnCl2):n(phenol)=1:144, room temperature (d) n(ZnCl2):n(phenol)=1:144, 150 ℃, 2 h |
(a) 外购新鲜ZnCl2;
(b) 外购新鲜苯酚;
(c) ZnCl2与苯酚按n(ZnCl2):n(苯酚)=1:144混合,室温研磨后做FTIR表征;
(d) ZnCl2与苯酚按n(ZnCl2):n(苯酚)=1:144混合,150 ℃进行氮气保护、常压维持2 h,然后取混合物做FTIR表征。
由图 2知,不同方式处理的ZnCl2与苯酚混合物的FTIR谱图均没有新的吸收峰出现,表明不同方式处理的ZnCl2与苯酚没有发生化学作用。
3.4.2 ZnCl2与尿素的相互作用分析分别对不同方式处理的ZnCl2、尿素及其混合物进行FTIR表征,样品处理方式如下(a)~(d)所述,表征结果如图 3所示。
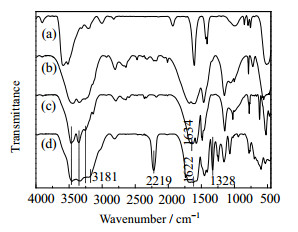
|
图 3 ZnCl2、尿素及其混合物的FTIR谱图 Fig.3 FTIR spectra of ZnCl2, urea and their mixtures (a) ZnCl2 (b) urea (c) n(ZnCl2):n(urea)=1:4, room temperature (d) n(ZnCl2):n(urea)=1:4, 150 ℃, 1.5 h |
(a) 外购新鲜ZnCl2;
(b) 外购新鲜尿素;
(c) ZnCl2与尿素按n(ZnCl2):n(尿素)=1:4比例混合,室温下研磨做FTIR表征;
(d) ZnCl2与尿素按n(ZnCl2):n(尿素)=1:4比例混合,150 ℃进行氮气保护,常压下维持1.5 h,然后混合物做FTIR表征。
由图 3可见,当ZnCl2与尿素在室温下混合时,混合物的红外谱图中除了ZnCl2与尿素的吸收峰外,没有其他新吸收峰出现,说明尿素与ZnCl2在室温下混合时没有发生化学作用。
然而,经加热处理过的ZnCl2与尿素混合物的谱图(图 3(d))中,3 181 cm-1处有新的吸收峰,可能是由于无机金属离子Zn2+与羰基氧配合形成络合物后使得N-H的伸缩振动峰发生了分裂所引起[20]。另外,图 3(d)中2 219 cm-1处出现的新特征吸收峰,是因为ZnCl2与尿素中羰基氧配位产生了新化学键;图 3(d)与图 3(c)比较可见,C═O的伸缩振动从1 634 cm-1向低波数方向移至1 622 cm-1,是由于加热过程中,随着温度升高金属离子Zn2+与羰基氧进行配位,从而增加了C═O键的单键特性,导致C═O的振动频率下降[21]。此外,经过加热处理后1 328 cm-1处出现了新的吸收峰,是因尿素互变异构形成C═N引起的[22]。于尿素存在共振结构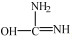

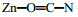
因此,红外分析表明ZnCl2与尿素经加热处理后,尿素羰基碳上的氧原子与ZnCl2的Zn2+形成了配位键,且尿素存在互变异构体,故推测尿素与ZnCl2相互作用机理分为如下两种情况:
I.由3.4.2节分析可知,ZnCl2中的Zn2+与尿素羰基碳上的氧原子发生了配位,因此该反应中尿素与ZnCl2相互作用过程为:尿素羰基上显负电的氧作为配位原子与ZnCl2中的Zn2+配位形成Zn─O配位键,形成了新的配位化合物。具体作用过程如式(2)所示。
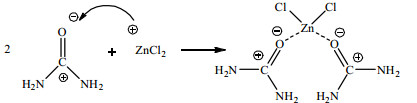
|
(2) |
II.由于尿素存在互变异构体 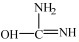
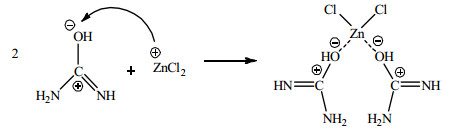
|
(3) |
在尿素的共振结构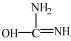
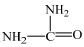
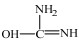
由以上分析可知,ZnCl2催化尿素和苯酚反应合成PC,实际上是ZnCl2首先与尿素中的氧发生配位,形成配合物;Zn2+的吸电子能力使尿素中氧上的负电荷增多,从而导致碳原子上的正电荷明显增多;这使得碳原子被活化,与苯酚中的苯氧基发生亲核取代反应,进而得到PC。3.4.2节中分析认为ZnCl2与尿素的作用存在两种情况,因此尿素与苯酚在ZnCl2作用下生成PC的反应机理也存在如下I和II两种情况。
I.尿素羰基上的氧作为配位原子,与ZnCl2中的Zn2+配位形成Zn─O配位键,得到一种新的配位化合物,同时尿素的羰基碳被活化;苯酚中的苯氧基作为亲核试剂,进攻配合物中显正电的羰基碳,导致配合物中的C─N键减弱;配合物中尿素与锌连接的Zn─O配位键会自动断裂,释放出催化剂ZnCl2,同时配合物中的一个C─N键也随之断裂,进而生成PC。具体作用过程如式(4)所示。
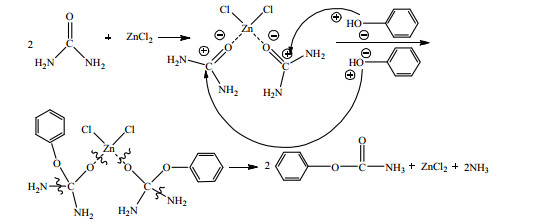
|
(4) |
II.尿素互变异构得到共振结构 
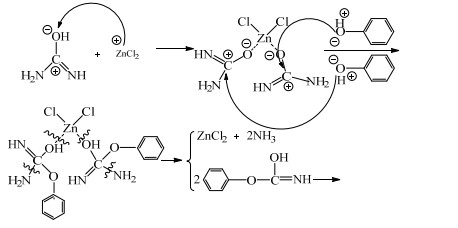
|
(5) |
因式(2)比式(3)进行的可能性大,故式(4)比式(5)发生的可能性大,即ZnCl2催化尿素与苯酚合成PC反应主要按机理I进行。
4 结论(1) 对金属氧化物和金属盐类催化尿素与苯酚合成PC的反应性能进行评价,表明催化性能较好的5种催化剂为Al2O3、ZnCl2、Fe2O3、Zn(OAc)2和Cr2O3。
5因素5水平的正交实验表明,合成PC的最佳水平组合为:以ZnCl2为催化剂、反应温度为150 ℃、反应时间为7 h、n(尿素):n(苯酚) = 1:6、mcat/mtotal=1.0%。对正交实验数据的方差分析表明:在催化剂种类、反应温度、反应时间、物料配比、催化剂用量5因素中,物料配比对反应影响显著。
正交实验结合单因素实验,得到合成PC反应的较好条件为:以ZnCl2为催化剂、n(尿素): n(苯酚)=1:36、mcat/mtotal=1.0%、反应温度150 ℃、反应时间9 h,该条件下PC的收率可达到64.25%。
(2) ZnCl2分别与尿素及苯酚相互作用的FTIR表征表明,ZnCl2与苯酚之间不发生化学作用,而与尿素存在化学作用。加热条件下,尿素中羰基上的氧原子与ZnCl2中的锌离子配位形成新化学键。
尿素存在共振结构,使ZnCl2中的Zn2+与尿素中氧配位时存在两种情况,即Zn─O=C─N与Zn─O─C=N共存,且结构Zn─O=C─N相对比较稳定。与之对应,ZnCl2催化尿素与苯酚合成PC反应机理也存在两种情况:一种是ZnCl2中Zn2+与尿素羰基上的氧进行配位,使碳原子上的正电荷增多,进而碳原子被活化;苯酚作为亲核试剂,苯氧基进攻尿素中显正电的羰基碳,导致配合物中的C─N键减弱,从而使反应得以发生。另一种则是苯酚作为亲核试剂,苯氧基进攻尿素中C─O上显正电的碳原子,导致C─N单键减弱,反应生成PC。而第1种反应机理优势更大。
| [1] |
尚建鹏, 李作鹏, 武美霞, 等. 非光气合成N-取代氨基甲酸酯的研究进展[J]. 化工进展, 2014, 33(4): 811-816, 849. SHANG J P, LI Z P, WU M X, et al. Progress in non-phosgene synthesis of N-substituted carbamates[J]. Chemical Industry and Engineering Progress, 2014, 33(4): 811-816, 849. |
| [2] |
刘青, 杜超, 谢伦嘉. 碳酸二甲酯与苯酚合成碳酸二苯酯的催化剂研究进展[J]. 石油化工, 2017, 46(12): 1542-1549. LIU Q, DU C, XIE L J. Research progress in catalysts for synthesis of diphenyl carbonate from dimethyl carbonate and phenol[J]. Petrochemical Technology, 2017, 46(12): 1542-1549. DOI:10.3969/j.issn.1000-8144.2017.12.018 |
| [3] |
ZHANG L F, HE Y C, YANG X J, et al. Oxidative carbonylation of phenol to diphenyl carbonate by Pd/MO-MnFe2O4 magnetic catalyst[J]. Chemical Engineering Journal, 2015, 278: 129-133. DOI:10.1016/j.cej.2014.11.096 |
| [4] |
孙中耀.合成碳酸二苯酯及聚碳酸酯的研究[D].天津: 天津大学, 2017. SUN Z Y. Study on synthesis of diphenyl carbonate and polycarbonate[D]. Tianjin: Tianjin University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10056-1018015606.htm |
| [5] |
汪欣萍, 王桂荣, 贾春谣, 等. 以醇为循环剂尿素法合成碳酸二苯酯过程探讨[J]. 化学通报, 2014, 77(3): 214-219. WANG X P, WANG G R, JIA C Y, et al. Discussion on the synthesis of diphenyl carbonate by alcohol as circulating agent urea method[J]. Chemistry Bulletin, 2014, 77(3): 214-219. |
| [6] |
国鑫, 施有民, 郑化安, 等. 不同反应原料合成碳酸二苯酯的热力学研究[J]. 高校化学工程学报, 2016, 30(4): 754-760. GUO X, SHI Y M, ZHENG H A, et al. Thermodynamic study on synthesis of diphenyl carbonate from different reaction materials[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(4): 754-760. DOI:10.3969/j.issn.1003-9015.2016.04.002 |
| [7] |
秦吉臣, 谢小莉, 曹贤武, 等. 有机胺催化双酚A与碳酸二苯酯熔融酯交换动力学的研究[J]. 高校化学工程学报, 2006, 20(6): 945-950. QIN J C, XIE X L, CAO X W, et al. Study on melt transesterification kinetics of bisphenol a and diphenyl carbonate catalyzed by organic amine[J]. Journal of Chemical Engineering of Chinese Universities, 2006, 20(6): 945-950. DOI:10.3321/j.issn:1003-9015.2006.06.017 |
| [8] |
WANG Q, SUN M M, GUO M, et al. Heterogeneous transesterification of dimethyl carbonate and phenol to diphenyl carbonate over vanadium pentoxide microstructures[J]. Integrated Ferroelectrics, 2015, 164(1): 154-164. DOI:10.1080/10584587.2015.1045399 |
| [9] |
FIGUEIREDO M C, TRIEU V, EIDEN S, et al. Spectroscopic investigation of the electrosynthesis of diphenyl carbonate from CO and phenol on gold electrodes[J]. Acs Catalysis, 2018, 8(4): 3087-3090. DOI:10.1021/acscatal.7b04204 |
| [10] |
徐瑞峰.酯交换法合成碳酸二苯酯的工艺研究[D].上海: 华东理工大学, 2013. XU R F. Study on the synthesis of diphenyl carbonate by transesterification[D]. Shanghai: East China University of Science and Technology, 2013. |
| [11] |
GUO H X, LV J D, WU H Q, et al. Synthesis of diphenyl carbonate by oxidative carbonylation of phenol with Pd-Co/Hopcalite[J]. Advanced Materials Research, 2013, 750/751/752(10): 1292-1295. |
| [12] |
ITO M. Production of diaryl carbonate ester: Japan, 9104658[P]. 1997-04-22.
|
| [13] |
兰支利, 吕妍, 李靖, 等. 四丁基二锡氧烷催化合成碳酸二酯类化合物的新方法[J]. 催化学报, 2002(1): 77-80. LAN Z L, LV Y, LI J, et al. A new method for the synthesis of carbonic acid diesters catalyzed by tetrabutyldistannoxane[J]. Chinese Journal of Catalysis, 2002(1): 77-80. DOI:10.3321/j.issn:0253-9837.2002.01.018 |
| [14] |
钱伯章. 国内外特种异氰酸酯市场与供需[J]. 化学推进剂与高分子材料, 2012, 10(5): 36-40. QIAN B Z. Domestic and international specialty isocyanate market and supply and demand[J]. Chemical Propellants & Polymeric Materials, 2012, 10(5): 36-40. |
| [15] |
冯东, 农洁静, 张政, 等. 非光气法合成碳酸二苯酯的热力学与催化剂研究进展)[J]. 材料导报, 2015, 29(21): 68-74. FENG D, NONG J J, ZHANG Z, et al. Progress in thermodynamics and catalysts for synthesis of diphenyl carbonate by non-phosgene method[J]. Materials Review, 2015, 29(21): 68-74. |
| [16] |
舒婷. 尿素与苯酚合成碳酸二苯酯的热力学分析[J]. 化工中间体, 2009, 5(6): 29-31. SHU T. Thermodynamic analysis of synthesis of diphenyl carbonate from urea and phenol[J]. Chemical Intermediates, 2009, 5(6): 29-31. |
| [17] |
刘勇, 刘坚. 非光气法催化合成碳酸二苯酯研究进展[J]. 化工进展, 2013, 32(11): 2614-2620. LIU Y, LIU J. Research progress in non-phosgene catalytic synthesis of diphenyl carbonate[J]. Chemical Industry and Engineering Progress, 2013, 32(11): 2614-2620. |
| [18] |
刘亮, 杜治平, 袁华, 等. 尿素醇解合成碳酸丙烯酯研究进展[J]. 化学与生物工程, 2009, 26(7): 1-4. LIU L, DU Z P, YUAN H, et al. Research progress in the synthesis of propylene carbonate by urea alcoholysis[J]. Chemistry & Bioengineering, 2009, 26(7): 1-4. DOI:10.3969/j.issn.1672-5425.2009.07.001 |
| [19] |
刘达民, 程岩. 应用统计[M]. 北京: 化学工业出版社, 2004. LIU D M, CHENG Y. Applied statistics[M]. Beijing: Chemical Industry Press, 2004. |
| [20] |
李习祥, 王尚沛, 石晓波. 尿素合Fe(Ⅲ)配合物的室温固相合成与表征[J]. 湛江师范学院学报, 2015, 66(6): 60-64. LI X X, WANG S P, SHI X B. Solid state synthesis and characterization of urea and Fe(Ⅲ) complexes at room temperature[J]. Journal of Zhanjiang Normal College, 2015, 66(9): 3504-3510. |
| [21] |
赵地顺, 李雪刚, 刘宝友, 等. 离子液体体系ZnCl2-尿素的制备及性质[J]. 精细化工, 2007(7): 632-635. ZHAO D S, LI X G, LIU B Y, et al. Preparation and properties of ionic liquid system ZnCl2-urea[J]. Fine Chemicals, 2007(7): 632-635. DOI:10.3321/j.issn:1003-5214.2007.07.003 |
| [22] |
孟令芝, 龚淑玲, 何永炳. 有机波普分析[M]. 武汉: 武汉大学出版社, 2009. MENG L Z, GONG S L, HE Y B. Organic pop analysis[M]. Wuhan: Wuhan University Press, 2009. |
| [23] |
中本一雄.无机和配位化合物的红外和拉曼光谱[M].黄德如, 汪仁庆译, 第4版.北京: 化学工业出版社, 1986.中本一雄. Infrared and raman spectra of inorganic and coordination compounds[M]. HUANG D R, WANG R Q. Trans, 4th ed. Beijing: Chemical Industry Press, 1986. |
| [24] |
李洁, 高赛, 高孝恢. 金-尿素配合物的合成及结构[J]. 中国有色金属学报, 1993(2): 33-36. LI J, GAO S, GAO X H. Synthesis and structure of gold-urea complex[J]. The Chinese Journal of Nonferrous Metals, 1993(2): 33-36. DOI:10.3321/j.issn:1004-0609.1993.02.009 |




