W沸石作为一种人工合成的钾型沸石,具有结构稳定和高选择性等优良性能,被广泛应用于催化和离子交换等领域[1-2]。近年来,一系列以天然矿物和工农业废料为原料制备沸石成为研究的热点[3-6]。含钾岩石(potassic ores)作为一种天然硅铝酸盐,其各元素含量与W沸石的化学组成相似。因此,以含钾岩石为原料合成W沸石可减少化学试剂的使用和降低生产成本。
含钾岩石的结构是由AlO45−和SiO44−组成的笼状三维框架,受Si、Al排列顺序和阳离子种类的影响,稳定性极强,难以分解[7-8]。含钾岩石用作沸石合成的原料时,需对其进行活化预处理。目前,含钾岩石活化方法有以高温煅烧法[9]、酸浸法[10]、微生物分解法[11]和水热分解法[12]等,但上述方法均有不足。例如,高温煅烧法所需反应温度过高,能耗较大。酸浸法的反应液腐蚀性很强。微生物分解法中菌种的培养周期长,且分解效率低。水热分解法中反应体系的液固比高,分解液处理过程复杂。相比之下,亚熔盐是一种具有高化学活性和高活度负氧离子,质量分数为50%~85% 的碱金属离子化介质,因温度要求低、热效率高等优点,在矿物加工和冶金等领域得到迅速发展[13-14]。
活化助剂的选择对亚熔盐法活化至关重要。近年来,氟化物被广泛用作活化助剂。例如,张小东等以KF为助剂从粉煤灰中提取氧化铝,通过KF改变了氧化铝在粉煤灰中的存在形式,将原来的莫来石、刚玉转变为可溶于酸的物质,提取率高达97%[15]。Karamanoy等[16]探究了CaF2从冶金料渣中制备玻璃陶瓷的影响,发现CaF2的显著降低了熔融和烧结温度。Zhou等[17]探究了磷钾伴生矿在HCl-CaF2体系中钾铝元素的浸出动力学,其溶解机理是生成的HF对矿物的刻蚀。基于以上研究,可以推测向亚熔盐体系中引入氟化物可以有效提高含钾岩石的活化效果。
在这项工作中,以KOH-KF为助剂,通过亚熔盐法对含钾岩石进行活化,并优化其活化条件。活化产物被进一步用于合成W沸石,并测试其改型后在人工海水中的提钾性能。同时,设计了沸石合成母液循环利用工艺,以实现资源节约与工业化应用。
2 实验 2.1 原料和试剂含钾岩石矿粉由中国福建省鑫晟矿业有限公司提供(矿粉粒径 < 74 μm),该含钾岩石由钾长石,钠长石和石英组成(见图 1),主要化学组成如表 1所示。表中wB为质量分数,氢氧化钾(KOH,质量分数为85%)购自天津市科密欧试剂有限公司;氟化钾(KF,质量分数为99%)购自北京市迈瑞达科技有限公司;氢氧化铝(Al(OH)3,质量分数为99%)购自成都科龙化工试剂厂;气相二氧化硅(SiO2,质量分数为99%)购自上海振江化工有限公司;蒸馏水由实验室自制。
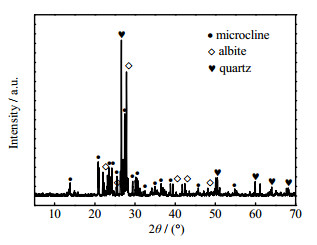
|
图 1 含钾岩石粉末的XRD图 Fig.1 XRD pattern of potassic ore powder |
|
|
表 1 含钾岩石主要化学成分 Table 1 Chemical compositions of potassic ores |
按一定比例称取含钾岩石矿粉、KF、KOH和水,装入水热合成釜(带有聚四氟乙烯内衬的不锈钢反应釜)中,密封后将其固定在恒温器的可转动支架上,控制恒温器的温度和转速,使反应物料在设定温度下反应,达到设定反应时间后取出合成釜,并迅速用凉水冷却,获得液固混合产物,加水溶解后抽滤,滤渣经烘干后为含钾岩石活化产物。
2.3 W沸石的制备按照物质的量比n(K2O): n(SiO2): n(Al2O3): n(H2O)= 15:10:1:570向2.2节的液固混合产物中补加KOH、气相SiO2和H2O,配成W沸石合成液。合成液室温老化2 h后,转移至聚四氟乙烯反应釜中于150 ℃静态晶化24 h,经抽滤获得W沸石和沸石合成母液。合成的W沸石洗涤至中性后,在110 ℃下干燥2 h。沸石合成母液中K+的含量根据GB/T 8574 2010采用四苯硼钠重量法测定,SiO32−和Al3+含量分别根据GB/T 4209 2008和GB/T 5484 2012通过传统滴定法确定,并循环利用沸石合成母液。
2.4 W沸石改型和海水提钾性能测试0.7 g W沸石和70 mL NH4Cl(3 mol·L−1)的混合液在40 ℃水浴中搅拌2 h,经3次洗涤完成铵改型。将铵改型后的W沸石与70 mL饱和NaCl溶液混合,在100 ℃水浴中搅拌2 h后洗涤3次完成钠改型。将0.1 g改型后的W沸石加入50 mL模拟海水(0.766 4 g·L−1 KCl、27.23 g·L−1 NaCl、4.997 g·L−1 MgCl2·6H2O、7.031 g·L−1 MgSO4·7H2O和1.141 g·L−1 CaCl2)中,室温搅拌至离子交换平衡并静置分层,测定上清液中K+含量,并通过式(1)计算W沸石海水提钾量。
| $ {q_{\mathop{\rm e}\nolimits} } = \frac{{V({\rho _0} - {\rho _{\mathop{\rm e}\nolimits} })}}{m} $ | (1) |
式中:V是模拟海水的体积,L;ρ0和ρe是海水中K+的初始质量浓度和平衡质量浓度,mg·L−1;m是W沸石的质量,g。
2.5 表征采用赛默飞世尔科技有限公司(中国)生产的ARL QUANT型X射线荧光光谱仪(X-ray fluorescence,XRF)分析含钾岩石粉末和沸石产物的化学组成。采用Bruker公司(德国)生产的D8 Focus Powder型X射线衍射仪(X ray diffraction,XRD)测定含钾岩石和沸石产物的物相组成。采用FEI公司(美国)生产的Nova Nano SEM 450型扫描电子显微镜(scanning electron microscope,SEM)确定沸石产物的形貌。
3 结果与讨论 3.1 含钾岩石活化条件优化 3.1.1 KF和KOH量比的影响KOH和含钾岩石的质量比m(KOH)/m(potassic ores)为3、KOH的质量分数为70%、反应6 h、反应温度190 ℃、不同KF和KOH量比n(KF)/n(KOH)条件下活化产物的XRD图如图 2所示。相比于图 1,随着n(KF)/n(KOH)的增加,含钾岩石中各组分的衍射峰强度减弱。当n(KF)/n(KOH) = 0.025时,XRD曲线中已没有石英的衍射峰,表明石英完全分解。而钾长石和钠长石的衍射峰仍较明显。同时,在2θ = 27.6°和28.8°处出现了钾霞石的衍射峰。在碱性环境中,含钾岩石分解并释放出K+、Al(OH)4−和H2SiO42−,其中硅铝基团作为中间产物,进一步反应生成钾霞石[18]。涉及的反应方程式如下:
| $ \begin{array}{*{20}{c}} {{\rm{KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}\left( {{\rm{Microcline}}} \right){\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + 6O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{ Al}}{{\left( {{\rm{OH}}} \right)}_{\rm{4}}}^{\rm{ - }}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}{\rm{ + }}{{\rm{K}}^{\rm{ + }}}}\\ {{{\rm{K}}^{\rm{ + }}}{\rm{ + Al}}{{\left( {{\rm{OH}}} \right)}_{\rm{4}}}^{\rm{ - }}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}} \to {\rm{ KAlSi}}{{\rm{O}}_{\rm{4}}}\left( {{\rm{Kalsilite}}} \right){\rm{ }} \downarrow {\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + 2O}}{{\rm{H}}^{\rm{ - }}}} \end{array} $ |
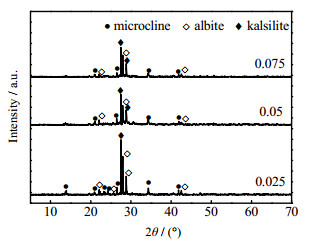
|
图 2 不同n(KF)/n(KOH)活化产物的XRD图 Fig.2 XRD patterns of activated products under different n(KF)/n(KOH) |
当n(KF)/n(KOH)增加至0.05时,含钾岩石进一步分解,XRD图显示钾长石和钠长石衍射峰数量减少。增加KF的量有助于含钾岩石的分解,可能是因为F−与O2−的离子半径接近,F−很容易进入含钾岩石由AlO45−和SiO44−组成的四面体结构中,造成Al O Si的价键断裂,破坏含钾岩石的结构。增大n(KF)/n(KOH)至0.075时,活化产物的衍射峰无明显变化。综合上述分析,n(KF)/n(KOH) = 0.05为KOH-KF亚熔盐法活化含钾岩石的适宜KF用量。
3.1.2 KOH和含钾岩石质量比的影响n(KF)/n(KOH) = 0.05、KOH质量分数为70%、反应6 h、反应温度190 ℃、不同m(KOH)/m(potassic ores)条件下活化产物的XRD图如图 3所示。当m(KOH)/m(potassic ores) = 2.5时,石英的衍射峰消失,说明其全部分解,钾长石和钠长石衍射峰数量减少,并出现了归属于钾霞石的衍射峰。当m(KOH)/m(potassic ores)=3时,钾长石和钠长石的衍射峰数量减少且强度进一步降低,而钾霞石衍射峰显著增强。这是因为更多的钾长石和钠长石被分解,浸出的活性硅铝元素含量增加,进而提高了钾霞石的产量。在OH−的极化作用下,Si─O─Si和Al─O─Si键发生断裂形成活泼的Si─OH和Al─OH基团,矿石结晶度下降,使硅铝等元素从晶格结构中释放出来[19]。碱量的增加使这种极化作用增强,并强化了矿石的分解。当m(KOH)/m(potassic ores)=3.5时,产物XRD显示活化效果没有得到进一步的提高。故KOH−KF亚熔盐法活化含钾岩石的适宜碱矿质量比为3。
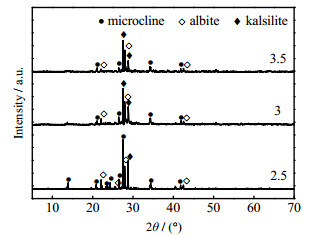
|
图 3 不同m(KOH)/m(potassic ores)活化产物的XRD图 Fig.3 XRD patterns of activated products under different m(KOH)/m(potassic ores) |
n(KF)/n(KOH) = 0.05、m(KOH)/m(potassic ores) = 3:1、反应时间为6 h、反应温度190 ℃、不同KOH质量分数条件下活化产物的XRD图如图 4所示。当KOH质量分数为55% 时,钾长石、钠长石和石英的衍射峰均未完全消失,并出现少量钾霞石的衍射峰。在低碱浓度体系中,含钾岩石的三维网状结构只是遭到轻度破坏,矿石中的主要组分仍可稳定存在。硅铝元素浸出较少,新相钾霞石产量低。KOH质量分数增至70% 时,XRD曲线显示钾长石和钠长石的衍射峰数量减少且强度降低,石英的衍射峰消失,钾霞石的衍射峰数量增加。提高KOH质量分数可以有效提高活化效果,说明含钾岩石的结构在高浓度碱液中更易遭到破坏。当KOH质量分数增至75% 时,钾长石和钠长石衍射峰强度只是略有减弱。故确定70% 为KOH-KF亚熔盐法活化含钾岩石的适宜KOH质量分数。

|
图 4 不同KOH浓度活化产物的XRD图 Fig.4 XRD patterns of activated products under different of KOH concentrations |
图 5为n(KF)/n(KOH) = 0.05、m(KOH)/m(potassic ores) = 3:1、KOH质量分数为70%、反应温度为190 ℃、不同反应时间下活化产物的XRD图。如图 5所示,当反应时间为4 h时,活化产物中仍有较多的钾长石和钠长石,但石英完全分解,并有钾霞石的生成。由于反应时间较短,含钾岩石不能大量分解。碱液对含钾岩石的侵蚀是由外而内的,该过程需要足够的时间。反应6 h以上,XRD曲线显示钾长石和钠长石的衍射峰数量减少,且强度减弱,钾霞石的衍射峰增多。随着反应时间的延长,含钾岩石不断被分解,使钾长石和钠长石的含量不断减少,更多的硅铝元素重结晶生成钾霞石。延长反应时间可以强化含钾岩石的分解和促进钾霞石的结晶。考虑节约能耗,故确定KOH-KF亚熔盐法活化含钾岩石的适宜反应时间为6 h。
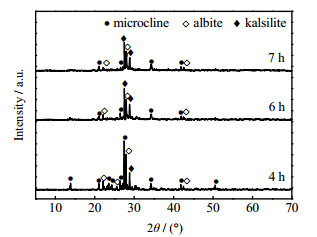
|
图 5 不同反应时间活化产物的XRD图 Fig.5 XRD patterns of activated products under different reaction times |
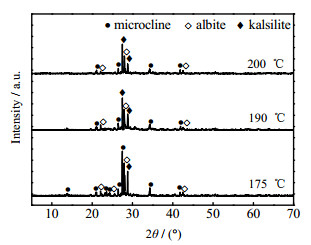
如图 6所示为n(KF)/n(KOH) = 0.05、m(KOH)/m(potassic ores) = 3:1、KOH质量分数为70%、反应时间为6 h、不同反应温度条件下活化产物的XRD图。当反应温度为175 ℃时,只有石英被完全分解,钾霞石开始生成。升高反应温度至190 ℃时,钾长石和钠长石的分解量增加。根据Arrhenius公式,升高温度,反应的活化能降低[20],故含钾岩石的结构在高温碱液中更容易被破坏。同时,根据分子热运动理论,升温可以加剧矿石内部分子的热运动,使含钾岩石与碱液的反应变得更加剧烈。继续升温,产物在组成上无改变。因此,选择190 ℃为KOH-KF亚熔盐法活化含钾岩石的反应温度较为合适。
|
图 6 不同反应温度活化产物的XRD图 Fig.6 XRD patterns of activated products under different reaction temperatures |
综上所述,含钾岩石通过KOH-KF亚熔盐法活化的适宜条件为:n(KF)/n(KOH) = 0.05、m(KOH)/m(potassic ores) = 3、KOH质量分数为70%、反应时间为6 h、反应温度为190 ℃。
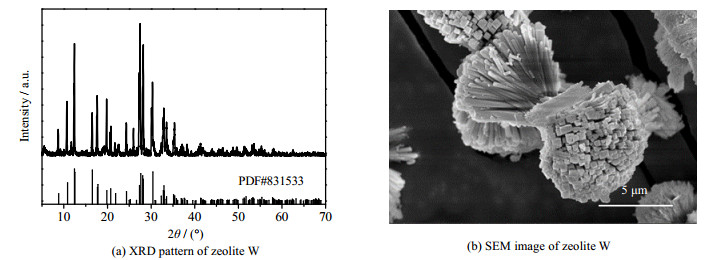
3.2 W沸石的表征以适宜活化条件下的液固混合产物为原料合成了W沸石,化学式为K10.32Al10.3Si21.7O64·24.3H2O,硅、铝的量比为2.1。图 7为合成W沸石的XRD图和SEM图。从图 7(a)可以看出,产物的衍射峰与W沸石的标准峰相对应,且衍射峰强度较高,无其他杂质。测得合成W沸石的质量分数为K2O:17.31%、SiO2:47.88 %、Al2O3:19.13%,接近于W沸石化学组成的理论值。称量合成W沸石的质量,根据W沸石化学式可得产品中硅铝质量分数和硅铝利用率分别为35.3% 和88.2%。按照含钾岩石中铝元素全部消耗计算W沸石理论产量,并可得W沸石的产率为84.1%,如图 7(b)所示,合成的W沸石的形貌为两端蓬松的纺锤体,组成纺锤体的棒状物排列松散。
|
图 7 W沸石的XRD图和SEM图 Fig.7 XRD pattern and SEM image of zeolite W |
对改型后的W沸石进行海水提钾性能测试,测得其最大提钾量(K+)为48.39 mg·g−1,与目前常被用于海水提钾的改型斜发沸石相比,提钾量增加了2倍[21],这与2种沸石的孔道结构和硅、铝物质的量比有关。斜发沸石(Na(AlSi5O12)·4H2O)理论硅、铝物质的量比为5,高于合成W沸石的硅、铝物质的量比,但硅、铝物质的量比较高会降低其阳离子交换能力,且由于斜发沸石孔道结构中含有大量杂质颗粒,也限制了其K+交换能力[22-23]。表 2为不同原料合成W沸石的海水提钾性能对比。本研究制备的W沸石比大部分以化学试剂为原料合成的W沸石的海水提钾量略低,但差距较小,且比本课题组采用KOH亚熔盐法活化含钾岩石制备W沸石的海水提钾量高[24]。综合考虑原料成本和产品性能,该工艺合成的W沸石可在海水提钾领域推广使用。
|
|
表 2 不同原料合成W沸石的海水提钾性能对比 Table 2 Comparison of potassium extraction performance from seawater with zeolite W synthesized using different raw materials |
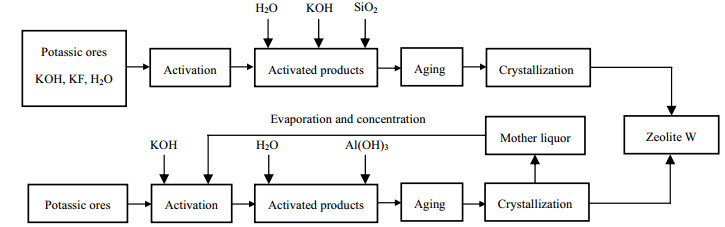
为了节约资源并实现含钾岩石合成W沸石的工业化应用,如图 8设计了W沸石合成母液循环利用工艺。沸石合成母液经处理后可再次用于含钾岩石活化,具体流程为:向蒸发浓缩后的沸石合成母液中加入KOH和含钾岩石矿粉,调整体系的KOH质量分数为70%,碱矿质量比为3:1,混合物在190 ℃下反应6 h。因首次沸石合成过程中铝元素消耗量远大于硅元素,沸石合成母液中剩余大量硅元素,加之又补加了原矿,使循环体系沸石合成液的硅铝比增大,故需补加Al(OH)3和H2O以降低沸石合成液的硅铝比,并进一步制得W沸石。图 9为母液循环工艺合成W沸石的XRD图和SEM图。如图 9(a)所示,循环工艺合成W沸石的物相组成与首次合成产品相同,硅铝比无变化。如图 9(b)所示,循环工艺合成W沸石的形貌仍为两端蓬松的纺锤体。两次合成W沸石产品相同,故沸石合成母液可循环用于活化含钾岩石制备W沸石。
|
图 8 W沸石的合成工艺流程图 Fig.8 Synthesis procudure of zeolite W |

|
图 9 母液循环工艺合成的W沸石的XRD图和SEM图 Fig.9 XRD pattern and SEM image of zeolite W synthesized using a mother liquor recycling process |
(1) 以KOH-KF为活化助剂,采用亚熔盐法对含钾岩石进行活化。确定了含钾岩石活化的适宜条件为:n(KF)/n(KOH) = 0.05、m(KOH)/m(potassic ores) = 3、KOH质量分数为70%、反应时间为6 h、反应温度为190 ℃。含钾岩石在分解过程中,浸出的硅铝等元素重结晶生成了钾霞石。
(2) 以活化液固混合产物为原料合成了W沸石,经钠改型后测得其在人工海水中的提钾量为48.39 mg·g−1。
(3) 沸石合成母液可作为含钾岩石活化的初始原料循环利用,避免了资源浪费,为天然矿物的利用和低成本合成W沸石提供了一种新方法。
| [1] |
GEORGIEVA V M, BRUCE E L, VERBRAEKEN M C, et al. Triggered gate opening and breathing effects during selective CO2 adsorption by merlinoite zeolite[J]. Journal of the American Chemical Society, 2019, 141(32): 12744-12759. DOI:10.1021/jacs.9b05539 |
| [2] |
HERMASSI M, VALDERRAMA C, FONT O, et al. Phosphate recovery from aqueous solution by K-zeolite synthesized from fly ash for subsequent valorisation as slow release fertilizer[J]. Science of the Total Environment, 2020, 731: 139002. DOI:10.1016/j.scitotenv.2020.139002 |
| [3] |
YANG J B, LIU H Y, DIAO H J, et al. A quasi-solid-phase approach to activate natural minerals for zeolite synthesis[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(4): 3233-3242. |
| [4] |
QIANG Z Q, SHEN X J, GUO M, et al. A simple hydrothermal synthesis of zeolite X from bauxite tailings for highly efficient adsorbing CO2 at room temperature[J]. Microporous and Mesoporous Materials, 2019, 287: 77-84. DOI:10.1016/j.micromeso.2019.05.062 |
| [5] |
LIU Y, YAN C J, ZHAO J J, et al. Synthesis of zeolite P1 from fly ash under solvent-free conditions for ammonium removal from water[J]. Journal of Cleaner Production, 2018, 202: 11-22. DOI:10.1016/j.jclepro.2018.08.128 |
| [6] |
ZHOU J M, ZHENG F, LI H, et al. Optimization of post-treatment variables to produce hierarchical porous zeolites from coal gangue to enhance adsorption performance[J]. Chemical Engineering Journal, 2020, 381: 122698. DOI:10.1016/j.cej.2019.122698 |
| [7] |
SKORINA T, ALLANORE A. Aqueous alteration of potassium-bearing aluminosilicate minerals: From mechanism to processing[J]. Green Chemistry, 2015, 17(4): 2123-2136. DOI:10.1039/C4GC02084G |
| [8] |
JENA S K, DASH N, SAMAL A K, et al. Competency of chlorination roasting coupled water leaching process for potash recovery from K-feldspar: Mechanism and kinetics aspects[J]. Korean Journal of Chemical Engineering, 2019, 36(12): 2060-2073. DOI:10.1007/s11814-019-0393-9 |
| [9] |
SERDENGECTI M T, BASTURKCU H, BURAT F, et al. The correlation of roasting conditions in selective potassium extraction from K-Feldspar ore[J]. Minerals, 2019, 9(2): 109-120. DOI:10.3390/min9020109 |
| [10] |
MA J Y, ZHANG Y F, QIN Y H, et al. The leaching kinetics of K-feldspar in sulfuric acid with the aid of ultrasound[J]. Ultrasonics Sonochemistry, 2017, 35(Part A): 304-312. |
| [11] |
BHATTACHARYA S, BACHANI P, JAIN D, et al. Extraction of potassium from K-feldspar through potassium solubilization in the halophilic Acinetobacter soli (MTCC 5918) isolated from the experimental salt farm[J]. International Journal of Mineral Processing, 2016, 152: 53-57. DOI:10.1016/j.minpro.2016.05.003 |
| [12] |
CICERI D, OLIVEIRA M D, ALLANORE A. Potassium fertilizer via hydrothermal alteration of K-feldspar ore[J]. Green Chemistry, 2017, 19(21): 5187-5202. DOI:10.1039/C7GC02633A |
| [13] |
SUN H Q, SONG J, SUN S, et al. Decomposition kinetics of zircon sand in NaOH sub-molten salt solution[J]. Transactions of Nonferrous Metals Society of China, 2019, 29(9): 1948-1955. DOI:10.1016/S1003-6326(19)65102-2 |
| [14] |
LI S C, KIM S C, KANG C S, et al. Recovery of scandium from KOH sub-molten salt leaching cake of fergusonite[J]. Minerals Engineering, 2019, 137: 200-206. DOI:10.1016/j.mineng.2018.11.052 |
| [15] |
氟化钾助溶法从粉煤灰中提取氧化铝工艺活化及溶出机理研究[J]. 化工管理, 2017, 15(449): 84-86. ZHANG X D, ZHAO F Y, GUO S H, et al. Study on activation and dissolution mechanism of fly ash with KF·2H2O assistant[J]. Chemical Enterprise Management, 2017, 15(449): 84-86. |
| [16] |
KARAMANOY A, HAMZAWY E M A, KARAMANOVA E, et al. Sintered glass-ceramics and foams by metallurgical slag with addition of CaF2[J]. Ceramics International, 2020, 46(5): 6507-6516. DOI:10.1016/j.ceramint.2019.11.132 |
| [17] |
ZHOU J F, ZHAO J H, YANG F, et al. Leaching kinetics of potassium and aluminum from phosphorus-potassium associated ore in HCl-CaF2 system[J]. Separation and Purification Technology, 2020, 253: 117528. DOI:10.1016/j.seppur.2020.117528 |
| [18] |
SU S Q, MA H W, CHUAN X Y. Hydrothermal decomposition of K-feldspar in KOH–NaOH–H2O medium[J]. Hydrometallurgy, 2015, 156: 47-52. DOI:10.1016/j.hydromet.2015.05.014 |
| [19] |
刘杰. 富钾页岩钾赋存状态及提钾过程机理研究[D]. 沈阳: 东北大学, 2009. LIU J. Research on occurrence state of potassium-rich shale and mechanisms of potassium extraction [D]. Shenyang: Northeastern University, 2009. |
| [20] |
JENA S K, MISRA P K, DAS B. Studies on extraction of potassium from feldspar by roast-leach method using phosphogypsum and sodium chloride[J]. Mineral Processing and Extractive Metallurgy Review, 2016, 37(5): 323-332. DOI:10.1080/08827508.2016.1218869 |
| [21] |
离子交换法海水提钾工艺研究[J]. 化学工程, 2020, 48(3): 11-14. GUO X F, YUAN J S, JI Z Y, et al. Process of extracting potassium from seawater with ion exchange method[J]. Chemical Engineering, 2020, 48(3): 11-14. |
| [22] |
WANG Y F, LIN F. Synthesis of high capacity cation exchangers from a low-grade Chinese natural zeolite[J]. Journal of Hazardous Materials, 2009, 166(2/3): 1014-1019. |
| [23] |
天然斜发沸石除硅补铝改型对海水中K+的吸附性能研究[J]. 福州大学学报(自然科学版), 2017, 45(3): 418-423. YANG P, LIN R Y, ZHANG B M, et al. Study of desilication and realuminization modification of natural clinoptilolite on its adsorption properties to K+ in seawater[J]. Journal of Fuzhou University (Natural Science), 2017, 45(3): 418-423. |
| [24] |
MENG Y R, ZHAO B, ZHANG H Q, et al. Synthesis of zeolite W from potassic rocks activated by KOH sub-molten salt method[J]. Crystal Research and Technology, 2018, 53(6): 1700216. DOI:10.1002/crat.201700216 |
| [25] |
JIN N, MENG C X, HOU J. Preparation and characterization of merlinoite for potassium extraction from seawater[J]. Journal of Industrial and Engineering Chemistry, 2014, 20(4): 1227-1230. DOI:10.1016/j.jiec.2013.08.003 |
| [26] |
HOU J, YUAN J S, SHANG R. Synthesis and characterization of zeolite W and its ion-exchange properties to K+ in seawater[J]. Powder Technology, 2012, 226: 222-224. DOI:10.1016/j.powtec.2012.04.046 |
| [27] |
WQD–1沸石的合成及其对K+离子交换选择性[J]. 应用化学, 1996, 13(3): 109-110. CHEN X X, DONG D Q, ZHOU Z Y, et al. Synthesis of zeolite WQD-1 and its selectivity to K+ ion exchange[J]. Chinese Journal of Applied Chemistry, 1996, 13(3): 109-110. |
| [28] |
HU Z K, ZHAO B, ZHANG S, et al. Rapid and high efficient synthesis of zeolite W by gel-like-solid phase method[J]. Microporous and Mesoporous Materials, 2019, 281: 75-83. DOI:10.1016/j.micromeso.2019.03.008 |
| [29] |
TONG C H, HOU J, YANG C P. Preparation of NH4+-loaded merlinoite for extracting potassium continuously at room temperature[J]. Journal of Industrial and Engineering Chemistry, 2019, 80: 11-16. DOI:10.1016/j.jiec.2019.07.025 |




