席夫碱(亚胺)是指含有(> C=N-)基团的一类有机化合物的总称[1],席夫碱及其金属配合物在医药[2]、催化[3]、腐蚀[4]、分析化学[5]以及光致变色[6]等领域有重要应用。目前,席夫碱都是采用间歇法进行合成[7-10],即一次性将对应的胺和醛(酮)加入反应器,使用带水剂将水逐渐带走,以促进平衡正向移动,进而提高产率。N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺3a作为一种重要的席夫碱,是制备手性农药─精异丙甲草胺5的重要中间体[11],也可以用于合成具有重要生物活性的β-内酰胺类物质6[12]。瑞士先正达公司正是采用间歇法[13],以2-甲基-6-乙基苯胺1a (MEA,2-methyl-6-ethylaniline)和甲氧基丙酮2a (MOA,Methoxyacetone)为原料生产N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺,反应路线如图 1所示。但是,与席夫碱的通用合成方法一样,该合成方法存在(1)反应转化率低;(2)放大效应明显,随着反应釜体积的增加,反应转化率大大减少;(3)反应能耗高、产能低等缺点。
为了克服间歇法制备席夫碱的不足,本文提出采用连续反应精馏法合成席夫碱,有望打破热力学平衡限制,提高反应选择性和收率,从而降低原料消耗和能耗,进而降低总成本[14-15]。目前,反应精馏已经在工业生产上有了一些应用,例如乙酸和甲醇酯化生成乙酸甲酯[16]、环氧乙烷水解为乙二醇[17]、乙烯和苯烷基化生成乙苯[18]。与上述反应相类似,席夫碱的合成也是典型的可逆平衡限制反应,反应的产率受到平衡转化的强烈限制。因此,鉴于上述情况,本课题组选择连续反应精馏法合成N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺。
与酯化、水解和烷基化相比,席夫碱的连续反应精馏制备方法鲜有报道。为了工艺放大并优化工业生产过程,需要准确地确定其反应动力学,进一步指导工业反应器的设计,然而合成席夫碱的反应动力学目前在文献中尚未见报道。因此,在本论文中研究了N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺的合成反应动力学,同时在连续反应精馏塔中合成该席夫碱。此外,还采用该方法合成了其它几种席夫碱(图 2),与间歇法相比均具有较好结果,从而为席夫碱的连续化生产奠定基础。

|
图 1 反应路线图 Fig.1 Synthetic route of the Schiff base |
|
图 2 其他席夫碱的合成 Fig.2 Synthetic route of other Schiff bases |
试剂:2-甲基-6-乙基苯胺(化学纯,中农发河南农化有限公司),2, 6-二甲基苯胺(分析纯,沃凯化工科技有限公司),2, 6-二乙基苯胺(化学纯,中农发河南农化有限公司),2, 6-二乙基-4-甲基苯胺(化学纯,中农发河南农化有限公司),甲氧基丙酮(化学纯,山东乔昌化学有限公司),环己酮(分析纯,国药化学试剂有限公司),甲苯(分析纯,国药化学试剂有限公司),硫酸(分析纯,国药化学试剂有限公司)。
仪器:安捷伦气相色谱仪(7890B,上海莱睿科学仪器有限公司),蠕动泵(BT100-2J,保定兰格恒流泵有限公司),水份测定仪(ZSD-1,上海市安亭电子仪器厂),反应精馏填料塔(天大北洋化工实验设备公司)。
检测方法:目标产物的收率由GC (气相色谱仪,gas chromatograph)测定,具体条件为:色谱柱:SE-3石英毛细管柱,柱长50 m;氢气和载气氮气的柱前压为0.1 MPa,空气柱前压为0.03 MPa;进样量:0.1 μL;进样温度:250 ℃;FID检测温度:280 ℃;程序升温:80 ℃保持5 min,之后以10 ℃·min-1的速率升至250 ℃,保持2 min。以苯甲醇作为内标物,标定各个组分的实际含量。
3 动力学模型 3.1 实验方法先将分水器里加满甲苯,以维持反应体系体积不变。分别将32.59 g甲氧基丙酮(B)、80 g甲苯、0.12 g稀硫酸和50 g 2-甲基-6-乙基苯胺(A)预热到指定的温度后混合。通过调节反应体系真空度,改变温度进行实验。使用注射器定时取样进行GC分析,实验装置如图 3所示。

|
图 3 动力学测定装置 Fig.3 Schematic diagram of the kinetic measurement setup 1. oil bath pot 2. thermometer 3. sampling needle 4. water trap 5. condenser pipe 6. vacuum pump |
在反应过程中,由于甲苯与水形成共沸物,将反应生成的水连续不断地移出,因此可近似认为反应体系中水的浓度很低,且不随反应时间而增加。据此,设想该反应可近似用二级不可逆反应动力学[19-20]来描述。其动力学方程为式(1):
| $ - \frac{{{\rm{d}}{C_{\rm{A}}}}}{{{\rm{d}}t}} = k{C_{\rm{A}}}{C_{\rm{B}}}$ | (1) |
由反应初始条件可得
| ${C_{{\rm{A}}, 0}} = {C_{{\rm{B}}, 0}}$ | (2) |
| ${C_{\rm{A}}} = {C_{{\rm{A}}, 0}}\left( {1 - x} \right)$ | (3) |
| ${C_{\rm{B}}} = {C_{{\rm{B}}, 0}}\left( {1 - x} \right)$ | (4) |
由上式可得
| $ - \frac{{{\rm{d}}{C_{\rm{A}}}}}{{{\rm{d}}t}} = - \frac{{{\rm{d}}{C_{{\rm{A}}, 0}}\left( {1 - x} \right)}}{{{\rm{d}}t}} = {C_{{\rm{A}}, 0}}\frac{{{\rm{d}}x}}{{{\rm{d}}t}}$ | (5) |
| ${C_{{\rm{A}}, 0}}\frac{{{\rm{d}}x}}{{{\rm{d}}t}} = kC_{{\rm{A}}, 0}^2{\left( {1 - x} \right)^2}$ | (6) |
积分得
| $\frac{1}{{1 - x}} = {C_{{\rm{A}}, 0}}kt + {C_{{\rm{A}}, 0}} \cdot c$ | (7) |
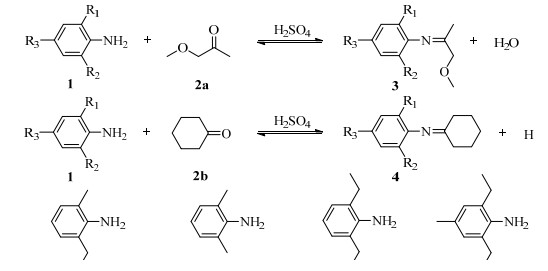
由图 4可知,(1-x)-1与时间t呈线性关系,且相关性较好,间接证明了该合成过程采用二级不可逆反应动力学方程式拟合数据是合理的。为保证等温反应,将反应物分别预热再混合,在混合过程中,反应已经进行,故混合后立即取样时,初始计时t下的反应已经开始,x > 0,因此未过(0,1)点。根据所得直线的斜率求得反应速率常数k,其结果列于表 1中。
|
|
表 1 不同温度下的反应速率常数 Table 1 Reaction rate constants at different temperatures |
|
图 4 不同温度下(1-x)-1与时间 t的关系图 Fig.4 Relationship between (1-x)-1 and t at different temperatures |
根据Arrhenius关系式,
| $k = A\exp \left( { - \frac{{{E_{\rm{a}}}}}{{RT}}} \right)$ | (8) |
| $\ln k = - \frac{{{E_{\rm{a}}}}}{{RT}} + \ln A$ | (9) |
由表 1数据,作图 5,反应的活化能Ea = 17.63 kJ·mol-1,指前因子A = 0.801 0 L×(mol·min)-1。

|
图 5 反应速率常数与温度的关系 Fig.5 Relationship between reaction rate constant and temperature |
基于二级不可逆模型的假定,研究对MEA与MOA反应的动力学进行分析,并证明了假定的正确性。同时,计算不同温度下的反应速率常数、活化能和指前因子,为后续精馏塔的模拟提供数据。
4 连续反应精馏实验 4.1 间歇反应在装有温度计、分水器、磁子的500 mL三口烧瓶中,加入75 g 2-甲基-6-乙基苯胺(MEA)和83 g甲氧基丙酮(MOA),以150 g甲苯作为带水剂,0.5 g稀硫酸(w = (3~5)%)作为催化剂,在0.075 MPa的真空度下,80 ℃回流6 h。反应结束后,冷却降温,取样,GC检测。
3a : 1H NMR (500 MHz, CDCl3) δ(10-6): 1.11~1.14 (3H, t, J= 7.5 Hz), 1.67 (3H, s), 1.99 (3H, s), 2.30~2.41 (2H, m, J = 9.1 Hz), 3.48 (3H, s), 4.19 (2H, s), 6.92~ 6.95 (1H, t, J = 7.5 Hz), 7.00~7.05 (2H, q, J = 8.3 Hz); 13C NMR (126 MHz, CDCl3) δ(10-6): 13.85, 16.93, 17.92, 24.42, 58.84, 123.11, 125.40, 125.96, 127.86, 131.73, 147.46, 169.51.
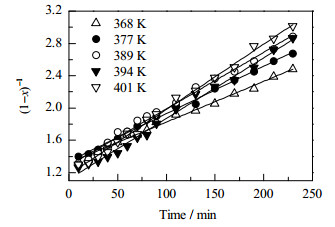
4.2 初始半连续反应连续化实验在反应精馏塔上进行,塔釜体积为500 mL,塔径为Φ32 mm,内装Φ3 mm×3 mm的θ环填料,填料段高度为1 500 mm。塔体采用玻璃材质,塔体外壁涂以特殊的透明膜通电加热保温,在操作过程中能清楚地观察到塔内气液流动状况,塔壁保温手动控制。精馏塔上平均分布着5个进料口,顶部进料口a距离填料顶端约250 mm,实验装置如图 6所示。实验中,根据进料位置的不同,改变精馏段和提馏段的高度。
具体操作为:将甲苯加入釜底,通过再沸器形成上升蒸汽为反应提供气升量,待塔顶温度稳定后,将2-甲基-6-乙基苯胺和甲氧基丙酮按一定的摩尔比、进料速度从塔侧进料,稀硫酸加入到MOA中一起进料。稳定后塔顶馏出物组分为甲苯85%~87%、MOA 12%~14%、水0.5%~1.0 %,流量为3.5 mL·min-1,分水器上层液(甲苯85%~87%、MOA 12%~14%、水0.02%~0.05%)从塔侧重新进入塔内进行循环,夹带剂甲苯与水和MOA形成三相共沸物,将水带离反应体系。由于回流的夹带剂从塔中部重新进入塔内,其浓度在塔下段较高(如图 6)。反应过程中定时取样,GC检测各组分的含量。
|
图 6 初始半连续反应精馏塔 Fig.6 Schematic diagram of the initial semi-continuous reactive distillation column 1, 2. peristaltic pump 3. temperature probe 4. condenser pipe 5. electromagnet 6. water trap 7. reboiler 8. liquid storage bottle 9. vacuum pump |
通过对反应产物进行GC检测,发现采用半连续方法时,釜底残留较多的MEA,表明有一部分MEA未参与反应。为了促进MEA的转化,对半连续方法进行改进,设计了塔釜物料的循环和连续出料,填料部分及精馏塔的结构参数与半连续操作过程一致,具体如图 7所示。开启循环后,可以让釜底的MEA再次进入塔内,与塔中的MOA进行反应,提高反应转化率,塔釜物料出料与循环的流量比为5:2。反应过程中定时取样,GC检测各组分的含量。

|
图 7 改进全连续反应精馏塔 Fig.7 Schematic diagram of the improved fully continuous reactive distillation column 1, 2, 3, 4, 11. peristaltic pump 5. temperature probe 6. condenser pipe 7. electromagnet 8. watertrap 9. reboiler 10, 12. liquid storage bottle 13. vacuum pump |
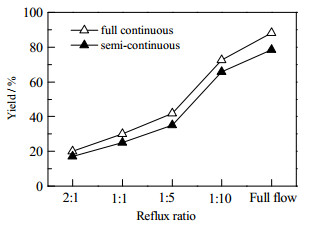
回流比越小,塔顶的H2O被移出体系的越多,促进平衡正向移动,目标产物的收率越高。为尽可能提高目标产物的收率,应将反应生成水尽快移走,因此反应回流比应越小越好,当采用全外流时,水被带离体系的程度达到最大。由图 8可知,无论是半连续还是全连续,回流比对反应的影响都显著,回流比越小,产物收率越高,故选择全外流进行反应。
|
图 8 回流比对反应的影响 Fig.8 Effects of reflux ratio on reaction yield |
以固定的摩尔比(xMEA:xMOA = 1:1.7),进料速度(uMEA/uMOA = 0.11/0.19 mol·h-1),采用全外流的方式反应。将高沸点组分2-甲基-6-乙基苯胺从上端进料,低沸点组分甲氧基丙酮从下端进料。由于MOA与甲苯共沸,MOA随着甲苯蒸汽上升,在塔中部与MEA接触反应。反应物在精馏塔上的接触时间主要由进料位置决定,进料口位置相差越大,反应物的停留时间越长,而停留时间直接影响反应转化率。由表 2可得,采用全连续方式,MEA从a号进料口进料,MOA从c号进料口进料,塔釜物料从d号进料口循环最佳。此时,反应主要发生在a-c段,精馏主要发生在c口以下,少量未反应原料在a口以上、c口以下继续反应,以提高反应转化率。
|
|
表 2 不同进料位置对实验的影响 Table 2 Effects of different feeding positions on the experiment |
为了考察进料速率对反应的影响,在上述最佳进料方式下,仅改变进料速率进行实验。由图 9可得,进料速率越慢,停留时间越长,收率越高。但在进料速率低于0.11/0.19 mol·h-1后,收率基本保持不变。综合考虑反应能耗、周期等影响,选择进料速率MEA/MOA为0.11/0.19 mol·h-1较为合适。

|
图 9 进料速率反应的影响 Fig.9 Effects of feed speed on reaction yield |
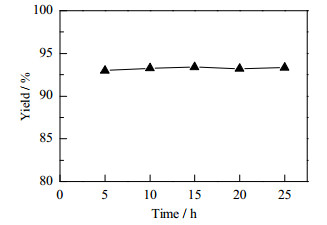
为考察实际操作的稳定性,将2-甲基-6-乙基苯胺从塔顶a号进料口进料、速率为0.11 mol·h-1,甲氧基丙酮从塔中c号进料口进料、速率为0.19 mol·h-1,塔釜物料从d号进料口进行循环,采用全外流的方式反应。保持装置连续稳定运行25 h,并在不同的时间节点对塔釜取样分析。由图 10可知,在整个制备过程中,收率基本保持不变,装置运行平稳。
|
图 10 反应时间对反应的影响 Fig.10 Effects of reaction time on reaction yield |
此外,将连续反应精馏法与间歇法合成N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺的收率进行对比。由图 11可知:(1)摩尔比(xMEA:xMOA)越小,目标产物收率越高,但当摩尔比小于1:1.7时,收率基本保持不变,故选择摩尔比为1:1.7;(2)摩尔比(xMEA:xMOA)相同时,连续反应精馏法收率远高于间歇法,主要原因是反应精馏法可以迅速将反应生成的水带出体系,以促进平衡正向移动;(3)达到相同收率时,连续反应精馏法所需要的摩尔比远大于间歇法,可以大大减少甲氧基丙酮的用量,降低原料成本。

|
图 11 间歇法与连续反应精馏法对比 Fig.11 Comparison of batch and continuous reactive distillation |
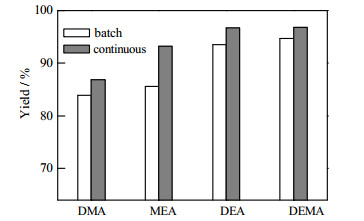
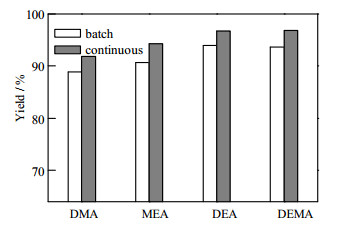
采用连续反应精馏法成功制备得到3a后,作者对该方法进行了拓展,采用相同的反应条件,更换不同的苯胺和酮进行连续化合成研究,以考察其普适性。包括2-甲基-6-乙基苯胺1a (MEA)、2, 6-二甲基苯胺1b (DMA,2, 6-dimethylaniline)、2, 6-二乙基苯胺1c (DEA,2, 6-diethylaniline)、2, 6-二乙基-4-甲基苯胺1d (DEMA,2, 6-diethyl-4-methylaniline)、甲氧基丙酮2a (MOA),环己酮2b (CYC,cyclohexanone)。图 12和图 13给出了间歇法和连续反应精馏法的收率对比,由图可得:(1)供电子基团越多,产物收率越高;(2)基团的供电子能力越强,产物收率越高;(3)对不同的苯胺而言,连续反应精馏法的收率均比间歇法的高,证明了该方法适合多种席夫碱的合成。
|
图 12 苯胺与MOA反应的间歇法与连续法的收率比较 Fig.12 Comparison of batch and continuous aniline and MOA reaction yields |
|
图 13 苯胺与CYC反应的间歇法与连续法的收率比较 Fig.13 Comparison of batch and continuous aniline and CYC reaction yields |
3b:1H NMR (500 MHz, CDCl3) δ(10-6): 1.69 (3H, s), 2.03 (6H, s), 3.51 (3H, s), 4.22 (2H, s), 6.90~6.95 (1H, q, J = 8.3 Hz), 7.02~7.04 (2H, d, J = 10.0 Hz);13C NMR (126 MHz, CDCl3) δ(10-6):16.69, 16.75, 17.78, 17.86, 58.79, 58.83, 58.86, 121.63, 122.92, 122.95, 125.57, 127.86, 147.95, 169.49.
3c:1H NMR (500 MHz, CDCl3) δ(10-6): 1.15~1.18 (6H, t, J = 7.5 Hz), 1.71 (3H, s), 2.30~2.35 (2H, q, J = 8.3 Hz), 2.39~2.44 (2H, q, J = 8.3 Hz), 3.51 (3H, s), 4.23 (2H, s), 7.00~7.03 (1H, t, J = 7.5 Hz), 7.08~7.09 (2H, d, J = 5.0 Hz);13C NMR (126 MHz, CDCl3) δ(10-6): 13.77, 17.11, 24.32, 58.24, 123.25, 125.83, 131.44, 146.93, 169.47.
3d:1H NMR (500 MHz, CDCl3) δ(10-6): 1.13~1.16 (6H, t, J = 7.5 Hz), 1.71 (3H, s), 2.28~2.37 (7H, m, J = 7.5 Hz), 3.50 (3H, s), 4.22 (2H, s), 6.88~6.90 (2H, d, J = 10.0 Hz);13C NMR (126 MHz, CDCl3) δ(10-6): 13.90, 17.04, 20.69, 24.32, 58.79, 126.59, 126.73, 131.34, 132.31, 144.38, 169.63.
4a:1H NMR (500 MHz, CDCl3) δ(10-6): 1.16~1.19 (3H, t, J = 7.5 Hz), 1.62~1.69 (4H, m, J = 11.7 Hz), 1.88~1.89 (2H, d, J = 5.0 Hz), 1.99~2.02 (2H, t, J = 7.5 Hz), 2.04 (3H, s), 2.32~2.48 (2H, m, J = 11.4 Hz), 2.56~2.58 (2H, m, J = 5.0 Hz), 6.92~6.95 (1H, t, J = 7.5 Hz), 7.01~7.06 (2H, m, J = 8.3 Hz);13C NMR (126 MHz, CDCl3) δ(10-6): 13.78, 18.10, 24.32, 25.83, 27.76, 31.65, 38.72, 122.62, 125.66, 132.33, 147.59, 173.96.
4b:1H NMR (500 MHz, CDCl3) δ(10-6): 1.58~1.66 (4H, t, J = 20.0 Hz), 1.85~1.94 (4H, m, J = 11.3 Hz), 2.01 (6H, s), 2.52~2.55 (2H, m, J = 7.5 Hz), 6.84~6.87 (1H, t, J = 7.5 Hz), 6.97~6.99 (2H, d, J = 10.0 Hz);13C NMR (126 MHz, CDCl3) δ(10-6): 18.00, 25.87, 26.96, 27.89, 31.53, 38.70, 122.45, 126.25, 127.64, 148.21, 174.16.
4c:1H NMR (500 MHz, CDCl3) δ(10-6): 1.16~1.19 (6H, t, J = 7.5 Hz), 1.62~1.69 (4H, m, J = 11.7 Hz), 1.84~1.89 (2H, t, J = 12.5 Hz), 1.99~2.02 (2H, t, J = 7.5 Hz), 2.30~2.47 (4H, m, J = 9.4 Hz), 2.56~2.58 (2H, m, J = 5.0 Hz), 6.97~7.00 (1H, t, J = 7.5 Hz), 7.05~7.07 (2H, d, J = 10.0 Hz);13C NMR (126 MHz, CDCl3) δ(10-6): 13.72, 24.24, 25.80, 26.70, 27.65, 31.74, 38.71, 122.76, 125.50, 132.07, 147.02, 173.78.
4d:1H NMR (500 MHz, CDCl3) δ(10-6):1.14~1.17 (6H, t, J = 7.5 Hz), 1.61~1.69 (4H, m, J = 10.0 Hz), 1.88 (3H, s), 2.00~2.02 (2H, t, J = 5.0 Hz), 2.26~2.32 (4H, m, J = 7.5 Hz), 2.37~2.45 (2H, m, J = 8.0 Hz), 2.55~2.57 (2H, t, J = 5.0 Hz), 6.87 (2H, s);13C NMR (126 MHz, CDCl3) δ(10-6): 13.85, 20.98, 24.22, 26.71, 31.63, 38.74, 126.27, 131.81, 132.00, 144.43, 173.97.
6 结论(1) 首次对席夫碱(N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺)的合成反应进行动力学研究,证明该反应过程是拟二级动力学反应,拟合得到了不同温度下的反应速率常数,计算出反应活化能Ea = 17.63 kJ·mol-1,指前因子A = 0.801 0 L×(mol·min)-1。
(2) 首次进行了席夫碱的连续化合成,采用连续反应精馏法合成了N-(2-甲基-6-乙基苯基)-1-甲氧基丙基-2-亚胺,收率可达93.27%。
(3) 通过实验确定了连续反应精馏法的最佳进料方式:采用全外流的方式反应,2-甲基-6-乙基苯胺从a号进料口进料、速率为0.11 mol·h-1,甲氧基丙酮从c号进料口进料、速度为0.19 mol·h-1,塔釜物料从d号进料口进行循环。
(4) 将该方法拓展到其他多种席夫碱的合成中,与间歇法相比结果均较好,验证了连续反应精馏法的适用性,为席夫碱的连续化生产提供了一种高效的方法。
符号说明:
|
|
| [1] |
KATWAL R, KAUR H, KAPUR B K. Applications of Copper-Schiff's base Complexes: A review[J]. Scientific Reviews & Chemical Communications, 2013, 3(1): 1-15. |
| [2] |
MAHAJAN P G, KOLEKAR G B, PATIL S R. Recognition of D-penicillamine using Schiff base centered fluorescent organic nanoparticles and application to medicine analysis[J]. Journal of Fluorescence, 2017, 27(3): 829-839. DOI:10.1007/s10895-016-2019-5 |
| [3] |
BHAT F A, JAN G M, BOKED H R. Catalytic oxidation of phenols, benzyl alcohols and olefins using Schiff base metal complexes—A review[J]. American Journal of PharmTech Research, 2016, 6(5): 814-822. |
| [4] |
GHAMES A, DOUADI T, ISSAADI S, et al. Theoretical and experimental studies of adsorption characteristics of newly synthesized Schiff bases and their evaluation as corrosion inhibitors for mild steel in 1 mol·L-1 HCl[J]. International Journal of Electrochemical Science, 2017, 12(6): 4867-4897. |
| [5] |
BADER N R. Applications of Schiff's bases chelates in quantitative analysis: A review[J]. Rasayan Journal of Chemistry, 2010, 3(4): 660-670. |
| [6] |
KOCHMAN M A, BIL A, MORRISON C A. Hybrid QM/QM simulations of photochemical reactions in the molecular crystal N-salicylidene-2-chloroaniline[J]. Physical Chemistry Chemical Physics, 2013, 15(26): 10803-10816. DOI:10.1039/c3cp51263k |
| [7] |
THATTE C S, RATHNAM M V, PISE A C. Chitosan-based Schiff base-metal complexes (Mn, Cu, Co) as heterogeneous, new catalysts for the β-isophorone oxidation[J]. Journal of Chemical Sciences, 2014, 126(3): 727-737. DOI:10.1007/s12039-014-0601-4 |
| [8] |
MACHADO K, TAVARES P B, MISHRA G S. Synthesis and application of FeIII, NiII and MnII complexes anchored to HMS as efficient catalysts for cycloalkane oxyfunctionalization[J]. Journal of Molecular Catalysis A: Chemical, 2014, 383: 159-166. |
| [9] |
姜鹏.一种亚胺不对称催化加氢的方法: China, 102951980[P]. 2013-03-06. JIANG P. Method for asymmetric catalytic hydrogenation of imine: China, 102951980[P]. 2013-03-06. |
| [10] |
林双政.一种酸性催化脱水合成N-芳基酮亚胺的方法: China, 102898329[P]. 2013-01-30. LIN S Z. Method for synthesizing N-aryl ketimine by acid catalytic dehydration: China, 102898329[P]. 2013-01-30. |
| [11] |
XI H, OMAR M, CARL T, et al. Preparation of an N-sec-alkyl 2, 6-disubstituted aniline: a key intermediate in the divergent synthesis of S-Metolachlor metabolites[J]. Tetrahedron, 2016, 57(48): 5363-5367. DOI:10.1016/j.tetlet.2016.10.077 |
| [12] |
VIJAY V, DABHOLKA R, GANDHALE S N, et al. Novel β-lactum-1, 2, 3-tariazoles their synthesis and antibacterial activity[J]. Heterocyclic Letters, 2012, 2(1): 91-98. |
| [13] |
景闻华.除草剂精异丙甲草胺的合成工艺研究[D].杭州: 浙江工业大学, 2017. JING W H. Study on the synthetic process of herbicide s-metolachlor[D]. Hangzhou: Zhejiang University of Technology, 2017. |
| [14] |
TYAGI S, GICHINGA M, KEY J A, et al. A reactive distillation process to produce 5-hydroxy-2-methyl-1, 3-dioxane from mixed glycerol acetal isomers[J]. Organic Process Research & Development, 2012, 16(5): 1141-1145. |
| [15] |
WENG K C, LEE H Y. Design of hybrid heat-integrated configuration for indirect reactive distillation processes[J]. Computer-Aided Chemical Engineering, 2015, 37: 1469-1474. DOI:10.1016/B978-0-444-63577-8.50090-5 |
| [16] |
MALLAIAH M, REDDY G V. Optimization studies on a continuous catalytic reactive distillation column for methyl acetate production with response surface methodology[J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 12(69): 25-40. |
| [17] |
HUANG Y, XU W, ZHU L, et al. Study of technology on production of ethylene glycol by catalytic hydrolysis of ethylene oxide[J]. Science & Technology in Chemical Industry, 2006, 6(1): 13-17. |
| [18] |
KHLEBNIKOVA E, IVASHKINA E, DOLGANOVA I. Benzene alkylation with ethylene: The way to increase the process efficiency[J]. Chemical Engineering and Processing: Process Intensification, 2017, 12(120): 234-240. |
| [19] |
HUANG W, LI H, WANG R, et al. Application of the aldolization reaction in separating the mixture of ethylene glycol and 1, 2-butanediol: Kinetics and reactive distillation[J]. Chemical Engineering and Processing, 2017, 120: 173-183. DOI:10.1016/j.cep.2017.07.004 |
| [20] |
ZUO C, PAN L, CAO S, et al. Catalysts, kinetics, and reactive distillation for methyl acetate synthesis[J]. Industrial & Engineering Chemistry Research, 2014, 53(26): 10540-10548. |




