2. 浙江海拓环境技术有限公司,浙江 杭州 310015;
3. 浙江一清环保工程有限公司,浙江 杭州 310018
2. Zhejiang Haituo Environmental Technology Co. Ltd., Hangzhou 310015, China;
3. Zhejiang Yeking Environmental Engineering Co. Ltd., Hangzhou 310018, China
近年来,工业生产过程中排放的大量挥发性有机物(volatile organic compounds, VOCs)严重污染了大气环境。氯苯(monochlorobenzene, CB)是一种常见的挥发性有机物,常被用作有机溶剂以及染料、医药、农药有机合成中间体。它性质稳定,极易在环境中迁移残留,并且具有强烈的“三致效应”,被美国EPA列入优先控制污染物名单[1-3]。当前,针对氯苯废气的处理方法主要包括燃烧、吸附、催化氧化、生物降解以及化学-生物耦合技术,其中生物法因具有反应条件温和、经济成本低、二次污染少等优点而被广泛关注[4-8]。研究表明,Acidovorax avenae[9]、Planococcus sp.[10]、Ralstonia pickettii[11]和Acinetobacter calcoaceticus[12]等细菌能有效降解氯苯。本课题组也在前期研究中分离获得一株氯苯高效降解菌(Delftia tsuruhatensis LW26),该菌能以氯苯为唯一碳源和能源生长,最大比生长速率达到0.42 h-1 [13]。尽管利用高效降解菌可强化氯苯生物降解过程,但氯苯水溶性低,传统生物反应器处理氯苯废气时传质阻力较大,因此处理效率并不高[14]。WANG等单独采用生物滤塔处理浓度为500 mg·m-3的氯苯废气,生物去除率仅为60% [15]。
为提高有机污染物的生物处理效果,DAUGULIS等提出在水相中引入非水相物质构成两相分配生物反应体系(two-phase partitioning bioreactor, TPPB),进而强化疏水性VOCs的气液传质过程,同时非水相还可为微生物提供缓冲和保护作用,降低高浓度、高毒性的底物或中间产物对生物的毒害作用[16]。常用的非水相有十六烷、硅油、疏水性离子液体等[17]。其中,硅油无生物毒性,且一般情况下不能被微生物降解,是比较理想的非水相介质,有研究表明它可以提高邻二甲苯、己烷、ɑ-蒎烯、苯乙烯等的处理效果[18-22],但也有一些研究发现一些污染物的去除效率在添加硅油的条件下并无明显增加[23]。
搅拌式生物反应器是常见的生物洗涤器,本文以硅油作为有机相,考察硅油对搅拌式生物反应器处理氯苯废气的影响,并基于已有的传质理论模型对氧气和氯苯在油水两相中的传质规律进行分析,探讨硅油的强化机制,从而为反应体系的进一步优化提供依据。
2 实验材料与方法 2.1 菌种来源氯苯降解菌为本实验室筛选获得的Delftia tsuruhatensis LW26 (GenBank登录号:KP966097),该菌株保存于中国典型培养物保藏中心,编号为M2015113。
2.2 培养基无机盐培养基:CaCl2,0.023 g·L-1;MgSO4·7H2O,0.2 g·L-1;(NH4)2SO4,2.5 g·L-1;KH2PO4,1.0 g·L-1;Na2HPO4·12H2O,4.5 g·L-1;微量元素母液[24]1 mL·L-1,控制pH 7.0~7.5。
2.3 实验装置和方法实验装置如图 1所示。反应器高30 cm,内径18 cm,有效容积4 L。采用环形空气分布器布气,内置双层六片平直叶圆盘涡轮搅拌器,沿内壁装有4块挡板以提高混合效果,并设有温度、pH、溶解氧(DO)以及搅拌速率的自动控制系统。氯苯经空气吹脱后挥发,并与另一路空气在气体混合瓶中混合,通过调节流量控制模拟氯苯废气的进气浓度与流量。氯苯废气经空气分布器自上而下进入反应器主体,经处理后从反应器顶部出气口排出至尾气处理装置。进气和出气管路上分别设有气体取样口。
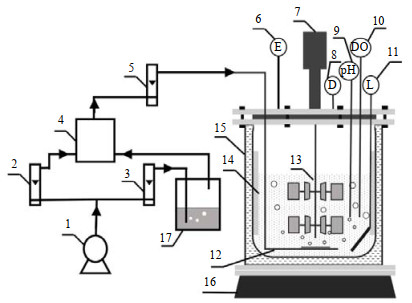
|
图 1 实验装置 Fig.1 Schematic diagram of the bioreactor 1. air pump 2, 3, 5. flowmeter 4. mixing unit 6. exhaust gas treatment device 7. agitation motor 8. liquid inlet 9. pH control module 10. dissolved oxygen sensor 11. temperature sensor 12. gas inlet 13. stirrer 14. baffle 15. water-bath jacket 16. heating base 17. monochlorobenzene |
实验所采用的硅油为二甲基硅油,黏度200 mPa·s,neat (25 ℃)。研究硅油添加对系统处理氯苯废气性能影响时,预先进行菌种扩大培养,培养24 h后在其中一个反应器中添加体积10%的硅油,另一个反应器作为空白对照。运行过程中,均维持系统温度30 ℃,pH 7.0~7.5,每天约更换600 mL营养液(硅油和培养基混合液)。更换时,先将排出的营养液进行静置分层处理,然后回收硅油(回收率约90%)并将其与新鲜培养基混合,添加少量新硅油(添加量为回收过程中损失的硅油量)后加入至反应器。
氯苯去除率(removal efficiency, RE)和去除负荷(elimination capability, EC)的计算式分别如下:
| ${\rm{RE = }}\frac{{C_{\rm{g}}^{{\rm{in}}} - C_{\rm{g}}^{{\rm{out}}}}}{{C_{\rm{g}}^{{\rm{in}}}}} \times 100\% $ | (1) |
| ${\rm{EC = }}\frac{{{Q_{\rm{g}}}}}{{{V_{\rm{r}}} \times 3600}}(C_{\rm{g}}^{{\rm{in}}} - C_{\rm{g}}^{{\rm{out}}})$ | (2) |
式中,Cgin为进气氯苯浓度,g·m-3;Cgout为出气氯苯浓度,g·m-3;Qg为气体流量,m3·s-1;Vr为反应器有效容积,m3。
2.4 氧传质系数的测定实验采用溶氧电极法[25-26]在非培养条件下测定氧气体积传质系数(KLaO2)。当反应器中溶液处于完全混合状态,且无微生物呼吸作用时,单位反应体积的氧传质速率符合下式[27]:
| $\frac{{{\rm{d}}{C_{{\rm{L, }}{{\rm{O}}_{\rm{2}}}}}}}{{{\rm{d}}t}} = {K_{\rm{L}}}{a_{{{\rm{O}}_{\rm{2}}}}}\left( {C_{{\rm{L, }}{{\rm{O}}_{\rm{2}}}}^{\rm{*}}{ - _{}}{C_{{\rm{L, }}{{\rm{O}}_{\rm{2}}}}}} \right)$ | (3) |
式中,CL,O2*为操作条件下液相中的饱和溶解氧浓度,g·m-3;
采用Agilent 6890气相色谱仪(Agilent,美国)定量分析氯苯浓度。色谱柱为HP-Innowax型毛细管柱(30 m × 0.32 mm × 0.5 μm)。气相色谱条件:进样口温度200 ℃;柱温100 ℃;检测器温度(FID) 180 ℃;载气为N2;总流量为1 mL·min-1,分流比30:1;气体进样量为1 mL。每个样品平行测定3次。
2.5.2 生物量采用Hitachi U-2910型紫外/可见分光光度计(Hitachi High Technologies,日本)在600 nm波长下测定菌体的吸光度(OD600),根据吸光度与生物量干重间的标准曲线计算菌体细胞干重。
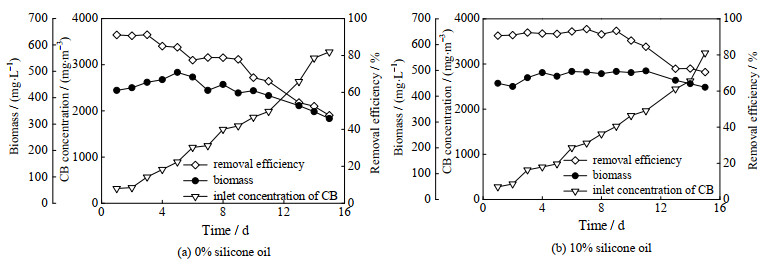
3 结果与讨论 3.1 硅油添加对搅拌式生物反应器处理氯苯性能的影响保持空床停留时间(empty bed retention time, EBRT) 60 s不变,考察不同氯苯进气浓度条件下硅油添加对搅拌式生物反应器处理氯苯效果的影响,结果如图 2所示。从图中可以看出,在进气量240 L·h-1、进气浓度1 100~3 300 mg·m-3条件下,含10%硅油的生物反应器比普通生物反应器的氯苯去除率高10%~23%,最大去除负荷可达137 g·m-3·h-1,而且当氯苯浓度高达3 244 mg·m-3时,去除率仍能维持在70.5%。普通搅拌式生物反应器的最大去除负荷相对较低,为99 g·m-3·h-1,当进气浓度增加至3 200 mg·m-3左右时,氯苯去除率仅为47.6%。说明添加硅油能有效提高搅拌式生物反应器处理氯苯废气的效果,且使其更能适应高浓度的氯苯废气。经测算,本反应器每天随营养液更换排放的液相氯苯量占其总去除量的0.5%以下,因此上述体系中氯苯的去除主要是源于其生物降解作用。
|
图 2 无硅油和含硅油生物反应器中氯苯进口浓度、去除率、菌体浓度随时间的变化 Fig.2 Inlet CB concentration, CB removal efficiency, and biomass in the bioreactors without and with silicone oil |
由图 2还可以看出,含硅油的搅拌式生物反应器中生物量相对稳定,而普通搅拌式生物反应器中的生物量随氯苯进口浓度的增加呈下降趋势。这可能是因为氯苯本身具有较强的生物毒性,普通搅拌式生物反应器中持续高浓度氯苯抑制了LW26菌的生长和降解活性,菌体繁殖的速度跟不上每天更换部分培养基损失的菌体数量,进而导致体系中菌体浓度下降。而添加了硅油的反应体系中,由于氯苯在气相和硅油之间的分配系数(0.000 66)远小于其在气相和水相之间的分配系数(0.24),因此硅油对氯苯具有良好的亲和力,可以吸收大量氯苯,从而使水相中的氯苯可维持在较低的浓度,降低其对LW26菌的毒性。
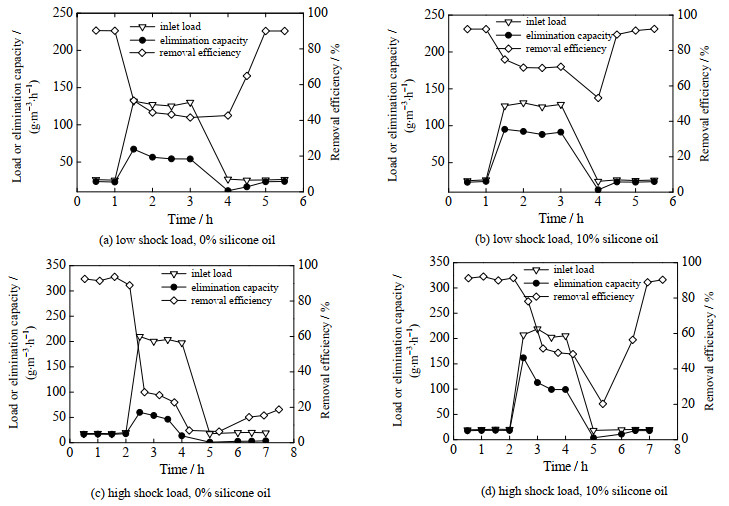
3.2 硅油添加对搅拌式生物反应器抗冲击负荷性能的影响在实际工业废气处理过程中,气体浓度波动较大,短时间内污染物浓度可能会突然升高,形成负荷冲击。因此,分别考察低冲击和较高冲击负荷条件下硅油添加对搅拌式生物反应器处理性能的影响,结果见图 3。由图 3(a)和(b)可以看出,当进气负荷由25 g·m-3·h-1突然提高5倍后,普通搅拌式生物反应器的去除率下降了44%,最低降至42%,而含硅油的反应器中氯苯去除率仅下降约19%,并稳定在70%左右。由图(c)和(d)可知,10倍冲击负荷条件下,普通反应器和含硅油反应器中的氯苯去除率分别由90%以上降低至约26%和50%。当冲击负荷结束后,经历了低冲击负荷的两个反应体系其氯苯降解能力均能恢复至正常水平;而经历了高冲击负荷后,含硅油体系的氯苯去除效果可以逐渐恢复,恢复时间约为2.5 h,但不含硅油的体系2.5 h后氯苯去除率仅恢复至15.8%。因此,添加硅油可以大幅增强搅拌式生物反应器对高浓度冲击负荷的抵抗能力,有利于实际工程中克服气体浓度波动带来的影响。
|
图 3 不同冲击负荷条件下无硅油和含硅油生物反应器中进气负荷、去除负荷、去除率随时间的变化 Fig.3 Inlet load, elimination capacity, and removal efficiency of CB in the bioreactors without and with silicone oil under different transient shock load conditions |
氧气难溶于水,室温下氧气在水中的溶解度约为0.25 mol·m-3。然而,对于好氧微生物而言,分子态氧是细胞呼吸电子传递链末端的电子受体。如果好氧生物降解污染物过程中供氧不足,则会抑制细胞的生长代谢,进而降低生物反应器的处理效率。因此,分析硅油对氧传质的影响。
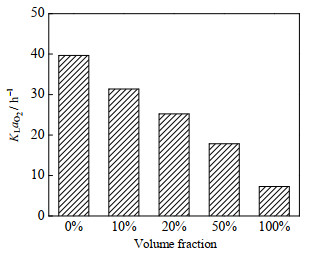
分别测定不同硅油比例条件下(0%,10%,20%,50%,100%)反应体系中的总氧传质系数,结果见图 4。随着硅油比例的增加,体系中的总氧传质系数逐渐减小。文献中也有类似报道,如NIELSEN等[28]以十六烷作为有机相,同样发现
|
图 4 硅油的添加量对氧传质系数的影响 Fig.4 Effects of silicone oil addition on oxygen mass transfer coefficient (agitation rate of 600 r·min-1, inlet flow of 2 L·min-1) |
进一步对反应体系中的氧传质速率进行分析。在非培养条件下,含硅油搅拌式生物反应器与普通搅拌式生物反应器的氧传质速率之比可以表示为[28]:
| $\frac{{{v_{\rm{2}}}}}{{{v_{\rm{1}}}}}{\rm{ = }}\frac{{{k_{\rm{L}}}{a_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}}(C_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}^{\rm{*}}{ - _{}}{C_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}}){V_{\rm{W}}} + {k_{\rm{L}}}{a_{{\rm{oil, }}{{\rm{O}}_{\rm{2}}}}}{K_{{\rm{oil/W}}}}(C_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}^{\rm{*}}{ - _{}}{C_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}}){V_{{\rm{oil}}}}}}{{{k_{\rm{L}}}{a_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}}(C_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}^{\rm{*}}{ - _{}}{C_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}}){V_{\rm{r}}}}}$ | (4) |
式中,v1为普通搅拌式生物反应器的氧传质速率,g·h-1;v2为含硅油的搅拌式生物反应器的氧传质速率,g·h-1;
上式可简化为:
| $\frac{{{v_{\rm{2}}}}}{{{v_{\rm{1}}}}}{\rm{ = 1 + }}\left( {\frac{{{k_{\rm{L}}}{a_{{\rm{oil, }}{{\rm{O}}_{\rm{2}}}}}{K_{{\rm{oil/W}}}}}}{{{k_{\rm{L}}}{a_{{\rm{W, }}{{\rm{O}}_{\rm{2}}}}}}}{\rm{ - }}1} \right) \cdot {\varphi _{{\rm{oil}}}}$ | (5) |
式中,
当硅油比例分别为0%和100%时,实验测得的反应体系中的氧传质系数即为
上述结果表明,尽管添加硅油导致总氧传质系数减小,但仍能提高氧的传质速率。主要原因可能是硅油对氧的增溶作用显著增大了传质推动力,进而促进了氧的传质。
3.4 氯苯传质特征的分析生物反应器处理有机废气时,底物的传质效果是影响反应器去除效率的关键因子[29-30]。根据文献报道,在液相均匀混合的反应器中,单位反应体积的VOCS传质速率R可以表示为[31-32]:
| $R = \frac{{{Q_{\rm{g}}}}}{{{V_{\rm{r}}}}}\beta _{\rm{s}}^{\rm{*}}\left( {C_{\rm{g}}^{{\rm{in}}} - {m_{{\rm{ef}}}}{C_{\rm{W}}}} \right)$ | (6) |
式中,Cgin为进口VOCs浓度,g·m-3;CW为VOCs在水相中的浓度,g·m-3;Qg为气体流量,m3·s-1;mef为VOCs在液相(水相或水油伪均相)中的亨利系数;βs*为VOCs从气相传质到液相(水相或水油伪均相)的最大分数(无量纲),理想的反应器设计应该使βs*= 1。
当体系达到热力学平衡时,则参数βs*满足如下关系式:
| $\ln \left( {1 - \frac{{C_{\rm{g}}^{{\rm{out}}}}}{{C_{\rm{g}}^{{\rm{in}}}}}} \right) = \ln \beta _{\rm{s}}^{\rm{*}} - \left( {\frac{{{Q_{\rm{g}}}}}{{{V_{\rm{r}}}}}E\beta _{\rm{s}}^{\rm{*}}} \right)t$ | (7) |
式中,Cgout为出口VOCs浓度,g·m-3;t为反应时间,s;E为无量纲参数。
利用该传质模型对单一水相及水油两相体系中的氯苯传质特性进行分析比较。在EBRT为60 s的条件下,分别测定求解普通搅拌式生物反应器和含10%硅油的搅拌式生物反应器中氯苯的βs*,结果见图 5。由图 5(a)和5(b)可知,两个体系中氯苯的吸收过程数据可以利用式(7)进行线性拟合,R2值均大于0.97。利用拟合结果求得普通反应器和含硅油反应器中的βs*分别为0.67和0.99,后者较前者增加了47.8%。另外,氯苯的βs*在含硅油反应器中接近1,说明该体系中绝大部分氯苯都由气相传质到了液相。因此,硅油显著提高了氯苯的气液传质效果,进而强化了搅拌式生物反应器对氯苯的处理效率。
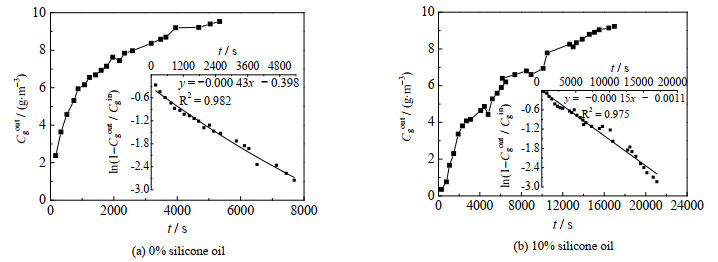
|
图 5 普通搅拌式生物反应器和含硅油搅拌式生物反应器中βs*的测定(EBRT = 60 s) Fig.5 Determination of βs* for bioreactors without and with silicone oil (EBRT = 60 s) |
(1) 含硅油的搅拌式生物反应器较普通搅拌式生物反应器氯苯去除率高10%以上,最大去除负荷是其1.4倍,且抗冲击负荷性能更好。硅油能有效强化搅拌式生物反应器处理氯苯废气尤其是高浓度氯苯废气的效果。
(2) 含硅油的搅拌式生物反应器中氧传质速率较普通搅拌式生物反应器高,硅油可促进氧的传质。
(3) 基于传质模型,拟合获得含硅油的搅拌式生物反应器和普通搅拌式生物反应器中氯苯的最大传质分数βs*分别为0.99和0.67,硅油的添加使βs*增加了47.8%,氯苯的气液传质效果得到显著改善。
符号说明:
Cgin —进气浓度,g·m-3 mef —氯苯在液相(水相或水油伪均相)中的亨利系数
Cgout —出气浓度,g·m-3 Qg —气体流量,m3·s-1
CL, O2 —t时刻液相中的溶解氧浓度,g·m-3 R —单位反应体积的氯苯传质速率,g·m-3·s-1
C*L, O2 —操作条件下液相的饱和溶解氧浓度,g·m-3 RE —氯苯去除率,%
CW —氯苯在水相中的浓度,g·m-3 v1 —单相反应器中的氧传质速率,g·h-1
CW, O2 —氧气在水相中的浓度,g·m-3 v2 —两相反应器中的氧传质速率,g·h-1
CW, O2* —氧气在水中的饱和浓度,g·m-3 Vr —反应器有效容积,m3
EC —氯苯去除负荷,g·m-3·h-1 Voil —硅油体积,m3
KLaO2 —总氧传质系数,h-1 VW —水相体积,m3
Koil/W —氧气在硅油和水相间的分配系数 βs* —氯苯的最大传质分数
kLaW, O2 —氧在水相中的体积传质系数,h-1 φoil —硅油的体积分数
kLaoil, O2 —氧在硅油中的体积传质系数,h-1
| [1] |
成卓韦, 林雯雯, 蒋轶锋, 等. 利用紫外预处理加强氯苯的生物滴滤净化[J]. 环境科学, 2010, 31(5): 1160-1166. CHENG Z W, LIN W W, JIANG Y F, et al. Using UV pretreatment to enhance biofiltration of chlorobenzene[J]. Environmental Science, 2010, 31(5): 1160-1166. |
| [2] |
ZHANG K K, SUN P, FAYE M C A S, et al. Characterization of biochar derived from rice husks and its potential in chlorobenzene degradation[J]. Carbon, 2018, 130: 730-740. DOI:10.1016/j.carbon.2018.01.036 |
| [3] |
ZHANG L, SAWELL S, MORALEJO C, et al. Heterogeneous photocatalytic decomposition of gas-phase chlorobenzene[J]. Applied Catalysis B:Environmental, 2007, 71(3/4): 135-142. |
| [4] |
郭海倩, 缪晶晶, 姜理英, 等. 低温等离子体-生物耦合系统对复合CVOCs的降解[J]. 环境科学, 2018, 39(2): 640-647. GUO H Q, MIAO J J, JAING L Y, et al. Composite CVOCs removal in a combined system of nonthermal plasma and a biotrickling filter[J]. Environmental Science, 2018, 39(2): 640-647. |
| [5] |
聂国锋, 李莎, 姜理英, 等. DBD协同CuO/MnO2耦合生物滴滤塔降解氯苯的工艺性能分析[J]. 环境科学学报, 2017, 37(2): 528-537. NIE G F, LI S, JIANG L Y, et al. Chlorobenzene removal in the coupling system consisting of DBD with CuO/MnO2 and biotrickling filter[J]. Acta Scientiae Circumstantiae, 2017, 37(2): 528-537. |
| [6] |
LHOTSKY O, KRAKOROVA E, MASIN P, et al. Pharmaceuticals, benzene, toluene and chlorobenzene removal from contaminated groundwater by combined UV/H2O2 photo-oxidation and aeration[J]. Water Research, 2017, 120: 245-255. DOI:10.1016/j.watres.2017.04.076 |
| [7] |
SUN P, WANG W, DAI X, et al. Mechanism study on catalytic oxidation of chlorobenzene over MnxCe1-xO2/H-ZSM5 catalysts under dry and humid conditions[J]. Applied Catalysis B:Environmental, 2017, 198: 389-397. |
| [8] |
CHENG Z, LI C, KENNES C, et al. Improved biodegradation potential of chlorobenzene by a mixed fungal-bacterial consortium[J]. International Biodeterioration & Biodegradation, 2017, 123: 276-285. |
| [9] |
MONFERRÁN V, ECHENIQUE J R, WUNDERLIN D A, et al. Degradation of chlorobenzenes by a strain of Acidovorax avenae isolated from a polluted aquifer[J]. Chemosphere, 2005, 61(1): 98-106. DOI:10.1016/j.chemosphere.2005.03.003 |
| [10] |
LI H, LIU Y H, LUO N, et al. Biodegradation of benzene and its derivatives by a psychrotolerant and moderately haloalkaliphilic Planococcus sp. strain ZD22[J]. Research in Microbiology, 2006, 157(7): 629-636. DOI:10.1016/j.resmic.2006.01.002 |
| [11] |
ZHANG L L, LENG S Q, ZHU R Y, et al. Degradation of chlorobenzene by strain Ralstonia pickettii L2 isolated from a biotrickling filter treating a chlorobenzene-contaminated gas stream[J]. Applied Microbiology and Biotechnology, 2011, 91(2): 407-415. DOI:10.1007/s00253-011-3255-x |
| [12] |
李明堂, 郝林琳, 崔俊涛, 等. 好氧氯苯降解菌的分离鉴定[J]. 微生物学报, 2010, 50(5): 586-592. LI M T, HAO L L, CUI J T, et al. Identification and characterization of an aerobic bacterium degrading chlorobenzene[J]. Acta Microbiologica Sinica, 2010, 50(5): 586-415. |
| [13] |
叶杰旭, 林彤晖, 骆煜昊, 等. 1株氯苯高效降解菌的分离鉴定及降解特性[J]. 环境科学, 2017, 38(2): 802-808. YE J X, LIN T H, LUO Y H, et al. Isolation and identification of a chlorobenzene-degrading bacterium and its degradation characteristics[J]. Environmental Science, 2017, 38(2): 802-808. |
| [14] |
RAUL M, SANTIAGO V, BENOIT G, et al. Two-phase partitioning bioreactors for treatment of volatile organic compounds[J]. Biotechnology Advances, 2007, 25(4): 410-422. DOI:10.1016/j.biotechadv.2007.03.005 |
| [15] |
WANG C, XI J, HU H. A novel integrated UV-biofilter system to treat high concentration of gaseous chlorobenzene[J]. Chinese Science Bulletin, 2008, 53(17): 2712-2716. |
| [16] |
MUNRO D R, DAUGULIS A J. The use of an organic solvent and integrated fermentation for improved xenobiotic degradation[J]. Resource & Environmental Biotechnology, 1997, 1(3): 207-225. |
| [17] |
MUÑOZ R, DAUGULIS A J, HERNÁDEZ M, et al. Recent advances in two-phase partitioning bioreactors for the treatment of volatile organic compounds[J]. Biotechnology Advances, 2012, 30(6): 1707-1720. DOI:10.1016/j.biotechadv.2012.08.009 |
| [18] |
徐百龙, 夏银峰, 王向前, 等. 硅油对生物滴滤塔处理邻二甲苯废气的影响[J]. 高校化学工程学报, 2014, 28(5): 1154-1159. XU B L, XIA Y F, WANG X Q, et al. Effect of silicone oil on the removal of o-xylene from waste gases in biotrickling filters[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(5): 1154-1159. DOI:10.3969/j.issn.1003-9015.2014.05.033 |
| [19] |
DAVIDSON C T, DAUGULIS A J. The treatment of gaseous benzene by two phase partitioning bioreactors:A high performance alternative to the use of biofilters[J]. Applied Microbiology and Biotechnology, 2003, 62(2/3): 297-301. |
| [20] |
MUÑOZ R, CHAMBAUD M, BORDEL S, et al. A systematic selection of the non-aqueous phase in a bacterial two liquid phase bioreactor treating α-pinene[J]. Biotechnological Products and Process Engineering, 2008, 79(1): 33-41. |
| [21] |
ZAMIR S M, BABATABAR S, SHOJAOSADATI S A. Styrene vapor biodegradation in single- and two-liquid phase biotrickling filters using Ralstonia eutropha[J]. Chemical Engineering Journal, 2015, 268(15): 21-27. |
| [22] |
ARRIAGA S, MUÑOZ R, HERNANDEZ S, et al. Gaseous hexane biodegradation by Fusarium solani in two liquid phase packed-bed and stirred-tank bioreactors[J]. Environmental Science & Technology, 2006, 40(7): 2390-2395. |
| [23] |
吴超.气升式生物反应器处理多组分VOCs废气的关键技术研究[D].杭州: 浙江大学, 2017. WU C. Key techniques for treating a complex VOC mixture in airlift bioreactors[D]. Hangzhou: Zhejiang University, 2017. |
| [24] |
WANG J, YU M, LIU C, et al. Chlorobenzene degradation by electro-heterogeneous catalysis in aqueous solution:Intermediates and reaction mechanism[J]. Journal of Environmental Sciences, 2008, 20(11): 1306-1311. DOI:10.1016/S1001-0742(08)62226-3 |
| [25] |
QUIJANO G, CHÁVE-AVILA R, MUÑOZ R, et al. KLa measurement in two-phase partitioning bioreactors:New insights on potential errors at low power input[J]. Journal of Chemical Technology and Biotechnology, 2010, 85: 1407-1412. DOI:10.1002/jctb.2460 |
| [26] |
GARCIA-OCHOAA F, GOMEZ E, SANTOS V E, et al. Oxygen uptake rate in microbial processes:An overview[J]. Biochemical Engineering Journal, 2010, 49(3): 289-307. |
| [27] |
GARCIA-OCHOA F, GOMEZ E. Bioreactor scale-up and oxygen transfer rate in microbial processes:An overview[J]. Biotechnology Advances, 2009, 27(2): 153-176. DOI:10.1016/j.biotechadv.2008.10.006 |
| [28] |
NIELSEN D R, DAUGULIS A J, MCLELLAN P J. A restructured framework for modeling oxygen transfer in two-phase partitioning bioreactors[J]. Biotechnology & Bioengineering, 2005, 91(6): 773-777. |
| [29] |
PARHAM P, SEYED M, SEYED A. Styrene vapor mass transfer in a biotrickling filter:Effects of silicone oil volume fraction, gas-to-liquid flow ratio, and operating temperature[J]. Chemical Engineering Journal, 2016, 284(15): 926-933. DOI:10.1016/j.cej.2015.08.148 |
| [30] |
YE J X, QIU J F, CHEN D Z, et al. Removal of gaseous dichloromethane using a solid-liquid partitioning bioreactor under gradual and stepped load increase[J]. International Biodeterioration & Biodegradation, 2018, 133: 79-85. |
| [31] |
MARÍA H, GUILLERMO Q, RAÚL M, et al. Modeling of VOC mass transfer in two-liquid phase stirred tank, biotrickling filter and airlift reactors[J]. Chemical Engineering Journal, 2011, 172(2/3): 961-969. |
| [32] |
BORDEL S, HERNANDEZ M, VILLAVERDE S, et al. Modelling gas-liquid VOCs transport in two-liquid phase partitioning bioreactors[J]. International Journal of Heat & Mass Transfer, 2010, 53(5/6): 1139-1145. |




