2. 浙江恒逸石化研究院有限公司, 浙江 杭州 311209
2. Zhejiang Hengyi Petrochemical Research Institute Co. Ltd., Hangzhou 311209, China
乳酸甲酯(MLA)是重要的生物质基平台化合物,除用作生物可降解材料聚乳酸的合成原料外,还是一种溶解性能优良的绿色溶剂,应用前景极其广阔[1]。
MLA的制备方法主要有生物发酵法和化学催化醇解法。生物发酵法是目前工业化的方法,先采用微生物发酵制备乳酸、再与甲醇酯化[2],该方法存在生产效率低、周期长、废液多等问题;而化学催化醇解法与生物发酵法相比,具有反应速度快、容积产率高、适合于大规模连续化生产等优点,特别是生物质非均相催化醇解法制备MLA,因与绿色催化理念相符,成为近年生物质定向化学转化领域研究热点之一[3-4]。
生物质非均相催化醇解制备MLA的关键是固体催化剂开发。文献报道的固体催化剂有分子筛[5-9]、MOF材料[10-12]、金属氧化物[13-16]、碳硅复合材料[17]等,其中Sn是公认的较佳活性组分,Snβ分子筛催化剂由于在其催化作用下MLA收率高而备受关注。Zhang等[18]采用多级孔Snβ分子筛催化剂、以蔗糖为原料时MLA收率最高可达72.1%。
Snβ分子筛催化剂制备方法主要包括水热法[19-20]和后合成法。水热法周期长、过程繁琐,且常用到对环境有害的氟化物;而后合成法可大大缩短合成周期、过程简便。后合成法主要包括气态离子交换法[21]、固态离子交换法[22-23]和液态离子交换法(即浸渍法),其中,浸渍法制备Snβ分子筛催化剂的优势尤为突出,更适合大规模工业生产。传统浸渍法Snβ分子筛催化剂制备工艺包括脱铝、浸渍和焙烧等3步。Padovan等[24]证实,浸渍法得到的Snβ分子筛催化剂能实现果糖连续化合成MLA,反应体系中若加入少量水能大大延迟催化剂失活;van der Graaff等[25]研究了Snβ分子筛催化1, 3-二羟基丙酮生成MLA反应,结果表明,浸渍法得到的Snβ分子筛可达到与水热法相近的催化活性;Yang等[26]以共浸渍法得到的Mg-Snβ分子筛催化葡萄糖合成MLA,结果表明,镁的引入对MLA的生成有一定促进作用。上述研究结果表明,浸渍法得到的Snβ分子筛催化生物质制备MLA具有广阔的应用前景,但关于Snβ分子筛催化剂的制备工艺对其催化生物质糖转化生成MLA的活性和重复使用性能影响的研究还不系统、不全面,不同课题组的实验结果难以重现。本研究系统考察了Snβ分子筛催化剂制备工艺对其催化果糖转化生成MLA的性能的影响,以期为生物质非均相催化醇解制备MLA技术的工业化提供参考。
2 实验部分 2.1 实验试剂不同硅铝比(物质的量比(n(Si): n(Al)),下同)的市售Hβ分子筛购自天津南化催化剂有限公司;果糖(质量分数w为99%)、柠檬酸一水合物(CAM,w为99.5%)购自上海麦克林生化科技有限公司;甲醇(分析纯(AR))、无水乙醇(AR)、硝酸(优级纯(GR)),w为65%~68%)、盐酸(AR,w为36%~38%)、硫酸(AR,w为95%~98%)、MLA(w为98%)购自国药集团化学试剂有限公司;无水氯化亚锡(w为99%)、甲酸(w为95%)购自阿拉丁试剂上海有限公司;甲氧基乙醛缩二甲醇(MADDA,w为98%)购自北京百灵威科技有限公司;羟基乙醛二甲基缩醛(GADMA,液体)购自阿法埃莎(中国)化学有限公司。
2.2 Snβ分子筛制备Snβ分子筛采用浸渍法制备,制备工艺如图 1所示,包括酸处理、浸渍和焙烧等3步。具体操作过程如下:第1步酸处理,不同硅铝比的Hβ分子筛与酸(酸的种类和质量分数可调)在70 ℃、磁力搅拌下脱铝反应6 h,冷却后抽滤,用去离子水洗涤至中性,在60 ℃干燥箱中烘干,得到脱铝Hβ分子筛,记作deAl-Hβ-A,其中A表示酸处理过程中酸的质量分数及种类。本研究分别用10% CAM、95% HCOOH、36% HCl、72% H2SO4及21%、35%、47%、65% HNO3 (百分数均为质量分数,下同)。第2步浸渍,deAl-Hβ-A与SnCl2乙醇溶液(SnCl2的质量分数可调)充分混合后置于110℃常压干燥箱中烘12 h,得到Snβ分子筛母体。第3步焙烧,Snβ分子筛母体放入马弗炉中以2 ℃⋅min−1速度升温至焙烧温度(焙烧温度可调),并保持6 h,最终得到的Snβ分子筛催化剂,标记为Snβ-A,具体分别为Snβ-10% CAM、Snβ-95% HCOOH、Snβ-36% HCl、Snβ-72% H2SO4、Snβ-21% HNO3、Snβ-35% HNO3、Snβ-47% HNO3、Snβ-65% HNO3。未做特殊说明时,Hβ分子筛中n(Si): n(Al)为60、浸渍液中SnCl2浓度为0.1 mol⋅L−1、焙烧温度为550 ℃。

|
图 1 浸渍法Snβ分子筛催化剂制备工艺 Fig.1 Preparation process of Snβ zeolite catalyst by impregnation method |
采用14 mL的316 L不锈钢微型高压反应釜对Snβ分子筛催化活性进行评价。微型高压反应釜购自大连科茂实验设备有限公司,由铝体加热炉加热。实验步骤如下:先配制0.01 g⋅mL−1的果糖甲醇溶液,取6 mL上述溶液(其中果糖为60 mg)、30 mg Snβ分子筛加入微型高压反应釜,将反应釜拧紧后放入已预热至180 ℃的铝体加热炉中反应6 h(反应条件全文相同,下面第3节中不再赘述);待反应结束后放入冷水中迅速冷至室温;接着用甲醇将反应液全部定容至25 mL容量瓶中,再用尺寸为0.22 μm微孔有机滤膜过滤;反应液中未反应的果糖采用高效液相色谱(HPLC)仪分析,反应产物MLA、GADMA和MADDA采用气相色谱(GC)仪分析,外标法定量。
原料果糖转化率及3种产物收率的计算式如下:
| $ 果糖转化率=1-\frac{果糖剩余物质的量}{原料果糖总物质的量}\times 100\% $ |
| $ {\rm{MLA}}的收率=\frac{{\rm{MLA}}的物质的量}{2\times 原料果糖的物质的量}\times 100\% $ |
| $ {\rm{GADMA或MADDA}}的收率=\frac{{\rm{GADMA}}或{\rm{MADDA}}的物质的量}{3\times 原料果糖的物质的量}\times 100\% $ |
Snβ分子筛重复使用性能测试具体如下:反应结束后将反应产物全部转移至离心管,通过高速离心机将催化剂与反应液分开,并用甲醇重复洗涤、离心3次;将洗涤后的催化剂置于60 ℃烘箱中烘干过夜,最后得到的催化剂用于重复性实验。第6次重复实验前,将烘干后的催化剂置于马弗炉中,以2 ℃⋅min−1升温至550 ℃焙烧6 h。
每组实验设置3个平行样,结果为3个平行样的平均值,误差为3次实验结果的标准偏差。
2.4 分析与表征果糖使用Agilent 1100 HPLC分析。色谱柱为美国Bio-Rad的Aminex HPX-87 H (300 mm×7.8 mm);流动相为5 mmol⋅L−1的H2SO4水溶液、流速为0.4 mL⋅min−1,柱温为60 ℃,检测器为示差折光检测器,温度为30 ℃,进样量为10 μL。
MLA、GADMA和MADDA使用Agilent 7890A GC分析。检测器为氢火焰检测器(FID),色谱柱为Agilent HP-5毛细管柱(30 m×0.32 mm×0.25 µm),进样温度为250 ℃,进样量为1 μL。FID检测温度为320 ℃,采用程序升温:40 ℃下保持2 min,之后以5 ℃⋅min−1速度升至100 ℃,然后再以20 ℃⋅min−1速度升至280 ℃并保持2 min。
X-射线衍射(XRD)仪使用德国布鲁克Bruker D8 ADVACNCE,在5°~50°扫描。氮气吸、脱附使用美国QUANTACHROME仪器公司全自动比表面和微孔孔径分析仪,样品先在200 ℃下脱气8 h,然后在77 K条件下以氮气为吸附质进行样品吸、脱附测试。氨气程序升温脱附(NH3-TPD)使用浙江泛泰仪器有限公司FINESORB-3010化学吸附仪。电感耦合等离子体发射光谱(ICP-OES)使用Perkin-Elmer OPTIMA 8000DV测得。紫外可见漫反射光谱(UV-Vis DRS)使用日本Shimadzu UV-3600i Plus测得。X射线光电子能谱仪(XPS)使用美国Thermo Scientific K-Alpha。
3 实验结果与讨论 3.1 不同硅铝比的Hβ分子筛对Snβ分子筛催化活性影响考察市售Hβ分子筛的n(Si): n(Al)分别为20、25、60时对Snβ分子筛催化果糖转化生成MLA的影响,结果如图 2所示。其中,Snβ分子筛催化剂制备条件为70 ℃下47% HNO3酸处理Hβ分子筛6 h、0.1 mol⋅L−1的SnCl2乙醇溶液浸渍、焙烧温度为550 ℃。由图 2可见,果糖几乎完全转化;随Hβ分子筛硅铝比的增大,MLA的收率逐渐增大;MLA、GADMA和MADDA等3种产物总收率也逐渐增大,分别为42.7%、45.8% 和52.4%。因此,后面的研究都采用n(Si): n(Al)=60的Hβ分子筛。

|
图 2 Hβ分子筛的硅铝比对Snβ分子筛催化果糖转化生成MLA的活性影响 Fig.2 Effects of n(Si): n(Al) of Hβ zeolites on Snβ zeolite activity in fructose conversion to MLA (catalyst 30 mg, fructose 60 mg, methanol 6 mL, 180 ℃, 6 h) |
探究酸处理过程中酸的种类(分别为CAM、HCOOH、HCl、HNO3、H2SO4)对Snβ分子筛催化果糖转化生成MLA的影响,结果如图 3所示,其中Snβ分子筛催化剂制备条件为70 ℃下用不同酸处理Hβ分子筛6 h、0.1 mol⋅L−1的SnCl2乙醇溶液浸渍、焙烧温度为550 ℃。由图 3可见,果糖几乎完全转化;不同种类的酸对Snβ分子筛催化活性影响差别较大,使用强酸(HCl、HNO3、H2SO4)处理的Snβ分子筛在反应中表现出更好的催化活性,表明需用强酸脱铝以便后续浸渍过程中Sn插入分子筛骨架;强酸中的47% HNO3酸处理得到的Snβ分子筛催化活性最优,MLA收率可达45.4%,因此,后面的研究选择HNO3对Hβ分子筛进行酸处理。

|
图 3 酸处理过程酸种类对Snβ分子筛催化果糖转化生成MLA的活性影响 Fig.3 Effects of acid types during acid treatment on Snβ zeolite activity in fructose conversion to MLA (catalyst 30 mg, fructose 60 mg, methanol 6 mL, 180 ℃, 6 h) |
为了优化HNO3的质量分数w(HNO3),考察了酸处理过程中w(HNO3)对Snβ分子筛催化果糖转化生成MLA的活性影响,结果如图 4所示,其中Snβ分子筛催化剂制备条件同上。由图 4可见,随w(HNO3)增大,MLA的收率先增大后减小,有1个极大值,原因是w(HNO3)过低时脱铝不充分,而过高时有可能发生过度脱铝,导致分子筛骨架发生一定程度的坍塌。因此,酸处理过程中w(HNO3)的选择较为重要。后续研究将采用47% HNO3对Hβ分子筛进行酸处理。

|
图 4 酸处理过程HNO3质量分数对Snβ分子筛催化果糖转化生成MLA的活性影响 Fig.4 Effects of HNO3 mass fraction during acid treatment on Snβ zeolite activity in fructose conversion to MLA (catalyst 30 mg, fructose 60 mg, methanol 6 mL, 180 ℃, 6 h) |
测定了浸渍过程中SnCl2乙醇溶液浓度对Snβ分子筛催化果糖转化生成MLA的活性影响,结果如图 5所示,其中Snβ催化剂制备条件为在70 ℃下47% HNO3酸处理Hβ分子筛6 h、焙烧温度为550 ℃。由图 5可见,当SnCl2乙醇溶液浓度由0.05 mol⋅L−1增大到0.1 mol⋅L−1时,MLA收率从35.5%提高到45.4%;而当浓度进一步提高时,MLA收率则呈下降趋势,因为过高的浸渍液浓度有可能堵塞Snβ分子筛孔道,因此,浸渍液中SnCl2浓度有极大值。后面的研究将选用浓度为0.1 mol⋅L−1的SnCl2乙醇溶液作为浸渍液。

|
图 5 浸渍液中SnCl2浓度对Snβ分子筛催化果糖转化生成MLA的活性影响 Fig.5 Effects of impregnation SnCl2 concentration on Snβ zeolite activity in fructose conversion to MLA (catalyst 30 mg, fructose 60 mg, methanol 6 mL, 180 ℃, 6 h) |
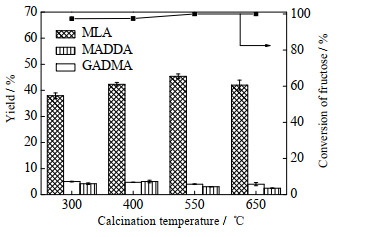
考察了焙烧温度对Snβ分子筛催化果糖转化生成MLA的活性影响,结果如图 6所示,其中Snβ催化剂制备条件为70 ℃下47% HNO3酸处理Hβ分子筛6 h、浓度为0.1mol⋅L−1 SnCl2乙醇溶液浸渍。由图 6可见,焙烧温度同样也有1个极大值,550 ℃时MLA的收率最大。
|
图 6 焙烧温度对Snβ分子筛催化果糖转化生成MLA的活性影响 Fig.6 Effects of calcination temperature on Snβ zeolite activity in fructose conversion to MLA (catalyst 30 mg, fructose 60 mg, methanol 6 mL, 180 ℃, 6 h) |
为进一步解释上述实验结果,对脱铝Hβ分子筛开展了氮气吸、脱附和NH3-TPD表征,并对部分Snβ分子筛开展了XRD、UV-Vis DRS和XPS表征。
3.5.1 氮气吸、脱附表 1是酸处理前、后Hβ分子筛氮气吸、脱附表征结果,表中SBET、VTotal分别代表比表面积、孔容。由表 1可见,弱酸(CAM和HCOOH)处理前、后的Hβ分子筛的SBET几乎不变;而强酸(HCl、HNO3、H2SO4)处理前、后的Hβ分子筛的SBET有所下降、平均孔径变大,达到了脱铝的效果。
|
|
表 1 酸处理前、后Hβ分子筛比表面积、孔容及孔径数据 Table 1 Specific surface area, pore volume and pore size of Hβ zeolites before and after acid treatment |
为探究酸处理脱铝过程对Hβ分子筛酸性影响,对酸处理前、后的Hβ分子筛进行NH3-TPD表征,结果如图 7所示。酸处理前的Hβ分子筛(Blank-Hβ)在小于200 ℃、200~450 ℃及大于450 ℃时产生的脱附峰分别对应于催化剂表面的弱酸、中等强度酸和强酸位点[27]。通过对样品脱附峰进行拟合计算,得到分子筛中总酸量、弱酸量、中等强度酸量和强酸量数据(见表 2)。由表 2可见,使用弱酸(CAM、HCOOH)对Hβ分子筛进行酸处理后,总酸量均明显下降,说明分子筛发生了部分脱铝;而使用强酸(HCl、HNO3、H2SO4)处理后,Hβ分子筛仅保留微量的弱酸性位点,这是因为强酸具有更强的脱铝能力,能够将骨架中大部分铝脱除,产生更多的硅羟基巢,更有利于后续的Sn插入骨架。

|
图 7 酸处理前、后Hβ分子筛NH3-TPD曲线 Fig.7 NH3-TPD patterns of Hβ zeolites before and after acid treatment |
|
|
表 2 酸处理前、后Hβ分子筛的酸量 Table 2 Acid amounts of Hβ zeolites before and after acid treatment |
图 8为Hβ分子筛(n(Si): n(Al)=60)、经不同酸处理后的Snβ分子筛的XRD图谱。图中Hβ分子筛在衍射角2θ为7.8°、22.4°时出现的2个明显衍射峰,对应β分子筛的拓扑(BEA)结构特征峰。使用浸渍法制备的Snβ分子筛均出现了该特征峰,这表明分子筛有一定的BEA结构,没有出现明显的Sn氧化物的峰[28]。

|
图 8 Hβ分子筛和不同Snβ分子筛的XRD图谱 Fig.8 XRD spectra of Hβ and Snβ zeolites |
为探究不同酸处理过程对Snβ分子筛中Sn存在形式的影响,对Snβ-10% CAM、Snβ-47% HNO3分子筛进行UV-Vis DRS表征,结果如图 9所示。由图 9可见,2个样品均在210 nm波长附近出现了属于4配位的骨架Sn强吸收峰,表明Snβ分子筛中Sn主要以骨架锡形式存在[22, 29]。而Snβ-10% CAM分子筛在280 nm波长附近出现了归属于骨架外SnO2吸收峰[30],表明弱酸对Al的脱除能力较差,导致浸渍后Sn不能完全进入骨架,经焙烧后以SnO2形式存在。而在Snβ-10% CAM分子筛的XRD图谱中(见图 8)未检测到SnO2吸收峰,这是由于SnO2含量太少或晶粒太小导致无法被检测到。

|
图 9 Snβ分子筛UV-Vis DRS图 Fig.9 UV-Vis DRS spectra of Snβ zeolites |
通过XPS表征了Snβ-47% HNO3分子筛中Sn的存在形式,Sn 3d轨道的XPS图谱如图 10所示。在结合能为487.5 eV和495.9 eV处出现了2个光电子吸收峰,分别归属于4配位的骨架Sn的3d5/2和3d3/2[22, 30],进一步说明浸渍法可将Sn以4配位形式引入β分子筛骨架。

|
图 10 Snβ-47% HNO3分子筛XPS谱图(Sn 3d) Fig.10 XPS spectra of Snβ-47% HNO3 zeolite (Sn 3d) |
Snβ-47% HNO3分子筛的10次重复使用性能测试结果如图 11所示,除第6次回用前需550 ℃焙烧6 h外,其他回用实验均只经过简单的甲醇清洗和烘干。由图 11可见,第1~5次和第6~10次回用规律相似,仿佛是2个相似的循环;每个循环MLA收率均先升后缓慢下降,果糖转化率有约4% 的小幅度下降。第1~2次反应,MLA收率从45.4%增至53.6%,这可能是因为Snβ分子筛在高温甲醇中发生了活化[31];Snβ分子筛回用5次后MLA收率才降至了42.4%。在第2次循环中,分子筛经焙烧后用于第6次回用时MLA的收率由第5次的42.4%略增至43.2%;在第7次回用时,催化剂再一次被活化,MLA的收率增至51.2%;继续回用,MLA的收率呈缓慢下降趋势,回用到第10次时MLA的收率仍可保持在44.6%。可见Snβ-47% HNO3分子筛催化剂具有良好的重复使用性能。

|
图 11 Snβ-47% HNO3分子筛催化剂重复使用性能测试 Fig.11 Recycling tests of Snβ-47% HNO3 zeolites (catalyst 30 mg, fructose 60 mg, methanol 6 mL, 180 ℃, 6 h) |
新鲜的和第4次回用的Snβ分子筛的比表面积、孔容数据见表 3。由表 3可见,分子筛回用后比表面积和孔容都有较大幅度下降,可能是生成的副产物胡敏素部分堵塞了分子筛孔道引起的[32],通过焙烧可以部分除去分子筛表面富集的胡敏素,这可以解释第2次循环中果糖转化率约有4%的下降现象。
|
|
表 3 新鲜的和第4次回用的Snβ分子筛比表面积和孔容数据 Table 3 Specific surface areas and pore volumes of fresh and the 4th reused Snβ zeolites |
通过ICP-OES测定了第1~5次回用反应液中Sn的浓度,得到如表 4所示的Snβ分子筛重复使用过程中Sn的浸出率。由表 4可见,每次循环后约有1%Sn浸出,如何减少Sn的浸出仍是需要解决的问题。
|
|
表 4 Snβ分子筛重复使用过程中Sn的浸出率 Table 4 Leaching rate of Sn during Snβ recycling test |
本研究系统探究了Snβ分子筛催化剂制备工艺对其催化果糖转化生成MLA性能的影响,主要结论如下:
(1) Hβ分子筛酸处理时需要强酸,其中HNO3较佳;
(2) Snβ分子筛催化剂制备工艺中市售Hβ分子筛的硅铝比、酸处理过程中酸浓度、浸渍液中SnCl2浓度和焙烧温度都存在较佳值,具体是:以n(Si): n(Al)=60的Hβ分子筛为原料、先用质量分数为47% 的HNO3脱铝、再在浓度为0.1 mol⋅L−1的SnCl2乙醇溶液中浸渍,最后再在550 ℃下焙烧;
(3) 果糖在180 ℃、Snβ-47% HNO3分子筛催化作用下,反应6 h后,MLA的收率最高可达53.6%;
(4) Snβ-47% HNO3分子筛具有良好的重复使用性能;
(5) 表征证实了浸渍法可以将Sn引入β分子筛骨架。
| [1] |
DUSSELIER M, VAN WOUWE P, DEWAELE A, et al. Lactic acid as a platform chemical in the biobased economy: The role of chemocatalysis[J]. Energy & Environmental Science, 2013, 6(5): 1415-1442. |
| [2] |
DATTA R, HENRY M. Lactic acid: Recent advances in products, processes and technologies: A review[J]. Journal of Chemical Technology & Biotechnology, 2006, 81(7): 1119-1129. |
| [3] |
LYU X L, WANG L X, CHEN X J, et al. Enhancement of catalytic activity by γ-NiOOH for the production of methyl lactate from sugars in near-critical methanol solutions[J]. Industrial & Engineering Chemistry Research, 2019, 58(9): 3659-3665. |
| [4] |
LU X L, FU J, LANGRISH T, et al. Simultaneous catalytic conversion of C6 and C5 sugars to methyl lactate in near-critical methanol with metal chlorides[J]. BioResources, 2018, 13(2): 3627-3641. |
| [5] |
YAN Y, ZHANG Z H, BAK S-M, et al. Confinement of ultrasmall cobalt oxide clusters within silicalite-1 crystals for efficient conversion of fructose into methyl lactate[J]. ACS Catalysis, 2019, 9(3): 1923-1930. DOI:10.1021/acscatal.8b03230 |
| [6] |
MÄKI-ARVELA P, AHO A, MURZIN D Y. Heterogeneous catalytic synthesis of methyl lactate and lactic acid from sugars and their derivatives[J]. ChemSusChem, 2020, 13(18): 4833-4855. DOI:10.1002/cssc.202001223 |
| [7] |
YANG L S, YANG X K, TIAN E, et al. Mechanistic insights into the production of methyl lactate by catalytic conversion of carbohydrates on mesoporous Zr-SBA-15[J]. Journal of Catalysis, 2016, 333: 207-216. DOI:10.1016/j.jcat.2015.10.013 |
| [8] |
TANG B, LI S, SONG W C, et al. Fabrication of hierarchical Sn-beta zeolite as efficient catalyst for conversion of cellulosic sugar to methyl lactate[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(9): 3796-3808. |
| [9] |
JIANG Y X, LYU X L, CHEN H, et al. Catalytic conversion of high fructose corn syrup to methyl lactate with CoO@silicalite-1[J]. Catalysts, 2022, 12(4): 442. DOI:10.3390/catal12040442 |
| [10] |
MURILLO B, ZORNOZA B, DE LA IGLESIA O, et al. Chemocatalysis of sugars to produce lactic acid derivatives on zeolitic imidazolate frameworks[J]. Journal of Catalysis, 2016, 334: 60-67. DOI:10.1016/j.jcat.2015.11.016 |
| [11] |
MURILLO B, ZORNOZA B, DE LA IGLESIA O, et al. Tin-carboxylate MOFs for sugar transformation into methyl lactate[J]. European Journal of Inorganic Chemistry, 2019, 2019(21): 2624-2629. DOI:10.1002/ejic.201900310 |
| [12] |
LU X L, WANG L X, LU X Y. Catalytic conversion of sugars to methyl lactate over Mg-MOF-74 in near-critical methanol solutions[J]. Catalysis Communications, 2018, 110: 23-27. DOI:10.1016/j.catcom.2018.02.027 |
| [13] |
LIU Z, LI W, PAN C Y, et al. Conversion of biomass-derived carbohydrates to methyl lactate using solid base catalysts[J]. Catalysis Communications, 2011, 15(1): 82-87. DOI:10.1016/j.catcom.2011.08.019 |
| [14] |
LYU X L, XU L, WANG J C, et al. New insights into the NiO catalytic mechanism on the conversion of fructose to methyl lactate[J]. Catalysis Communications, 2019, 119: 46-50. DOI:10.1016/j.catcom.2018.10.015 |
| [15] |
王立新, 吕喜蕾, 阮厚航, 等. 近临界甲醇中NiO催化生物质糖转化制备乳酸甲酯的研究[J]. 高校化学工程学报, 2017, 31(4): 841-847. WANG L X, LÜ X L, RUAN H H, et al. A study on catalytic conversion of biomass-derived carbohydrates to methyl lactate by NiO in near-critical methanol[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(4): 841-847. DOI:10.3969/j.issn.1003-9015.2017.04.012 |
| [16] |
LYU X L, XU M, CHEN X J, et al. Beneficial effect of water on the catalytic conversion of sugars to methyl lactate in near-critical methanol solutions[J]. Industrial & Engineering Chemistry Research, 2019, 58(27): 12451-12458. |
| [17] |
DE CLIPPEL F, DUSSELIER M, VAN ROMPAEY R, et al. Fast and selective sugar conversion to alkyl lactate and lactic acid with bifunctional carbon-silica catalysts[J]. Journal of the American Chemical Society, 2012, 134(24): 10089-10101. DOI:10.1021/ja301678w |
| [18] |
ZHANG J, WANG L, WANG G X, et al. Hierarchical Sn-beta zeolite catalyst for the conversion of sugars to alkyl lactates[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(4): 3123-3131. |
| [19] |
ZHANG Y F, LUO H, ZHAO X P, et al. Continuous conversion of glucose into methyl lactate over the Sn-beta zeolite: Catalytic performance and activity insight[J]. Industrial & Engineering Chemistry Research, 2020, 59(39): 17365-17372. |
| [20] |
HOLM M S, SARAVANAMURUGAN S, TAARNING E. Conversion of sugars to lactic acid derivatives using heterogeneous zeotype catalysts[J]. Science, 2010, 328(5978): 602-605. DOI:10.1126/science.1183990 |
| [21] |
LI P, LIU G Q, WU H H, et al. Postsynthesis and selective oxidation properties of nanosized Sn-beta zeolite[J]. The Journal of Physical Chemistry C, 2011, 115(9): 3663-3670. DOI:10.1021/jp1076966 |
| [22] |
HU W D, CHI Z X, WAN Y, et al. Synergetic effect of Lewis acid and base in modified Sn-β on the direct conversion of levoglucosan to lactic acid[J]. Catalysis Science & Technology, 2020, 10(9): 2986-2993. |
| [23] |
WOLF P, HAMMOND C, CONRAD S, et al. Post-synthetic preparation of Sn-, Ti- and Zr-beta: A facile route to water tolerant, highly active Lewis acidic zeolites[J]. Dalton transactions, 2014, 43(11): 4514-4519. DOI:10.1039/c3dt52972j |
| [24] |
PADOVAN D, TOLBORG S, BOTTI L, et al. Overcoming catalyst deactivation during the continuous conversion of sugars to chemicals: Maximising the performance of Sn-beta with a little drop of water[J]. Reaction Chemistry & Engineering, 2018, 3(2): 155-163. |
| [25] |
VAN DER GRAAFF W N P, LI G N, MEZARI B, et al. Synthesis of Sn-beta with exclusive and high framework Sn content[J]. ChemCatChem, 2015, 7(7): 1152-1160. DOI:10.1002/cctc.201403050 |
| [26] |
YANG X M, LV B, LU T L, et al. Promotion effect of Mg on a post-synthesized Sn-beta zeolite for the conversion of glucose to methyl lactate[J]. Catalysis Science & Technology, 2020, 10(3): 700-709. |
| [27] |
MORAIS E K L, JIMÈNEZ-SÀNCHEZ S, HERNANDO H, et al. Catalytic copyrolysis of lignocellulose and polyethylene blends over H-beta zeolite[J]. Industrial & Engineering Chemistry Research, 2019, 58(16): 6243-6254. |
| [28] |
文韬. SnO2基酸碱两性催化剂的设计、改性及其催化生物质糖制乳酸甲酯[D]. 武汉: 华中农业大学, 2019. WEN T. SnO2-based acid-base amphoteric catalysts: design, modification and catalysis of biomass sugar converting into methyl lactate [D]. Wuhan: Huazhong Agricultural University, 2019. |
| [29] |
IGLESIAS J, MORENO J, MORALES G, et al. Sn–Al-USY for the valorization of glucose to methyl lactate: Switching from hydrolytic to retro-aldol activity by alkaline ion exchange[J]. Green Chemistry, 2019, 21(21): 5876-5885. DOI:10.1039/C9GC02609F |
| [30] |
TANG B, DAI W L, WU G J, et al. Improved postsynthesis strategy to Sn-beta zeolites as lewis acid catalysts for the ring-opening hydration of epoxides[J]. ACS Catalysis, 2014, 4(8): 2801-2810. DOI:10.1021/cs500891s |
| [31] |
PADOVAN D, BOTTI L, HAMMOND C. Active site hydration governs the stability of Sn-beta during continuous glucose conversion[J]. ACS Catalysis, 2018, 8(8): 7131-7140. DOI:10.1021/acscatal.8b01759 |
| [32] |
FILICIOTTO L, BALU A M, VAN DER WAAL J C, et al. Catalytic insights into the production of biomass-derived side products methyl levulinate, furfural and humins[J]. Catalysis Today, 2018, 302: 2-15. DOI:10.1016/j.cattod.2017.03.008 |




