2. 河南科技学院 化学化工学院,河南 新乡 453003
2. College of Chemistry and Chemical Engineering, Henan Institute of Science and Technology, Xinxiang 453003, China
自然界中天然存在的19种手性氨基酸均为L构型,D型可由人工合成。DL异构体在非手性环境下理化性质相同,而在生物体内生物活性、毒理药理活性则显著不同,所以氨基酸的手性拆分对生命科学的研究有重要意义[1, 2]。目前已经开展了许多氨基酸衍生物分离的研究工作,包括化学分离法、膜分离法、色谱分离法、酶分离法、诱导结晶法等[3]。其中,色谱分离法具有高效能、选择性好、灵敏度高、操作简单等特点,成为发展最快、研究最多的方法[4]。就氨基酸衍生物色谱分离法而言目前应用较多的主要是手性高效液相分离法[5]。多种类型的手性固定相被广泛用于氨基酸衍生物对映体分离,其中在硅胶表面键合奎宁或奎尼丁衍生物的色谱柱,因其优异的选择性而引起了广泛关注[6~8]。基于奎宁或奎尼丁叔丁基氨基甲酸酯衍生物的手性整体柱在对氨基酸衍生物对映异构体分离的对映体选择性、色谱柱效率和分析时间等方面展示了优势。Lämmerhofer和同事们开发了几种基于奎宁及奎尼丁衍生物的整体柱,用于毛细管电色谱及微流液相的氨基酸衍生物的分离,这些整体柱显示出优异的手性分离能力[9~13]。
本实验中,合成奎宁衍生物MBQN并作为手性功能单体,制备Poly(MBQN-co-HEMA-co-EDMA)整体柱,在自组装微流液相中用于拆分氨基酸衍生物,考察整体柱的分离性能和重现性。
2 实验部分 2.1 仪器及试剂自组装微流液相色谱包括以下模块[14]:EasySepTM-1020UV/VIC Detector紫外检测器(上海通微分析技术有限公司,中国)、EasySepTM-1020LC泵(上海通微分析技术有限公司,中国)、7725i六通进样阀(Rheodyne,美国)、三通(郑州英诺高科有限公司,中国)、PCU-360零死体积二通(PICOCLEAR,美国)、熔融石英毛细管(50 μm i.d.,100 μm i.d.,375 μm o.d.,河北省永年锐沣色谱器件公司,中国);FA1204 B电子天平(上海佑科仪器仪表有限公司,中国);DZF-6020型真空干燥箱(上海-恒科科技有限公司,中国);SYU-3-100D超声波清洗仪(郑州生元仪器有限公司,中国);HH·S211-6-S电热恒温水浴锅(上海新苗医疗器械制造有限公司,中国);PHSJ-3F实验室pH计(上海仪电科学仪器股份有限公司,中国);vario MICRO select元素分析仪(Elementar,德国);Auto PoreIV压汞仪(micromeritics,美国);Quant650扫描电镜(FEI,美国);Agilent Technologies 1290 Infinity Ⅱ UHPLC-6530 ESI Q-TOF MS(安捷伦科技有限公司,美国);Mercury-plus-400MHz核磁共振谱仪(VARIAN,美国);FTIR-7600型傅里叶变换红外光谱仪(Lambda,澳大利亚);0.22 μm膜过滤器(上海医药工业研究所,中国)。
N-苯甲酰基-DL-缬氨酸(N-Bz-DL-Val)、N-苯甲酰基-DL-苯丙氨酸(N-Bz-DL-Phe)、N-苯甲酰基-DL-亮氨酸(N-Bz-DL-Leu)、N-苯甲酰基-DL-丙氨酸(N-Bz-DL-Ala)、丹磺酰基-DL-缬氨酸(Dansyl-DL-Val)、丹磺酰基-DL-苯丙氨酸(Dansyl-DL-Phe)、N-苄氧羰基-DL-缬氨酸(N-CBZ-DL-Val)、N-苄氧羰基-DL-色氨酸(N-CBZ-DL-Trp)(BR,Sigma-Aldrich,美国);叔丁基异氰酸酯、二月桂酸二丁基锡、2-巯基乙醇、甲基丙烯酰氯、甲基丙烯酸羟基乙酯、乙二醇二甲基丙烯酸酯、偶氮二异丁腈、乙酸铵、甲醇、冰乙酸、奎宁、正己烷、乙酸乙酯、三乙胺(AR,阿拉丁试剂公司,中国)、溴化钾(光谱纯,阿拉丁试剂公司,中国)、CDCl3(阿拉丁试剂公司,中国)。
2.2 MBQN的制备及表征的制备合成并纯化MBQN[10],MBQN分子式为C31H43N3O5S,相对分子质量为569.76,其化学结构如图 1所示。使用液质联用正离子模式测试所合成产物,理论计算[M+H]+值为570.29,测试[M+H]+值为570.2930。该产物的核磁氢谱及红外光谱数据如下:
1H NMR (400 MHz, CDCl3): δ 1.32(s, 9H), 1.45~1.96(m, 8H), 2.02(s, 3H), 2.41(d, 1H), 2.55(t, 2H), 2.70(m, 1H), 2.77(t, 2H), 3.12(m, 2H), 3.34(m, 1H), 3.99(s, 3H), 4.29(t, 2H), 4.81(s, 1H), 5.54(s, 1H), 6.10(s, 1H), 6.51(d, 1H), 7.39(m, 2H), 7.51(s, 1H), 8.04(d, 1H), 8.76(d, 1H)ppm; IR(KBr): 1510, 1622, 1718, 2931, 3377 cm-1。
2.3 整体材料的制备称取0.9200 g MBQN、2.8200 g HEMA、0.9200 g EDMA、1.7400 g环己醇、5.2200 g正十二醇、0.0400 g AIBN配制聚合液。将聚合液超声20 min,通N2 10 min后灌入已预烯基化的毛细管[15]中,填料部分长度20 cm、两端封口,在60℃的水浴中共聚反应12 h后用甲醇在泵作用下冲洗整体柱12 h,上机评测。
元素分析用整体材料制备,配制两份聚合液,比例与制备整体柱所用比例相同。其中一份添加MBQN,另一份不添加MBQN,在与整体柱聚合相同的条件下聚合制备用于表征的手性整体材料。聚合完成后用甲醇索氏提取12 h,60℃真空干燥过夜。元素分析测定元素含量时,使用碳氢氮硫模式,测定整体材料中C、H、N、S四种元素所占比例。
2.4 液相条件所有的分离测试实验都在自组装微流液相色谱上进行。流动相条件:甲醇与一定浓度乙酸铵水溶液按比例混合,使用冰乙酸调至所需pH;流速0.15 mL·min-1;分离毛细管柱有效长度16 cm;分流毛细管:3 m长、内径为50 μm;分流比大约为1:1700;检测波长为214 nm,检测窗口距出口端7 cm;样品浓度为5 mg·mL-1,样品及流动相经0.22 μm滤膜过滤。α是分离因子,α=k2-k1式中的ki(i = 1或2)是保留因子,ki=(ti-t0)/t0。分离氨基酸衍生物样品化学结构如图 1所示。
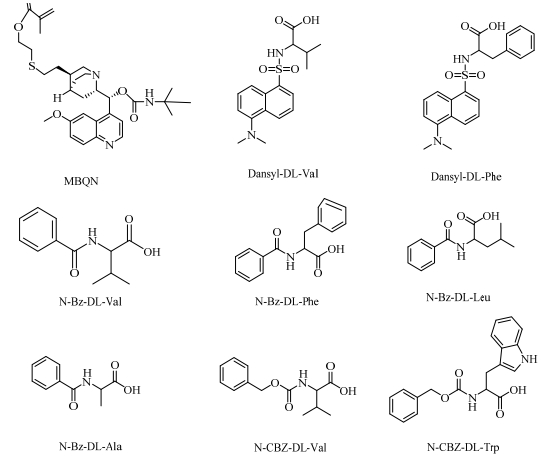
|
图 1 MBQN及氨基酸衍生物样品化学结构 Fig.1 Chemical structures of MBQN and amino acid derivatives |
不含MBQN的整体材料中C、H所占比例分别为53.93%、7.17%,添加MBQN的整体材料中C、H、N、S所占比例分别为55.86%、7.36%、0.91%、0.90%。以N含量为基准计算每1克整体材料所含手性单体为0.22 mmol,以S含量为基准计算每1克整体材料所含手性单体为0.28 mmol。使用压汞仪对添加MBQN的整体材料进行表征,其平均孔径、孔体积及比表面积分别为:2802 nm,0.74 mL·g-1,1.052 m2·g-1。
3.2 整体柱内固定相的SEM观察整体柱内固定相表面形貌的SEM如图 2所示。由图 2可看出,固定相形成了致密且均匀连续的网状结构,且具有较大的孔径,这种结构既保证了整体柱有良好的通透性,又可以使分离对象和固定相之间充分的作用[16~18],是对映体分离的良好基础。

|
图 2 整体柱固定相的扫描电子显微镜图 Fig.2 SEM micrographs of stationary phase of the monolithic column |
流动相pH对在固定相表面生成的非对映异构体的稳定性差异有显著的影响,因此对氨基酸衍生物的分离效果产生影响。将流动相pH分别调至6.0、5.0、4.0,保证其他条件一样。在不同流动相pH下,分离数据如表 1所示。由表 1数据对比可知流动相pH为5.0的条件下,分离度Rs最佳。这种情况可能的原因是在pH 5.0时,固定相与对映体相互作用形成的瞬时配合物,这样一对非对映异构体稳定性差异最大。故选择pH 5.0作为以下研究的条件。Dansyl-DL-Phe在三种pH条件下的分离色谱图参见图 3。
|
|
表 1 流动相pH对氨基酸衍生物拆分效果的影响 Table 1 Effects of mobile phase pH on separation of amino acid derivatives |
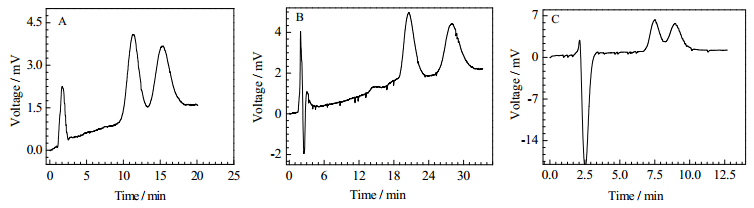
|
图 3 Dansyl-DL-Phe在三种pH条件下的分离色谱图 Fig.3 Chromatogram of Dansyl-DL-Phe separation under three pH conditions Methanol: 0.033 mol·L-1 ammonium acetate = 80:20 (V/V); flow rate = 0.15 mL·min-1; column effective length = 16 cm; room temperature; A: pH 6.0, B: pH 5.0, C:pH 4.00 |
乙酸铵的浓度对分离效果及分离时间都有重要影响。不同乙酸铵浓度条件下,分离数据如表 2所示。由表 2可知随乙酸铵浓度的降低,拆分效果显著提高,但所需分离时间也增加。这是因为盐含量越低,配体交换色谱动力学过程相对越慢,这有利于配体的充分交换;反之,盐含量增加,待拆分氨基酸与固定相之间进行的配体交换不充分,使得拆分效果变差[19]。在0.016 mol·L-1时Rs最大,故选择0.016 mol·L-1的乙酸铵浓度为优化后流动相条件。N-Bz-DL-Val在三种乙酸铵浓度条件下的分离色谱图参见图 4。
|
|
表 2 乙酸铵浓度对氨基酸衍生物拆分的影响 Table 2 Effects of ammonium acetate concentrations on the separation of amino acid derivatives |
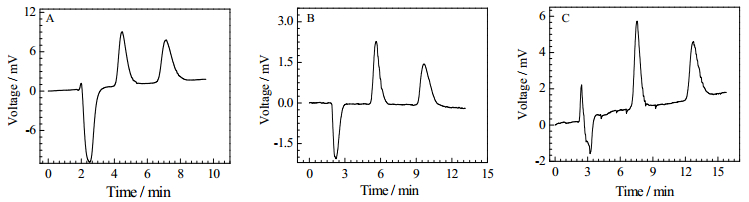
|
图 4 N-Bz-DL-Val在三种乙酸铵浓度条件下的分离色谱图 Fig.4 Chromatogram of N-Bz-DL-Val separation under three ammonium acetate concentrations Methanol: ammonium acetate = 80:20 (V/V); pH 5.0; flow rate = 0.15 mL·min-1; column effective length = 16 cm; room temperature; A: 0.1 mol·L-1, B: 0.033 mol·L-1, C: 0.016 mol·L-1 |
实验结果见表 3所示,随着甲醇含量的降低,分离度略微提高,但所需分离时间也增加。当甲醇含量由90%降至70%分离度变大,但分离所需时间增加显著。在甲醇含量为80%时出峰时间较短,同时也可以达到基线分离的要求,故选择80%的甲醇比例配制流动相。N-Bz-DL-Phe在三种流动相配比下的分离色谱图参见图 5。
|
|
表 3 流动相配比对分离的影响 Table 3 Effects of mobile phase ratios on separation |
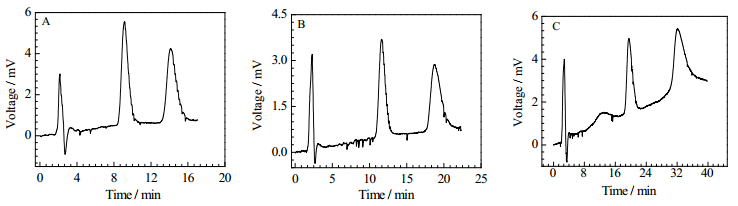
|
图 5 N-Bz-DL-Phe在三种流动相配比下的分离色谱图 Fig.5 Chromatogram of N-Bz-DL-Phe separation under three mobile phase ratios pH 5.0 flow rate = 0.15 mL·min-1; column effective length = 16 cm; room temperature; methanol: 0.016 mol·L-1 ammonium acetate (V/V) = A: 90:10; B: 80:20; C: 70:30 |
为了考察poly(MBQN-co-HEMA-co-EDMA)整体柱的重现性,本实验在微流液相色谱模式下,在流动相条件甲醇:0.016 mol·L-1乙酸铵=80:20、pH5.0;分离柱长16 cm;流速0.15 mL·min-1;检测窗口距出口端7 cm;室温的条件下,以N-Bz-DL-Leu为测试对象一天连续进样6针(Run-to-Run)、连续进行六天实验(Day-to-Day)、采用同样的配方,制备三根毛细管色谱整体柱(Column-to-Column),由表 4可知,保留时间t1、分离度Rs、分离因子α的RSD均符合要求,其重现性良好。
|
|
表 4 Poly(MBQN-co-HEMA-co-EDMA)整体柱的重现性 Table 4 Reproducibility of the poly(MBQN-co-HEMA -co-EDMA) monolithic column |
(1) 本文合成并纯化奎宁衍生物MBQN,并采用液质联用、核磁氢谱及红外光谱进行表征。
(2) 使用MBQN为手性单体,HEMA为功能单体,EDMA为交联剂,十二醇基环己醇作为二元制孔体系,以AIBN为引发剂,制备了Poly(MBQN-co-HEMA-co-EDMA)有机聚合物手性整体柱。并对整体材料进行元素分析、压汞仪、SEM的表征,发现整体柱固定相成功键合了奎宁衍生物;其孔径为2802 nm,孔容为0.74 mL·g-1;结构均匀,与毛细管内壁结合牢固。这些良好的结构是整体柱具备良好分离性能的基础。
(3) 通过流动相优化,在流动相:甲醇: 0.016 mol·L-1乙酸铵(V/V)=80:20;pH 5.0条件下,使用MBQN手性整体柱在微流液相模式下对8种氨基酸衍生物达到基线分离(Rs>1.5)。
(4) 以N-Bz-DL-Leu为测试对象,对整体柱进行重现性考察,发现其Run-to-Run、Day-to-Day、Column-to-Column各参数的RSD值均符合要求,表明此整体柱重现性良好。
| [1] | SUN Ya-ming(孙亚明), BI Qing(毕青), WANG Li-tao(王利涛), et al. Reasearch advances in chiral separation of amino acids by capillary electrophoresis(毛细管电泳在手性氨基酸拆分中的研究进展)[J]. Analysis and Testing Technology and Instruments(分析测试技术与仪器), 2015, 21(3): 129-139. |
| [2] | Pataj Z, Berkecz R, Ilisz I, et al. High-performance liquid chromatographic chiral separation of beta2-homoamino acids[J]. Chirality, 2009, 21(9): 787-798. DOI:10.1002/chir.v21:9. |
| [3] | WANG Qian-ru(王倩如). Research progress on chiral separation of drugs in vivo(体内药物手性拆分方法研究进展)[J]. Asia-Pacific Traditional Medicine(亚太传统医药), 2010, 6(5): 149-151. |
| [4] | YANG Mu(杨沐), ZHONG Wen-ying(钟文英), HOU Wen(侯雯). Research progress of analytical methods for chiral drugs(手性药物分析方法研究进展)[J]. Advances in Pharmaceutical Sciences(药学进展), 2014, 38(3): 209-214. |
| [5] | HU Jian-qiang(胡建强), HUANG Zhi-ping(黄志平), LI Jing(李晶). Progress on chiral resolution of amino acids(氨基酸手性拆分研究进展)[J]. Food and Drug(食品与药品), 2012, 4(01): 60-63. DOI:10.3969/j.issn.1672-979X.2012.01.018. |
| [6] | Wu H B, Wang Q Q, Meng R, et al. Enantioseparation of N-derivatized amino acids by micro-liquid chromatography/laser induced fluorescence detection using quinidine-based monolithic columns[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 121: 244-252. DOI:10.1016/j.jpba.2015.12.011. |
| [7] | Hamase K, Morikawa A, Ohgusu T, et al. Comprehensive analysis of branched aliphatic d -amino acids in mammals using an integrated multi-loop two-dimensional column-switching high-performance liquid chromatographic system combining reversed-phase and enantioselective columns[J]. Journal of Chromatography A, 2007, 1143(1-2): 105-111. DOI:10.1016/j.chroma.2006.12.078. |
| [8] | DU Zu-yin(杜祖银), XIAO Ru-ting(肖如亭). Preparation of a Bis-Quinine bonded chiral stationary phase and its chiral resolution ability(键合偶联双奎宁手性固定相的制备和手性拆分性能)[J]. Chiense Journal of Applied Chemistry(应用化学), 2005, 22(12): 1372-1374. DOI:10.3969/j.issn.1000-0518.2005.12.025. |
| [9] | Wang Q Q, Zhua P J, Ruan M, et al. Chiral separation of acidic compounds using an O-9-(tert-butylcarbamoyl)quinidine functionalized monolith inmicro-liquid chromatography[J]. Journal of Chromatography A, 2016, 1444: 64-73. DOI:10.1016/j.chroma.2016.03.047. |
| [10] | Lämerhofer M, Tobler E, Zarbl E, et al. Macroporous monolithic chiral stationary phases for capillary electrochromatography:New chiral monomer derived from cinchona alkaloid with enhanced enantioselectivity[J]. Electrophoresis, 2003, 24(17): 2986-2999. DOI:10.1002/(ISSN)1522-2683. |
| [11] | Lämerhofer M, Peters E C, Yu C, et al. Chiral monolithic columns for enantioselective capillary electrochromatography prepared by copolymerization of a monomer with quinidine functionality. 1. Optimization of polymerization conditions, porous properties, and chemistry of the stationary phase[J]. Analytical Chemistry, 2000, 72(19): 4614-4622. DOI:10.1021/ac000322l. |
| [12] | Lämmerhofer M, Svec F, Fréchet J M J, et al. Monolithic stationary phases for enantioselective capillary electrochromatography[J]. Journal of Microcolumn Separations, 2015, 12(12): 597-602. |
| [13] | Lämmerhofer M, Zarbl E, Lindner W, et al. Simultaneous separation of the stereoisomers of 1-amino-2-hydroxy and 2-amino-1-hydroxypropane phosphonic acids by stereoselective capillary electrophoresis employing a quinine carbamate type chiral selector[J]. Electrophoresis, 2001, 22(6): 1182-1187. DOI:10.1002/(ISSN)1522-2683. |
| [14] | LI Wei(李伟), CHNE Jun(陈军), ZHANG Yu-ping(张裕平). Preparation and evaluation of novel porogen organic-based monolithic capillary column(新型致孔剂的有机基质毛细管整体柱的制备与评价)[J]. Chinese Journal of Analysis Laboratory(分析实验室), 2013, 32(12): 79-83. |
| [15] | CHEN Na(陈娜), ZHANG Yu-ping(张裕平), YE Xiong-wen(叶雄文), et al. Preparation of monolithic capillary columns of mixed alkyl silane by sol-gel technology(溶胶凝胶法制备混合硅烷毛细管整体柱)[J]. Journal of Henan Institute of Science and Technology(河南科技学院学报), 2010, 38(2): 101-106. DOI:10.3969/j.issn.1008-7516.2010.02.023. |
| [16] | LV Ren-jiang(吕仁江), DING Hui-min(丁会敏), LI Ying-jie(李英杰), et al. Preparation and application of acrylamide-β-cyclodextrin chiral monolithic column for capillary electrochromatography(丙烯酰胺-β-环糊精毛细管电色谱手性整体柱的制备及应用)[J]. Chinese Journal of Apply Chemistry(应用化学), 2012, 29(5): 604-607. DOI:10.3969/j.issn.1001-4160.2012.05.020. |
| [17] | WANG Jia-bin(王家斌), WANG Xiao(王啸), LI Jian-hua(李建华), et al. Preparation of chiral monolithic column with covalently bonded cellulose and their application to rapid enantioseparation(纤维素键合型手性整体柱的制备及其在快速手性分离中的应用)[J]. Chinese Journal of Chromatography(色谱), 2011, 29(12): 1222-1229. |
| [18] | ZHOU Ling-ling(周玲玲), LI Guo-xiang(李国祥), WANG Jian-yu(王剑瑜), et al. Preparation of N-(4-Methybenzoyl) phenylglycine stationary phase and application to the separation of various enantiomers(N-(4-甲基苯甲酰基)苯甘氨酸手性固定相的合成及对多种手性化合物的拆分)[J]. Chinese Journal of Analytical Chemistry(分析化学), 2007, 35(9): 1301-1304. DOI:10.3321/j.issn:0253-3820.2007.09.012. |
| [19] | MA Gui-juan(马桂娟), GONG Bo-lin(龚波林), YAN Chao(闫超), et al. Preparation of polymer-bonded chiral ligand exchange chromatographic stationary phase and resolution of racemates(新型L-羟脯氨酸聚合物键合手性固定相的制备及对手性化合物的拆分)[J]. Chinese Journal of Analytical Chemistry(分析化学), 2008, 36(3): 275-279. DOI:10.3321/j.issn:0253-3820.2008.03.001. |




