2. 中科院 大连化学物理研究所,辽宁 大连 116023
2. Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China
近年来,锂二次电池因其具有能量密度高、循环寿命长,以及无污染等优点,已经成为各类电子产品的首选电源。随着科学技术的快速发展,移动电子设备、电动汽车以及航空航天技术等对锂二次电池的比能量提出了更高的要求[1~4]。锂硫电池是一种高比能量的锂二次电池。单质硫作为正极活性组分发生双电子氧化还原反应,其理论比容量高达1672 mA·h·g-1;并且单质硫资源丰富、环境友好、成本低廉,是理想的正极材料。锂硫电池的理论比能量可达2600 W·h·kg-1,远高于传统锂离子电池,是下一代高能量密度二次电池的代表和重要发展方向,受到国内外研究人员的广泛关注[5~8]。
由于锂硫电池在充放电反应过程中存在“穿梭”效应,高价态多硫化物易溶解在电解液中,并扩散到金属锂负极表面,与金属锂发生反应,造成锂硫电池充放电过程中的自放电率高及电池容量衰减快等问题。因此,研究锂硫电池的自放电特性无论对于实际应用的能源管理还是研究测试中获取准确的测量结果皆具有重要意义[9~13]。
本文主要考察了环境温度、搁置时间和搁置放电深度对锂硫软包电池自放电特性的影响。通过在锂硫软包电池隔膜间加入两根金属锂包裹的铜丝作为参比电极,与电池正负极一起形成四电极结构,原位测量了电解液在不同放电深度时的电导率,研究了电解液电导率变化对电池自放电的影响规律,探索了抑制锂硫电池自放电的途径。
2 实验部分实验所用的锂硫电池为大连化物所自制的同一批次1 Ah软包电池。采用LAND CT2001A-7V/3A型电池测试系统进行恒流放电测试。充放电的电压范围为1.8~2.65 V。使用交流阻抗测试仪器Versa STAT 4进行交流阻抗的测试。在所有实验中,电池均放在恒温箱(DGG-9023A型,上海森信实验仪器有限公司)中,分别设置实验温度为25℃和40℃。
将同一批次的电池分成五组。其中一组作为对照,以0.1C倍率电流(0.1 A)进行充放电,记录各个电池的实际放电比容量、循环性能及每次循环后电池的容量衰减。另外三组电池分别搁置3 d、7 d和30 d后,测量电池的首次放电比容量,并与对照组比较以便得出未循环过的锂硫电池的搁置自放电率。最后一组电池用来研究放电深度对锂硫电池搁置自放电率的影响。具体实验步骤为:首先将各个电池进行充放电,循环到第n次时,以0.1 A电流放电到指定放电深度,然后搁置电池一定的时间后,再继续放电到截止电压,记录总的放电容量(Cn)。第n-1次放电容量为Cn-1。按以下公式计算自放电率Ct:
| ${C_{\rm{t}}} = 1 - \frac{{Cn}}{{(Cn - 1 - Cir)}}$ |
式中:Cn为搁置组第n次循环所测得的总放电比容量;
Cn-1为搁置组第n-1次循环放电比容量;
Cir为对照组电池第n-1次与第n次放电比容量之差,为本次循环不可逆容量损失。
充放电过程中电池电解液的电导率测试方法:在锂硫软包电池的两层隔膜间插入两根被金属锂包裹的细铜丝,如图 1所示。在25℃下,以0.1 A电流对电池进行充放电,至指定的放电深度,利用Versa STAT 4测量两铜丝间电解液的交流阻抗,进而计算出各放电深度时电解液的电导率。根据所测电解液阻抗数据通过如下方法计算电解液电导率κ:
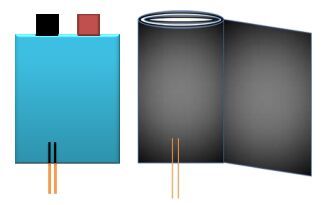
|
图 1 四电极锂硫软包电池安装示意图 Fig.1 Schematic diagram of a four-electrode lithium sulfur battery |
| $\kappa = \frac{L}{{R \times S}}$ |
式中:L为两铜丝间距离为0.1 cm;
R为所测得阻抗(Ω);
S为两铜丝与电解液接触的表面积为0.1884 cm2;
d为铜丝直径0.04 cm;
h为铜丝伸进电池长度1.5 cm。
3 结果与讨论本实验采用1 Ah级锂硫软包装电池研究电池的自放电行为。图 2为1 Ah级软包装锂硫电池在25℃和40℃时的循环性能曲线。环境温度为25℃时,电池前15次循环的放电比容量基本保持稳定,表现出较好的稳定性。在40℃的环境温度中,电池的首次放电比容量接近1.18 Ah,较其在25℃时提高10%。随后的循环过程中,电池的放电容量随循环次数的增加发生轻微的衰减。因此,在计算电池搁置自放电性能时,需要扣除电池的这部分不可逆容量损失。
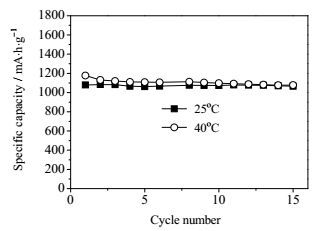
|
图 2 对照组电池不同温度下的比容量衰减情况 Fig.2 Specific capacity fades of the cell in control group at different temperatures |
采用醚类电解液的锂硫电池的放电中间产物涉及多种价态的多硫化物。在锂硫电池的放电曲线上出现两个电压平台区。高放电平台阶段为2.4~2.1 V,低放电平台阶段为2.1~1.5 V。在高放电电压平台阶段,正极发生单质硫电化学还原反应,生成高价态的多硫化物(Li2Sn,4≤n≤8),在低放电平台阶段,多硫化物(Sn2-,4≤n≤8) 进一步被还原成低价态多硫化物(Sn2-,2≤n≤4)、Li2S2和终产物不溶性的Li2S[14]。
图 3为锂硫软包电池搁置不同时间之后的首次放电比容量。电池搁置3 d、7 d和30 d的自放电率分别为0.56%·d-1、0.45%·d-1和0.15%·d-1。发现随着搁置时间的增多自放电率明显降低。未循环过的电池因其内部还没有多硫化物产生,搁置时内部几乎没有自发的反应发生所以自放电率非常低,因此刚制出的满电锂硫电池可以较长时间搁置贮存。图 4为在25℃环境中,锂硫电池放电至不同的DOD后搁置72 h的放电性能曲线。电池以0.1 A电流放电到指定放电深度,然后电池搁置72 h,此时电池转为静置阶段,放电电路中没有电流通过,电压恢复到平衡电位附近,因此电压会升高,表现在曲线上就是出现了一个高点,搁置完成后电池继续放电到截止电压,此时由于通入电流放电,极化的作用放电电压降低,曲线恢复到正常放电平台电压附近,最终得到放电性能曲线。
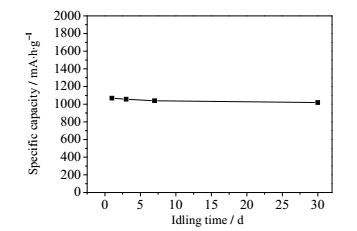
|
图 3 25℃下未循环状态的锂硫软包电池搁置不同时间之后首次放电比容量变化 Fig.3 First discharge specific capacities of the Li-S pouch type cell after storing for various times |
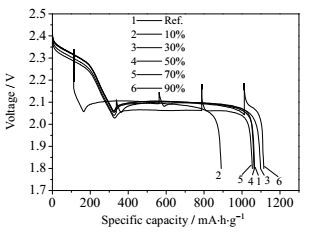
|
图 4 25℃下不同DOD搁置72 h电池放电电压曲线 Fig.4 Discharge curves of the Li-S pouch type cell at various DOD after storage for 72 h under 25℃ |
从图 4中可以看到,电池放电至10%DOD后搁置72 h,再次放电,比容量明显衰减,仅为0.89 Ah。这种情况下,电池的自放电明显。电池放电至30% DOD后搁置,再次放电的容量为1.1 Ah,较对照组电池的容量略有提高。放电至50% DOD和70% DOD后搁置的电池,再次放电,电池的容量几乎没有损失。放电至90% DOD后搁置的电池的容量较对照电池提高。
从以上实验结果可以看到,放电深度影响锂硫电池的搁置性能。放电到高电压平台后搁置,电池发生明显的自放电;而放电到低电压平台后搁置,电池的自放电不明显。电池在高电压平台时,高价态的多硫化物易溶解于醚类电解液中,通过隔膜迁移至金属锂负极的表面发生自放电反应。当DOD>30%时,高价态的多硫化物(Sn2-,4≤n≤8) 大部分已经转化为低价态的多硫化物(Sn2-,2≤n≤4),在搁置的状态下,正极附近的Li2S4很难自发地向不溶性的产物L2S2或L2S转化,在搁置过程中可能是没有完全利用的单质硫逐渐向多硫化物转化,这部分多硫化物在后续的放电过程中提供容量,这也是造成电池容量在搁置后反而增加的情况。而在放电末期(如90% DOD时),多硫化物以低价态形式存在,且很大一部分已转化为不溶性产物L2S2或L2S,相比于高价态多硫化物其更不容易与金属锂发生反应,从而抑制自放电行为的产生。因此,锂硫电池内部存在的可溶性多硫化物与金属锂负极发生反应是造成锂硫电池自放电的主要原因。
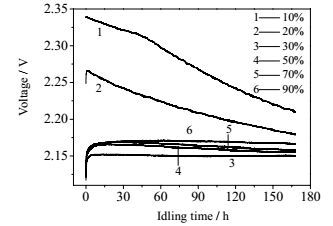
从以上分析可知锂硫电池在不同搁置状态下自放电特性存在明显差异,在搁置时锂硫电池内部各价态多硫化物会发生复杂的相互转化反应,不同放电深度下多硫化物浓度也不同,而多硫化物的存在状态直接反映到电池的开路电压。因此,建立多硫化物存在状态-电池开路电压-电池自放电间的关联,并通过电池搁置后的开路电压来预判电池的自放电程度。图 5为环境温度25℃条件下不同DOD搁置时电池开路电压的变化曲线。电池10% DOD搁置时,在搁置期间内电池开路电压发生明显的衰减,随着搁置DOD的提高电池开路电压搁置前后的差值降低。当搁置DOD为30%时,电池开路电压没有发生变化,而50%和70% DOD时电池开路电压衰减较小,当DOD为90%时,电池开路电压没有发生变化。与自放电数据对比发现,开路电压的衰减与自放电存在相关性。
|
图 5 25℃时在不同DOD下锂硫电池开路电压随搁置时间变化 Fig.5 Variation of open-circuit voltages of Li-S cells as a function of idling time at different depths of discharge under 25℃ |
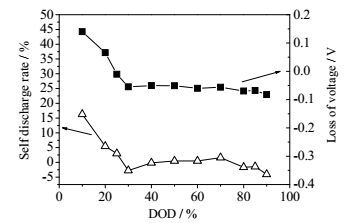
为了更直观地对比开路电压与自放电的关系,通过计算得出25℃搁置72 h时各DOD处开路电压变化值,使之与同条件下锂硫电池自放电曲线相比较。如图 6所示,锂硫电池自放电行为与搁置DOD的关系为:在低DOD时(<30%),电池处于高电压平台,电池开路电压衰减快,电池自放电率高,且随着DOD增加,自放电率随之降低,在30% DOD时,即高电压平台转为低电压平台的节点处,电池开路电压稳定,电池没有自放电现象。在低电压平台时(DOD 30%~80%),电池开路电压衰减小,自放电率低。
|
图 6 25℃下在各DOD处搁置72 h的自放电率和开路电压前后变化 Fig.6 Self-discharge rates and open circuit voltage variations after 72 hours of relaxation under different depths of discharge at 25℃ |
电池的自放电趋势与开路电压差值曲线的变化规律相一致,因此推测搁置时开路电压的变化情况可能用于预测锂硫电池的自放电情况。这可能会使得观察锂硫电池储存时的自放电情况变得快捷。目前开路电压法估测锂离子电池荷电状态已经有较为广泛的研究[15~18]。然而对通过锂硫电池开路电压(OCV)的变化估测其自放电的方法还鲜有报道。有关锂硫电池的开路电压变化与电池自放电情况的关联还需进一步地研究。
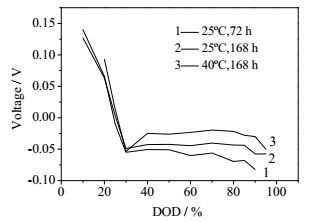
3.2 搁置时间、环境温度对锂硫电池自放电的影响环境温度和搁置时间是影响电池的自放电率的重要影响因素,因此对锂硫电池在不同环境温度和搁置时间的开路电压和自放电情况进行了测试。图 7为锂硫电池在25℃和40℃条件下,不同放电深度时搁置72 h和168 h前开路电压减去搁置后开路电压的差值的变化曲线。在相同的环境温度条件下,随着搁置时间的延长,电池开路电压差值增加,说明电池自放电增加,这也可以从后面的自放电测试数据证明。当电池在不同环境温度搁置时可以发现,随着环境温度的增加,电池的开路电压值明显增大,电池自放电同样增大。即随着搁置时间的增加和环境温度的升高,自放电随之增大。
|
图 7 不同温度、搁置时间和放电深度下搁置前后开路电压差值比较 Fig.7 Comparison of open circuit voltage differential before and after relaxation under different temperatures, idling times and depths of discharge |
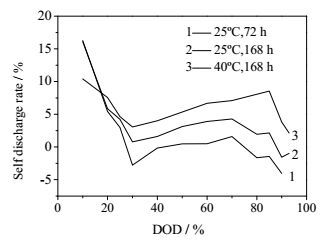
图 8为锂硫电池在不同温度和搁置时间条件下的自放电变化曲线。与开路电压规律相同,锂硫电池的自放电随搁置温度和时间的增加而增大。值得注意的是,25℃搁置72 h时存在自放电为负值的情况,即搁置后容量反而增加的情况,这与3.1节所述的内部多硫化物自发的转化和反应有关。随着温度的上升和搁置时间的加长,此现象随之消失。同为搁置一周,环境温度40℃时的自放电率明显高于25℃时的自放电率。随着环境温度升高,内部多硫化物转化反应速度及扩散速度加快,其更易与锂负极反应,加速锂硫电池的自放电。而同在25℃环境温度下,搁置168 h的自放电率要高于搁置72 h的自放电率,这是因为随着搁置时间的增加,会有更多的多硫化物参与自放电反应,加剧电池的自放电。
|
图 8 不同温度和搁置时间下自放电率 Fig.8 Self-discharge rates at different temperatures and idling times |
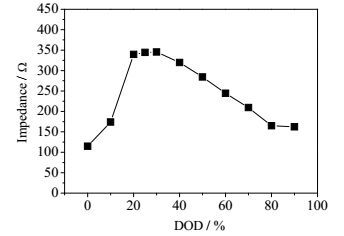
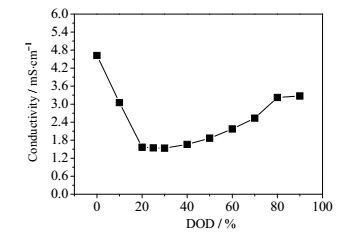
锂硫电池的自放电特性与电池内部多硫化物的存在状态密切相关,而高价态多硫化物的浓度对电解液的电导率具有重要影响,因此可以通过原位测量手段分析锂硫电池反应过程中电解液的电导率变化规律,并分析电解液电导率与自放电特性的关联[19~24]。本文通过原位四电极法的研究方法测试分析不同放电DOD时内部电解液电导率的变化情况,电池两个参比电极间距小,测试阻抗时不影响电解液和锂硫软包电池的充放电过程。图 9和图 10分别为不同放电深度时锂硫电池内部电解液阻抗变化曲线和放电过程中电解液电导率变化曲线。
|
图 9 不同放电深度下锂硫电池内部电解液阻抗变化曲线 Fig.9 Impedance profile of the lithium sulfur battery electrolyte under different depths of discharge |
|
图 10 不同放电深度下锂硫电池内部电解液电导率变化曲线 Fig.10 Conductivity profile of the lithium sulfur battery electrolyte under different depths of discharge |
如图所示,随着锂硫电池放电DOD的增加,电池内部电解液阻抗增加,在30% DOD时达到最高值,其对应于高价态多硫化物的生成以及向低价态多硫化物的转化,此时电解液中多硫化物浓度不断增加并达到最高值。当继续放电时阻抗降低,对应于低价态多硫化物向Li2S2和Li2S的转化,可溶性多硫化物的浓度不断降低。值得注意的是,通过计算所得的不同放电深度下电解液电导率变化趋势与电池自放电曲线趋势相同。
通过上述分析,影响锂硫电池自放电的主要原因为:电解液电导率在溶剂确定的条件下与锂盐的浓度密切相关,锂盐浓度增加到一定数值时锂盐的电离受到限制,同时电解液黏度增大,进而导致电解液电导率降低。锂硫电池电解液电导率降低说明放电过程中多硫化物不断溶解到电解液中,导致盐浓度增加以及黏度增大,而自放电与多硫化物的价态和浓度密切相关,高价态的多硫化物浓度越高自放电越大(因为有更多的高价态多硫化物迁移到负极与金属锂发生反应),随着放电过程的进行,虽然盐浓度增加,但是多硫化物的价态不断降低,低价态的多硫化物很难与金属锂发生反应,而高浓度多硫化物导致的黏度增加亦会限制其向负极扩散。在30% DOD之后,因为没有高价态的多硫化物生成,自放电小,随着多硫化物浓度的降低,多硫化物向负极的迁移变得容易,自放电有所增加,这也说明了在30% DOD之后自放电有所提高的现象。随着接近放电终点,多硫化物的浓度急剧降低,自放电也随之降低。多硫化物浓度的变化可以从电解液的电导率的变化获得。因此,锂硫电池自放电特性的研究对锂硫电池的最佳搁置状态的选择非常重要。
4 结论锂硫电池的自放电受电池搁置环境、搁置时间和搁置放电状态影响,在室温环境下,放电深度在30%附近或放电末期搁置贮存,锂硫电池的自放电率较小,容量损失小,对于锂硫电池的储存更有利。锂硫电池搁置时开路电压的变化可以用于预测电池自放电,其对于锂硫电池储存时的容量状态估测具有积极的意义。锂硫电池放电时电池内部电解液电导率与多硫化物状态和浓度密切相关并与锂硫电池自放电行为存在内在联系。搁置时电池内部多硫化物的浓度、多硫化物的价态、扩散速率等直接影响锂硫电池的自放电行为。
| [1] | Marom R, Amalraj S F, Leifer N, et al. A review of advanced and practical lithium battery materials[J]. Journal of Materials Chemistry , 2011, 21(27): 9938-9954. DOI:10.1039/c0jm04225k. |
| [2] | ZUO Peng-jian(左朋建), YIN Ge-ping(尹鸽平). Si-Mn composite anode used for Li-ion battery(锂离子电池用Si-Mn复合电极的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2006, 20(4): 634-637. |
| [3] | Manthiram A, Fu Y, Su Y S. Challenges and prospects of lithium-sulfur batteries[J]. Accounts of Chemical Research , 2013, 46(5): 1125-34. DOI:10.1021/ar300179v. |
| [4] | Fotouhi A, Auger D J, Propp K, et al. A review on electric vehicle battery modelling:from lithium-ion toward lithium-sulphur[J]. Renewable & Sustainable Energy Reviews , 2016, 56: 1008-1021. |
| [5] | Li K, Wang B, Su D, et al. Enhance electrochemical performance of lithium sulfur battery through a solution-based processing technique[J]. Journal of Power Sources , 2012, 202: 389-393. DOI:10.1016/j.jpowsour.2011.11.073. |
| [6] | Ahn W, Kim K B, Jung K N, et al. Synthesis and electrochemical properties of a sulfur-multi walled carbon nanotubes composite as a cathode material for lithium sulfur batteries[J]. Journal of Power Sources , 2012, 202: 394-399. DOI:10.1016/j.jpowsour.2011.11.074. |
| [7] | Barchasz C, Leprêtre J C, Alloin F, et al. New insights into the limiting parameters of the Li/S rechargeable cell[J]. Journal of Power Sources , 2012, 199: 322-330. DOI:10.1016/j.jpowsour.2011.07.021. |
| [8] | Manthiram A, Chung S H, Zu C. Lithium-sulfur batteries:progress and prospects[J]. Advanced Materials , 2015, 27(12): 1980-2006. DOI:10.1002/adma.v27.12. |
| [9] | Knap V, Stroe D I, Swierczynski M, et al. Investigation of the self-discharge behavior of lithium-sulfur batteries[J]. Journal of the Electrochemical Society , 2016, 163(6): A911-A916. DOI:10.1149/2.0641606jes. |
| [10] | Lacey M J, Yalamanchili A, Maibach J, et al. The Li-S battery:an investigation of redox shuttle and self-discharge behaviour with LiNO3-containing electrolytes[J]. Rsc Advances , 2015, 6(5): 3632-3641. |
| [11] | Xu W T, Peng H J, Huang J Q, et al. Towards stable lithium-sulfur batteries with a low self-discharge rate:ion diffusion modulation and anode protection[J]. Chemsuschem , 2015, 8(17): 2892-2901. DOI:10.1002/cssc.201500428. |
| [12] | Al-Mahmoud S M, Dibden J W, Owen J R, et al. A simple, experiment-based model of the initial self-discharge of lithium-sulphur batteries[J]. Journal of Power Sources , 2016, 306: 323-328. DOI:10.1016/j.jpowsour.2015.12.031. |
| [13] | XIONG Shi-zhao(熊仕昭), XIE Kai(谢凯), HONG Xiao-bin(洪晓斌), et al. Effects of temperature and additive on self-discharge of lithium-sulfur batteries(温度和添加剂对锂硫电池自放电的影响)[J]. Chinese Battery Industry(电池工业) , 2010, 15(6): 363-366. |
| [14] | Cheon S E, Ko K S, Cho J H, et al. Rechargeable lithium sulfur battery I. structural change of sulfur cathode during discharge and charge[J]. Journal of the Electrochemical Society , 2003, 150(6): A796-A799. DOI:10.1149/1.1571532. |
| [15] | LIN Cheng-tao(林成涛), WANG Jun-ping(王军平), CHEN Quan-shi(陈全世). Methods for state of charge estimation of EV batteries and their application(电动汽车SOC估计方法原理与应用)[J]. Battery Bimonthly(电池) , 2004, 34(5): 376-378. |
| [16] | Roscher M A, Sauer D U. Dynamic electric behavior and open-circuit-voltage modeling of LiFePO4-based lithium ion secondary batteries[J]. Journal of Power Sources , 2011, 196: 331-336. DOI:10.1016/j.jpowsour.2010.06.098. |
| [17] | Ryu H S, Ahn H J, Kim K W, et al. Self-discharge characteristics of lithium/sulfur batteries using TEGDME liquid electrolyte[J]. Electrochimica Acta , 2006, 52(4): 1563-1566. DOI:10.1016/j.electacta.2006.01.086. |
| [18] | XU Xin-ge(徐欣歌), YANG Song(杨松), LI Yan-fang(李艳芳), et al. A method of SOC-estimate based on forecast of open-circuit voltage(一种基于预测开路电压的SOC估算方法)[J]. Electronic Design Engineering(电子设计工程) , 2011, 19(14): 127-129. DOI:10.3969/j.issn.1674-6236.2011.14.053. |
| [19] | Choi J W, Kim J K, Cheruvally G, et al. Rechargeable lithium/sulfur battery with suitable mixed liquid electrolytes[J]. Electrochimica Acta , 2007, 52(5): 2075-2082. DOI:10.1016/j.electacta.2006.08.016. |
| [20] | Chang D R, Lee S H, Kim S W, et al. Binary electrolyte based on tetra(ethylene glycol) dimethyl ether and 1, 3-dioxolane for lithium-sulfur battery[J]. Journal of Power Sources , 2002, 112(2): 452-460. DOI:10.1016/S0378-7753(02)00418-4. |
| [21] | Zhang S S. Liquid electrolyte lithium/sulfur battery:Fundamental chemistry, problems, and solutions[J]. Journal of Power Sources , 2013, 231: 153-162. DOI:10.1016/j.jpowsour.2012.12.102. |
| [22] | XIONG Shi-zhao(熊仕昭), XIE Kai(谢凯), HONG Xiao-bin(洪晓斌). Effect of LiNO3 as additive on electrochemical properties of lithium-sulfur batteries(硝酸锂作添加剂对锂硫电池电化学性能的影响)[J]. Chemical Journal of Chinese Universities(高等学校化学学报) , 2011, 32(11): 2645-2649. |
| [23] | JIN Zhao-qing(金朝庆), XIE Kai(谢凯), HONG Xiao-bin(洪晓斌). Review of electrolyte for lithium sulfur battery(锂硫电池电解质研究进展)[J]. Acta Chimica Sinica(化学学报) , 2014, 72(1): 11-20. DOI:10.3866/PKU.WHXB201411063. |
| [24] | MA Yu-lin(马玉林), GAO Yun-zhi(高云智), ZUO Peng-jian(左朋建). Effect of triphenyl phosphate on the safety and electrochemical performance of lithium ion batteries(磷酸三苯酯对锂离子电池安全性及电化学性能的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24(6): 954-959. |




