1-氨甲基-2-萘酚类化合物具有萘环、羟基、胺基、酰胺基等众多潜在的药效基团,在新药的创制研发中引起了广泛的关注。研究表明,1-氨甲基-2-萘酚类化合物具有抗病毒、抗感染、抗真菌、抗氧化、消炎和杀菌等药理学作用,因而被广泛的应用于合成各种抗菌、消炎、镇痛等药物[1~3]。
目前,根据反应机理以及底物的不同,可将其合成方法分为两大类:(1) Perumal课题组[4]报道了以β-萘酚、取代醛和腈为原料制得1-氨甲基-2-萘酚。在反应中乙腈既作为反应物同时也作为反应的溶剂。由于与胺类相比,乙腈的N活性相对较弱,在反应中,使用当量的Ce(SO4)2作为催化剂。另一方面,在该反应条件下,不仅是β-萘酚,一般的苯酚也能得到该类产物,但收率较低。随后Shaterian课题组先后报道了用Fe(HSO4)3[5]、HClO4·SiO2[6]、FeCl3·SiO2[7]作为催化剂制备合成,收率为47%~88%。然而,在该反应条件下,脂肪醛以及不饱和芳香醛都得不到相应的1-氨甲基-2-萘酚产物。(2) Saidi课题组[8]报道了以高氯酸锂为催化剂,β-萘酚、亚胺一锅法合成氨甲基萘酚类化合物。此法反应条件温和,室温下即可反应。Naimi-Jamal[9]和Jha[10]分别采用微波的方法,以β-萘酚、取代醛和环仲胺作为原料在酸性Al2O3和对甲苯磺酸条件下合成此类化合物。2006年,Khodaei课题组[11]在报道了以对甲苯磺酸为催化剂,催化的β-萘酚、芳香醛和酰胺的缩合反应,并得到较高产率目标化合物。随后这种方法得到广泛的运用和发展,多种酸催化剂被用来合成,如ZnCl2[12]、Bi(NO3)3∙5H2O[13]、三氟甲磺酸金属盐[14, 15]、酸性纳米粒[16, 17]、离子液体[18, 19]等。虽然该类反应收率较高,但其底物的适用范围不广,且一些催化剂对环境污染大,不易回收套用。为此,仍有必要继续探索更好的合成方法。
为进一步认识具有氨甲基萘酚结构化合物的化学以及药理性质,在总结前人工作的基础上,有必要拓展反应的应用对象,合成该家族的其他系列新型化合物。同时,设计选择新型高效的有机小分子催化剂,高效简便合成该类氨甲基萘酚结构的化合物,在新药设计及药物中间体的合成领域仍具有重要的研究意义和应用前景。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料Büchi B-540熔点仪;Nicolet Aviatar-370型红外分光光度计;Varian-400(400 MHz)或者Bruker Avance Ⅲ (500 MHz)核磁共振仪;Thermo Finnigan LCQ Advantage (ESI)质谱仪;Agilent 6210 TOF LC/MS质谱仪。
硅胶GF 254(青岛海洋化工厂)、羧甲基纤维素钠(CMC)、200-300目硅胶(青岛海洋化工厂)、胺、取代醛、萘酚、三氟甲磺酸脯氨酸盐、二氯甲烷、乙酸乙酯、石油醚等为分析纯,购自中国国药集团有限公司。
2.2 实验方法 2.2.1 1-氨甲基-2-萘酚类化合物合成一般方法在100 mL三口瓶中,加入胺(11 mmol)、醛(10 mmol)、萘酚(10 mmol)、三氟甲磺酸脯氨酸盐(10%(mol))和20 mL二氯甲烷,回流搅拌反应,待反应完成后(TLC监控,石油醚:乙酸乙酯= 5:4),得粗品。粗品经过乙酸乙酯(50 mL)重结晶即得产物。
2.2.2 N-((2-羟基萘酚-1-基)(苯基)甲基)苯甲酰胺4a的合成在100 mL三口瓶中,加入苯甲酰胺(1.33 g,11 mmol)、苯甲醛(1.06 g,10 mmol)、β-萘酚(1.44 g,10 mmol)、三氟甲磺酸脯氨酸盐(0.27 g,10%(mol))和20 mL二氯甲烷,回流搅拌反应,待反应完成后(TLC监控,石油醚:乙酸乙酯= 5:4),过滤,滤饼用水洗涤,得粗品。粗品在50 mL乙酸乙酯中重结晶,过滤干燥即得纯品N-((2-羟基萘酚-1-基)(苯基)甲基)苯甲酰胺4a,3.29 g,收率93%。
2.2.3 N-((1-羟基萘酚-2-基)(4-氯苯基)甲基)苯甲酰胺5a的合成在100 mL三口瓶中,加入苯甲酰胺(1.33 g,11 mmol)、4-氯苯甲醛(1.41 g,10 mmol)、α-萘酚(1.44 g,10 mmol)、三氟甲磺酸脯氨酸盐(0.27 g,10%(mol))和20 mL二氯甲烷,回流搅拌反应,待反应完成后(TLC监控,石油醚:乙酸乙酯= 5:4),加入水,再用30 mL乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,减压浓缩得粗品。粗品经柱层析(乙酸乙酯:石油醚为1:12~1:4)分离纯化得到纯品N-((1-羟基萘酚-2-基)(4-氯苯基)甲基)苯甲酰胺5a,1.78 g,收率46%。
2.2.4 N-((2-羟基萘酚-1-基)(苯基)甲基)对氯苯胺6a的合成在100 mL三口瓶中,加入对氯苯胺(1.40 g,11 mmol)、苯甲醛(1.06 g,10 mmol)、β-萘酚(1.44 g,10 mmol)、三氟甲磺酸脯氨酸盐(0.27 g,10%(mol))和20 mL二氯甲烷,回流搅拌反应,待反应完成后(TLC监控,石油醚:乙酸乙酯= 5:4),加入水,再用30 mL乙酸乙酯萃取三次,合并有机相,无水硫酸镁干燥,减压浓缩得粗品。粗品经柱层析(乙酸乙酯:石油醚为1:12~1:4)分离纯化得到纯品N-((2-羟基萘酚-1-基)(苯基)甲基)对氯苯胺7a,2.80 g,收率78%。
2.3 代表性产物结构表征N-((2-羟基萘酚-1-基)(苯基)甲基)苯甲酰胺4a:Mp.: 242~243℃. IR (KBr, cm−1): 3422, 3147, 1629, 1538, 1400, 1347, 822, 751, 582. 1H NMR (500 MHz, DMSO-d6) δ(ppm): 10.33 (s, 1H, OH), 9.03 (d, J = 8.5 Hz, 1H, NH), 8.08 (d, J = 8.5 Hz, 1H, Ar-H), 7.87~7.79 (m, 4H, Ar-H), 7.57~7.54 (m, 1H, Ar-H), 7.50~7.47 (m, 3H, Ar-H), 7.32-7.20 (m, 8H, Ar-H). 13C NMR (125 MHz, DMSO-d6) δ(ppm): 166.2, 153.6, 142.4, 134.8, 132.8, 131.9, 129.9, 129.1, 129.9, 129.1, 129.0, 128.8, 128.7, 127.6, 127.2, 127.0, 126.9, 123.2, 119.1, 118.8, 49.7. MS (ESI): m/z 352 (M-)。
N-((1-羟基萘酚-2-基)(4-氯苯基)甲基)苯甲酰胺5a:Mp.: 207~210℃. IR (KBr, cm−1): 3420, 3132, 1611, 1400, 804, 759. 1H NMR (400 MHz, DMSO-d6) δ(ppm): 9.67 (s, 1H, OH), 9.26 (d, J = 8.4 Hz, 1H, NH), 8.25~8.22 (m, 1H, Ar-H), 7.94~7.92 (m, 2H, Ar-H), 7.84~7.81 (m, 1H, Ar-H), 7.55~7.32 (m, 11H, Ar-H), 7.01 (d, J = 8.4 Hz, 1H, CH). 13C NMR (100 MHz, DMSO-d6) δ(ppm): 166.2, 149.4, 141.4, 134.3, 133.6, 131.4, 131.3, 129.2, 128.2, 128.1, 127.6, 126.0, 125.2, 125.1, 123.2, 122.2, 119.6, 50.3. MS (EI): m/z (%) 389 (M+, 2), 387 (4), 265 (39), 231 (100)。
N-((2-羟基萘酚-1-基)(苯基)甲基)对氯苯胺6a:Mp.: 131~134℃. IR (KBr, cm−1) νmax: 3330, 3131, 1400, 817, 703. 1H NMR(400 MHz, DMSO-d6) δ(ppm): 7.80~7.74 (m, 3H, Ar-H), 7.48~7.46 (m, 2H, Ar-H), 7.41~7.29 (m, 5H, Ar-H), 7.15~7.09 (m, 3H, Ar-H), 6.72~6.69 (m, 2H, Ar-H), 6.13 (s, 1H, CH). 13C NMR (100 MHz, DMSO-d6) δ(ppm): 156.0, 145.2, 140.7, 131.5, 130.2, 129.5, 129.4, 129.2, 129.1, 128.7, 128.0, 126.9, 123.0, 121.3, 120.0, 117.5, 113.3, 62.7. MS (ESI): m/z 358 (M-)。
3 实验结果与讨论三氟甲磺酸铵盐作为新型绿色高效的有机小分子催化剂,受到广泛的关注并应用于一系列的有机反应。研究发现三氟甲磺酸铵盐能很好地促进β-萘酚、芳香醛和酰胺的缩合反应,合成一系列1-氨甲基-2-萘酚化合物(图 1)。
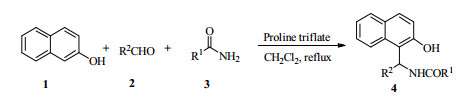
|
图 1 三氟甲磺酸铵盐催化合成1-氨甲基-2-萘酚化合物 Fig.1 Synthesis of 1-amidomethyl-2-naphthols catalyzed by proline triflate |
以β-萘酚、苯甲醛和苯甲酰胺为底物,在二氯甲烷溶剂中回流反应,考察不同催化剂及其催化剂回收重利用对产物4a的合成收率的影响,结果见表 1。
|
|
表 1 不同催化剂对反应的影响 Table 1 Effects of different catalysts on reaction a |
由表 1看出,有机酸对该反应的催化活性非常有限,尤其是三氟甲磺酸,作为超强酸并不适合该类Mannich反应(收率为79%)。因此,考察了一系列的三氟甲磺酸铵盐对该反应的催化活性,根据实验结果以及文献资料[20, 21],对于三氟甲磺酸有机芳香铵盐,氨基取代基的多少成为影响其催化作用的主要原因。而在催化剂的回收利用方面,三氟甲磺酸有机芳香铵盐回收利用率很低(< 30%)。对于三氟甲磺酸有机脂肪铵盐,三氟甲磺酸脯氨酸盐(proline triflate)的催化效果最佳,这可能跟脯氨酸自身的酸性有一定的关系。此外,三氟甲磺酸脯氨酸盐在催化剂的回收利用方面,也表现出一定的优势,即使重复回收利用4次之后,其催化活性仍没有明显的变化。而且回收方法非常简便,在反应结束后,用水萃取再减压蒸馏即得回收的催化剂,收率达到95%以上。
3.2 不同溶剂对反应的影响以β-萘酚、苯甲醛和苯甲酰胺为底物,以三氟甲磺酸铵盐为催化剂,考察不同溶剂在60℃及回流温度下对产物4a的合成收率的影响,结果见表 2。
|
|
表 2 不同溶剂对反应的影响 Table 2 Effects of different solvents on reactiona |
由表 2看出,一些常用溶剂如乙酸乙酯、四氢呋喃、2-甲基四氢呋喃、乙醇、甲苯等,无论是在60℃条件下还是回流条件下,都不能很好的得到目标产物。当用乙腈作为反应溶剂时,尽管推测可能会生成相应的烷基取代的1-氨甲基-2-萘酚副产物,而减少苯基取代的1-氨甲基-2-萘酚的收率。但是,在实验过程中并没有跟踪检测到烷基取代的1-氨甲基-2-萘酚化合物。从环保的角度考虑,曾尝试用水作为反应溶剂或者反应在无溶剂的条件下进行,但是无论是回流状态还是反应物的熔融状态下,结果都不尽人意。当使用氯代溶剂时,其反应收率得到了很大的提高。综合考虑以上反应结果以及对环境的可控性,最终选择了CH2Cl2作为反应的溶剂。
3.3 不同底物对反应的影响在得到了较优的反应条件之后,考查反应底物的变化对于合成1-氨甲基-2-萘酚化合物的影响。在较优的反应条件下,简便地合成了一系列的1-氨甲基-2-萘酚类化合物。结果列于表 3。
|
|
表 3 三氟甲磺酸脯氨酸盐催化合成各种1-氨基2-萘酚类化合物 Table 3 Synthesis of 1-amidomethyl-2-naphthols catalyzed by proline triflatea |
由表 3看出,当以各种取代芳醛和酰胺作为反应底物时,都能获得良好收率的1-氨甲基2-萘酚类化合物。芳香醛的取代基对反应结果有一定的影响,含有吸电子基团的芳香醛,无论是与芳基酰胺反应,还是与脂肪酰胺反应,反应都需要较长时间,收率也略低。而含有给电子基团的芳香醛,则能顺利促进该反应的进行,反应产率明显提高。当选用杂环芳香醛参与反应时,反应时间要比芳香醛长,收率也相对较低,但都能够得到较满意的结果。另一方面,脂肪醛在该催化条件下也能得到对应的1-氨甲基2-萘酚化合物。实验显示,与以往的研究相比,该反应条件有良好的适用性,所选用的脂肪醛都能得到中等收率的目标产物。
3.4 其他底物对反应的影响为了更进一步的了解在三氟甲磺酸脯氨酸催化体系下,考察了其它一些底物对该反应的影响(图 2)。当选用α-萘酚作为反应底物时,只得到了α-萘酚β-位的氨甲基萘酚5a,而未得到其他的产物。用α-萘酚作为反应底物时,其反应时间要比相应的β-萘酚反应时间长(10 h),收率也较低(46%)。可能的原因是,α-萘酚的β-位电子云密度较低,不易于与亲核试剂发生反应。当选用对氯苯胺作为反应底物时,可获得相应的产物6a,收率78%。
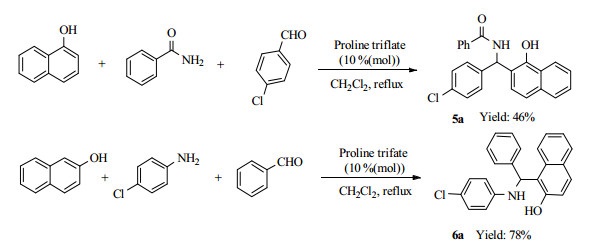
|
图 2 合成其他氨基萘酚化合物 Fig.2 Synthesis of other amidonaphthols |
参考文献[22, 23],结合反应过程中观察到的实验现象和得到的实验结果,提出了如下可能的反应机理(图 3)。三氟甲磺酸脯氨酸先与醛2形成亚胺8,β-萘酚1在三氟甲磺酸的诱导下与亚胺形成邻亚甲基苯醌(o-QMs)中间体,同时催化剂得到循环利用。邻亚甲基苯醌再与酰胺发生亲核加成反应生成目标产物1-氨甲基2-萘酚类化合物。
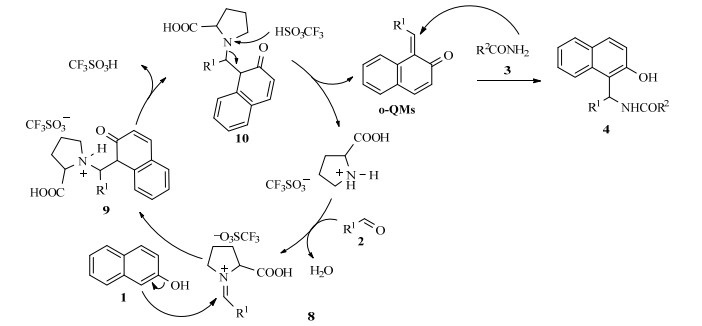
|
图 3 反应机理 Fig.3 Scheme of possible reaction mechanism |
以β-萘酚、醛和胺为起始原料,在有机小分子三氟甲磺酸脯氨酸盐的催化下,一锅法合成了系列1-氨甲基-2-萘酚类化合物,并对不同有机小分子催化剂以及不同溶剂对该反应的影响进行了系统的考察,确定了适宜的反应条件为:n(β-萘酚):n(醛):n(胺):n(三氟甲磺酸脯氨酸盐) = 1:1:1.1:0.1,于二氯甲烷溶剂中回流反应。该方法对不同的醛、α-萘酚和芳胺也具有适用性,并合成了目标产物。
| [1] | Shen A Y, Tsai C T, Chen C L. Synthesis and cardiovascular evaluation of N-substituted 1-aminomethyl-2-naphthols[J]. European Journal of Medicinal Chemistry , 1999, 34(10): 877-882. DOI:10.1016/S0223-5234(99)00204-4. |
| [2] | Shen A Y, Chen C L, Lin C I. Electrophysiological basis for the bradycardic effects of 1-(1-pyrrolidinylmethyl)-2-naphthol in rodents[J]. Chinese Journal of Physiology , 1992, 35(1): 45-54. |
| [3] | Zamani L, Zomorodian K, Mirjalili B B F, et al. One pot preparations 1-amidoalkyl-2-naphthols derivative catalyzed by nano-TiCl4.SiO2 with antimicrobial studies of some products[J]. Journal of Pharmaceutical and Scientific Innovation , 2014, 3(3): 208-216. DOI:10.7897/2277-4572. |
| [4] | Selvam N P, Perumal P T. A new synthesis of acetamido phenols promoted by Ce(SO4)2[J]. Tetrahedron Letters , 2006, 47(42): 7481-7483. DOI:10.1016/j.tetlet.2006.08.038. |
| [5] | Shaterian H R, Yarahmadi H, Ghashang M. An efficient, simple and expedition synthesis of 1-amidoalkyl-2-naphthols as 'drug like' molecules for biological screening[J]. Bioorganic & Medicinal Chemistry Letters , 2008, 18(2): 788-792. |
| [6] | Shaterian H R, Yarahmadi H, Ghashang M. Silica supported perchloric acid (HClO4.SiO2):an efficient and recyclable heterogeneous catalyst for the one-pot synthesis of amidoalkyl naphthols[J]. Tetrahedron , 2008, 64(7): 1263-1269. DOI:10.1016/j.tet.2007.11.070. |
| [7] | Shaterian H R, Yarahmadi H. A modified reaction for the preparation of amidoalkyl naphthols[J]. Tetrahedron Letters , 2008, 49(8): 1297-1300. DOI:10.1016/j.tetlet.2007.12.093. |
| [8] | Saidi M R, Azizi N. Highly diastereoselective aminoalkylation of naphthols with chiral amines mediated by lithium perchlorate solution in diethyl ether[J]. Tetrahedron:Asymmetry , 2003, 14(3): 389-392. DOI:10.1016/S0957-4166(02)00863-7. |
| [9] | Sharifi A, Mirzaei M, Naimi-Jamal M R. Solvent-free aminoalkylation of phenols and indoles assisted by Microwave irradiation[J]. Monashefte für Chemie , 2001, 132(7): 875-880. DOI:10.1007/s007060170077. |
| [10] | Jha A, Paul N K, Trikha S, . Novel synthesis of 2-naphthol Mannich bases and their NMR behaviour[J]. Canadian Journal of Chemistry , 2006, 84(6): 843-853. DOI:10.1139/v06-081. |
| [11] | Khodaei M M, Khosropour A R, Moghanian H. A simple and efficient procedure for the synthesis of amidoalkyl naphthols by p-TSA in solution or under solvent-free conditions[J]. Synlett , 2006, 17(6): 916-920. |
| [12] | Salama T A. Silicon-induced general, mild, and efficient one-pot, three-component synthesis of amidoalkyl naphthol libraries[J]. Synlett , 2013, 24(6): 713-718. DOI:10.1055/s-00000083. |
| [13] | Wang M, Liang Y, Zhang T T, et al. Three-component synthesis of amidoalkyl naphthols catalyzed by bismuth(Ⅲ) nitrate pentahydrate[J]. Chinese Chemical Letters , 2012, 23(1): 65-68. DOI:10.1016/j.cclet.2011.10.008. |
| [14] | Su W K, Tang W Y, Li J J. Strontium(Ⅱ) triflate catalysed condensation of β-naphthol, aldehyde and urea or amides:a facile synthesis of amidoalkyl naphthols[J]. Journal of Chemical Research , 2008, 32(3): 123-128. |
| [15] | Kumar A, Rao M S, Ahmad I, et al. A simple and facile synthesis of amidoalkyl naphthols catalyzed by Yb(OTf)3 in ionic liquids[J]. Canadian Journal Chemistry , 2009, 87(6): 714-719. DOI:10.1139/V09-049. |
| [16] | Taghrir H, Ghashang M, Biregan M N. Preparation of 1-amidoalkyl-2-naphthol derivatives using barium phosphate nano-powders[J]. Chinese Chemical Letters , 2016, 27(1): 119-126. DOI:10.1016/j.cclet.2015.08.011. |
| [17] | Das V K, Borah M, Thakur A J. Piper-betle-shaped nano-S-catalyzed synthesis of 1-amidoalkyl-2-naphthols under solvent-free reaction condition:a greener "Nanoparticle-catalyzed organic synthesis enhancement" approach[J]. The Journal of Organic Chemistry , 2013, 78(7): 3361-3366. DOI:10.1021/jo302682k. |
| [18] | Mulla S A R, Salama T A, Pathan M Y, et al. Solvent-free, highly efficient one-pot multicomponent synthesis of 1-amido-and 1-carbamato-alkyl naphthols/phenols catalyzed by ethylammonium nitrate as reusable ionic liquid under neat reaction condition at ambient temperature[J]. Tetrahedron Letters , 2013, 54(7): 672-675. DOI:10.1016/j.tetlet.2012.12.004. |
| [19] | Alinezhad H, Tajbakhsh M, Norouzi M. Characterization, consideration and catalytic application of novel pyrazine-1, 4-diium trifluoromethanesulfonate {[1, 4-DHPyrazine](OTf)2} as a green and recyclable ionic liquid catalyst in the synthesis of amidoalkyl naphthol derivatives[J]. Journal of Heterocyclic Chemistry , 2017, 54(1): 278-288. DOI:10.1002/jhet.v54.1. |
| [20] | Funatomi T, Wakasugi K, Misaki T, et al. Pentafluorophenylammonium triflate (PFPAT):an efficient, practical, and cost-effective catalyst for esterification, thioesterification, transesterification, and macrolactone formation[J]. Green Chemistry , 2006, 8(12): 1022-1027. DOI:10.1039/b609181b. |
| [21] | Sakakura A, Nakagawa S, Ishihara K. Bulky diarylammonium arenesulfonates as mild and extremely active dehydrative ester condensation catalysts[J]. Tetrahedron , 2006, 62(2-3): 422-433. DOI:10.1016/j.tet.2005.09.059. |
| [22] | Seebach D, Groselj U, Badine D M, et al. Isolation and X-ray structures of reactive intermediates of organocatalysis with diphenylprolinol ethers and with imidazolidinones. A survey and comparison with computed structures and with 1-acyl-imidazolidinones:the 1, 5-repulsion and the geminal-diaryl effect at work[J]. Helvetica Chimica Acta , 2008, 91(11): 1999-2034. DOI:10.1002/hlca.v91:11. |
| [23] | Groselj U, Schweizer W B, Ebert M O, et al. 5-Benzyl-3-methylimidazolidin-4-one-derived reactive intermediates of organocatalysis-a comforting resemblance of X-ray, NMR, and DFT solid-phase, liquid-phase, and gas-phase structures[J]. Helvetica Chimica Acta , 2009, 92(1): 1-13. DOI:10.1002/hlca.v92:1. |




