2. 广西碳酸钙产业化工程院,广西 南宁 530004
2. Guangxi Engineering Academy of Calcium Carbonate Industrialization, Nanning 530004, China
碳酸钙是一种无毒、环保和生物相容性好的无机化工原料,其具有多种形貌,常见的有菱形、纺锤形、球形、片状、针状等[1-2]。球形碳酸钙因具有良好的分散性、平滑性和耐磨性等优异性能而被广泛应用于油墨、纸张、药物和催化等领域,已受到国内外研究者的广泛关注[3]。
目前,能制备出球形度较高的球形碳酸钙主要是通过复分解法[4],但是该方法存在工艺条件复杂、成本较高及制备出来的碳酸钙粒径较大等缺陷,因而不易于工业化生产。而利用碳化法制备球形碳酸钙还比较罕见,利用超重力反应结晶法制备球形碳酸钙尚未见报道。由于球形碳酸钙在多数情况下是由球霰石生长而成的,但球霰石属于热力学最不稳定的晶型[5],因此必须在体系中加入晶型控制剂才能生成球形碳酸钙。SEO等[6]研究在乙醇溶剂的条件下对碳酸钙制备的影响,发现在体积含量为60%以上的乙醇溶液中,更有利于文石和球霰石晶型的形式沉淀。LUO等[7]采用Ca(OH)2悬浮液鼓泡碳化法,以L-天冬氨酸(L-aspartic acid, Asp)作为晶型诱导剂,合成介孔结构的球霰石碳酸钙微球,但该方法存在晶型控制剂用量多、球形度低和粒径大等缺陷。郑天文等[8]以碳酸钠(Na2CO3)和氯化钙(CaCl2)为原料,采用聚丙烯酸(polyacrylic acid, PAA)和十二烷基苯磺酸钠(sodium dodencylbenzenesulphonate, SDBS)为有机添加剂,合成出粒径为5~8 μm的碳酸钙微球,该方法存在原料昂贵、产品粒径较大等不足,不利于工业化生产。
为了突破工业上制备球形碳酸钙的难题,本文采用超重力反应结晶法[9],以高浓度的氢氧化钙作为原料,乙醇-水作为溶剂,L-天冬氨酸作为晶型控制剂制备出球形度高、分散性好和粒径分布窄的球形碳酸钙。将碳酸钙浆液离心后得到产品和滤液,其中滤液再次作为氢氧化钙的溶剂,使体系的溶剂得到了循环利用。同时通过在不同的碳化时间进行取样,采用SEM、XRD和FT-IR等仪器对产品表面形貌和晶体结构进行表征分析,探讨了在超重力场中碳酸钙成球的机理。研究所得结果对球形碳酸钙的制备和工业化生产具有一定的指导意义。
2 实验部分 2.1 实验试剂与分析仪器生石灰(CaO),工业级,广西华纳新材料科技股份有限;CO2,99.5%,钢瓶气体,广西诚信气体研究有限公司;无水乙醇(CH3CH2OH), 分析纯,成都市科隆化学品有限公司;L-天冬氨酸(C4H7NO4),分析纯,国药集团化学试剂有限公司;扫描电子显微镜(SEM),S-3400N,日本Hitachi公司;静态颗粒图像分析仪,MORPHO1OGIG3S型,马尔文仪器有限公司;X-射线双晶粉末衍射仪(XRD),Smartlab-9 kw,日本理学公司;傅里叶变换红外光谱仪(FT-IR),Nicolet iS50,美国Thermo Fisher公司。
2.2 实验装置与方法超重力反应器购置于北京化工大学教育部超重力工程研究中心,其核心部件为旋转填充反应器,基本结构如图 1所示。
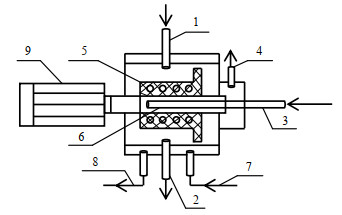
|
图 1 旋转填充床反应器示意图 Fig.1 Schematic diagram of RPB 1.gas inlet 2.liquid outlet 3.liquid inlet 4.gas outlet 5.packing rotor 6.liquid distributor 7.circulating water inlet 8.circulating water outlet 9.motor |
氢氧化钙浆料经电泵由图 1中的3进入到旋转填充床中,在电机高速旋转产生强大的离心力下,浆料将在填料床中被打成液膜由内缘向外缘流动,而二氧化碳靠压力梯度由填料床外缘向内缘扩散,气液两相逆流接触发生碳化反应。在旋转填料床中产生的巨大离心力可以模拟出超重力场的环境,加快了相界面的更新速度,使得微观混合和传质作用得到了极大的强化,缩短了反应时间,有利于工业化生产[10]。
图 2是在超重力场中利用碳化法制备碳酸钙的工艺流程图,在调浓过程中加入乙醇,在碳化前加入晶型控制剂。经过前期实验的探索,以产品球形度为评价指标,得到制备球形碳酸钙的工艺条件为:Ca(OH)2初始浓度为9%,二氧化碳气流量为0.5 m3·h-1,碳化温度为20 ℃。本文在这些条件下,研究乙醇体积分数、L-天冬氨酸添加量和超重力水平对产品质量的影响。
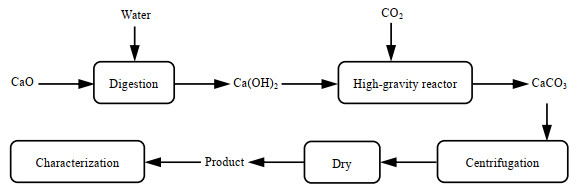
|
图 2 超重力反应结晶法制备碳酸钙的工艺流程图 Fig.2 Flow chart of calcium carbonate preparation by high-gravity reaction crystallization |
表 1和图 3分别为在L-天冬氨酸添加量为w=3%和超重力水平为1 400 r·min-1下,添加不同乙醇体积分数下所制备的碳酸钙样品的球形度和电镜图。由球形度和SEM结果可知,在不加入乙醇的情况下,碳酸钙产品没有生长为球形,而是形成由纳米碳酸钙聚集成无固定形貌的大颗粒碳酸钙产品,且大颗粒比较稀松。这可能是由于不添加乙醇,在反应过程中不稳定的球霰石在母液中转化为热力学稳定的方解石,从而不能生长成为球形碳酸钙。这是已经发生了溶解-重结晶过程,遵循Ostwald熟化规则[11]。随着乙醇的含量不断增加,碳酸钙产品也初具形貌,由椭球形慢慢转变为球形碳酸钙,球形度逐渐提升。当加入乙醇体积分数为50%及以上时,得到了球形碳酸钙产品,乙醇体积分数为50%时其球形度为0.912。
|
|
表 1 不同乙醇体积分数下碳酸钙样品的球形度 Table 1 Spherical degrees of calcium carbonate samples with different ethanol volume fractions |

|
图 3 不同乙醇体积分数下所制备的碳酸钙的SEM图 Fig.3 SEM micrographs of calcium carbonate prepared under different ethanol volume fractions |
表 2和图 4分别为在乙醇体积分数为50%和超重力水平为1 400 r·min-1下,添加不同质量分数的L-天冬氨酸下所制备的碳酸钙样品的球形度和电镜图。由球形度和SEM结果可知,在没有L-天冬氨酸下,生成了棒状碳酸钙,长径比约为2,说明不添加晶型控制剂而直接在超重力反应器中进行碳化是不能生成球形碳酸钙的。当添加了L-天冬氨酸后,产品的形貌发生了改变,当添加量较低时(w=1%),生成了椭球形碳酸钙,球形度为0.734。随着添加量的增加,碳酸钙的形貌由椭球形转变为类球形,当添加量达到w=3%时生成了球形度为0.917的球形碳酸钙。说明了晶型控制剂参与了碳酸钙的生长调控[12]。
|
|
表 2 不同L-天冬氨酸添加量下碳酸钙样品的球形度 Table 2 Spherical degrees of calcium carbonate samples with different L-aspartic acid additions |

|
图 4 不同L-天冬氨酸添加量下所制备的碳酸钙的SEM图 Fig.4 SEM micrographs of calcium carbonate prepared under different L-aspartic acid additions |
表 3和图 5分别为在乙醇体积分数为50%和L-天冬氨酸添加量为w=3%下,不同超重力水平下所制备碳酸钙样品的球形度和电镜图。由球形度和SEM结果可知,在普通重力场中,所生成的碳酸钙无法形成完美的球形,这是由于在普通重力场中,高浓度浆料搅拌不充分,使得球霰石包覆在氢氧化钙表面,随着反应的进行,包覆体破碎、溶解后,会破坏碳酸钙的球形度[13]。而在超重力条件下,巨大的离心力将浆料打成液膜,提高表面更新率,强化传质,防止氢氧化钙被过度包覆,因而为生长成为完美的球形碳酸钙提供了一个良好的环境。碳酸钙在普通重力场和超重力场中的生长示意图如图 6所示。但当超重力水平过低时(≤1 200 r·min-1),生成的碳酸钙产品球形度不高,且样品中会存在较大的孔洞,这是由于离心力不够大,还存在少量小颗粒包覆体,随着反应进行,包覆体破碎、溶解后会使样品留下孔洞。而当超重力水平过高时(≥1 600 r·min-1),产品的球形度也会变差,这可能是由于离心力过于强大,容易把球形碳酸钙打坏,不易于聚集成球。当超重力水平为1 400 r·min-1时(超重力因子β= 228.67),可以制备出球形度高和分散性好的球形碳酸钙。
|
|
表 3 不同超重力水平下碳酸钙样品的球形度 Table 3 Spherical degrees of calcium carbonate samples prepared at different levels of high-gravity |

|
图 5 不同超重力水平下所制备的碳酸钙的SEM图 Fig.5 SEM micrographs of calcium carbonate prepared at different levels of high-gravity |
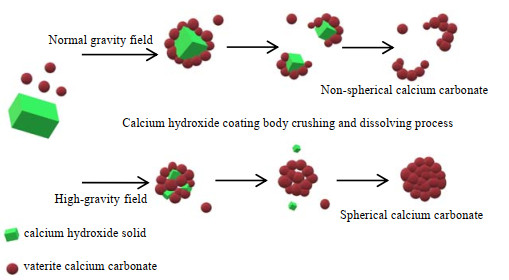
|
图 6 碳酸钙在不同重力场下的生长示意图 Fig.6 Schematic diagram of calcium carbonate growth under different gravity fields |
将碳化后的碳酸钙浆液进行离心得到产品和滤液,滤液再次作为氢氧化钙的溶剂,补加不同质量分数的L-天冬氨酸后,投入超重力反应器中进行碳化反应,得到了如表 4和图 7所示的碳酸钙产品的球形度和电镜图。由球形度和SEM结果可知,不添加晶型控制剂后生成了部分球形碳酸钙,其余的是无固定形貌的碳酸钙。而在补加有晶型控制剂后,球形碳酸钙含量明显增加,补加量为w=1%~2%时可生成球形度高、分散性好、粒径分布窄的球形碳酸钙。这说明了,将体系中的乙醇-水溶剂进行回收和循环使用,同样能制备出高质量的球形碳酸钙,避免了资源的浪费,有了利于工业化生产。
|
|
表 4 补加不同质量分数的晶型控制剂下碳酸钙样品的球形度 Table 4 Spherical degrees of calcium carbonate samples under different mass fractions of crystal-controlling agent |

|
图 7 补加不同质量分数的晶型控制剂的影响 Fig.7 Effects of different mass fractions of crystal-controlling agent on calcium carbonate formation |
根据经典理论中,晶体的形成分为成核和生长两个步骤。即在过饱和的溶液中首先形成晶核,随后构晶离子按一定的点阵结构规则地在晶核上堆砌,不断复制晶胞,晶体逐渐长大[14]。如图 8所示,在碳酸钙结晶过程中,Ca2+离子和CO32-离子首先形成无定形碳酸钙ACC,这是很不稳定的球形颗粒,在极短的时间内,根据反应环境的不同,ACC迅速转化为方解石或球霰石[15]。一方面,方解石生长成为立方体碳酸钙;而另一方面,球霰石生长成为球形碳酸钙,但球霰石属于亚稳态晶型,会进一步发生溶解-重结晶过程,最终转化为热力学稳定的方解石型立方体碳酸钙[16]。
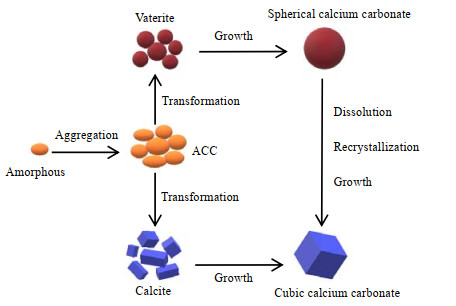
|
图 8 碳酸钙晶型转化的及其生长示意图 Fig.8 Transformation and growth of calcium carbonate crystals |
本文在超重力场中以高浓度的氢氧化钙为原料,通过添加一定体积分数的乙醇作为醇-水混合溶剂,同时添加少量L-天冬氨酸作为晶型控制剂来制备球形碳酸钙。上面讨论了超重力反应器是因为拥有巨大的离心力将浆料打成液膜,提高表面更新率,强化传质,防止氢氧化钙被过度包覆,而为生长成为完美的球形碳酸钙提供了一个良好的环境。这说明合适的超重力场能够为碳酸钙生长提供一个良好的成球环境,但无定形碳酸钙ACC为何向球霰石转变、生长为球形碳酸钙后为何在母液中能够保持稳定存在,这就需要进一步探究。作者通过在不同的时间下进行取样,通过SEM、XRD和FT-IR等分析仪器对样品的表面形貌和晶体结构进行表征,分析碳酸钙成核-生长过程,研究其成球机理。不同的时间下取样分别是在pH值为11、9.5、8和7下,对应的碳化时间为4、5、7和12 min下进行取样。
图 9为在不同碳化时间下样品的红外和XRD谱图分析结果。由左边红外谱图分析结果可知,pH=11时的样品图谱显示在3 643 cm-1出现羟基O─H的伸缩振动吸收峰,以及在2 510 cm-1出现羧基二聚体吸收峰,说明有天冬氨酸钙中间体存在[7]。而随着pH的下降,也就是反应的进行,这两个峰慢慢减弱,到反应结束时(pH=7),3 643和2 510 cm-1的两处峰已经消失,说明随着反应的进行,中间体天冬氨酸钙已经转化为碳酸钙。同时,后面这3个阶段的样品中在1 384和1 350 cm-1出现了CO3的反对称吸收峰,说明生成较多的球霰石型碳酸钙。在874 cm-1处归属于球霰石型碳酸钙振动峰,在714 cm-1处归属于方解石型碳酸钙振动峰,由4个样品红外结果可知,所生成的碳酸钙都含有球霰石,且随着反应的进行,球霰石含量不断增加,说明了L-天冬氨酸提供了球霰石的成核位点,从而让球霰石生长为球形碳酸钙。而由图 4的SEM结果也说明了没有添加L-天冬氨酸作为晶型控制剂是不能制备出球形碳酸钙的。
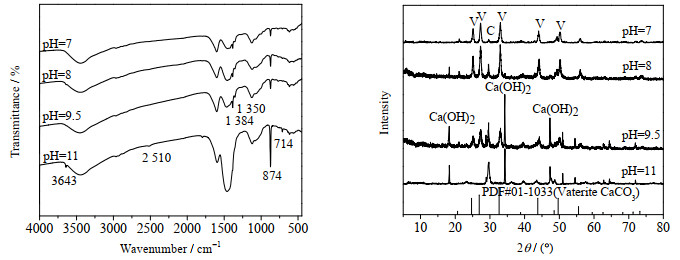
|
图 9 不同碳化时间下样品的红外和XRD谱图 Fig.9 Infrared and XRD spectra of samples at different reaction times |
由图 9右边XRD谱图分析结果可知,在pH为11、9.5和8时还存在氢氧化钙衍射峰,说明反应尚未结束,当pH为8时氢氧化钙衍射峰很弱,说明反应接近结束,pH为7时此峰消失,说明反应结束。pH为11时,反应刚刚开始,此时存在方解石衍射峰,而球霰石衍射峰十分微弱,说明此时二氧化碳直接与氢氧化钙反应生成了少量的方解石型碳酸钙,而中间体L-天冬氨酸钙只有少部分碳化转变为球霰石型碳酸钙。由XRD结果可知,随着反应的进行,球霰石衍射峰逐渐增强,说明了样品中的球霰石型碳酸钙含量在不断增加。而方解石衍射峰会减弱,这是因为随着反应的进行,产品球霰石型碳酸钙含量增多,而方解石型碳酸钙一直没变,但所占的比重减小了。同时,这说明了所生成的球霰石并没有发生溶解-重结晶过程,这主要是因为乙醇溶液的存在。而由图 3的SEM结果也说明了没有乙醇的存在,不稳定的球霰石会在母液中转化为热力学稳定的方解石。据研究表明,在乙醇-水混合溶液中,离子(主要是CO32-)溶解性更差,活度更小(尤其是CO32-以隔室化形式存在),使得溶解-重结晶受阻,因此球霞石转变速率减慢,使其稳定存在于母液中[17-18]。其中产品中球霰石相含量是根据式(1)和(2)计算[19]得出:
| $ I_{104(\mathrm{C})} / I_{110(\mathrm{V})}=7.691\left(X_{\mathrm{C}} / X_{\mathrm{V}}\right) $ | (1) |
| $ {X_{\rm V}} = 1 - {X_{\rm C}} $ | (2) |
式中XC、XV分别为方解石相碳酸钙和球霰石相碳酸钙的含量。I104(C)代表方解石104面的峰强度,I110(V)代表球霰石110面的峰强度。计算得反应结束后的碳酸钙产品的球霰石相含量高达89.89%。
图 10为不同碳化时间下样品的SEM图。(a)是尚未进行碳化的氢氧化钙原料,该样品多数为大块状聚集体。(b)~(d)分别是pH值为11、9.5和8时样品的SEM结果,由图 9的XRD和红外谱图分析可知,在pH值为11、9.5和8时分别为碳化反应的前期、中期和后期,样品中同时存在碳酸钙和未反应的氢氧化钙固体。(b)是反应初期的样品,其中有长大的球形颗粒和还未完全长大的小球形颗粒。(c)是反应中期的样品,其球形颗粒含量增多。(d)是反应后期的样品,其生长成了较多的球形颗粒,且球形颗粒的粒径分布较窄,说明了此时的反应准备结束,这些球形颗粒是碳化生成的碳酸钙产品。(e)是pH为7时的样品,此时碳化反应结束,生成了球形度高、分散性好、粒径分布在600~800 nm的球形碳酸钙。(f)是碳酸钙产品在100 k倍下的电镜图,其球形度高,粒径约为600 nm,是由小颗粒聚集成长而形成的球形碳酸钙。

|
图 10 不同碳化时间下样品的SEM图 Fig.10 SEM micrographs of samples at different reaction times |
综上讨论结果可得碳酸钙成球机理为:根据分步结晶的基础上[20],从晶面上出发,利用天冬氨酸螯合钙离子诱导其向球霰石成核,再从乙醇-水体系的微观异质性和离子的溶剂化角度出发,使得溶解-重结晶受阻,从而让生成的球霰石稳定存在于母液中,最后在超重力环境下成长为球霰石型球形碳酸钙。其成球模型如图 11所示。
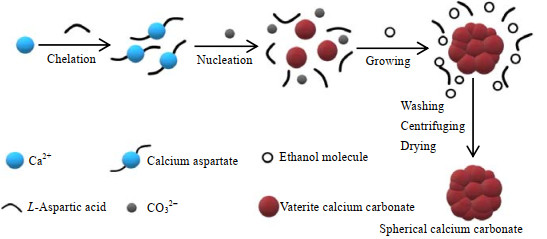
|
图 11 碳酸钙成球的机理示意图 Fig.11 Schematic diagram of spherical calcium carbonate forming mechanism |
碳酸钙在超重力场中的成球机理为:L-天冬氨酸首先螯合钙离子,生成中间体天冬氨酸钙,通入二氧化碳后经过碳化生成球霰石碳酸钙,并在乙醇-水的体系中保持稳定存在,然后在超重力场中生长成为球形碳酸钙,最后经过离心、洗涤和干燥后得到球形碳酸钙产品。
4 结论以高浓度(9%)的氢氧化钙为原料,在超重力场中制备出球形碳酸钙,并对其成球机理进行了研究,得到以下结论:
(1) 当乙醇体积分数为50%、L-天冬氨酸添加量为w = 3%和超重力水平为1 400 r·min-1时可制备得球形度为0.937、粒径分布在600~800 nm的球形碳酸钙,其球霰石含量高达89.89%。
(2) 将碳化后的浆液进行离心得到产品和滤液,滤液再次作为氢氧化钙的溶剂,补加晶型控制剂的量为w=1%~2%时可制备得球形度高、分散性好、粒径分布窄的球形碳酸钙。
(3) 研究发现,碳酸钙成球机理为:L-天冬氨酸螯合钙离子,生成中间体天冬氨酸钙诱导球霰石成核,乙醇-水体系阻止球霰石溶解-重结晶,最后在超重力环境下生成球霰石型球形碳酸钙。
| [1] |
BOYJOO Y, PAREEK V K, LIU J. Synthesis of micro and nano-sized calcium carbonate particles and their applications[J]. Journal of Materials Chemistry A, 2014, 2(35): 14270-14288. DOI:10.1039/C4TA02070G |
| [2] |
朱万诚, 王玉红, 陈建峰. 超重力反应结晶法合成微细针状碳酸钙研究[J]. 高校化学工程学报, 2002, 16(5): 560-564. ZHU W C, WANG Y H, CHEN J F. Synthesis of ultra-fine needle-like calcium carbonate particles by high-gravity reactive precipitation[J]. Journal of Chemical Engineering of Chinese Universities, 2002, 16(5): 560-564. DOI:10.3321/j.issn:1003-9015.2002.05.016 |
| [3] |
ABEBE M, HEDIN N, ZOLTAN B. Spherical and porous particles of calcium carbonate synthesized with food friendly polymer additives[J]. Crystal Growth & Design, 2015, 179(13): 4096-4105. |
| [4] |
张晓蕾, 邱勇波. 球霰石碳酸钙的制备及其稳定性研究[J]. 无机盐工业, 2018, 52(2): 46-49. ZHANG X L, QIU Y B. Study on synthesis and stability of vaterite calcium carbonate[J]. Inorganic Salt Industry, 2018, 52(2): 46-49. |
| [5] |
LIU R, LIU F, SU Y, et al. Catanionic surfactant-assisted mineralization and structural properties of single-crystal-like vaterite hexagonal bifrustums[J]. Langmuir, 2015, 31(8): 2502-2510. DOI:10.1021/la503726y |
| [6] |
SEO K S, HAN C, WEE J H, et al. Synthesis of calcium carbonate in a pure ethanol and aqueous ethanol solution as the solvent[J]. Journal of Crystal Growth, 2005, 276(3/4): 680-687. |
| [7] |
LUO J, KONG F, MA X. Role of aspartic acid in the synthesis of spherical vaterite by the Ca(OH)2-CO2 reaction[J]. Crystal Growth & Design, 2016, 16(2): 728-736. |
| [8] |
郑天文, 陈雪梅. 球霰石碳酸钙微球的合成及其机理[J]. 材料科学与工程学报, 2018, 36(3): 358-364. ZHENG T W, CHEN X M. Synthesis of vaterite calcium carbonate microspheres and the crystal growth mechanism[J]. Journal of Materials Science and Engineering, 2018, 36(3): 358-364. |
| [9] |
KANG F, WANG D, PU Y, et al. Efficient preparation of monodisperse CaCO3 nanoparticles as overbased nanodetergents in a high-gravity rotating packed bed reactor[J]. Powder Technology, 2018, 32: 405-411. |
| [10] |
贺鑫, 尹大伟, 赵祯霞, 等. 超重力场中影响碳酸钙晶须断裂的影响因素分析[J]. 高校化学工程学报, 2016, 30(6): 1359-1365. HE X, YIN D W, ZHAO Z X, et al. Analysis of CaCO3 whisker fracture under high-gravity environment[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(6): 1359-1365. DOI:10.3969/j.issn.1003-9015.2016.06.018 |
| [11] |
THRELFALL, TERRY. Structural and thermodynamic explanations of Ostwald\' s rule[J]. Organic Process Research & Development, 2003, 7(6): 1017-1027. |
| [12] |
王明, 丁杨, 闫红旭, 等. 碳化法形貌可控制备碳酸钙的研究[J]. 无机盐工业, 2018, 50(12): 33-36. WANG M, DING Y, YAN H X, et al. Study on morphology-controllable synthesis of calcium carbonate in carbonization process[J]. Inorganic Chemicals Industry, 2018, 50(12): 33-36. |
| [13] |
罗佳, 孔凡滔, 马新胜. 仿生碳化中天冬氨酸对碳酸钙晶型和形貌的影响[J]. 无机盐工业, 2017, 49(3): 26-30. LUO J, KONG F T, MA X S. Effects of aspartic acid on polymorph and morphology of calcium carbonate in biomimetic carbonation[J]. Inorganic Chemicals Industry, 2017, 49(3): 26-30. |
| [14] |
VEKILO V, PETER G. The two-step mechanism of nucleation of crystals in solution[J]. Nanoscale, 2010, 2(11): 2346-2357. DOI:10.1039/c0nr00628a |
| [15] |
LU H, LUTZ H, ROETERS S J, et al. Calcium-induced molecular rearrangement of peptide folds enables biomineralization of vaterite calcium carbonate[J]. Journal of the American Chemical Society, 2018, 140(8): 2793-2796. DOI:10.1021/jacs.8b00281 |
| [16] |
LU H, HOOD M A, MAURI S, et al. Biomimetic vaterite formation at surfaces structurally templated by oligo (glutamic acid) peptides[J]. Chemical Communications (Cambridge, England), 2015, 51(88): 15902-15905. DOI:10.1039/C5CC05830A |
| [17] |
潘晓芳, 王海水. 乙醇/水混合溶剂体系中碳酸钙晶体晶型和取向的控制[J]. 无机化学学报, 2014, 30(6): 1312-1316. PAN X F, WANG H S. Control of crystalline polymorphs and orientations for calcium carbonate in mixed solvents of ethanol and water[J]. Chinese Journal of Inorganic Chemistry, 2014, 30(6): 1312-1316. |
| [18] |
Zhang Z, Yang B, Tang H, et al. High-yield synthesis of vaterite CaCO3 microspheres in ethanol/water:Structural characterization and formation mechanisms[J]. Journal of Materials Science, 2015, 50(16): 5540-5548. DOI:10.1007/s10853-015-9101-2 |
| [19] |
KONTOYANNIS C G, VAGENAS N V. Calcium carbonate phase analysis using XRD and FT-Raman spectroscopy[J]. Analyst, 2000, 125(2): 251-255. DOI:10.1039/a908609i |
| [20] |
BOST P, BENNING, LIANE G, et al. Mechanistic insights into the crystallization of amorphous calcium carbonate (ACC)[J]. Crystal Growth & Design, 2012, 12(7): 3806-3814. |




