2. 东莞深圳清华大学研究院创新中心,广东 东莞 523808
2. Tsinghua innovation center in Dongguan, Dongguan 523808, China
近年来,生物柴油作为一种可替代石化柴油的清洁能源,其发展受到人们的重视。生物柴油主要是指由动植物油脂与短链醇经过转酯化或酯化反应得到的脂肪酸酯类物质。目前来说,生物柴油的原料成本较高,占到生物柴油生产总成本的70%~85%[1, 2],成为生物柴油难以商业化的主要障碍之一。以非精制油脂为原料可以降低生物柴油的生产成本,然而,这些非精制油脂中往往含有一定量的磷脂。研究表明,磷脂对生物柴油的制备过程会产生多方面复杂的影响,使得以非精制油脂为原料制备生物柴油面临困境。目前来说,非精制油脂通常都需要先进行预处理去除磷脂,然后才能用于制备生物柴油。研究磷脂对于生物柴油制备过程的影响及其机理,有利于促进含磷脂油脂在生物柴油制备过程的应用。本文首先介绍了天然动植物或微生物油脂中的磷脂种类、结构及其特性;随后根据磷脂的理化性质,总结了磷脂对生物柴油制备过程主要的影响机理;最后分别总结了磷脂对化学法和生物酶法制备生物柴油的影响。
2 油脂中的磷脂磷脂 (Phospholipids) 是一种含有磷酸基团的复合脂类物质,是组成生物膜的主要成分,广泛存在于动植物和微生物的细胞中。
来源于动植物或微生物细胞的油脂往往会带有一定量的磷脂,因为各类油料的品种、产地和制油工艺的不同,油脂中磷脂的含量也表现出很大差异。表 1列出了一些不同来源的油脂中磷脂含量的区别[3]。从表 1中可以看出,动物油脂中磷脂含量较低,而植物和微生物油脂中磷脂含量较高。植物油脂中的磷脂含量一般在2%左右,在植物油精炼的过程中,油脚中磷脂的含量更高,比如大豆油脚中磷脂的含量为20%~30%[4]。在微生物油脂中,磷脂的含量一般可达10%以上[5]。
| 表 1 不同来源油脂中磷脂的含量[3] Table 1 Contents of phospholipids in the oils from different resources |
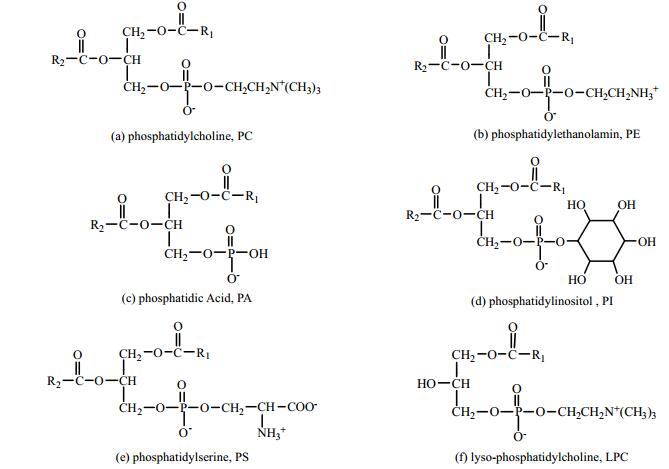
根据磷脂骨架结构的不同,可以将磷脂分为甘油磷脂和鞘磷脂两大类,来源于植物和微生物的油脂,一般为甘油磷脂。甘油磷脂以甘油为骨架,根据其侧链的不同,又可分为六种形式,分别为分别为磷脂酰胆碱 (Phosphatidylcholine, PC)、磷脂酰乙醇胺 (Phosphatidylethanolamin, PE)、磷脂酸 (Phosphatidic Acid, PA)、磷脂酰肌醇 (Phosphatidylinositol, PI)、磷脂酰丝氨酸 (Phosphatidylserine, PS) 和溶血性磷脂酰胆碱 (Lyso-phosphatidylcholine, LPC),其结构如图 1所示。可以看出,磷脂的结构和甘油三酯的结构非常类似,将甘油三酯的一个长链脂肪酸替换成磷酸基团即为磷脂。在磷脂分子的结构中,另外两条脂肪酸链R1和R2的碳原子数一般为14~20,通常R1为饱和脂肪酸,R2为不饱和脂肪酸。
|
图 1 甘油磷脂的六种形式 Fig.1 Six different structures of glycerophospholipid (R1 and R2 represent fatty acid chains which normally contain 14~20 carbons) |
油脂中的磷脂通常是含有多种磷脂组分的混合物,在不同来源的油脂中,不同磷脂组分的含量也不同。一般来说,含量最高的磷脂组分为PC,其次为PE和PI。例如在大豆磷脂中,PC、PI、PE、PA、LPC和PS的含量分别为38.2%、17.6%、17.3%、8.4%、1.5%和0.5%[6];在来源于玉米油的磷脂中,PC、PE和PI的含量分别为26.3%、17.7%和9.3%[3]。
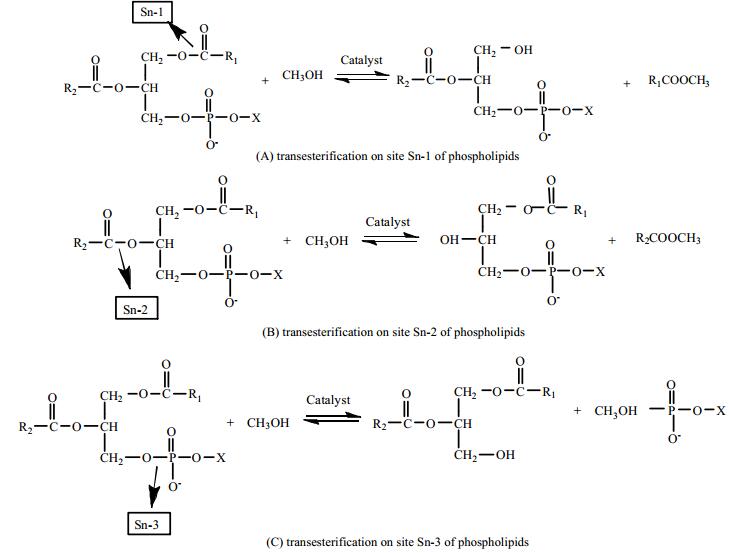
3 磷脂的性质及其对生物柴油品质的影响 3.1 磷脂的降解性质磷脂的结构和甘油三酯的结构非常类似,只是将甘油三酯的一个长链脂肪酸替换成磷酸基团。因此,有些脂肪酶也有磷脂酶的功能,可以催化磷脂和醇类发生转酯化反应[7, 8]。磷脂分子有三个酯键,分别为Sn-1、Sn-2、Sn-3,这三个酯键都有可能和甲醇发生反应,酯键的断裂位置将决定磷的去向 (图 2)。
|
图 2 磷脂的降解 Fig.2 Possible degradation routes of phoshpolipids |
若Sn-1和Sn-2分别和甲醇发生转酯化反应,将会生成脂肪酸甲酯 (生物柴油) 和对应的溶血磷脂;若Sn-1和Sn-2同时和甲醇发生转酯化反应,则会生成生物柴油和甘油磷脂;若Sn-3和甲醇发生转酯化反应,则会生成甘油二酯和磷酸酯。磷脂、溶血磷脂、甘油磷脂和磷酸酯的亲疏水性各不相同,其中,磷脂、溶血磷脂因含有非极性的脂肪酸侧链,因此可能混合在生物柴油中使其磷含量超标,而甘油磷脂和磷酸酯的水溶性较强,可以溶解在水相中被除去[7]。因此,以含有高浓度磷脂的油脂为原料制备生物柴油是可行的,但需要确保最终生物柴油产品中的磷含量符合标准。
3.2 磷脂的表面活性剂性质磷脂分子含有亲水的极性头和疏水的非极性头,是一种典型的表面活性剂。表面活性剂对整个反应体系具有多重的影响,一般来说,低浓度的表面活性剂可以促进整个体系的传质,但高浓度的表面活性剂对于脂肪酶催化的酰基化反应往往具有抑制作用。Wantanabe等[9]认为磷脂的抑制作用主要和磷脂覆盖在催化剂表面阻碍了催化剂和底物的结合有关,Amoah等[10]则认为磷脂影响了油水界面的形成从而对反应造成不利影响。
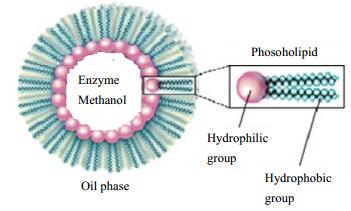
在非水溶剂中,若表面活性剂的浓度超过了临界胶束浓度,则会在非水溶液中形成非极性疏水尾朝外、极性亲水头朝内的反胶束。文献报道,当植物毛油中的磷脂含量超过其临界胶束浓度时,磷脂分子会在溶剂中形成反胶束[11, 12],反胶束的中间会形成极性的“水池”,其结构如图 3所示。在酶法制备生物柴油的体系中,酶、甲醇、水等极性物质会溶于极性“水池”中。Li等[13]研究表明,反胶束“水池”中酶分子周围的局部甲醇浓度对于脂肪酶的活性具有重要影响。
磷脂作为一种表面活性剂,同时具有亲水和亲油的性质,可以使得油相和水相互溶而难以分离,因此会对后续生物柴油和副产物甘油的分离造成影响,从而降低最终生物柴油得率。Jang等[14]以含有 (100~300) ppm磷脂的粗芥花油为原料制备生物柴油,研究发现,当油脂原料没有进行脱胶除去磷脂时,反应结束后生物柴油和副产物甘油在磷脂的乳化作用下难以分离;而以除去磷脂的油脂作为原料制备生物柴油,产物和副产物能够较好分层,如图 4所示。
3.3 磷脂对生物柴油品质的影响在生物柴油制备过程中,若油脂原料中含有磷脂,则很有可能会导致生物柴油产品中出现磷脂的残留。文献报道,油品中磷元素过高会影响汽车尾气排放系统中的催化转换器[15]。磷在高温下会形成氧化物颗粒,吸附在催化剂表面,使催化剂无法与废弃接触,造成催化剂“中毒”的现象。另一方面,磷元素的存在会增加生物柴油汽车尾气中的颗粒物和生物柴油中的硫酸盐灰分,而硫酸盐灰分对汽车引擎中积炭的形成有很大的关系[16]。
因此,在欧盟生物柴油标准 (EN14214:2012) 和美国生物柴油标准 (ASTM D6751-12) 中,对生物柴油中的磷含量都作出了严格的规定,其最大磷含量分别为4 ppm和10 ppm。
4 磷脂对化学法制备生物柴油的影响Gerpen等[17]研究了原料油脂中的磷脂对碱法催化大豆油甲醇解制备生物柴油的影响,发现在反应过程中大部分的磷都不会进入到最终的生物柴油产品中。当磷的初始含量为 (4~620) ppm时,反应结束时生物柴油中的磷含量仅为 (2~5) ppm。但是当磷的初始含量超过50 ppm时,则会导致最终生物柴油得率降低3%~5%,作者认为这可能主要是因为磷脂具有表面活性剂的作用,使得生物柴油与甘油难以分离而使最终得率下降。
Mendow等[18]研究了化学法制备生物柴油过程中磷元素的流向和分布。研究发现,油脂原料中97%的磷都富集在甘油相中,生物柴油中微量的磷可以在水洗的过程中去除。同时,生物柴油中甲醇的含量对于磷含量有很大的影响。用蒸发的方法使得生物柴油中甲醇的含量从4.6%(wt) 减少到0.35%(wt),发现磷含量随之从7.1 ppm降低到4 ppm,这主要是因为甲醇的存在能够增加磷脂组分在生物柴油中的溶解度,随着甲醇含量的减少,生物柴油中的磷含量也减少。
Freedman等[19]研究了甲醇钠催化花生油、大豆油、红花油等粗油脂和精制油脂制备生物柴油的区别 (表 2),结果显示粗油脂中一般含有较高含量的磷,以粗油脂为原料制备生物柴油的得率均比相应的精制油脂明显降低。例如,大豆油粗油脂中磷含量高达953 ppm,以此为原料最终甲酯得率为83%,而以磷含量为1 ppm的精制大豆油为原料时,最终甲酯得率达到98%。作者认为这可能是两方面的原因造成的,一方面磷脂对催化剂有一定的抑制作用,另一方面也有可能是粗油脂中杂质的存在造成最终甲酯得率降低。
| 表 2 粗油脂和精制油脂与甲醇转酯化反应的比较 Table 2 Comparison of metholysis processes of raw oils and refined oils |
Balasubramanian等[7]研究了分别以甲醇钙、氧化钙和氢氧化钾作为催化剂催化磷脂酰胆碱 (PC) 制备生物柴油的效果,结果显示KOH的催化初速率最大,甲醇钙次之。虽然KOH能取得较高的反应速率,但后续分离纯比较困难,说明均相碱催化剂不适用于高磷脂含量的体系。随后将以10%、30%、50%(PC10、PC30、PC50) 的比例混合到大豆油中,利用甲醇钙作为催化剂制备生物柴油,最终生物柴油得率都能达到90%以上。且生物柴油中磷含量都有明显下降,其中PC100、PC50、PC30和PC10中磷含量分别为0.081%、0.041%、0.035%和0.028%。
5 磷脂对酶法制备生物柴油的影响和化学法相比,酶法制备生物柴油具有对原料油脂要求低、反应条件温和、环境友好等优点受到人们的日益关注[20]。然而,脂肪酶作为一种生物催化剂,磷脂对其影响往往更复杂。
脂肪酶的催化机理被称为界面活化效应[21~23],在大多数脂肪酶活性中心的上方,都有一个由α螺旋构成的“盖子”结构,在通常情况下,“盖子”结构处于关闭状态,此时底物无法进入活性中心,脂肪酶也没有活性;在油水界面存在的条件下,“盖子”结构打开,活性中心暴露,底物得以进入疏水性口袋和活性中心结合从而发生催化作用。磷脂作为一种表面活性剂,有可能影响脂肪酶的界面活化作用而影响其催化活性。同时,当油脂中的磷脂达到一定浓度,则会形成磷脂反胶束,也会对脂肪酶的活性造成影响。磷脂对脂肪酶催化的水解、酯化和转酯化反应具有不同的影响。
5.1 对水解反应的影响磷脂对脂肪酶催化的水解反应一般呈现促进作用,但高浓度的磷脂往往会抑制脂肪酶的活性。Kariya等[24]研究了磷脂酰丝氨酸对来自鼠肝的溶酶体脂肪酶水解软脂酸甘油酯的影响,当体系中添加3.5 mg·mL-1的磷脂酰丝氨酸时,脂肪酶的水解活力得到明显提高,反应的最大水解速率提高到不添加磷脂酰丝氨酸体系的35倍。
Chen等[25]研究了卵磷脂体系中Candida cylindracea脂肪酶对乳脂水解反应的影响,结果显示当卵磷脂的浓度大于50 mmol·L-1时,即会对脂肪酶的活性造成抑制作用。作者认为抑制作用的原因主要来源于两方面:首先可能是磷脂的存在影响了脂肪酶的界面活化作用;其次,当体系中磷脂浓度较高时,可能形成了磷脂反胶束,磷脂浓度的增大使得磷脂反胶束数量的增多,从而加速了反胶束之间的碰撞以及胶束内物质的交换,导致溶液中形成不同的反胶束聚集体,从而影响了反胶束内部脂肪酶的活性。
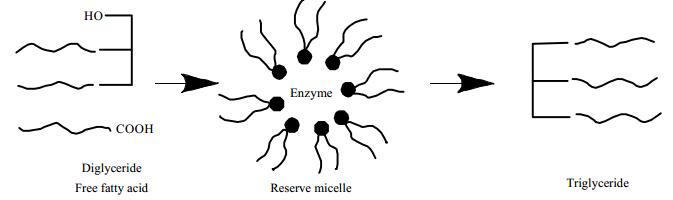
5.2 对酯化反应的影响脂肪酸和醇类发生酯化反应会生成酯类和水,在磷脂反胶束体系中,酯类和水因亲疏水性不同,自动分配到油相和水相中,有利于反应平衡向正向移动,从而提高酯化反应速率[26~28]。Morita等[29]使用R. delemar脂肪酶催化1, 2-甘油二酯和脂肪酸在磷脂酰胆碱反胶束中的酯化反应 (图 5),发现该反应只有当磷脂反胶束存在的时候才能发生,否则会发生甘油二酯的水解反应。
|
图 5 在反胶束体系中甘油二酯和脂肪酸合成甘油三酯示意图[74]\ Fig.5 Schematic diagram of triglyceride sythesis in reverse micelle with diglyceride and fatty acid |
Nagayama等[30]研究了磷脂微乳液中R.delemar脂肪酶催化油酸和辛醇酯化反应的动力学,发现在磷脂微乳液中得到的kcat和Km比AOT[琥珀酸双 (2-乙基已基) 酯磺酸钠]微乳体系高,说明脂肪酶在磷脂微乳液中催化速率得到提高,但是底物亲和性降低,这可能是因为磷脂对脂肪酶的竞争性抑制造成的。
5.3 对转酯化反应的影响磷脂对转酯化反应影响的研究主要集中在固定化酶,一般呈现抑制作用。Wantanabe等[9]在研究磷脂对固定化脂肪酶Novozym 435催化精制油脂甲醇解的影响时发现,向反应体系中添加0.2% (w/w) 的大豆磷脂即会对反应造成抑制作用,且这种抑制作用随着磷脂浓度的增大而增大,用磷脂酰胆碱代替大豆磷脂得到类似的结果。作者认为这可能是因为磷脂吸附在固定化酶或其载体上,从而阻碍了底物和酶的结合。
Du等[31]在研究固定化脂肪酶Novozym 435催化油脂转酯化的过程中发现,当体系中磷脂的含量大于0.2% (w/w) 时,反应初速率和最终生物柴油得率均明显降低。Lai等[32]的研究表明,向Novozym 435催化米糠油制备生物柴油的体系中添加2% (w/w) 的磷脂,则会在反应6 h时使得生物柴油得率降低10%。Amoah等[10]研究了磷脂对固定化Aspergillus oryzae全细胞催化剂催化油脂乙醇解的影响,发现10%~30% (w/w) 的磷脂使得反应速率和最终生物柴油得率明显降低,进一步通过显微镜观察到磷脂反胶束的存在,并认为磷脂的抑制作用主要是因为磷脂反胶束的存在阻碍了油水界面的形成。
也有少数文献报道磷脂对游离脂肪酶催化油脂甲醇解的影响,和对固定化酶单纯的抑制作用不同,磷脂对游离脂肪酶一般呈现低浓度促进、高浓度抑制的作用。Li等[13]在研究磷脂对游离脂肪酶NS81006催化油脂甲醇解影响的过程中发现,向体系中添加2% (w/w) 以下的磷脂能提高脂肪酶的活性和回用稳定性;当磷脂浓度提高到5% (w/w) 时,则会对酶活性和回用稳定性产生不利影响。
5.4 对脂肪酶最适作用温度的影响另外,也有研究者发现磷脂可以提高脂肪酶的最适作用温度。Schmidli等[33]在研究中发现,R. delemar脂肪酶催化对硝基棕榈酸酯水解的最佳作用温度为35℃,而在50 mmol·L-1的磷脂微乳液中提高到60℃。Chen等[25]发现C. cylindracea脂肪酶在水溶液中水解乳脂的最适温度为35℃,而在50 mmol·L-1的磷脂反胶束中提高至55℃,作者认为这可能是磷脂反胶束体系中水的物理化学性质和水溶液中有所不同导致。在磷脂反胶束体系中,水分子溶解在反胶束内部的“水池”中,“水池”中水的介电常数等物理化学性质和水溶液中有所不同,因此可能影响了脂肪酶的最适作用温度。
6 展望磷脂对生物柴油制备过程的影响非常复杂,有促进作用也有抑制作用,这往往和磷脂浓度以及反应体系的不同有关。总体来说,磷脂的存在可能对生物柴油的制备过程造成负面影响,因此一般需要对低品质油脂进行脱胶预处理,以去除油脂中的磷脂。传统的油脂脱胶工艺包括水化脱胶和酸化脱胶,但水化脱胶对磷脂脱除效率不高,而酸化脱胶则一般对设备的要求较高[34, 35]。近年来,人们开始利用磷脂酶进行脱胶处理,效果显著,且对于不同来源的油脂具有较好的适应性,具有较大的发展潜力[36]。也有研究发现,在酶法制备生物柴油的过程中,有些脂肪酶本身就具有磷脂酶的功能,能够催化磷脂的降解[8, 37]。若能进一步强化其磷脂酶的功能,可以直接利用含磷脂的油脂来制备生物柴油,免去预处理工艺,具有较大的推广价值。然后,磷脂对生物柴油制备体系的影响机制和技术开发仍有很多地方值得深入研究,以在降低磷脂的负面影响的同时对其有效利用。因此,今后的研究重点应包括如下几个方面:
1) 分析磷脂在油脂、生物柴油体系中的性质,结合热力学分析,开发有效分离油脂与磷脂的技术及其过程强化;
2) 系统解析磷脂对脂肪酶的活性、稳定性影响的机理,及其与反应物、产物的相互作用对脂肪催化过程的影响特性;
3) 结合磷脂加工技术、转酯化技术及生物柴油纯化技术,实现技术系统集成,提高原料转化率,降低能耗。
| [1] | Zhang Y, Dube M A, Mclean D D, et al. Biodiesel production from waste cooking oil:2. Economic assessment and sensitivity analysis[J]. Bioresource Technology , 2003, 90(3): 229-240. DOI:10.1016/S0960-8524(03)00150-0. |
| [2] | Haas M J, Mcaloon A J, Yee W C, et al. A process model to estimate biodiesel production costs[J]. Bioresource Technology , 2006, 97(4): 671-678. DOI:10.1016/j.biortech.2005.03.039. |
| [3] | LIU Yu-lan(刘玉兰). Oil extraction and processing technology(油脂制取与加工工艺学)[M].Beijing(北京): Science Press(科学出版社), 2009. |
| [4] | YU Tao (余涛). Comprehensive utilization of soybean oil sediment (大豆油脚的综合利用) [D]. Harbin (哈尔滨): Harbin University of Science and Technology (哈尔滨理工大学), 2005. |
| [5] | Foley P M, Beach E S, Zimmerman J B. Algae as a source of renewable chemicals:opportunities and challenges[J]. Green Chemistry , 2011, 13(6): 1399-1405. DOI:10.1039/c1gc00015b. |
| [6] | LU Xing-fang(卢行芳), LU Rong(卢荣). Processing and application of natural phospholipid products(天然磷脂产品的加工及应用)[M].Beijing(北京): Chemical Industry Press(化学工业出版社), 2004. |
| [7] | Balasubramanian R K, Obbard J P. Heterogeneous catalytic transesterification of phosphatidylcholine[J]. Bioresource Technology , 2011, 102(2): 1942-1946. DOI:10.1016/j.biortech.2010.08.040. |
| [8] | Li W, Du W, Liu D. Rhizopus oryzae IFO 4697 whole cell catalyzed methanolysis of crude and acidified rapeseed oils for biodiesel production in tert-butanol system[J]. Process Biochemistry , 2007, 42(11): 1481-1485. DOI:10.1016/j.procbio.2007.05.015. |
| [9] | Watanabe Y, Shimada Y, Sugihara A, et al. Conversion of degummed soybean oil to biodiesel fuel with immobilized Candida antarctica lipase[J]. Journal of Molecular Catalysis B-Enzymatic , 2002, 17(PⅡ S1381-1177(02)00022-X3-5): 151-155. |
| [10] | Amoah J, Ho S, Hama S, et al. Converting oils high in phospholipids to biodiesel using immobilized Aspergillus oryzae whole-cell biocatalysts expressing Fusarium heterosporum lipase[J]. Biochemical Engineering Journal , 2016, 105(A): 10-15. |
| [11] | Lin L, Rhee K C, Koseoglu S S. Bench-scale membrane degumming of crude vegetable oil:process optimization[J]. Journal of Membrane Science , 1997, 134(1): 101-108. DOI:10.1016/S0376-7388(97)00098-7. |
| [12] | Subramanian R, Nakajima M. Membrane degumming of crude soybean and rapeseed oils[J]. Journal of the American Oil Chemists Society , 1997, 74(8): 971-975. DOI:10.1007/s11746-997-0013-4. |
| [13] | Li Y, Du W, Liu D. Exploration on the effect of phospholipids on free lipase-mediated biodiesel production[J]. Journal of Molecular Catalysis B-Enzymatic , 2014, 102(4): 88-93. |
| [14] | Jang M G, Kim D K, Park S C, et al. Biodiesel production from crude canola oil by two-step enzymatic processes[J]. Renewable Energy , 2012, 42(1): 99-104. |
| [15] | Kaleli H. The impact of crankcase oil containing phosphorus on catalytic converters and engine exhaust emissions[J]. Industrial Lubrication and Tribology , 2001, 53(6): 237-255. DOI:10.1108/00368790110408337. |
| [16] | Mittelbach M. Diesel fuel derived from vegetable oils.6. Specifications and quality control of biodiesel[J]. Bioresource Technology , 1996, 56(1): 7-11. DOI:10.1016/0960-8524(95)00172-7. |
| [17] | Gerpen J H V, Dvorak B. The effect of phosphorus level on the total glycerol and reaction yield of biodiesel[Z]. Boise, ID:2002. |
| [18] | Mendow G, Monella F C, Pisarello M L, et al. Biodiesel production from non-degummed vegetable oils:Phosphorus balance throughout the process[J]. Fuel Processing Technology , 2011, 92(5): 864-870. DOI:10.1016/j.fuproc.2010.11.029. |
| [19] | Freedman B, Pryde E H, Mounts T L. Variables affecting the yields of fatty esters from transesterified vegetable-oils[J]. Journal of the American Oil Chemists Society , 1984, 61(10): 1638-1643. DOI:10.1007/BF02541649. |
| [20] | Robles-Medina A, Gonzalez-Moreno P A, Esteban-Cerdan L, et al. Biocatalysis:Towards ever greener biodiesel production[J]. Biotechnology Advances , 2009, 27(4): 398-408. DOI:10.1016/j.biotechadv.2008.10.008. |
| [21] | Chapus C, Semeriva M. Mechanism of pancreatic lipase action. 2. Catalytic properties of modified lipases[J]. Biochemistr , 1976, 15(23): 4988-4991. DOI:10.1021/bi00668a007. |
| [22] | Chapus C, Semeriva M, Bovier-Lapierre C, et al. Mechanism of pancreatic lipase action. 1. Interfacial activation of pancreatic lipase[J]. Biochemistry , 1976, 15(23): 4980-4987. DOI:10.1021/bi00668a006. |
| [23] | Maruyama T, Nakajima M, Ichikawa S, et al. Oil-water interfacial activation of lipase for interesterification of triglyceride and fatty acid[J]. Journal of the American Oil Chemists Society , 2000, 77(11): 1121-1126. DOI:10.1007/s11746-000-0176-4. |
| [24] | Kariya M, Kaplan A. Effects of acidic phospholipids, nucleotides, and heparin on the activity of lipase from rat liver lysosomes[J]. Journal of Lipid Research , 1973, 14(2): 243-249. |
| [25] | Chen J P, Chang K C. Lipase-catalyzed hydrolysis of milk-fat in lecithin reverse micelles[J]. Journal of Fermentation and Bioengineering , 1993, 76(2): 98-104. DOI:10.1016/0922-338X(93)90064-F. |
| [26] | Stamatis H, Xenakis A, Provelegiou M, et al. Esterification reactions catalyzed by lipases in microemulsions-the role of enzyme localization in relation to its selectivity[J]. Biotechnology and Bioengineering , 1993, 42(1): 103-110. DOI:10.1002/(ISSN)1097-0290. |
| [27] | Stamatis H, Xenakis A, Bornscheuer U, et al. Pseudomonas-cepacia lipase-esterification reactions in AOT microemulsion systems[J]. Biotechnology Letters , 1993, 15(7): 703-708. DOI:10.1007/BF01080143. |
| [28] | Avramiotis S, Stamatis H, Kolisis F N, et al. Structural studies of lecithin-and AOT-based water-in-oil microemulsions, in the presence of lipase[J]. Langmuir , 1996, 12(26): 6320-6325. DOI:10.1021/la9606862. |
| [29] | Morita S, Narita H, Matoba T, et al. Synthesis of triacylglycerol by lipase in phosphatidylcholine reverse micellar system[J]. Journal of the American Oil Chemists Society , 1984, 61(10): 1571-1574. DOI:10.1007/BF02541635. |
| [30] | Nagayama K, Matsu-Ura S, Doi T, et al. Kinetic characterization of esterification catalyzed by Rhizopus delemar lipase in lecithin-AOT microemulsion systems[J]. Journal of Molecular Catalysis B-Enzymatic , 1998, 4(1-2): 25-32. DOI:10.1016/S1381-1177(97)00017-9. |
| [31] | Du W, Xu Y Y, Zeng J, et al. Novozym 435-catalysed transesterification of crude soya bean oils for biodiesel production in a solvent-free medium[J]. Biotechnology and Applied Biochemistry , 2004, 40(Pt 2): 187-190. |
| [32] | Lai C C, Zullaikah S, Vali S R, et al. Lipase-catalyzed production of biodiesel from rice bran oil[J]. Journal of Chemical Technology and Biotechnology , 2005, 80(3): 331-337. DOI:10.1002/(ISSN)1097-4660. |
| [33] | Schmidli P K, Luisi P L. Lipase-catalyzed reactions in reverse micelles formed by soybean lecithin[J]. Biocatalysis & Biotransformation , 2009, 3(4): 367-376. |
| [34] | LUO Shu-nian(罗淑年), YU Dian-yu(于殿宇), SHI Jia-ning(史加宁). Soybean oil degumming technology research and discussion(大豆油脱胶技术研究与探讨)[J]. China Oils and Fats(中国油脂) , 2005(12): 25-27. DOI:10.3321/j.issn:1003-7969.2005.12.007. |
| [35] | YANG Ji-guo(杨继国), YANG Bo(杨博), LIN Wei-tie(林炜铁). Degumming process of vegetable oils physical refining(植物油物理精炼中的脱胶工艺)[J]. China Oils and Fats(中国油脂) , 2004(2): 7-10. |
| [36] | Yang B, Wang Y, Yang J. Optimization of enzymatic degumming process for rapeseed oil[J]. Journal of the American Oil Chemists Society , 2006, 83(7): 653-658. DOI:10.1007/s11746-006-1253-4. |
| [37] | LI Yang (李扬). Study on the effect of phospholipids on free lipase-mediated methanolysis for biodiesel production (磷脂对游离脂肪酶催化制备生物柴油的影响及机理研究) [D]. Beijing (北京): Tsinghua Univerisity (清华大学), 2015. |