异戊烯醇,化学名为3-甲基-2-丁烯-1-醇(3-methyl-2-butene-1-ol,MBO321),是一种重要的精细化工中间体,可用于贲亭酸甲酯(拟除虫菊酯类杀虫剂中间体)、异植物醇(维E中间体)、柠檬醛、橡胶单体等的合成[1-2]。近年来,随着高效低毒农药拟除虫菊酯类杀虫剂的快速发展,MBO321的需求量大幅上升。
目前异戊烯醇的合成技术主要有氯代异戊烯水解工艺(包括直接水解和经酯化再水解)和异丁烯-甲醛缩合工艺[3-6]。在氯代异戊烯水解工艺中,水解产物包括MBO321和2-甲基-3-丁烯-2-醇(2-methyl-3-butene-2-ol,MBO232)。在异丁烯-甲醛缩合工艺中,异丁烯与甲醛缩合的主要产物是3-甲基-3-丁烯-1-醇(3-methyl-3-butene-1-ol,MBO331),MBO321含量很少。可见,MBO232或MBO331的异构化反应是MBO321合成工艺中的关键[7-9]。异构化反应结束后,为获得较高纯度的目标产物MBO321,需采用精馏操作分离MBO232+MBO321或MBO331+MBO321体系[10-11]。测定上述体系的汽液平衡数据和选用合适的热力学模型对MBO321的分离工艺优化和设计具有重要意义。目前尚未发现有关MBO321汽液平衡数据的文献报道。相关报道仅有Lei等[12]测定的MBO232+乙醇及MBO232+1-丁醇在50、60及70 kPa下的汽液平衡数据。所测数据采用UNIQUAC活度系数模型拟合,关联度较好。
由于MBO321在常压下的沸点较高,工业上多采用减压精馏进行分离提纯[13]。本文测定了MBO232+MBO321、MBO331+MBO321体系在51.2和81.9 kPa下的汽液平衡数据,并用Wilson和NRTL活度系数模型对实验数据进行关联,以期为MBO321的分离提纯提供基础数据及合适的预测模型。
2 实验 2.1 实验试剂本实验中所用的MBO321(质量分数w > 99.0%)、MBO331 (w > 99.0%)、MBO232(w > 98.0%)均购于上海麦克林生化科技有限公司。MBO232用无水Na2SO4干燥后经气相色谱分析,质量分数为99.6%。MBO321和MBO331未经纯化直接使用。所用试剂的常压沸点如表 1所示,表中Tb为常压沸点。
|
|
表 1 试剂的常压沸点 Table 1 Boiling points of the experimental materials at normal pressure |
装置为改进的Rose平衡釜(天大北洋化工实验设备有限公司)。该装置适用于常压及减压条件下汽液平衡数据的测定。采用SHB-ⅢS循环水式真空泵抽真空,体系压力用精密压力表测量,精度为0.1 kPa;系统温度用50~100 ℃、100~150 ℃的精密温度计测量,精度为0.1 ℃,已经露颈校正。考虑到研究体系的沸点较高,在平衡釜外包裹保温材料以保证温度控制要求。
2.3 实验方法配制一定组成的二元混合物加入平衡釜中,将三通阀调至真空操作,打开总电源,对系统抽真空,通过稳压阀及针型阀调节体系真空度,设定控温仪表对釜液加热,待釜液沸腾后调节加热电流控制回流液为20~30滴·min-1。当温度计读数稳定并至少保持30 min不变时可认为汽液两相达到平衡,用提前冷却至0 ℃左右的1 mL注射器同时从汽液两相取样口取样。
2.4 分析方法样品组成采用岛津GC-2014C气相色谱仪分析。分析条件:氢火焰离子检测器(FID);DB-1701毛细管柱(30 m×0.25 mm×0.25 μm);汽化室和检测器温度均为180 ℃;采用程序升温,初始温度80 ℃,持续时间1 min,样品为MBO331+MBO321时,以0.5 ℃·min-1的速率升温至90 ℃,样品为MBO232+MBO321时,以20 ℃·min-1的速率升温至150 ℃。进样量均为0.1 μL。每个样品连续测定3次,相对标准偏差小于2%。取3次测量的平均值,采用面积校正归一化法计算样品组成。
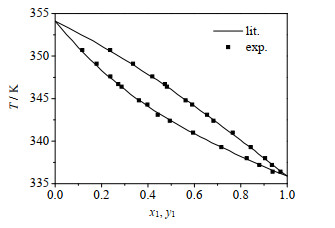
2.5 实验装置及测定方法的可靠性校验以乙醇-正丙醇体系为校核体系。精确配制一系列不同浓度的乙醇-正丙醇标准溶液,用阿贝折光仪(WAY型,上海精科)测定其在(30±0.1 ℃)时的折光率,每个样品至少测定3次,相对标准偏差小于2%。取3次测量的平均值,绘制成标准曲线,用于乙醇-正丙醇体系汽液平衡数据的分析。采用上述实验方法测定乙醇-正丙醇体系在53.1 kPa下的汽液平衡数据,并与文献[16]数值相比较,结果如图 1所示。由图可见,实验数据与文献值具有很好的一致性,说明该实验装置适用于减压条件下汽液平衡数据的测定。
|
图 1 53.1 kPa下乙醇(1)-正丙醇(2)体系汽液平衡数据文献值与实验值的对比 Fig.1 Comparison of experimental and literature data of ethanol(1)-n-propanol(2) system at 53.1 kPa |
测定了MBO232+MBO321、MBO331+MBO321体系分别在压力51.2和81.9 kPa下的汽液平衡数据,见表 2和3。
|
|
表 2 MBO232 (1)+ MBO321 (3)体系汽液平衡数据与关联 Table 2 VLE data and fitting results of the MBO232 (1)+ MBO321 (3) system |
|
|
表 3 MBO331 (2)+ MBO321 (3)体系汽液平衡数据与关联 Table 3 VLE data and fitting results of the MBO331 (2)+ MBO321 (3) system |
采用Aspen Plus数据回归系统中的面积检验法和Van Ness点检验法[17-18]对实验数据进行热力学一致性检验。MBO232+MBO321体系在压力51.2和81.9 kPa下的面积检验值分别为4.91%和-7.43%,MBO331+MBO321体系的面积检验值分别为5.00% 和7.38%,绝对值均小于10%,表明实验数据通过了面积检验法。
Van Ness点检验法表示为
| $ \Delta y = \frac{1}{N}\sum\limits_{i = 1}^N {100\left| {y_i^{\rm{exp} } - y_i^{\rm{cal}}} \right|} $ | (1) |
| $ \Delta p = \frac{1}{N}\sum\limits_{i = 1}^N {100\left| {\frac{{p_i^{{\rm{exp}}} - p_i^{{\rm{cal}}}}}{{p_i^{\rm{exp}}}}} \right|} $ | (2) |
式中:N为实验点的个数,yi为汽相摩尔分数,pi为压力。上标“cal”和“exp”分别表示NRTL模型计算值和实验值。若Δy和Δp均小于1,则认为实验数据符合热力学一致性条件。MBO232+MBO321、MBO331+MBO321体系的Van Ness法的检验结果如表 4所示。结果表明,上述体系的实验数据均通过了Van Ness点检验法。
|
|
表 4 Van Ness法热力学一致性检验结果 Table 4 Results of thermodynamic consistency tests by the Van Ness method |
Wilson[19]模型和NRTL[20]模型均是在工程设计中广泛使用的活度系数模型,二者均适用于从非极性到较强极性混合物的计算。分别用Wilson和NRTL模型对实验数据进行关联,用Aspen Plus V8.4回归出相应的模型参数。
Wilson模型:
| $ \ln {\gamma _i} = 1 - \ln (\sum\limits_j {{\mathit{\Lambda }_{ij}}} {x_j}) - \sum\limits_j {\frac{{{\mathit{\Lambda }_{ji}}{x_j}}}{{\sum\limits_k {{\mathit{\Lambda }_{jk}}{x_k}} }}} $ | (3) |
| $ \ln {\mathit{\Lambda }_{ij}} = {a_{ij}} + {b_{ij}}/T{\rm{ + }}{c_{ij}}\ln T + {d_{ij}}T + {e_{ij}}/{T^2} $ | (4) |
NRTL模型:
| $ \ln {\gamma _i} = \frac{{\sum\limits_j {{x_j}{\tau _{ji}}{G_{ji}}} }}{{\sum\limits_k {{x_k}{G_{ki}}} }} + \sum\limits_j {\frac{{{x_j}{G_{ij}}}}{{\sum\limits_k {{x_k}{G_{kj}}} }}} ({\tau _{ij}} - \frac{{\sum\limits_m {{x_m}{\tau _{mj}}{G_{mj}}} }}{{\sum\limits_k {{x_k}{G_{kj}}} }}) $ | (5) |
| $ {G_{ij}} = \exp ( - \alpha {\tau _{ij}}) $ | (6) |
| $ {\tau _{ij}} = {a_{ij}} + {b_{ij}}/T{\rm{ + }}{e_{ij}}\ln T{\rm{ + }}{f_{ij}}T $ | (7) |
式中:
|
|
表 5 MBO232 (1)+MBO321 (3)体系各模型参数 Table 5 Model parameters of the MBO232 (1)+ MBO321 (3) system |
|
|
表 6 MBO331 (2)+ MBO321 (3)体系各模型参数 Table 6 Model parameters of the MBO331 (2)+ MBO321 (3) system |
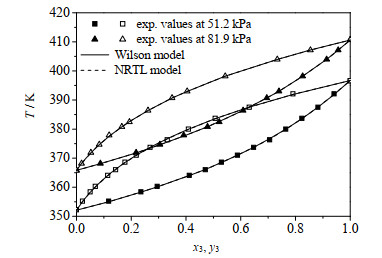
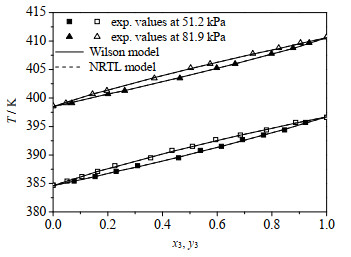
图 2和3分别为MBO232+MBO321和MBO331+MBO321体系的T-x-y图。用Wilson和NRTL模型计算得到的数据之间偏差很小,且都与实验值吻合得很好,满足工程设计的需要。
|
图 2 MBO232 (1)+MBO321 (3)体系T-x3-y3图 Fig.2 T-x3-y3 diagram of the MBO232 (1)+ MBO321 (3) system |
|
图 3 MBO331 (2)+ MBO321 (3)体系T-x3-y3图 Fig.3 T-x3-y3 diagram of the MBO331 (2)+ MBO321 (3) system |
(1) 用改进的Rose釜测定了MBO232+MBO321和MBO331+MBO321体系在51.2和81.9 kPa下的汽液平衡数据。
(2) 同时采用面积检验法和Van Ness点检验法对实验数据进行热力学一致性检验,所测数据通过了一致性检验。
(3) 用Wilson和NRTL模型对上述体系的汽液平衡数据进行关联,得到了相应的模型参数及泡点温度和汽相组成的绝对偏差。2种模型的关联结果没有明显差异,都可满足工程上放大设计的需要。所测数据及关联结果为MBO321的分离纯化提供了基础数据。
|
|
| [1] |
MCGINTY D, JONES L, LETIZIA C S, et al. Fragrance material review on 3-methyl-2-buten-1-ol[J]. Food and Chemical Toxicology, 2010, 48: 64-69. DOI:10.1016/j.fct.2009.11.013 |
| [2] |
秦国明, 秦技强, 傅建松, 等. 异戊烯醇合成与应用研究进展[J]. 石油化工与技术经济, 2010, 26(3): 55-58. QIN G M, QIN J Q, FU J S, et al. Progress on synthetic technologies and application of prenyl alcohol[J]. Technology & Economics in Petrochemicals, 2010, 26(3): 55-58. |
| [3] |
YOSHINORI Y, YOSHIRO Y. Process for preparing unsaturated alcohols: US, 4028424[P]. 1975-11-10.
|
| [4] |
GROSSELIN J M, MERCIER C. Process for the preparation of unsaturated alcohols: US, 4925990[P]. 1990-05-15.
|
| [5] |
BABLER J H, CHICAGO I. Methods for preparing prenyl alcohol: US, 5872277[P]. 1999-02-16.
|
| [6] |
余慧群, 何志鹏, 周海, 等. 异戊烯醇的合成研究进展[J]. 化工技术与开发, 2011, 40(11): 37-39. YU H Q, HE Z P, ZHOU H, et al. Research progress of prenyl alcohol synthesis[J]. Technology & Development of Chemical Industry, 2011, 40(11): 37-39. DOI:10.3969/j.issn.1671-9905.2011.11.012 |
| [7] |
余慧群, 廖艳芳, 周海, 等. 异构化反应合成异戊烯醇的研究进展[J]. 精细石油化工, 2012, 29(1): 79-82. YU H Q, LIAO Y F, ZHOU H, et al. Progress in isomerization for producing prenyl alcohol[J]. Speciality Petrochemicals, 2012, 29(1): 79-82. DOI:10.3969/j.issn.1003-9384.2012.01.021 |
| [8] |
KOGAN S B, KALIYA M, FROUMIN N. Liquid phase isomerization of isoprenol into prenol in hydrogen environment[J]. Applied Catalysis A: General, 2006, 297: 231-236. DOI:10.1016/j.apcata.2005.09.010 |
| [9] |
朱志庆, 孙敏达, 吕自红. 双键临氢异构化反应研究制备异戊烯醇[J]. 高校化学工程学报, 2011, 25(1): 119-122. ZHU Z Q, SUN M D, LÜ Z H. Studies on hydroisomerization of double bond for producing prenyl alcohol[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(1): 119-122. |
| [10] |
周宝强, 宋林林, 张楠, 等. 3-甲基-2-丁烯-1-醇的制备新工艺[J]. 化工进展, 2015, 34(1): 229-233. ZHOU B Q, SONG L L, ZHANG N, et al. A new process on the preparation of 3-methyl-2-butene-1-ol[J]. Chemical Industry and Engineering Progress, 2015, 34(1): 229-233. |
| [11] |
商志才, 钱洪胜, 王金明, 等. 连续化生产3-甲基-2-丁烯醇的方法: CN, 101381283A[P]. 2009-03-11. SHANG Z C, QIAN H S, WANG J M, et al. Method for continuous production of 3-methyl-2-butenol: CN, 101381283A[P]. 2009-3-11. |
| [12] |
LEI Y, LI H R, ZHU L H, et al. Isobaric vapor-liquid equilibria of the binary mixtures 2-methyl-3-buten-2-ol+ethanol and 2-methyl-3-buten-2-ol+1-butanol[J]. Fluid Phase Equilibria, 2003, 206: 87-94. DOI:10.1016/S0378-3812(02)00304-7 |
| [13] |
公彦真. 烯醇-饱和醇体系萃取精馏过程研究[D]. 杭州: 浙江大学, 2018. GONG Y Z. Study on the extractive distillation process of unsaturated and saturated alcohols[D]. Hangzhou: Zhejiang University, 2018. |
| [14] |
何志鹏. 异戊烯醇催化合成的工艺研究[D]. 南宁: 广西大学, 2012. HE Z P. Catalytic synthesis of prenyl alcohol process research[D]. Nanning: Guangxi University, 2012. |
| [15] |
BAGLAY A K, GURARIY L L, KULESHOV G G. Physical properties of compounds used in vitamin synthesis[J]. Journal of Chemical and Engineering Data, 1988, 33(4): 512-518. DOI:10.1021/je00054a035 |
| [16] |
GEMEHLING J, ONKEN U. Vapor-liquid equilibrium data collection[M]. Frankfurt: DECHEMA, 1981.
|
| [17] |
VAN NESS H C, BYER S M, GIBBS R E. Vapour-liquid equilibrium: Part I An appraisal of data reduction methods[J]. AIChE Journal, 1973, 19(2): 238-244. DOI:10.1002/aic.690190206 |
| [18] |
SHI P Y, GAO Y C, WU J Y, et al. Separation of azeotrope (2, 2, 3, 3-tetrafluoro-1-propanol + water): Isobaric vapour-liquid phase equilibrium measurements and azeotropic distillation[J]. Journal of Chemical Thermodynamics, 2018, 118: 139-146. DOI:10.1016/j.jct.2017.11.009 |
| [19] |
WILSON G M. Vapor-liquid equilibrium. Ⅺ. A new expression for the excess energy of mixing[J]. Journal of the American Chemical Society, 1964, 86(2): 127-130. DOI:10.1021/ja01056a002 |
| [20] |
RENON H, PRAUSNITZ J M. Local composition in thermodynamic excess functions for liquid mixtures[J]. AIChE Journal, 1968, 14(1): 135-144. DOI:10.1002/aic.690140124 |
| [21] |
孙兰义. 化工流程模拟实训-Aspen plus教程[M]. 北京: 化学工业出版社, 2012. SUN L Y. Chemical engineering process simulation using Aspen plus[M]. Beijing: Chemical Industry Press, 2012. |




