人血白蛋白(human serum albumin,HSA)是人血浆中含量最丰富的蛋白质,临床上HSA主要用于治疗因失血、创伤、烧伤、整形外科手术及脑损伤引起的低蛋白血症以及肝硬化、肾水肿等恶性病变,在癌症和艾滋病人放化疗的辅助治疗中也有较大需求[1]。目前治疗用HSA只能通过健康人血浆分离得到,由于血浆来源有限,HSA供给十分紧张,且存在血源性病原体的潜在风险,采用基因工程技术生产重组人血白蛋白(recombinant human serum albumin,rHSA)有助于解决相关问题。rHSA已在真菌、动物细胞和植物细胞等多种系统中成功表达[2-4],但发酵液成分非常复杂,除培养基成分外,还含有宿主细胞分泌的蛋白、多肽、脂质、多聚糖和色素等代谢产物,以及宿主细胞破碎后释放的核酸等杂质,rHSA分离纯化难度大,目前尚未有注射级的rHSA产品上市[5]。此外,pH对HSA结构有较大影响,在pH为4.3~8.0时,HSA分子以生理条件下的N型结构存在[6-10]。当pH小于2.7时,HSA分子呈延展的E型结构;当pH为2.7~4.3时,HSA分子呈快速迁移的F型结构;当pH为8~10时,HSA分子无α螺旋结构,呈B型结构;当pH大于10时,HSA分子呈A型结构。因此,分离过程需控制合适pH,过酸或过碱均会造成HSA构象变化,影响生理活性。
阳离子交换层析常用于分离rHSA,如Goodey等[11]采用阳离子交换介质SP Sepharose FF从酿酒酵母发酵液中捕获rHSA,选择性较低,且离子交换介质耐盐性差,需要稀释料液使得电导率低于5.5 mS·cm-1。基于多种相互作用的混合模式层析,可以有效组合疏水和静电相互作用,提高分离选择性[12-15]。李梅彦等[16]采用混合模式介质CST-Ⅱ FF从毕赤酵母发酵液中分离rHSA,该介质具有较强的耐盐性,但是选择性不高,在吸附后需要使用高浓度的NaCl溶液冲洗,以去除色素、糖、核酸和宿主细胞蛋白等杂质。杨代常等[17]采用混合模式介质Capto MMC从水稻种子提取物中分离rHSA,吸附后用浓度为1 mol·L-1的NaCl溶液冲洗,以去除吸附的杂质。Chu等[18-19]采用混合模式介质MX-Trp-650 M从毕赤酵母发酵液中分离rHSA,经优化,rHSA纯度可达到95%。不过,最佳上样pH为4.0,可能影响HSA分子正常构象。Wu等[20-21]以色胺为配基的新型混合模式介质,用于酵母发酵液中分离rHSA,rHSA单体纯度达到87.8%。此外,疏水相互作用层析也用于rHSA分离,如Dong等[22]采用双水相萃取结合疏水相互作用层析,从毕赤酵母发酵液中分离rHSA,纯度达99.1%。为了提高rHSA分离效率,研发特异性的新型分离介质,吸附和洗脱pH条件温和,且具有耐盐吸附特性,具有重要的意义。
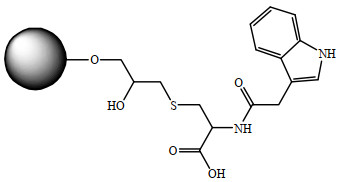
基于计算机分子模拟辅助设计方法,以HSA的位点Ⅱ为靶点,本实验室经设计和筛选得到HSA的特异性配基吲哚-3-乙酸-半胱氨酸(IAA-CYS),将其偶联于琼脂糖凝胶,制备了新型混合模式介质(IAA-CYS介质),配基结构见图 1[23]。本研究基于前期工作,实验考察IAA-CYS介质对HSA的吸附性能,针对毕赤酵母发酵液电导率较高、pH对HSA结构影响较大的特点,重点关注pH和盐浓度对rHSA分离的影响,优化分离条件,从毕赤酵母发酵液中高效分离rHSA。
2 材料与方法 2.1 材料IAA-CYS介质:本实验室按照文献方法制备[20-21, 23],以质量分数为6% 的琼脂糖凝胶为基质,经烯丙基溴活化,偶联IAA-CYS配基,配基浓度为175 μmol·mL-1,介质粒径为45~165 μm,平均粒径约90 μm;HSA(相对分子量66 700):Sigma公司;毕赤酵母发酵液:本地生物制药公司提供,pH为6.0,rHSA质量浓度为8 mg·mL-1,纯度3.9%,电导率为20 mS·cm-1;辛酸钠:上海阿拉丁生化科技股份有限公司;蛋白Marker:上海天能科技有限公司;毕赤酵母宿主细胞蛋白检测试剂盒:Cygnus公司;其他为市售分析纯试剂。
2.2 HSA吸附等温线配制20 mmol·L-1的乙酸钠缓冲液(pH=4.5)和添加200 mmol·L-1 NaCl的20 mmol·L-1的乙酸钠缓冲液(pH 4.5)。IAA-CYS介质用去离子水充分清洗,并用相应缓冲液平衡30 min,抽滤15 min;称取0.03 g抽干介质,置于2 mL离心管;采用相应缓冲液配制成不同质量浓度(2.4~9.6 mg·mL-1)的HSA溶液,分别取0.8 mL加入离心管中;将离心管放入25 ℃、转速为1 200 r·min-1恒温混匀仪振荡3 h,达到吸附平衡;以3 000 r·min-1的转速离心2 min,沉降介质;用One Drop OD-1000+分光光度计测定上清液在280 nm波长下的吸光度,根据标准曲线得到HSA的平衡浓度C(mg·mL-1)。根据物料衡算计算IAA-CYS介质对HSA的吸附量Q(mg·mL-1)。采用Langmuir吸附平衡式对吸附等温线进行拟合,得到饱和吸附容量Qm(mg·mL-1)和结合常数Ka(mL·mg-1)。Langmuir吸附平衡式如下:
| $ Q=\frac{Q_{\mathrm{m}} \times C}{C+1 / K_{\mathrm{a}}} $ | (1) |
1 mL IAA-CYS介质装填于Tricorn 5/50层析柱(内径5 mm,GE Healthcare公司),填充高度5 cm。以质量浓度为10 mg·mL-1的HSA溶液(pH 4.5)或含有浓度为200 mmol·L-1 NaCl的质量浓度为10 mg·mL-1的HSA溶液(pH=4.5)作为上样料液。上样前,用平衡缓冲液充分平衡介质。上样流速分别为100、200和300 cm·h-1。UV280 nm在线检测层析柱出口处的HSA浓度变化,绘制穿透曲线,计算10% 穿透时IAA-CYS介质对HSA的动态载量DBC10%(mg·mL-1)。上样结束后,用20 mmol·L-1磷酸盐缓冲液(pH 8.0)洗脱HSA,再用0.1 mol·L-1的NaOH溶液进行介质清洗和再生。
2.4 毕赤酵母发酵液预处理离心去除发酵液中的毕赤酵母细胞,上清液中加入辛酸钠至20 mmol·L-1浓度,68 ℃水浴30 min,沉淀杂蛋白和灭活蛋白酶,迅速冷却至室温,滴加乙酸溶液调节pH至4.5,以转速1 000 r·min-1离心15 min,0.45 μm滤膜过滤,得到毕赤酵母发酵处理液,rHSA质量浓度为7.6 mg·mL-1,纯度为4.0%。
2.5 rHSA动态载量1 mL IAA-CYS介质装填于Tricorn 5/50层析柱中,填充高度为5 cm。用20 mmol·L-1的乙酸钠缓冲液(pH 4.5,含200 mmol·L-1的NaCl)平衡床层,以毕赤酵母发酵处理液为上样料液,上样流速为100 cm·h-1。每0.5 mL收集流穿组分,用SEC-HPLC分析流穿液中的rHSA浓度,绘制穿透曲线,计算10% 穿透时IAA-CYS介质对rHSA的动态载量。上样结束后,用20 mmol·L-1的磷酸盐缓冲液(pH 8.0)洗脱rHSA,再用0.1 mol·L-1的NaOH溶液进行介质清洗和再生。
2.6 洗脱条件优化采用20 mmol·L-1的乙酸钠缓冲液(pH 5.0)、20 mmol·L-1的磷酸盐缓冲液(pH 6.0、7.0、8.0)和20 mmol·L-1甘氨酸-氢氧化钠缓冲液(pH 9.0)配制不同pH和NaCl浓度(200、400、600、800、1 000 mmol·L-1)的缓冲液。96孔过滤板的30个孔中分别加入80 μL IAA-CYS介质悬浮液(含有8 mg介质),真空抽滤;各孔介质用200 μL、20 mmol·L-1的乙酸钠缓冲液(pH 4.5,含200 mmol·L-1的NaCl)平衡3次,真空抽滤,去除缓冲液;各孔加入48 μL毕赤酵母发酵处理液,用封板膜密封96孔过滤板的顶部和底部,放入25 ℃、1 200 r·min-1恒温混匀仪振荡20 min,真空抽滤;用200 μL、20 mmol·L-1的乙酸钠缓冲液(pH 4.5,含200 mmol·L-1的NaCl)清洗介质2次;各孔加入不同pH和NaCl浓度的缓冲液,用封板膜密封96孔过滤板的顶部和底部,放入25 ℃、转速为1 200 r·min-1恒温混匀仪振荡10 min,真空抽滤,收集洗脱液,重复2次,合并洗脱液。用SEC-HPLC分析上样料液和洗脱液,计算rHSA纯度和收率。
2.7 毕赤酵母发酵液中分离rHSA1 mL IAA-CYS介质装填于Tricorn 5/50层析柱。20 mmol·L-1乙酸钠缓冲液(pH 4.5,含200 mmol·L-1的NaCl)平衡介质,以毕赤酵母发酵处理液为上样料液,上样量为38.6 mg·mL-1,上样流速为100 cm·h-1;上样后先用20 mmol·L-1的乙酸钠缓冲液(pH 4.5,含200 mmol·L-1的NaCl)淋洗,再用20 mmol·L-1的磷酸盐缓冲液(pH 8.0,含200 mmol·L-1的NaCl)洗脱rHSA,收集洗脱液;最后用0.1 mol·L-1的NaOH溶液进行介质清洗和再生。采用SDS-PAGE、SEC-HPLC和ELISA试剂盒分析上样料液和洗脱液。
2.8 SDS-PAGE分析将10 μL电泳缓冲液与40 μL样品混合,95 ℃金属浴10 min。分离胶浓度为10 %,浓缩胶浓度为5 %,样品上样量为10 μL,蛋白Marker上样量为5 μL,80 V恒压电泳30 min,120 V恒压分离45 min,考马斯亮蓝染色,采用Quantity One软件(Bio-Rad公司)分析凝胶图像。
2.9 SEC-HPLC分析采用TSK G3000SWXL分析柱(TOSOH公司)和LC-10A液相色谱仪(岛津公司),流动相为0.2 mol·L-1磷酸盐缓冲液(pH 7.0,异丙醇体积分数为1 %),流速为0.6 mL·min -1,上样体积为20 μL,检测波长为280 nm,室温下进行。
2.10 ELISA分析按照毕赤酵母宿主细胞蛋白检测试剂盒说明书进行。
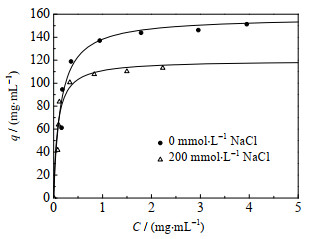
3 结果与讨论 3.1 HSA吸附等温线考察了pH和盐浓度对IAA-CYS介质吸附HSA的影响,发现在pH为4.0~5.0和NaCl浓度为0~1.0 mol·L-1时,HSA吸附量均高于100 mg·mL-1,最合适的吸附pH为4.5。进一步测定了pH为4.5条件下,不添加NaCl和添加浓度为200 mmol·L-1的NaCl时IAA-CYS介质对HSA的吸附等温线,结果见图 2。pH为4.5和不添加NaCl时,HSA饱和吸附容量高达157.6 mg·mL-1,结合常数为7.1 mL·mg-1。褚文宁等[18-19]测定了4种商业化混合模式介质(Capto adhere、Capto MMC、MX-Trp-650M和Nuvia cPrime)对HSA的吸附性能,最佳吸附的pH分别为8.5、4.0、4.0和4.0;吴启赐等[20-21]研发了混合模式新介质TA-B-6FF,也测定了HSA吸附性能,最佳吸附pH为5.0。与上述5种混合模式介质比较,在各自的最佳吸附pH条件下,IAA-CYS介质对HSA的饱和吸附容量最高。pH为4.5和添加200 mmol·L-1的NaCl时,IAA-CYS介质对HSA的饱和吸附容量降到119.8 mg·mL-1,结合常数增大到12.5 mL·mg-1。与上述5种混合模式介质比较,发现相同条件下IAA-CYS介质的饱和吸附容量高于Capto adhere、Nuvia cPrime和TA-B-6FF,与Capto MMC介质接近,略低于MX-Trp-650M介质,且吸附pH较为温和,有利于维持HSA的正常生理构象[6-8]。结果表明,IAA-CYS介质对HSA吸附容量高,条件温和,耐盐性好。
|
图 2 IAA-CYS介质对HSA的吸附等温线(pH 4.5) Fig.2 Adsorption isotherm curves of HSA on IAA-CYS at pH 4.5 |
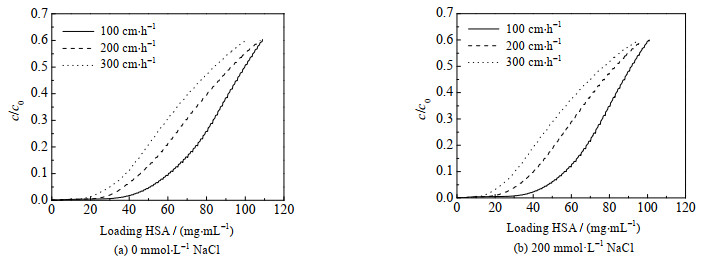
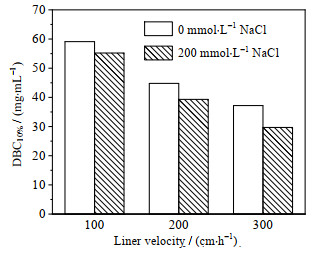
考察了pH为4.5,不同NaCl浓度和线性流速下IAA-CYS介质对HSA的动态载量,穿透曲线见图 3,10% 穿透的动态载量比较见图 4。当线性流速为100 cm·h-1、不添加NaCl时,HSA动态载量达到59.1 mg·mL-1。与Capto adhere、Capto MMC、MX-Trp-650M、Nuvia cPrime和TA-B-6FF等5种混合模式介质比较,在各自最佳吸附pH条件下,IAA-CYS介质的动态载量高于Capto MMC、MX-Trp-650M和Nuvia cPrime介质,略低于Capto adhere介质和TA-B-6FF介质。添加200 mmol·L-1的NaCl时,HSA动态载量仍较高,达到55.2 mg·mL-1,高于上述5种混合模式介质在相同条件下的HSA动态载量。结果表明,NaCl浓度对HSA动态载量影响较小,进一步证实IAA-CYS介质具有较强的耐盐吸附特性。毕赤酵母发酵液的电导率与200 mmol·L-1 NaCl溶液相当,故无需对发酵液进行稀释处理,可以直接上样分离。
|
图 3 不同线性流速下IAA-CYS介质对HSA的穿透曲线 Fig.3 Breakthrough curves of HSA on IAA-CYS at different linear velocities |
|
图 4 IAA-CYS介质对HSA的10%穿透动态载量比较(pH 4.5) Fig.4 Comparison of DBC10% of IAA-CYS resins for HSA adsorption at pH 4.5 |
从图 4可知,线性流速对HSA动态载量影响较大。不添加NaCl,线性流速从100增大到200 cm·h-1,HSA动态载量从59.1下降到44.8 mg·mL-1,下降了24.2%;当线性流速继续增大至300 cm·h-1,HSA动态载量降至37.2 mg·mL-1,仅为线性流速100 cm·h-1时的62.9%。因此,采用IAA-CYS介质从发酵液中分离rHSA,合适的上样流速为100 cm·h-1。
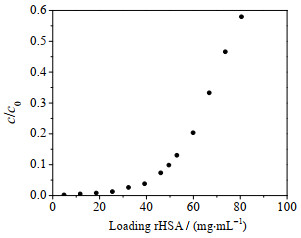
3.3 rHSA动态载量以毕赤酵母发酵处理液为料液,上样pH为4.5,上样流速为100 cm·h-1,考察了IAA-CYS介质对rHSA的动态载量。穿透曲线见图 5,10% 穿透的动态载量为48.3 mg·mL-1,比纯HSA降低了12.5%,可能是由于发酵液中部分杂质影响了rHSA吸附。后续分离时,选取上样量为动态载量的80%,即38.6 mg·mL-1。比较发现,IAA-CYS介质对rHSA的动态载量高于Nuvia cPrime和TA-B-6FF介质,接近Capto MMC介质和MX-Trp-650M介质。
|
图 5 IAA-CYS介质对rHSA的穿透曲线(pH 4.5) Fig.5 Breakthrough curve of rHSA on IAA-CYS at pH 4.5 |
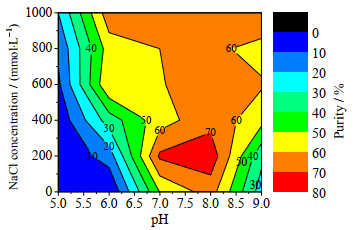
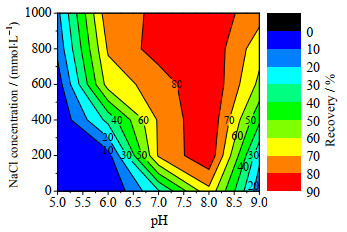
以毕赤酵母发酵处理液为料液,IAA-CYS介质在pH为4.5条件下吸附rHSA,然后以不同pH和NaCl浓度的缓冲液洗脱,考察了pH和盐浓度对rHSA洗脱的影响,不同洗脱条件的rHSA纯度和收率见图 6和7。
|
图 6 不同洗脱pH和NaCl浓度下的rHSA纯度 Fig.6 rHSA purities at different elution pH values and NaCl concentrations |
|
图 7 不同洗脱pH和NaCl浓度下的rHSA收率 Fig.7 Recoveries of rHSA at different elution pH values and NaCl concentrations |
比较rHSA纯度发现,不添加NaCl,洗脱pH从5.0升高到8.0,rHSA纯度逐步增大到64.5%;pH从8.0升高到9.0,rHSA纯度减小为25.3%;相对而言,pH 8.0洗脱的rHSA纯度最高。对于不同NaCl浓度(0~1.0 mol·L-1),pH为8.0条件下洗脱的rHSA纯度均为最高。在pH为8.0下,随着NaCl浓度从0升高到1 mol·L-1,rHSA纯度先增大后降低。比较而言,合适的洗脱条件为pH为8.0、NaCl浓度为200 mmol·L-1,rHSA纯度最高,达到76.1%。比较rHSA收率发现,在pH为5.0~9.0时,rHSA收率随着NaCl浓度的升高而增大;NaCl浓度在0~1.0 mol·L-1时,随着pH升高,rHSA收率先增大后减小,pH为8.0下的rHSA收率最大。比较而言,pH为8.0、NaCl浓度为200、400和600 mmol·L-1的rHSA收率较大,分别为88.1%、88.7% 和89.4%。
综合考虑,在pH为8.0、NaCl浓度为200 mmol·L-1下洗脱最合适,具有较高的rHSA纯度和收率。
3.5 毕赤酵母发酵液中分离rHSA根据前文优化结果,以毕赤酵母发酵处理液为料液,进行了rHSA分离。上样pH为4.5,上样流速为100 cm·h-1,上样量为38.6 mg·mL-1,洗脱条件为pH为8.0和NaCl浓度为200 mmol·L-1。
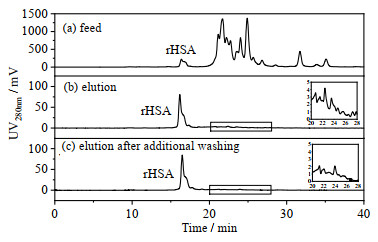
采用SDS-PAGE分析料液和洗脱液,发现料液的主要杂蛋白相对分子量约为45 000和36 000,前者可能是rHSA的降解片段。采用SEC-HPLC分析料液和洗脱液,结果见图 8。分析料液的SEC-HPLC图谱,发现rHSA峰的洗脱时间为16.5 min,在主峰右边有明显的肩峰,与SDS-PAGE分析结果一致,可能是rHSA的降解片段;20~28 min洗脱时间的杂质峰较大,主要是一些小分子杂质。洗脱液的SEC-HPLC图谱中未见明显的小分子杂质峰,rHSA收率为84.6%,纯度为80.2%,经IAA-CYS层析分离rHSA纯度提高了19.3倍。采用ELISA分析了料液和洗脱液中的宿主细胞蛋白含量,分别为2 614.0和714.2 mg·kg-1,减小了72.7%。
|
图 8 SEC-HPLC分析 Fig.8 Results of SEC-HPLC analysis |
为了进一步提高rHSA纯度,考虑在洗脱前添加淋洗步骤,以除去部分吸附的杂质。系统比较了不同pH和NaCl浓度的洗脱条件,经SEC-HPLC分析发现,pH为5.0、400 mmol·L-1的NaCl条件下的洗脱液中不含rHSA且小分子杂质含量较高,是较好的淋洗条件。因此,采用前文相同的吸附和洗脱条件,洗脱前添加淋洗步骤,洗脱液的SEC-HPLC分析结果见图 8,rHSA收率为88.6%,纯度提高到90.1%,洗脱液中的宿主细胞蛋白含量降为651.3 mg·kg-1。
褚文宁等[18-19]考察了SP Sepharose FF、Nuvia cPrime、Capto MMC和MX-Trp-650M从毕赤酵母发酵液中分离rHSA,发现SP Sepharose FF和Nuvia cPrime分离rHSA的纯度均较低,仅82% 左右,且SP Sepharose FF分离需要对料液进行稀释预处理;采用Capto MMC和MX-Trp-650M分离效果较好,rHSA收率和纯度均较高,大于95%,不过最佳上样pH为4.0。文献报道,当pH为4.0时HSA分子呈快速迁移的F型结构,与生理条件下的N型结构有较大区别[6-8]。此外,采用Capto MMC分离,洗脱pH为9.0,对HSA分子结构也有一定程度影响[6-8]。吴启赐等[20-21]采用TA-B-6FF从毕赤酵母发酵液中分离rHSA,rHSA单体纯度达到87.8%,收率98.5%,不过介质耐盐性较差,对于酵母发酵液的吸附容量较低,上样量仅为7.2 mg·mL-1介质。比较而言,本研究采用IAA-CYS介质进行分离,上样pH为4.5,洗脱pH为8.0,有利于保持HSA的正常生理构象,且每毫升介质的上样量达到38.6 mg。
总体来说,IAA-CYS介质用于从毕赤酵母发酵液分离rHSA,上样和洗脱条件温和,上样量较大,耐盐性好,料液不用稀释预处理,且分离得到的rHSA纯度和收率均较高。结果表明,IAA-CYS介质具有良好的应用前景。
4 结论针对新型混合模式介质IAA-CYS,探讨了HSA吸附性能,优化了吸附和洗脱条件,实现从毕赤酵母发酵液中高效分离rHSA。系统考察了pH和盐对IAA-CYS介质吸附HAS的影响,经优化,酵母发酵液中分离rHSA的最佳上样条件为pH 4.5,流速100 cm·h-1,每毫升介质的rHSA上样量为38.6 mg;淋洗条件为pH 5.0和400 mmol·L-1 NaCl;洗脱条件为pH 8.0和200 mmol·L-1 NaCl,得到rHSA纯度为90.1%,收率为88.6%。IAA-CYS介质分离rHSA条件温和,过程简便,应用前景良好。
| [1] |
RABBANI G, AHN S N. Structure, enzymatic activities, glycation and therapeutic potential of human serum albumin: A natural cargo[J]. International Journal of Biological Macromolecules, 2019, 123: 979-990. DOI:10.1016/j.ijbiomac.2018.11.053 |
| [2] |
WU X J, LIN Y L, XIONG F Y, et al. The extremely high level expression of human serum albumin in the milk of transgenic mice[J]. Transgenic Research, 2012, 21(6): 1359-1366. DOI:10.1007/s11248-012-9612-4 |
| [3] |
SUN Q Y, DING L W, LOMONOSSOFF G P, et al. Improved expression and purification of recombinant human serum albumin from transgenic tobacco suspension culture[J]. Journal of Biotechnology, 2011, 155(2): 164-172. DOI:10.1016/j.jbiotec.2011.06.033 |
| [4] |
CHEPEREGIN S E, EFREMOV B D, KOZLOV D G. Precipitation of human serum albumin from yeast culture liquid at pH values below 5[J]. Protein Expression and Purification, 2010, 72(2): 205-208. DOI:10.1016/j.pep.2010.04.005 |
| [5] |
HE Y, NING T T, XIE T T, et al. Large-scale production of functional human serum albumin from transgenic rice seeds[J]. Proceedings of the National Academy of Sciences, 2011, 108(47): 19078-19083. DOI:10.1073/pnas.1109736108 |
| [6] |
TANKOVSKAIA S, ABROSIMOVA K, PASTON S. Spectral demonstration of structural transitions in albumins[J]. Journal of Molecular Structure, 2018, 1171(8): 243-252. |
| [7] |
DOCKAL M, CARTER D, RUEKER F. Conformational transitions of the three recombinant domains of human serum albumin depending on pH[J]. Journal of Biological Chemistry, 2000, 275(5): 3042-3050. DOI:10.1074/jbc.275.5.3042 |
| [8] |
PETERS JR. T.. All about albumin: biochemistry, genetics, and medical applications[M]. San Diego: Academic Press, 1996.
|
| [9] |
余晶梅, 林东强, 童红飞, 等. 荧光探针法研究牛血清白蛋白和免疫球蛋白的表面疏水特性[J]. 高校化学工程学报, 2014, 28(4): 771-776. YU J M, LIN D Q, TONG H F, et al. Studies on surface hydrophobicity of bovine serum albumin and immunoglobulin by a fluorescence probe method[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(4): 771-776. DOI:10.3969/j.issn.1003-9015.2014.04.013 |
| [10] |
陈诗伟, 徐英年, 胡英. 双水相亲和分离人体血清蛋白质的研究[J]. 高校化学工程学报, 1991, 5(3): 203-211. CHEN S W, XU Y N, HU Y. Separation of human serum protein by aqueous two-phase affinity[J]. Journal of Chemical Engineering of Chinese Universities, 1991, 5(3): 203-211. |
| [11] |
GOODEY A R, SLEEP D, VANURK H, et al. Process of high purity albumin production: US, 6638740[P]. 2003-10-02.
|
| [12] |
LI M T, ZHANG Q L, LIN D Q, et al. Development and application of hydrophobic charge-induction chromatography for bioseparation[J]. Journal of Chromatography B, 2019, 1134-1135: 1-8. |
| [13] |
ZHANG K, LIU X D. Mixed-mode chromatography in pharmaceutical and biopharmaceutical applications[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 128: 73-88. DOI:10.1016/j.jpba.2016.05.007 |
| [14] |
武强, 林东强, 翁叶靖, 等. 用于双水相萃取的混合模式配基制备及对IgG分配的影响[J]. 高校化学工程学报, 2013, 27(6): 925-930. WU Q, LIN D Q, WENG Y J, et al. Preparation of mixed-mode ligand for aqueous two-phase extraction and the influences of the ligand on IgG partitioning[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(6): 925-930. DOI:10.3969/j.issn.1003-9015.2013.06.002 |
| [15] |
姚善泾, 高栋, 林东强. 一种新的生物分离方法——混合模式吸附层析[J]. 化工学报, 2007, 58(9): 2169-2177. YAO S J, GAO D, LIN D Q. Novel technology in bioseparation process-mixed-mode chromatography[J]. Journal of Chemical Industry and Engineering (China), 2007, 58(9): 2169-2177. DOI:10.3321/j.issn:0438-1157.2007.09.003 |
| [16] |
李梅彦, 贾茜, 张炜等. 一种纯化rHSA的方法: CN, 1854155[P]. 2006-11-01. LI M Y, JIA Q, ZHANG W, et al. Method for rHSA purification: CN, 1854155[P]. 2006-11-01. |
| [17] |
杨代常, 何洋, 李光飞. 一种从水稻种子中分离纯化重组人血清白蛋白的方法: CN, 201010606635.8[P]. 2012-07-04. YANG D C, HE Y, LI G F. Method for separating recombinant human serum albumin from rice seeds: CN, 201010606635.8[P]. 2012-07-04. |
| [18] |
CHU W N, WU Q C, ZHANG Q L, et al. High-throughput process development for recombinant human serum albumin separation from Pichia pastoris broth with mixed-mode chromatography[J]. Industrial & Engineering Chemistry Research, 2019, 58(8): 3238-3248. |
| [19] |
CHU W N, WU Q C, YAO S J, et al. High-throughput screening and optimization of mixed-mode resins for human serum albumin separation with microtiter filter plate[J]. Biochemical Engineering Journal, 2018, 131: 47-57. DOI:10.1016/j.bej.2017.12.001 |
| [20] |
WU Q C, ZHANG Q L, XU S W, et al. Preparation and evaluation of mixed-mode resins with tryptophan analogues as functional ligands for human serum albumin separation[J]. Chinese Journal of Chemical Engineering, 2017, 27(7): 898-905. |
| [21] |
WU Q C, LIN D Q, SHI W, et al. A mixed-mode resin with tryptamine ligand for humanserum albumin separation[J]. Journal of Chromatography A, 2016, 1431: 145-153. DOI:10.1016/j.chroma.2015.12.066 |
| [22] |
DONG Y S, ZHANG F, WANG Z M, et al. Extraction and purification of recombinant human serum albumin from Pichia pastoris broths using aqueous two-phase system combined with hydrophobic interaction chromatography[J]. Journal of Chromatography A, 2012, 1245: 143-149. DOI:10.1016/j.chroma.2012.05.041 |
| [23] |
林东强, 葛程童, 褚文宁, 等. 以羧基和吲哚基为功能基团的混合模式层析介质: CN, 201910917553.6[P]. 2020-01-14. LIN D Q, GE C T, CHU W N, et al. Mixed-mode chromatography resins with carboxyl and indolyl as functional groups: CN, 201910917553.6[P]. 2020-01-14. |