肝素是主要的抗凝血药物,临床使用历史悠久。目前,肝素主要是从猪小肠黏膜中提取,它也是我国出口量最大的生化原料药[1]。自从2007年发生的肝素污染事件[2, 3]以来,肝素的生物合成研究受到国内外的重视。近年的研究发现,肝素可以以大肠杆菌K5的荚膜多糖肝素前体 (heparosan) 为原料,经过多步的硫磺基修饰得到[4]。肝素硫磺基修饰过程中需要大量使用3'-磷酸腺苷5'-磷酸硫酸 (3'-phosphoadenosine 5'-phosphosulfate, PAPS)。而PAPS却具有价格高且易分解等不利于工业化生产的缺点,因此,PAPS是大规模合成肝素类多糖的一个关键原料[5]。
目前,PAPS再生系统以及酶法合成可以很好解决这个关键问题[6, 7]。PAPS再生系统已被用于制备生物工程肝素[8]。在该系统中,芳基硫磺基转移酶IV (arylsulfotransferase IV) 使用对硝基苯酚硫酸盐 (p-nitrophenol sulfate, PNPS) 作为硫磺基供体将3'-磷酸腺苷5'-磷酸 (3'-phosphoadenosine 5'-phosphate, PAP) 转化为PAPS[9, 10]。PAPS再生系统满足了PAP的催化量。然而,合成结构确定的超低分子量肝素 (ultralow molecular weight heparin, ULMWH) 时,PAPS被用作唯一的硫磺基供体[5, 11, 12]。
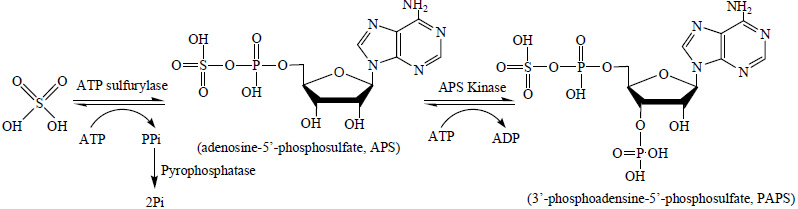
PAPS的酶合成途径如图 1所示,三磷酸腺苷 (adenosine triphosphate, ATP) 首先在ATP硫化酶 (EC2.7.7.4) 的作用下生成5'-腺苷磷酰硫酸 (adenosine 5'-phosphosulfate, APS), APS在APS激酶 (EC2.7.1.25) 的作用下3'-OH基团与ATP发生磷酸化反应,生成PAPS[9]。Burkart等人[9]使用E. coli K12来源的ATP硫化酶和APS激酶来制备PAPS,底物ATP浓度为5 mmol·L-1时,反应6 h后,PAPS得率仅为30.5%。Zhou等人[6]使用E.coli BL21表达的ATP硫化酶、APS激酶和无机焦磷酸水解酶,可以将PAPS的产量提高到5 g·L-1 (约10 mmol·L-1)。
|
图 1 PAPS的合成代谢途径 Fig.1 Pathway of PAPS synthesis |
本研究从乳酸克鲁维酵母 (Kluyveromyces lactis) 的基因组中克隆ATP硫化酶基因,根据大肠杆菌密码子偏好性对产黄青霉 (Penicillium chrysogenum) 的APS激酶基因序列进行优化并合成基因。将以上两个不同来源的基因分别构建到质粒中,获得重组表达载体并分别导入大肠杆菌中进行重组表达。经Ni2+亲和层析,分离纯化得到高纯度PAPS合成酶系,研究其合成PAPS的反应条件及性能,并在反应体系中添加无机焦磷酸水解酶 (inorganic pyrophosphatase, PPase), 将PAPS的产量进一步提高。
2 材料与方法 2.1 材料 2.1.1 菌株及培养基基因克隆宿主为大肠杆菌DH5α (Novangen,USA),蛋白质表达宿主为大肠杆菌BL21(DE3) (Novangen),表达载体为pET28a (Novangen)。LB培养基 (g·L-1):蛋白胨10,酵母粉5,NaCl 10。乳酸克鲁维酵母为实验室保藏。
2.1.2 主要试剂核酸限制性内切酶、DNA连接酶均购自TAKARA (Shiga, Japan);硫酸卡那霉素 (Kana)、大肠杆菌基因组提取试剂盒、酵母基因组提取试剂盒、小批量质粒提取试剂盒、ATP均购自上海生工;PAPS购自Sigma;Ni-NTA亲和层析填料购自QIAGEN;其余试剂均为分析纯。PPase为本实验室前期制备。
2.2 方法 2.2.1 APS激酶基因的密码子优化合成及表达载体的构建APS激酶基因来源于产黄青霉 (Gene ID: 8313362),利用在线软件 (http://www.entelechon.com),按照大肠杆菌密码子偏好性对APS激酶基因进行密码子优化。在目的基因前后插入Nco I和Xho I酶切位点,并在末端添加6个His亲和标签的编码序列。优化设计后的基因由上海捷瑞全合成,并连接到pET28a质粒得到重组载体pET28a-APS Kinase。将重组质粒转入BL21(DE3) 得到重组表达菌株BL21(DE3)/pET28a-APS Kinase。
2.2.2 ATP硫化酶基因克隆及表达载体的构建以乳酸克鲁维酵母基因组为模板,以5'-cgcccatgggcatgccttctcctcatggtggtg-3'为上游引物,5'-cgcctcgaggaattggaaaaagccttggtcttcc-3'为下游引物进行PCR扩增ATP硫化酶目的基因。分别对ATP硫化酶目的基因片段和pET28a+载体进行Nco I和Xho I双酶切,连接,得到pET28a-ATP sulfurylase。将重组质粒转入BL21(DE3) 得到重组表达菌株BL21(DE3)/pET28a-ATP sulfurylase。
2.2.3 ATP硫化酶与APS激酶的诱导表达将重组菌接种于5 mL LB种子培养基 (含50 μg⋅L-1Kana) 中,37℃、220 r⋅min-1培养过夜; 将种子液按2%体积分数转接到100 mL LB培养基中,37℃、220 r⋅min-1培养至菌体生长量达到OD600nm为0.6左右,加入IPTG至终浓度0.4 mmol⋅L-1,25℃、220 r⋅min-1下诱导6 h。发酵结束后收集菌体,超声破碎,得到的上清液经SDS-聚丙烯酰胺凝胶电泳分析和后续蛋白提取纯化。
2.2.4 ATP硫化酶与APS激酶的纯化纯化方法采用Ni柱[13]。将适量Ni-NTA填料置于层析柱内。对于ATP硫化酶,用10倍于柱体积的上样缓冲液Buffer A (NaCl 0.5 mol⋅L-1,咪唑20 mmol⋅L-1,Tris-HCl 20 mmol⋅L-1,pH 8.0) 平衡,样品以1 mL·min-1上样,上样后先用Buffer A平衡柱子,再用冲洗缓冲液Buffer B (NaCl 0.5 mol⋅L-1,咪唑70 m mol⋅L-1,Tris-HCl 20 m mol⋅L-1,pH 8.0) 洗脱杂蛋白,最后用洗脱缓冲液Buffer C (NaCl 0.5 mol⋅L-1,咪唑250 m mol⋅L-1,Tris-HCl 20 m mol⋅L-1,pH 8.0) 洗脱目标蛋白。对于APS激酶,用10倍于柱体积的上样缓冲液Buffer D (NaCl 0.3 mol⋅L-1,咪唑10 mmol⋅L-1,NaH2PO4 50 mmol⋅L-1,pH 8.0) 平衡,样品以1 mL·min-1上样,上样后先用Buffer E (NaCl 0.3 mol⋅L-1,咪唑20 mmol⋅L-1,NaH2PO4 50 mmol⋅L-1,pH 8.0) 平衡柱子,最后用洗脱缓冲液Buffer F (NaCl 0.3 mol⋅L-1,咪唑250 m mol⋅L-1,NaH2PO4 50 m mol⋅L-1,pH 8.0) 洗脱目标蛋白。目标蛋白脱盐浓缩后用Buffer G (Tris-HCl 50 m mol⋅L-1,pH 8.0, 30% (V/V) 甘油) 置于-20℃进行保存。
2.2.5 酶活的测定采用钼酸铵法测定反应生成的Pi来确定PPase的酶活。0.5 mL反应体系中含有100 mmol⋅L-1Tris-HCl (pH 7.2)、2 mmol⋅L-1 MgCl2和2 mmol⋅L-1焦磷酸 (Pyrophosphoric acid,PPi),加入适量酶,在25℃反应10 min,阴性对照不加PPi。测试管中含有0.5 mL样品,加入4.0 mL AAM溶液 (10 mmol⋅L-1 (NH4)6Mo7O24·4H2O:2.5 mol⋅L-1 H2SO4:丙酮=1:1:2,体积比),将溶液在漩涡震荡仪上混合均匀后,往管中加入0.4 mL 1 mol⋅L-1柠檬酸,然后测定405 nm处的吸光值。1 U定义为在上述反应条件下每分钟从焦磷酸催化生成1 μmol Pi所需要的酶量。
ATP硫化酶的测定:通过测定焦磷酸生成量来测定,而焦磷酸的生成量通过加入足量的PPase水解成Pi来测定。0.5 mL反应体系中含有100 mmol⋅L-1 Tris-HCl (pH 8.0)、10 mmol⋅L-1 MgCl2、5 mmol⋅L-1Na2MoO4、2 mmol⋅L-1 ATP和0.1 U PPase,在37℃反应15 min,阴性对照不加Na2MoO4。然后通过上述方法测定Pi浓度。1 U定义为在上述反应条件下每分钟从ATP和Na2MoO4催化生成1 μmol PPi所需要的酶量。
2.2.6 PAPS的合成体系以及合成条件的优化500 μL反应体系中:50 mmol⋅L-1Tris-Cl (pH 8.0),1 mmol⋅L-1 ATP, 5 mmol⋅L-1 Na2SO4,10 mmol⋅L-1 Mg2+,5 mmol⋅L-1 LiCl,加入0.13 U的ATP硫化酶,2 μL的APS激酶以及1 U的PPase (或不加PPase)。在25℃反应30 min,沸水浴10 min,12000 g离心10 min以除去蛋白。单因素变换以查看不同因素对PAPS转化率的影响。考察最优条件下不同底物浓度时PAPS随时间的积累,反应体积为10 mL,且Na2SO4和LiCl浓度是ATP浓度的2倍,在反应体系加入ATP后调节pH,13 U ATP硫化酶,200 μL APS激酶以及100 U的PPase。底物分批补加时反应体积为100 mL,130 U ATP硫化酶,2 mL APS激酶以及1000 U的PPase,反应体系加入ATP后用NaOH调节pH。
2.2.7 产物PAPS的检测采用Agilent 1100 HPLC系统,Zorbax C18柱 (4.6*250 mm,5 μm),流动相:含有5%甲醇的50 mmol⋅L-1甲酸铵溶液 (用甲酸调节pH至4.5),流速:1 mL⋅min-1,进样量:5 μL,检测器:UV 254 nm。
使用Bruker LC/MSD离子阱质谱在负离子检测模式进行质谱分析,扫描范围为100~2000 m⋅z-1,分辨率为13, 000 m⋅z-1s-1。对于负离子,毛细管电压为+4000 V,端板为+3500 V,数据由惠普化学工作站收集。
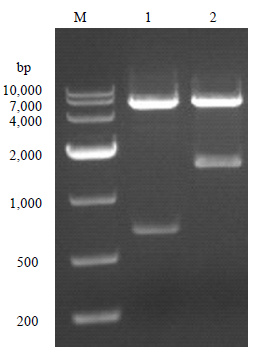
3 结果与讨论 3.1 ATP硫化酶和APS激酶表达与纯化为了构建体外合成PAPS途径,本文构建pET28a-ATP sulfurylase和pET28a-APS kinase两个载体。对构建好的载体使用Nco I和Xho I双酶切验证,用1.0%的琼脂糖凝胶电泳检测双酶切产物 (图 2),将验证无误的载体送去测序验证序列的正确性。
|
图 2 质粒pET28a-ATP sulfurylase和pET28a-APS kinase的双酶切鉴定图 Fig.2 Double digestion image of pET28a-ATP sulfurylase and pET28a-APS kinase with Nco I/Xho I M: DNA marker; Lane 1: pET28a-APS kinase; Lane 2: pET28a-ATP sulfurylase |
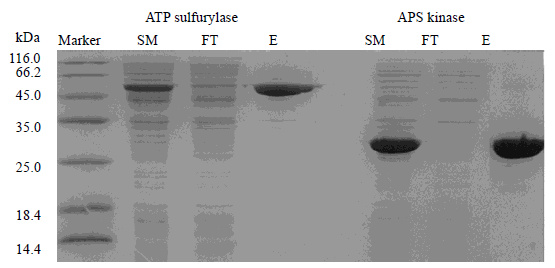
大肠发酵后收集菌体,加入上样缓冲液浓缩两倍后破胞,离心后取上清。在分离过程中收集穿透液以及洗脱液。上清液、穿透液以及洗脱液经过SDS-PAGE分析 (图 3),上样量为5 μL。
|
图 3 ATP硫化酶和APS激酶的表达以及纯化图 Fig.3 SDS-PAGE analysis of ATP sulfurylase and APS kinase expression and purification Marker: Protein marker; SM: Starting material sample FT: Flow through sample; E: Elution sample |
图 3表明,ATP硫化酶以及APS激酶占菌体可溶蛋白的20%以上,得到有效表达。利用Ni2+柱亲和层析进行纯化,上清液中的重组酶几乎完全被亲和树脂吸附,纯化后的重组酶纯度为90%以上。经BCA蛋白浓度试剂盒测定,保存的ATP硫化酶为7.5 g⋅L-1,APS激酶为9.6 g⋅L-1,PPase为8.3 g⋅L-1。ATP硫化酶的产量为181.1 U⋅L-1发酵液,比酶活为1.78 U⋅mg-1蛋白;APS激酶的产量为351 mg⋅L-1发酵液。
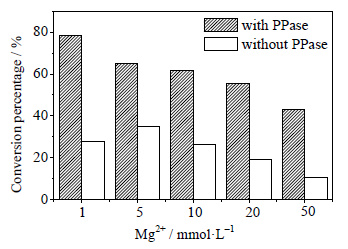
3.2 PAPS合成条件的优化 3.2.1 Mg2+浓度对PAPS合成的影响在PAPS的合成体系中加入不同浓度的Mg2+以考查Mg2+浓度对PAPS合成的影响 (图 4)。由图可见,当合成体系中含有PPase,Mg2+浓度为1 mmol⋅L-1时,PAPS转化率达到最高为78%;当合成体系中不含有PPase时,Mg2+浓度为5 mmol⋅L-1时,PAPS转化率达到最高值36%。在含有PPase时,PAPS的转化率远大于反应体系中不含有PPase的。
|
图 4 不同Mg2+浓度对PAPS转化率的影响 Fig.4 Effects of Mg2+ concentration on PAPS conversion |
用HEPES缓冲液 (pH=6.0~8.0) 和Tris-HCl缓冲液 (pH=7.5~9.5) 来考查不同缓冲体系以及pH值对PAPS转化率的影响 (图 5)。由图 5可见,当体系中含有PPase时,50 mmol⋅L-1Tris-HCl (pH=7.5),转化率最高为73%;当体系中不含有PPase时,50 mmol⋅L-1Tris-HCl (pH=8),转化率最高为46%。可见,在含有PPase时PAPS的转化率远大于不含有PPase的。
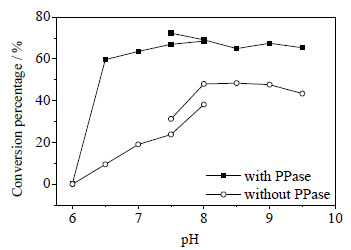
|
图 5 不同缓冲体系和pH对PAPS转化率的影响 Fig.5 Effects of buffer and pH on PAPS conversion |
在PAPS合成时,变化温度从20~55℃以考查不同温度对PAPS转化率的影响 (图 6)。由图可见,不管是在含有PPase还是在不含有PPase的情况下,反应温度为40℃时,转化率均最高。且在含有PPase时PAPS的转化率远大于不含有PPase时的。
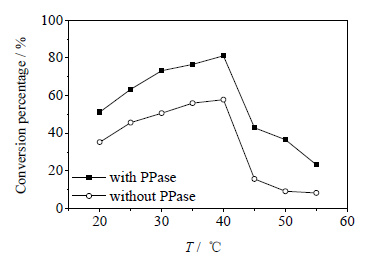
|
图 6 不同温度对PAPS转化率的影响 Fig.6 Effects of temperature on PAPS conversion |
综上所述,在反应体系中加入PPase极大地提高了PAPS的转化率,大大提高了反应效率。可能原因是ATP和Na2SO4在ATP硫化酶的作用下生成APS和焦磷酸,而焦磷酸是一种高能物质。PPase水解PPi生成Pi,PPase的添加可以极大地促进反应往合成PAPS方向移动[14]。图 4显示,当合成体系中含有PPase,Mg2+浓度1 mmol·L-1时的PAPS转化率最高;当合成体系中不含有PPase时,Mg2+浓度5 mmol⋅L-1下的PAPS转化率最高。图 5显示:当体系中含有PPase时,在50 mmol⋅L-1Tris-HCl (pH=7.5) 缓冲溶液中转化率最高;当体系中不含有PPase时,在50 mmol⋅L-1Tris-HCl (pH=8) 缓冲溶液中转化率最高。据报道[15],在2 mmol⋅L-1Mg2+、pH 7.2的条件下PPase的酶活最高。通过以上试验,合成PAPS的最优条件为,在PPase存在的前提下,Mg2+浓度为1 mmol⋅L-1、50 mmol⋅L-1Tris-HCl (pH=7.5)、反应温度为40℃。
3.3 最优条件下,不同底物浓度下PAPS随时间的积累量变化在最优反应条件下进一步研究不同底物 (ATP) 浓度下PAPS随时间的积累量变化 (图 7)。由图可见,ATP浓度为10 mmol⋅L-1时,反应1.5 h达到平衡,PAPS积累量为4.36 mmol⋅L-1,ATP转化率为87.2%;ATP浓度为20 mmol⋅L-1时,反应3 h达到平衡,PAPS积累量为8.43 mmol⋅L-1,ATP转化率为84.3%;ATP浓度为30 mmol⋅L-1时,反应9 h达到平衡,PAPS积累量为12.01 mmol⋅L-1,ATP转化率为80.1%;ATP浓度为40 mmol⋅L-1时,反应16 h达到平衡,PAPS积累量为17.46 mmol⋅L-1,ATP转化率为87.3%;ATP浓度为50 mmol⋅L-1时,反应25 h后PAPS积累量为18.87 mmol⋅L-1,ATP转化率为75.5%。ATP硫化酶和APS激酶催化的反应均为可逆反应,随着时间变长,反应达到平衡,因此转化率只能在85%左右,达不到100%。但从图上看出,反应达到平衡后,PAPS的积累量仍是缓慢增加的,这是由于部分ADP被降解为AMP,从而推动平衡向右移动。另一方面,当反应时间为0.5 h和1 h时,PAPS的积累量:10 mmol⋅L-1 > 20 mmol⋅L-1 > 30 mmol⋅L-1 > 40 mmol⋅L-1,这表明在反应过程中存在底物抑制作用。
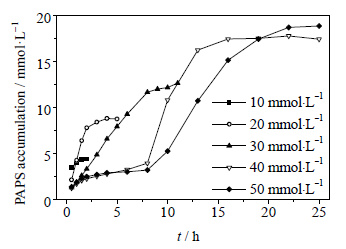
|
图 7 不同底物浓度PAPS随时间的积累量 Fig.7 PAPS accumulation profiles at different substrate concentrations |
反应中,ATP相较于其他底物 (如Na2SO4、LiCl) 价格昂贵,因此在反应过程中考虑提高Na2SO4、LiCl的浓度以推动平衡向右移动,从而提高ATP的转化率。反应体系中ATP 10 mmol⋅L-1,Na2SO4和LiCl浓度分别为20 mmol⋅L-1,50 mmol⋅L-1,100 mmol⋅L-1,200 mmol⋅L-1,500 mmol⋅L-1,反应30 min后,PAPS的生成量分别为3.86 mmol⋅L-1,4.15 mmol⋅L-1,4.30 mmol⋅L-1,4.21 mmol⋅L-1,2.80 mmol⋅L-1。可见,Na2SO4和LiCl浓度小于100 mmol⋅L-1时,浓度越高,反应越快;而Na2SO4和LiCl浓度大于200 mmol⋅L-1时存在明显的底物抑制。因此,在分批补料底物ATP中,Na2SO4和LiCl的初始浓度为200 mmol⋅L-1的条件下,反应过程中对ATP进行分批补料,每次补料量为0.650 g (图 8)。在补料4次下 (此时,ATP的投料浓度为50 mmol⋅L-1),反应11.5 h,PAPS的积累量达20.36 mmol⋅L-1 (10.32 g·L-1),转化率为81.4%。即可以从反应液中获得1.03 g PAPS。而在未进行分批补料的模式下,当ATP浓度为50 mmol⋅L-1时,反应25 h PAPS的生成量才为18.81 mmol⋅L-1,分批补料极大地提高了反应的催化速率。另外,PAPS的产量较文献[6]值5 g⋅L-1有了较大的提高。
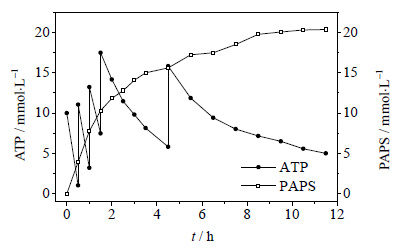
|
图 8 ATP补料下PAPS随时间的积累量 Fig.8 PAPS accumulation profiles under ATP fed-batch conditions |
利用液质联用 (HPLC-MS) 检测最优条件下制备的PAPS样品。HPLC和MS的图谱如图 9所示。在负电模式下,保留时间为3.648 min的液相峰所检测到的质荷比 (m·z-1) 为505.7,而C10H15N5O13P2S (M-H) 的理论计算m⋅z-1为506.0,两者相一致。之前的文献报道[6]采用PMAN-HPLC对PAPS进行检测一个样品的分析时间为50 min,本文采用甲酸甲酸铵反向离子对HPLC一个样品的分析时间仅为10分钟,并且该流动相适合用于MS分析。
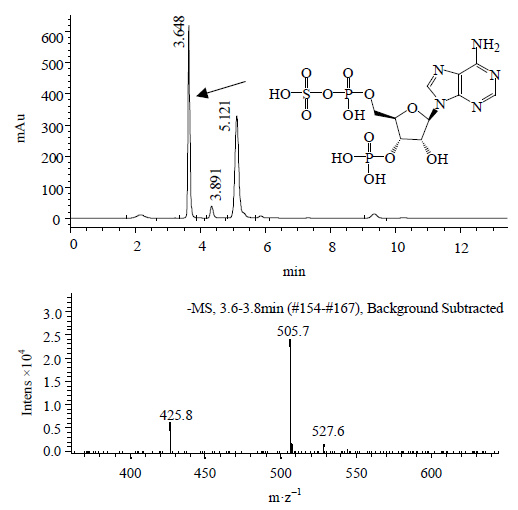
|
图 9 PAPS的液相图以及质谱图 Fig.9 HPLC and MS spectra of PAPS |
PAPS是酶法合成肝素所必需的硫磺基供体。但PAPS价格非常昂贵,远高于肝素,这成为体外合成肝素的严重障碍。本研究利用基因工程表达了ATP硫化酶和APS激酶,并将它们构建成PAPS酶反应体系,实现了PAPS的体外合成。同时在反应体系中添加了PPase,PPase可以水解ATP硫化酶生成的PPi,从而可以极大地促进反应往正方向移动。在优化的反应条件下,考察在不同底物ATP浓度下PAPS随时间的积累量,除ATP浓度为50 mmol·L-1外,ATP的转化率均可达到85%左右;同时发现反应存在底物抑制作用。考察不同Na2SO4和LiCl浓度对PAPS的生成量的影响,结果显示当Na2SO4和LiCl浓度为200 mmol·L-1时反应最优。控制反应中Na2SO4和LiCl初始浓度为200 mmol·L-1,在反应中对ATP进行分批补料,补料4次,反应11.5 h,PAPS的积累量达20.36 mmol·L-1(10.32 g·L-1),ATP的转化率为81.4%,即可以从反应液中获得1.03g PAPS,相较于非补料模式极大地提高了反应的催化速率。
| [1] | REN Yong-hai(任永海), LI Xiao-yan(李晓燕), HUANG Lei(黄磊), et al. High-level production and purification of recombinant heparinase I in Escherichia coli(重组肝素酶I在大肠杆菌中的表达及纯化)[J]. Chinese Journal of Pharmaceutical Biotechnology(药物生物技术) , 2012, 19(5): 377-380. |
| [2] | Guerrini M, Beccati D, Shriver Z, et al. Oversulfated chondroitin sulfate is a contaminant in heparin associated with adverse clinical events[J]. Nature biotechnology , 2008, 26(6): 669-675. DOI:10.1038/nbt1407. |
| [3] | Liu H, Zhang Z, Linhardt R J. Lessons learned from the contamination of heparin[J]. Natural Product Reports , 2009, 26(3): 313-321. DOI:10.1039/b819896a. |
| [4] | Liu J, Linhardt R J. Chemoenzymatic synthesis of heparan sulfate and heparin[J]. Natural Product Reports , 2014, 31(12): 1676-1685. DOI:10.1039/C4NP00076E. |
| [5] | Xu Y M, Masuko S, Takieddin M, et al. Chemoenzymatic synthesis of homogeneous ultralow molecular weight heparins[J]. Science , 2011, 334(6055): 498-501. DOI:10.1126/science.1207478. |
| [6] | Zhou X, Chandarajoti K, Pham T Q, et al. Expression of heparan sulfate sulfotransferases in Kluyveromyces lactis and preparation of 3'-phosphoadenosine-5'-phosphosulfate[J]. Glycobiology , 2011, 21(6): 771-780. DOI:10.1093/glycob/cwr001. |
| [7] | Zulueta M M L, Lin S Y, Hu Y P, . Synthetic heparin and heparan sulfate oligosaccharides and their protein interactions[J]. Current Opinion in Chemical Biology , 2013, 17(6): 1023-1029. DOI:10.1016/j.cbpa.2013.10.008. |
| [8] | Bhaskar U, Li G Y, Fu L, et al. Combinatorial one-pot chemoenzymatic synthesis of heparin[J]. Carbohydrate Polymers , 2015, 122: 399-407. DOI:10.1016/j.carbpol.2014.10.054. |
| [9] | Burkart M D, Izumi M, Chapman E, et al. Regeneration of PAPS for the enzymatic synthesis of sulfated oligosaccharides[J]. Journal of Organic Chemistry , 2000, 65(18): 5565-5574. DOI:10.1021/jo000266o. |
| [10] | QI Chen(齐晨), YANG Xiu-liang(杨修亮), LI Xiao-yan(李晓燕), et al. Efficient and soluble expression of aryl sulfotransferase IV in recombinant Escherichia coli(重组大肠杆菌高效可溶性表达芳基硫磺基转移酶的研究)[J]. Chinese Journal of Pharmaceutical Biotechnology(药物生物技术) , 2014, 21(5): 385-388. |
| [11] | Hsieh P H, Xu Y, Keire D A, . Chemoenzymatic synthesis and structural characterization of 2-O-sulfated glucuronic acid-containing heparan sulfate hexasaccharides[J]. Glycobiology , 2014, 24(8): 681-692. DOI:10.1093/glycob/cwu032. |
| [12] | Xu Y, Cai C, Chandarajoti K, et al. Homogeneous low-molecular-weight heparins with reversible anticoagulant activity[J]. Nature Chemical Biology , 2014, 10(4): 248-250. DOI:10.1038/nchembio.1459. |
| [13] | FANG Xin(房鑫), TIAN Si-si(田思思), YAO Zhong(姚忠), et al. Cloning, Expression and Characterization of γ-glutamyltranspeptidase from Escherichia coli and Bacillus subtilis(大肠杆菌和枯草芽孢杆菌来源γ-谷氨酰转肽酶的克隆表达和性质比较)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(2): 282-289. |
| [14] | Terkeltaub R A. Inorganic pyrophosphate generation and disposition in pathophysiology[J]. American Journal of Physiology-Cell Physiology , 2001, 281(1): C1-C11. |
| [15] | Kapyla J, Hyytia T, Lahti R, et al. Effect of D97E substitution on the kinetic and thermodynamic properties of Escherichia coli inorganic pyrophosphatase[J]. Biochemistry , 1995, 34(3): 792-800. DOI:10.1021/bi00003a012. |




